Nerium oleander en Corse : état des connaissances en 2024
Title
Nerium oleander in Corsica: state of knowledge in 2024.
Résumé
Nerium oleander L. (Apocynaceae) est en Corse un taxon rare et protégé. Il ne compte que six sous-populations, toutes situées dans le Cap Corse : à Luri, sur la côte est et dans la région de Saint-Florent sensu lato (ruisseaux de Farinole, du Fium’Albino, de la Strutta, de Poggio et de Morello). La population est estimée à 3 000-4 000 individus, sur une superficie de moins de cinq hectares. Un temps menacées par les pressions humaines (incendies, mise en valeur agricole…), ses sous-populations semblent stables depuis une vingtaine d’années. Elles restent néanmoins fragiles et nécessiteraient la prise de mesures réglementaires et foncières supplémentaires. Des études plus complètes seraient également nécessaires pour améliorer les connaissances sur la dynamique des populations, l’écologie et la génétique. Le risque d’introgression par des cultivars constitue une menace qui sera à surveiller dans les années à venir.
Abstract
Nerium oleander L. (Apocynaceae) is a rare and protected taxon in Corsica. It comprises only six subpopulations, all located in the Cap Corse region: in Luri (east coast) and in the Saint-Florent region sensu lato (Farinole, Fium’Albino, Strutta, Poggio and Morello streams). The population is estimated at 3,000-4,000 individuals, spread over an area of less than fives hectares. Once threatened by human pressures (fires, agricultural development, etc.), its subpopulations have appeared stable for the past twenty years. However, they remain fragile and would require additional regulatory and land management measures. More comprehensive studies would also be needed to improve understanding of population dynamics, ecology, and genetics. The risk of introgression by cultivated varieties poses a threat that will need to be monitored in the coming years.
1. Introduction
Le Laurier-rose (Nerium oleander L., 1753) est un arbuste de la famille des Apocynacées utilisé depuis l’Antiquité comme plante ornementale pour sa floraison abondante et durable ainsi que pour sa rusticité (Pagen, 1987 ; Eggenberger & Eggenberger, 1996). D’après Bernard-Nenault (in Encyclopædia Universalis, https://www.universalis.fr/encyclopedie/contortales/), les feuilles fossilisées, datant du Crétacé supérieur, trouvées dans les dépôts sédimentaires (Allemagne, vallée du Rhône, Bassin parisien), témoignent de l’ancienneté du genre Nerium et de sa stabilité morphologique. Son feuillage persistant à structure xéromorphique et les variations de sa répartition paléogéographique suggèrent qu’il s’agit d’un survivant d’une flore xérophile disparue ou refoulée lors des glaciations quaternaires.
L’aire de répartition du Laurier-rose est assez vaste. On le trouve sur trois continents, depuis le pourtour méditerranéen (sud de l’Europe, Afrique du Nord), jusqu’à la Birmanie (Pagen, 1987 ; POWO, 2024). Il existe des différences morphologiques et phénologiques entre les populations méditerranéenne et asiatique et les différents variants sont reconnus interfertiles (Pagen, 1987 ; Tison & de Foucault, 2014). Ainsi, comme le soulignent Tison & de Foucault (2014) « les plantations massives de Lauriers-roses d’origine asiatique dans l’aire européenne induisent un risque génétique chez les populations spontanées », d’autant plus que les cultivars se naturalisent facilement.
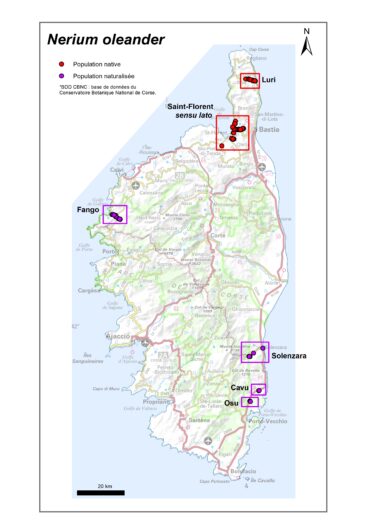
En Corse, l’espèce est relativement rare à l’état sauvage et localisée à quelques ruisseaux du Cap Corse. Par contre, les variétés horticoles sont largement répandues sur l’île, y compris dans l’aire de présence du Nerium autochtone. Elles deviennent subspontanées le long de certaines rivières du sud-est de l’île (Solenzara, Cavu, Osu) et dans le Fangu (côte ouest). Actuellement, il ne semble pas que des cultivars aient colonisé les habitats des populations naturelles. Quelques rares individus à fleurs de couleur rose foncé posent néanmoins question sur le Fium’Albino et l’origine autochtone de deux petites sous-populations découvertes récemment (Farinole et Morello) n’est pas confirmée.
Au niveau réglementaire, Nerium oleander figure à l’annexe II de la liste des espèces végétales protégées sur l’ensemble du territoire français métropolitain (arrêté du 20 janvier 1982, modifié par l’arrêté du 31 août 1995). Par ailleurs, le taxon se trouve dans le tome 1 du Livre rouge (Olivier et al., 1995) et il est inscrit sur les listes des espèces déterminantes de l’inventaire ZNIEFF (zones naturelles d’intérêt écologique, faunistique et floristique ; https://inpn.mnhn.fr/espece/cd_nom/109584/tab/statut) en Corse et en Provence-Alpes-Côte d’Azur. Enfin, Nerium oleander est évalué en « vulnérable » («VU») dans la Liste rouge régionale de la flore vasculaire de Corse (Delage & Hugot, 2015) et en « préoccupation mineure » (« LC ») dans la Liste rouge de la flore vasculaire de France métropolitaine (UICN France, FCBN, AFB & MNHN, 2018) et dans les listes rouges mondiale (http://www.iucnredlist.org) et européenne (http://www.iucnredlist.org/initiatives/europe).
En 2021, le Conservatoire botanique national de Corse (CBNC), dans le cadre de la rédaction de la stratégie régionale de conservation pour la flore de Corse (Piazza et al., 2021), a réalisé une hiérarchisation des taxons selon trois critères : la rareté biogéographique, la rareté locale et les menaces (vulnérabilité de l’habitat et artificialisation). L’application de ces critères à l’ensemble des taxons de la flore de Corse (hors taxons exotiques) a permis d’attribuer une note à chacun d’entre eux, allant de 15 pour les taxons à enjeu de conservation le plus fort à 3 pour les taxons à enjeu de conservation le plus faible. Nerium oleander a obtenu, en l’état des connaissances en 2021, une note de vulnérabilité de 9,5 sur 15. Il se classe, selon la méthodologie retenue, dans la catégorie d’enjeu « fort » sur l’île. Dans les étapes ultérieures de la stratégie, une action a été définie pour chaque taxon prioritaire de la stratégie régionale de conservation (c’est-à-dire pour les taxons à enjeu « fort », à score compris entre 9,5 et 11,29 et les taxons à enjeu « très fort », à score compris entre 11,3 et 15) (Piazza et al., 2022). Pour Nerium oleander, un « bilan stationnel » (note 1) a été préconisé. Ce travail a été réalisé de 2022 à 2024. Il a eu pour objectifs de rechercher et de vérifier l’état de ses sous-populations dans les différentes localités où il a été signalé et de comparer les résultats avec ceux de l’étude réalisée par Paradis (2006). Il a également permis de faire un premier inventaire des ruisseaux et rivières où des cultivars sont en cours de naturalisation.
Après une présentation de la méthodologie dans la première partie de l’article nous ferons, dans la seconde partie, un état des lieux des connaissances sur le taxon et nous présenterons, dans la dernière partie, les résultats de la campagne de terrain réalisée en Corse entre 2022 et 2024.
2. Méthodologie
Périodes de prospection. Le travail de terrain a été initié en octobre 2022 et s’est poursuivi jusqu’en octobre 2024. Les prospections des différents sites ont été effectuées par Isabelle Guyot et Carole Piazza (CBNC) sur la partie amont du Fium’Albino, le 13 octobre 2022, et par C. Piazza sur l’ensemble des sites en 2023 et 2024. Les données de terrain de Guilhan Paradis, en été 2005, ont aussi été exploitées.
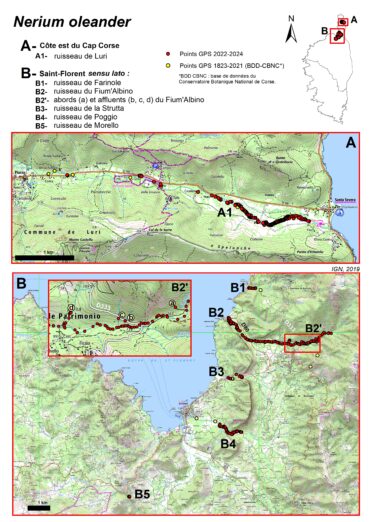
Localisation et cartographie des stations. Nous nous sommes appuyés sur la base de données floristiques Simethis, créée par le Conservatoire botanique national méditerranéen de Porquerolles et à laquelle le Conservatoire botanique national de Corse est associé (abrégé en « BDD-CBNC » dans le texte), sur la bibliographie et sur la consultation d’herbiers en ligne, dont l’herbier des Conservatoire et jardin botaniques de la ville de Genève (abrégé en «CBJ ville de Genève » dans le texte ; https://www.ville-ge.ch/musinfo/bd/cjb/chg/result.php?type_search=simple&lang=fr&criteria=Nerium+oleander&mode=tout) et l’herbier du Muséum national d’histoire naturelle de Paris (abrégé en «MNHN Paris » dans le texte ; https://science.mnhn.fr/institution/mnhn/collection/p/item/list?full_text=nerium+oleander) pour la recherche des stations « historiques», c’est-à-dire anciennement connues. Toutes ont été visitées. Quelques sites potentiellement favorables à la présence du taxon et/ou situés dans la continuité de stations existantes ont également été prospectés. Chaque individu ou groupe d’individus observés a été pointé au GPS de façon à établir une cartographie précise de la répartition du taxon sur ses différents sites de présence (planches 7, 9, 13).
Étude démographique et évolution des sous-populations. Les individus ont été comptés dans chacune des sous-populations et leur stade phénologique a été noté. Les résultats obtenus ont été comparés à ceux de l’étude de Paradis (2006). Les caractères concernant l’écologie, la biologie et la phénologie du taxon ont été notés, ainsi que les menaces pesant sur l’espèce et sur ses habitats. Enfin, une analyse des protections réglementaire et foncière a également été faite.
Détermination et nomenclature des taxons. Les espèces ont été déterminées avec les flores de Coste (1906), d’Arrigoni (2013), de Jeanmonod & Gamisans (2013), de Tison & de Foucault (2014) et de Pignatti (2017). La nomenclature suit Taxref 17 (Gargominy et al., 2022 ; Taxref, 2024) pour les noms scientifiques et Mercier (2022) pour les noms français.
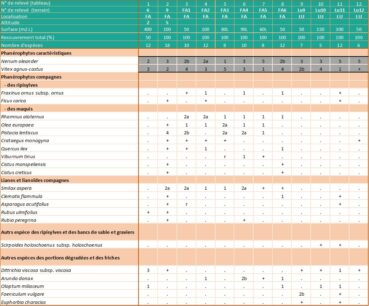
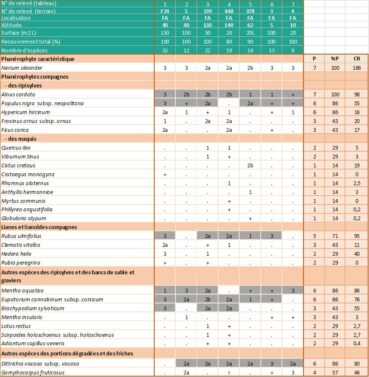
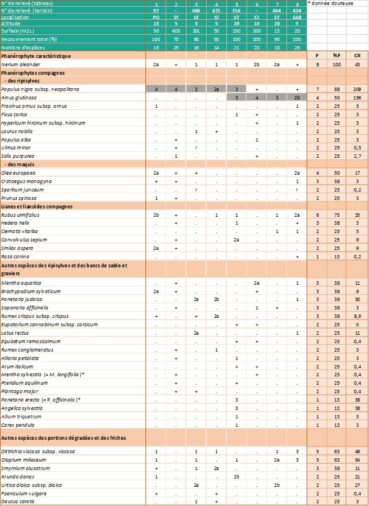
Relevés phytosociologiques. La description de la végétation se base sur quatorze de nos relevés, réalisés suivant la méthode phytosociologique sigmatiste (Géhu & Rivas-Martínez, 1981) et sur deux relevés extraits de Lhote (1985), neuf de Roger Molinier (1959) et dix de Paradis (2006). Les 35 relevés sont groupés dans l’annexe 2, tableaux 1 à 4. Les coefficients de recouvrement (CR) ont été calculés en suivant la pratique habituelle (Vanden Berghen, 1982 ; Géhu, 2006) (note 2).
La nomenclature syntaxonomique est, en général, celle du Prodrome des végétations de France (Bardat et al., 2004 ; UMS PatriNat, 2021). Elle s’appuie également sur de Bolòs (1985), Reymann et al. (2016) et Lafon et al. (2024). La nomenclature des habitats suit Corine Biotopes (Devillers et al., 1991 ; ENGREF, 1997), EUNIS (CBNC, 2016) et, dans quelques cas, le Manuel d’interprétation des habitats de l’Union européenne (Anonyme, 1999 ; Anonymous, 2007).
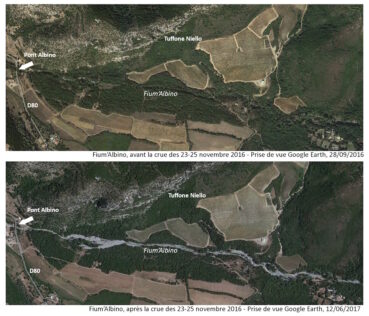
Les supports topographiques utilisés ont été les cartes au 1 : 25 000 (IGN, 2019), les photos aériennes (IGN/OEC, 2019) et, pour l’illustration de la crue de 2016 (planche 11), les images satellites Google Earth d’une partie du bassin versant du Fium’Albino, du 29/09/2016 et du 12/06/2017.
3. Présentation de Nerium oleander
3.1. Taxonomie, caryologie et synonymes
Taxonomie : Nerium oleander L., 1753 (Gargominy et al., 2022)
Caryologie : 2n = 22 (Larsen & Laegaard, 1971 in Pignatti 2017, Sicile méridionale ; Marhold & Kucera, 2016, Grèce ; Ebrahimi et al., 2021, Iran). D’après Bernard-Nenault (in Encyclopædia Universalis : https://www.universalis.fr/encyclopedie/contortales/) le génotype est très stable.
Synonymes (https://inpn.mnhn.fr/espece/cd_nom/109584/tab/taxo ; liste non exhaustive) : N. oleander L., 1753 subsp. oleander (Ortis & Arista, 2012 ; Jeanmonod & Gamisans, 2013), N. oleander L., 1753 var. oleander, N. indicum Mill., 1768, N. latifolium Mill., 1768, N. odorum Aiton, 1789, Oleander indica (Mill.) Medik., 1790, O. vulgaris Medik., 1790, N. flavescens Spin ex Roem. & Schult., 1819, N. thyrsiflorum Paxton, 1837, N. mascatense A. DC., 1844, N. kotschyi Boiss., 1846, N. oleander var. indicum (Mill.) O. Deg. & Greenwell, 1952, N. oleander subsp. kurdicum Rech. f., 1974.
Les références à deux genres (Nerium et Oleander) et à plusieurs espèces, sous-espèces ou variétés au sein du genre Nerium, trouvées dans la littérature, démontrent que la taxonomie est complexe et suscite, aujourd’hui encore, des débats. L’observation d’échantillons prélevés en divers points de l’aire de présence du Laurier-rose montre que des différences morphologiques et phénologiques existent entre les populations du pourtour méditerranéen et les populations asiatiques (Pagen, 1987 ; Tison & de Foucault, 2014). Les premières ont des corolles de taille médiocre, roses, peu odorantes, à écailles divisées en trois-quatre lobes triangulaires et à étamines inférieures au tube. Les secondes (souvent assimilées à la « var. indicum ») possèdent de grandes fleurs de couleur variable, très odorantes. La période de floraison est beaucoup plus longue. Les plantes sont moins robustes, nécessitant plus de chaleur et d’abri en culture. Les segments de la couronne sont plus longs et plus finement divisés, généralement irrégulièrement, en quatre à dix lobes filiformes. Les appendices des anthères sont saillants. Les lobes du calice sont dressés, alors qu’ils sont recourbés à leur extrémité chez le Laurier-rose méditerranéen. Les feuilles sont plus longues, plus étroites et plus largement espacées. Les plantes sud-ouest-asiatiques sont intermédiaires et souvent attribuées à la « subsp. kurdicum ».
Linnaeus (1737) a tout d’abord considéré le Laurier-rose indien comme une variété du Laurier-rose méditerranéen. Plus tard, il a rassemblé les deux taxons en un seul, Nerium oleander (Linnaeus, 1753). Enfin, dans la treizième édition de Systema Vegetabilium, il a attribué au Laurier-rose indien un statut variétal en le classant comme variété β et la forme à fleurs doubles comme variété γ (Linnaeus, 1774). Miller (1768) est le premier à avoir distingué le Laurier-rose indien comme une espèce (N. indicum Mill., 1768) et a nommé N. latifolium Mill., 1768 la forme à fleurs doubles. Ce nom a généralement été rejeté par les auteurs ultérieurs, qui l’ont plutôt considéré comme une variété du Laurier-rose indien à fleur unique. Par la suite, plusieurs autres espèces, sous-espèces ou variétés ont été décrites.
Leeuwenberg (1984), précurseur de la révision du genre Nerium L., a considéré, après avoir réalisé une étude comparative portant sur plusieurs centaines de spécimens d’herbier et sur de nombreuses plantes vivantes prélevées dans les jardins, que « tous les échantillons appartiennent à une seule espèce » et que « cette conclusion rend le genre monotypique ». Toujours d’après le même auteur, « N. oleander est même remarquablement constant, à l’exception des corolles ». Pour lui, toutes les variantes sont à rattacher au taxon décrit par Linnaeus (1753), Nerium oleander L., 1753. Certains auteurs ont admis ce résultat, qui est repris dans plusieurs flores de Méditerranée occidentale (Valdès et al., 1987 ; de Bolòs & Vigo, 1995 ; Arrigoni, 2013 ; Tison & de Foucault, 2014 ; Pignatti, 2017). C’est également le nom qui est actuellement retenu dans le référentiel taxonomique national français TaxRef. v. 17 (Gargominy et al., 2022). Par contre, d’autres auteurs, toujours en Méditerranée occidentale, ont conservé le rang subspécifique (N. oleander L. subsp. oleander) (Ortis & Arista, 2012 ; Jeanmonod & Gamisans, 2013).
Dans Flora Gallica, Tison et de Foucault (2014) notent que le genre est monospécifique. Néanmoins, ils soulignent que « l’existence d’une nette variabilité géographique, clinale ou non, semble certaine et devrait donc être traduite taxonomiquement ». Si cela advenait, il manquerait un nom pour le taxon méditerranéen, car le lectotype du nom N. oleander, désigné par W.T. Stearn (in Davis, 1978) et conservé au Natural History Museum de Londres, correspond à un spécimen cultivé, du genre indien.
Certaines études récentes apportent de nouvelles pistes de réflexion. Un premier travail de génétique a été réalisé par Portis et al. (2004) pour tenter de caractériser les cultivars. Cette étude, portant sur 71 accessions (représentant 51 variétés provenant de pépinières françaises et italiennes et 5 échantillons prélevés dans la nature, en Sicile), montre qu’un des échantillons parmi les sélections sauvages siciliennes a été le seul à ne pas être regroupé avec d’autres variétés. L’auteur émet l’hypothèse que cela pourrait confirmer sa dérivation à partir de matériel génétique autochtone plutôt que de matériel génétique naturalisé.
Des études récentes ont également été menées sur les populations iraniennes. D’après Roofigar et al. (2024), les flores d’Iran [Flora Iranica (Rechinger, 1974) et Flora of Iran (Dinarvand, 2002)] répertorient deux taxons au sein du genre : N. oleander subsp. kurdicum et N. indicum subsp. kotschyi. Le travail d’Ebrahimi et al. (2021) sur plusieurs sous-populations iraniennes conclut que des variations dans les indices caryologiques des échantillons étudiés ont été observées et que ces variations sont suffisamment significatives pour différencier les sous-populations. Sur la base de tous les paramètres caryotypiques et des indices d’asymétrie, les sous-populations méridionales (Chabahar, Fanuj et Khash), qui ont été identifiées comme N. indicum selon Flora Iranica (Rechinger, 1974), ont été séparées des sous-populations occidentales (Karaj et Kuhdasht). Les auteurs concluent qu’une étude future du caryotype chromosomique étendue à l’ensemble des sous-populations des différentes régions d’Iran pourrait être utile pour clarifier leurs relations taxonomiques.
Toujours en Iran, Roofigar et al. (2024) ont examiné les traits morphologiques quantitatifs et qualitatifs de diverses sous-populations de Nerium. Ils ont identifié deux groupes principaux correspondant aux sous-populations occidentales et méridionales. Les auteurs ajoutent cependant que « des ambiguïtés taxonomiques persistent concernant le chevauchement de certains traits morphologiques et la définition exacte des sous-espèces. Par conséquent, des études moléculaires sont recommandées pour résoudre ces ambiguïtés et confirmer les résultats des analyses morphologiques ».
Il est donc évident qu’aujourd’hui encore le problème taxonomique demeure. Une étude génétique sur l’ensemble des populations sauvages à l’échelle de l’aire de présence du taxon pourrait peut-être permettre de trancher la question.
3.2. Description morphologique (planches 1 et 2)
Nerium oleander est cultivé comme plante d’ornement. La culture a fortement développé son polymorphisme, de sorte qu’elle présente de nombreuses formes horticoles. La description du taxon présent à l’état spontané en Méditerranée est donnée ci-dessous d’après la bibliographie (Coste, 1906 ; Pignatti 1982, 2017 ; Mouterde, 1983 ; Garcia Martin, 1987 ; Herrera, 1991 ; de Bolòs & Vigo, 1995 ; Ortis & Arista, 2012 ; Arrigoni, 2013 ; Jeanmonod & Gamisans, 2013 ; Tison & de Foucault, 2014 ; Tison et al., 2014) et d’après nos observations de terrain.
Arbuste sempervirent de 1-4(6) m de haut, glabre, à suc laiteux, à tiges et rameaux dressés. Feuilles subsessiles, verticillées par 3(4), coriaces, longuement lancéolées aiguës, entières, glabres, à marge entière. Nervure centrale proéminente. Nervures secondaires fines, parallèles, serrées (50 à 70 paires). Fleurs de couleur rose clair, rarement blanche (couleur non observée lors de nos prospections sur les stations corses), peu odorantes, en corymbes terminaux bractéolés, d’environ 5,2 cm de diamètre. Calice à 5 lobes lancéolés, bien plus courts que le tube de la corolle. Corolle hypocratéiforme, à tube étroit d’environ 2 cm, à gorge munie de 5 écailles divisées en 3-4 lobes triangulaires. Écailles présentant un motif de lignes parallèles rose plus ou moins foncé descendant dans le tube. Étamines incluses, inférieures au tube, à filet court et à anthères sagittées surmontées d’un long appendice plumeux peu saillant. Stigmate à poils soyeux rassemblés en cône au-dessus du stigmate. Follicules soudés en gousse cylindracée striée-pubérulente, très longue (8-15 ´ 0,5-1,2 cm). Graines subarrondies, couvertes de nombreux poils courts et d’une touffe de poils plus longs qui s’étendent radialement lorsque l’humidité relative est faible. Le nombre moyen de graines par gousse est de 180. Toutes les parties de la plante sont toxiques.
En Corse, les sous-populations sauvages de N. oleander ont des fleurs de couleur rose clair. Néanmoins, trois individus aux fleurs de couleur rose foncé ont été observés au sein de la population spontanée du Fium’Albino (commune de Patrimonio). Le premier, en amont du pont sur la RD 333, les deux autres en aval du pont sur la RD 80. Nous ne savons pas en l’état des connaissances s’il s’agit (a) d’une variation au sein de la population spontanée, (b) d’individus résultant d’une hybridation (population spontanée/cultivar) ou (c) de la naturalisation d’un cultivar à partir de semences provenant de plantations environnantes.
3.3. Phénologie, cycle de vie et reproduction (planche 3)
En Méditerranée occidentale, la floraison a lieu de mai-juin à septembre (Briquet & de Litardière, 1955 ; Coste, 1906 ; de Bolòs & Vigo, 1995 ; Ortis & Arista, 2012 ; Jeanmonod & Gamisans, 2013 ; Tison & de Foucault, 2014 ; Tison et al., 2014). Elle est plus précoce et plus longue en Méditerranée orientale et en Asie, d’avril à octobre (Post, 1932 ; Mouterde, 1983). N. oleander commence à fleurir lorsqu’une grande partie de la floraison dans la communauté environnante est terminée. La période de floraison maximale s’étend sur les mois habituellement secs de juin et juillet. Cette floraison se traduit par la production massive de très nombreuses fleurs tubulaires voyantes. Une inflorescence peut porter jusqu’à 17 fleurs ouvertes (Herrera, 1991).
Les fleurs sont hermaphrodites. Des expériences d’autopollinisation réalisées par Pagen (1987) et Herrera (1991) montrent que Nerium oleander est autocompatible et qu’il n’y a aucun signe de séparation temporelle des fonctions mâles et femelles (Herrera, 1991). Cependant, dans la nature, l’autopollinisation se produit rarement en raison de la séparation spatiale du stigmate et des anthères. La présence de pollinisateurs est donc nécessaire pour assurer la fécondation (Herrera, 1991). Les nectaires sont situés autour de l’ovaire, à la base du tube étroit de la corolle. Cependant, une grande partie du passage est bloquée par les lobes de la couronne (écailles) et par le bouchon laineux formé par les appendices entrelacés des anthères qui rendent le passage difficile pour les insectes. Ainsi, la pollinisation ne peut être assurée que par des lépidoptères, car « seuls ces insectes ont une langue suffisamment longue pour atteindre le fond du tube de la corolle et ont la force et l’endurance nécessaires pour libérer leur langue du piège et établir la pollinisation de la fleur » (Pagen, 1987). Des recherches ultérieures (Herrera, 1991) précisent que le taux de visites par les pollinisateurs semble faible, car, malgré l’attractivité des fleurs (grandes, nombreuses et voyantes), elles sont dépourvues de nectar. L’auteur indique aussi que le pourcentage de fructification des fleurs s’est avéré extrêmement faible. En moyenne, le maximum d’ovaires se développant en fruits au sein d’une inflorescence est de quatre. Il suggère que, chez cette espèce sans nectar, environ 80 % du total sont des fleurs « en excès », qui contribuent à augmenter l’attraction des pollinisateurs.
Les fruits sont des follicules. Ils contiennent en moyenne 180 graines (jusqu’à 300), de sorte que chaque plante peut libérer des milliers de graines, malgré le faible pourcentage de nouaison (Herrera, 1991). Leur dispersion se fait par la torsion et l’enroulement des parois du follicule. Elle a lieu en hiver, de janvier à mars, pendant la saison la plus pluvieuse de l’année. Les graines, pourvues d’une aigrette, peuvent être disséminées par le vent (anémochorie). Mais elles semblent être principalement dispersées autour des pieds mères (barochorie) et dans l’eau (hydrochorie). Lorsque l’humidité relative est élevée autour d’une graine, tous les poils longs du pappus se replient le long de l’axe principal de la graine (planche 3). Ainsi, ces graines tombent beaucoup plus vite que celles dont les poils sont étendus. Herrera (1991) indique que « la capacité de dispersion réduite par le vent peut être un avantage pour un taxon dont l’habitat est limité dans l’espace et qui est entouré de vastes étendues d’habitats inadaptés. Ainsi, un taux de descente élevé des diaspores de N. oleander évite la propagation excessive des propagules transportées par le vent loin de la proximité du cours d’eau. Des épisodes occasionnels de dispersion à longue distance par rafales de vent ne peuvent pas être totalement exclus, mais il semble probable que l’anémochorie soit de moindre importance (au moins en termes de nombre de semis générés) tandis que le transport secondaire par l’eau joue un rôle majeur dans l’écologie et la distribution de l’espèce ». Des graines et des semis flottants sont d’ailleurs fréquemment observés dans la nature.
La germination suit rapidement la dissémination. Mais la plupart des semis dépérissent, principalement à cause de la dessiccation pendant la première sécheresse estivale. Les graines de N. oleander ont besoin d’un apport généreux en eau pour une germination optimale, tandis que les jeunes plants (moins d’un an) sont extrêmement sensibles à la sécheresse. Cela suffit à expliquer pourquoi, sous un climat méditerranéen, sec en été, les individus de cette espèce sont limités aux berges des cours d’eau. Les diaspores peuvent flotter pendant de longues périodes et être ainsi transportées loin en aval, ce qui doit faciliter la colonisation des berges et le développement des peuplements qui peuvent être denses (Herrera, 1991).
3.4. Chorologie (planche 4)
L’aire de présence naturelle du taxon est controversée, car la plante a été introduite comme plante ornementale dans de nombreuses régions et il est aujourd’hui difficile de savoir s’il s’agit de populations autochtones ou naturalisées (Ortis & Arista, 2012).
D’après la littérature, l’aire de répartition naturelle du Laurier-rose s’étend de la Méditerranée à la Birmanie (Pagen, 1987 ; Herrera, 1991 ; CBNC, 2020 ; POWO, 2024). Ainsi, il est présent 1/ sur tout le pourtour du bassin méditerranéen, dans les pays du Maghreb (Maroc, Algérie, Tunisie, jusqu’au Niger et à la Libye), dans la péninsule Ibérique (sud-ouest du Portugal, sud et est de l’Espagne), dans le sud-est de la France où il atteint la limite nord de son aire de distribution (Aboucaya, 2000), puis du sud de l’Italie à la Turquie, y compris en Croatie, en Albanie et en Grèce, 2/ au Moyen-Orient (Syrie, Liban, Israël, Jordanie, Iran, Irak, Arabie saoudite, Oman, États du golfe Persique), 3/ en Asie centrale (Afghanistan, Pakistan, Inde, Himalaya occidental, Birmanie). On le trouve également dans la plupart des grandes îles de la Méditerranée (Ibiza, Majorque, Corse, Sardaigne, Sicile, Malte, Crète et Chypre).
Il a aussi été largement introduit ailleurs dans les régions tempérées chaudes du monde, où il est souvent naturalisé. C’est le cas : 1/ en Amérique, aux États Unis (Alabama, Arizona, Arkansas, Caroline du Sud, Géorgie, Hawaï, Louisiane, Mississippi, Texas), en Amérique centrale et du Sud (Bélize, Brésil, Costa Rica, Guatemala, Honduras, Mexique, Nicaragua, Panama, Salvador) et dans les Caraïbes (Bermudes, Trinité-et-Tobago), 2/ en Afrique (Afrique du Sud, Cameroun, Éthiopie, Érythrée, Kenya, Sahara Occidental, Sénégal, Tchad, Zimbabwe), 3/ dans certaines îles atlantiques (Açores, Ascension, Canaries, îles du golfe de Guinée, Madère) ou du sud-est de l’Afrique (Madagascar), 4/ dans l’océan Indien (Comores, archipel des Chagos), 5/ dans l’Est asiatique (Bangladesh, Corée, Chine dont Hainan, Japon), 6/ en Australie (Nouvelle-Galles-du-Sud) et 7/ dans le Pacifique, en Nouvelle-Zélande, à Java et dans d’autres îles pacifiques (archipel Juan Fernández, archipel de la Société, archipel des Tuamotu, îles Cook, îles Gilbert, îles Kermadec, îles de la Ligne, îles Mariannes, îles Marshall, Nauru, petites îles de la Sonde, Tubuai, Vanuatu).
3.5. Écologie (planche 5)
La nériaie ne se développe que le long des cours d’eau à régime d’oued, c’est-à-dire à régime très tranché, restant sec une partie de l’année et ayant un débit variable, mais constant pendant l’autre partie. D’après Lavagne & Moutte (1971), il semble que la nériaie requière également l’une et l’autre phases. Les auteurs indiquent que « concernant la phase à sec, il est difficile d’affirmer si elle est véritablement nécessaire ou si, en empêchant l’implantation d’une ripisylve haute atlantico-européenne, elle favorise la nériaie par simple effet de concurrence ». Ainsi, la nériaie est exclue des rivières à cours permanent ; mais, inversement, elle est absente des cours d’eau à régime insuffisant. Ses besoins en eau paraissent donc assez stricts (Lavagne & Moutte, 1971).
De tels habitats ne sont pas particulièrement fréquents dans la zone d’occurrence du maquis de type méditerranéen et la plante est un exemple assez atypique d’espèce de maquis sclérophylle (Herrera, 1991). Des restes fossiles de N. oleander sont connus au moins depuis l’Oligocène (Pons & Quézel, 1985), ce qui indique qu’il s’agit d’un taxon très ancien. Il appartient à ce que Quézel (1995) a appelé l’« élément de souche paléotropicale » de la flore du maquis méditerranéen, c’est-à-dire un ensemble de taxons d’origine tropicale qui ont probablement évolué avant l’apparition du climat méditerranéen, mais qui coexistent aujourd’hui avec des taxons plus récents, purement méditerranéens.
L’influence de la température, et principalement des effets des valeurs minimales extrêmes, a aussi un effet sur l’extension et le maintien de la nériaie. Lavagne et Moutte (1971) ont montré que, dans le sud de la France, le début du gel foliaire se produit à -6,5 °C. Par contre, le gel du feuillage n’est pas total à -8 °C. Le seuil du gel des bourgeons se situe vers -12 °C et il est total à -14 °C. Les seuils du gel du cambium se situent à -14 °C et celui du bois à -15 °C.
La plante est très tolérante et adaptable (Pagen, 1987). Elle est capable de survivre aux inondations, ainsi qu’à de longues périodes de sécheresse (Leeuwenberg, 1984). Elle peut très bien pousser avec ses racines immergées. Ses branches flexibles aux feuilles tenaces, étroites et lisses et son système racinaire étendu lui permettent de survivre aux inondations (Pagen, 1987). Lors de fortes crues, certains individus peuvent plier et être entièrement couchés dans le sens du courant par la puissance de l’eau. La plupart d’entre eux restent enracinés grâce à leur système d’ancrage efficace. Dans cette situation, ils émettent sur leur tronc de nombreuses tiges orthotropes non racinées (aussi appelées suppléants ou rejets adventifs orthotropes). Ils régénèrent de cette façon leurs parties aériennes, assurant ainsi la photosynthèse et rééquilibrant leur architecture (planche 5). L’espèce est donc bien adaptée aux phénomènes de type catastrophique (crues). Par ailleurs, le Laurier-rose présente des caractéristiques typiques des xérophytes non succulentes lui permettant de résister à la sécheresse. La feuille est coriace et recouverte d’une cuticule épaisse. Les stomates sont enfoncés dans des dépressions sur la face inférieure des feuilles, ce qui évite une perte excessive d’eau en cas de vents desséchants. Des poils microscopiques dans ces dépressions réduisent encore davantage la circulation de l’air autour des stomates et donc la transpiration. Les longues racines permettent à la plante de puiser l’eau dans des nappes profondes (Pagen, 1987). Les travaux de Kumar et al. (2017) confirment la forte résistance de Nerium oleander à la sécheresse, liée principalement aux adaptations anatomiques de la structure foliaire et à l’accumulation de concentrations relativement élevées de sucres solubles pour l’équilibre osmotique, même en l’absence de stress. Leur étude montre aussi que le Laurier-rose, bien que ne pouvant pas être considéré comme une halophyte, est néanmoins assez résistant au stress salin, grâce notamment à des mécanismes efficaces pour bloquer le transport des ions toxiques vers la partie aérienne de la plante.
En Corse (planche 6), les Lauriers-roses se localisent principalement, à l’état naturel, dans les cours inférieurs de ruisseaux temporairement à sec, où ils peuvent être présents de façon plus ou moins continue (ruisseaux de Farinole, de la Strutta, de Poggio et de Luri). On les trouve toujours à plus de cent mètres en amont de l’embouchure des cours d’eau, ce qui, sur l’île, pourrait traduire une résistance très modérée à la salinité. D’autre part, ils sont habituellement présents à moins de 100 m d’altitude. Cependant, sur le Fium’Albino, le taxon remonte jusqu’à 300 m. À cette altitude, il occupe les gorges étroites du torrent et plus particulièrement les zones les plus déclives entrecoupées de vasques et de cascades. Une autre sous-population, atypique, constituée de seulement quelques individus, se trouve sur le ruisseau de Morello, de part et d’autre du pont sur la RD 62, à environ 150 m d’altitude.
Les Nerium peuvent s’implanter dans les fentes de la roche. L’enracinement est alors celui d’une chasmophyte, même si ultérieurement la souche est recouverte d’éléments alluvionnaires par la crue. Ils peuvent également s’implanter dans le lit mineur de ruisseaux constitué de sable et de blocs et parfois dans le lit majeur (ruisseaux de Luri, du Fium’Albino, de Poggio).
La végétation observée est différente suivant la portion du cours d’eau considérée. Ainsi, la syntaxonomie des groupements à Nerium oleander est complexe.
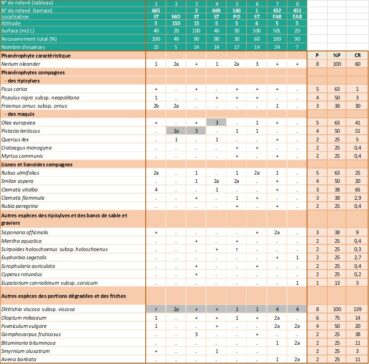
3.6. Syntaxonomie (annexe 2 : tableaux 1 à 4)
Gamisans (1991), dans son ouvrage général sur « la végétation de la Corse », classe les nériaies de Corse dans l’association du Rubo ulmifolii-Nerietum oleandri O. Bolòs 1956 (Rubo ulmifolii-Nerion oleandri O. Bolòs 1985, Tamaricetalia africanae Braun-Blanq. & O. Bolòs 1957, Nerio-Tamaricetea Braun-Blanq. & O. Bolòs (1956) 1957). À cette époque, seules les sous-populations de Saint-Florent étaient connues.
Par la suite, Paradis (2006) a étudié spécifiquement les nériaies et les vitiçaies de Corse. Ses observations de terrain ont montré qu’en Corse les tamariçaies sont présentes dans les milieux saumâtres et qu’elles ne comportent qu’exceptionnellement Nerium oleander et Vitex agnus-castus (taxons ne supportant ni un substrat gorgé d’eau, et donc asphyxiant, ni une teneur en sels élevée). Il suggère donc dans son article que l’alliance du Rubo ulmifolii-Nerion oleandri devrait être exclue de l’ordre des Tamaricetalia africanae.
Dans leur synthèse sur les Nerio-Tamaricetea, réalisée dans le cadre de leur contribution au prodrome des végétations de France, de Foucault et al. (2012) ont repris cette proposition et ont inclus le Rubo ulmifolii-Nerion oleandri dans un nouvel ordre, nommé Nerio oleandri-Viticetalia agni-casti B. Foucault, Bensettiti, Noble & Paradis 2012. D’après ce travail et d’après le prodrome des végétations de France (PVF2) (UMS PatriNat, 2021), les formations corses à Nerium oleander seraient donc à classer comme suit :
- NERIO OLEANDRI-TAMARICETEA AFRICANAE Braun-Blanq. & O. Bolòs 1958
- Nerio oleandri-Viticetalia agni-casti B. Foucault, Bensettiti, Noble & Paradis 2012
- Rubo ulmifolii-Nerion oleandri O. Bolòs 1985
- (a) Rubo ulmifolii-Nerietum oleandri Bolòs 1956
PVF2 : 46-05, Corine B. : 44.811, EUR 28 : 92D0.1, EUNIS : F9.311
- (b) Nerio oleandri-Viticetum agni-casti Paradis 2006
PVF2 : 46.08, Corine B. : 44.811/44.812, EUR 28 : 92D0(.2), EUNIS : F9.311/F9.312
Concernant la première association (a), Paradis (2006) considère qu’elle n’est pas présente en Corse. Pour l’auteur, les galeries riveraines à Vitex agnus-castus et à Nerium oleander du Fium’Albino (planche 6 ; station B2) et du ruisseau de Luri (planche 6 ; station A1) sont « caractérisées par une très forte dominance de ces deux arbustes sur Rubus ulmifolius ou toute autre espèce ». Il considère qu’il n’est donc pas justifié d’inclure ces galeries riveraines dans le Rubo ulmifolii-Nerietum oleandri et a créé, pour caractériser ces formations, une nouvelle association (b), le Nerio oleandri-Viticetum agni-casti Paradis 2006, reprise par de Foucault et al. (2012) et par Lafon et al. (2024) et qui montre, d’après Angius & Bacchetta (2009), des affinités avec le Tamarici africanae-Viticetum agni-casti Brullo & Spampinato 1997, décrit pour les rivières de la côte ionienne de la Calabre (Brullo & Spampinato, 1997) et aussi présent en Sardaigne (Angius & Bacchetta, 2009). Mais cette association ne concerne que les cours inférieurs des deux sous-populations présentant les deux taxons (Nerium oleander et Vitex agnus-castus), celle du Fium’Albino et celle de Luri (annexe 2 : tableau 1). L’auteur précise que les stations de Farinole, de la Strutta et de Poggio (planche 6 ; stations B1, B3 et B4) sont actuellement sans Vitex et ne sont donc pas à inclure dans le Nerio oleandri-Viticetum agni-casti. Il en va de même pour celle du ruisseau de Morello (planche 6 ; station B5) et pour celles des parties amont du Fium’Albino et du ruisseau de Luri (planche 6, stations B2 et A1).
L’inclusion syntaxonomique du taxon ne semble donc pas exclusive sur l’île, puisque certaines formations à Nerium ne sont pas classables dans le Nerio-Viticetum. Si l’on analyse les relevés de végétation effectués dans ces formations, on constate que la nériaie offre peu d’espèces particulières et pénètre souvent d’autres formations allant des ripisylves aux maquis. Ce trait caractérise souvent les associations ou séries en limite d’aire (Lavagne & Moutte, 1971).
Dans les zones éloignées des embouchures, où le tamaris n’est pas du tout présent et où la nériaie, parfois dense, voisine avec les ripisylves hautes, l’imprégnation des Populetalia albae Braun-Blanq. ex Tchou 1948 est manifeste (Lavagne & Moutte, 1971). On trouve notamment, et parfois avec des coefficients de recouvrement importants, Alnus glutinosa (ruisseaux de Luri, de La Strutta, de Poggio et ponctuellement de Farinole) ou Alnus cordata (ruisseau du Fium’Albino), Populus nigra subsp. neapolitana, Eupatorium cannabinum subsp. corsicum, Carex pendula et Saponaria officinalis (annexe 2 : tableaux 2 et 3).
Dans son travail, Lhote (1985) rattache les aulnaies à Alnus glutinosa et à A. cordata à l’Eupatorio corsici-Alnetum glutinosae (Litard. 1928) Dierschke 1975 (Osmundo regalis-Alnion glutinosae (Braun-Blanq., P. Silva et al. 1956) Dierschke & Rivas Mart. in Rivas Mart. 1975) et il propose, au sein de l’Eupatorio-Alnetum, la création d’une sous-association à Nerium oleander correspondant aux peuplements thermophiles, neutrophiles à calcicoles de la région de Saint-Florent. Gamisans (1991) nomme ces aulnaies ripicoles Hyperico-Alnetum Litard. 1928 nerietosum (Lhote 1985) Gamisans 1991 (= Eupatorio-Alnetum nerietosum Lhote 1985) et remplace le nom d’alliance Osmundo-Alnion par le nom Caricion microcarpae Gamisans (1968) 1975 (Populetalia albae Braun-Blanq. ex Tchou 1948, Querco roboris-Fagetea sylvaticae Braun-Blanq. & Vlieger in Vlieger 1937). Mais cette conception ne sera pas reprise par la suite. Dans un article postérieur (Gamisans, 2013), l’auteur considère que les groupements thermophiles à Vitex agnus-castus, Nerium oleander et Myrtus communis, bien que contenant diverses espèces du Caricion microcarpae et des Populetalia albae, peuvent être inclus dans les Nerio-Tamaricetea, ce qui sera repris par Reymann et al. (2017), Sciandrello et al. (2023) et Lafon et al. (2024).
Dans les relevés de végétation réalisés en Corse, les espèces compagnes (Olea europaea, Pistacia lentiscus, Rhamnus alaternus, Myrtus communis, Quercus ilex…) correspondent le plus souvent à des pénétrations d’espèces des climax environnants appartenant aux Quercetea ilicis Braun-Blanq., Roussine & Nègre 1952. Le cortège floristique comprend également de nombreuses espèces herbacées de formations plus septentrionales adaptées à l’assèchement temporaire : Mentha aquatica, Lotus rectus, Scirpoides holoschoenus subsp. holoschoenus, Pulicaria dysenterica… Enfin, dans les secteurs perturbés et dans le lit des ruisseaux constitués de sables grossiers et de blocs rocheux, Dittrichia viscosa subsp. viscosa est souvent très présente (annexe 2 : tableau 4).
À l’échelle du bassin méditerranéen, plusieurs associations ou sous-associations sont signalées dans la littérature (Biondi et al., 1995 ; Brullo & Spampinato, 1997 ; Bensettiti & Lacoste, 1999 ; Jasprica et al., 2007 ; de Foucault et al., 2012). Elles ont été classées, pour la plupart, dans les Nerio-Tamaricetea (Tamaricetalia Braun-Blanq. & O. Bolòs 1957 em. Izco et al. 1984, Rubo-Nerion oleandri O. Bolòs 1985) :
– le Rubo ulmifolii-Nerietum oleandri O. Bolòs 1956 ;
– le Spartio juncei-Nerietum oleandri Brullo & Spampinato 1997, caractérisé par la présence de Spartium junceum, Tamarix africana, Rubus ulmifolius et Calicotome infesta, présent en Sicile orientale et méridionale et sur la côte ionienne de la Calabre ;
– le Chrysopogono grylli-Nerietum oleandri Jasprica et al. 2007, pour le sud de la Croatie, seule association à Nerium présente dans le pays et qui semble proche du Spartio-Nerietum oleandri ;
– l’Andropogono distachyi-Nerietum oleandri (Jovanović & Vukičević, 1978) Jasprica et al. 2007, au Monténégro ;
– l’Aristolochio rotundae-Nerietum oleandri O. Bolòs et al. 1996, en Grèce.
Le Rubo-Nerietum et le Chrysopogono-Nerietum ont ensuite été classés par de Foucault et al. (2012) dans l’ordre des Nerio oleandri-Viticetalia agni-casti B. Foucault et al. 2012 et l’alliance du Rubo ulmifolii-Nerion oleandri O. Bolòs 1985, de même que :
– l’Erico erigenae-Nerietum oleandri Rivas Goday & Esteve 1972,
– l’Aro neglecti-Nerietum oleandri Asensi & Diez Garretas 2011,
– l’Erico scopariae-Nerietum oleandri (Lavagne & Moutte 1971) B. Foucault et al. 2012.
Cependant, plusieurs associations ou sous-associations à Nerium ont été intégrées à d’autres classes :
– celle des Salici purpureae-Populetea nigrae Rivas Mart. & Cantó ex Rivas Mart. et al. 2001 (Salicetalia purpureae Moor 1958, Tamarici-Salicion purpureae B. Foucault 1991) pour le Nerio oleandri-Salicetum purpureae Karp. 1962, présent notamment dans de petits oueds du sud de la Sardaigne et en Afrique du Nord (Biondi et al., 1995 ; Bensettiti & Lacoste, 1999 ; Angius & Bacchetta, 2009) ;
– celle des Cisto-Lavanduletea (Lavanduletalia stoechidis, Teucrion mari) pour le Stachydi glutinosae-Genistetum corsicae Gamisans & Muracciole 1984 nerietosum oleandri Biondi et al. 1995 (Biondi et al. 1995) ;
– ou celle des Lygeo-Stipetea Rivas Mart. 1977 (Hyparrhenietalia hirtae Rivas Mart. 1970, Bromo-Oryzopsion O. Bolòs 1970), pour l’Inulo viscosae-Oryzopsietum miliaceae (A. & O. Bolòs 1950) O. Bolòs 1957 nerietosum oleandri Biondi et al., 1995 (Biondi et al. 1995) ;
– ou encore, comme cela a été dit précédemment, dans celle des Querco-Fagetea.
La liste n’est pas exhaustive. Néanmoins, le complexe riverain apparaît constitué d’une intrication, à des degrés divers, d’éléments dépendant, a minima, de trois grandes unités : les Querco-Fagetea, les Salicetea purpureae et les Nerio-Tamaricetea. Une étude phytosociologique et écologique plus complète serait à entreprendre pour ces associations rares, de même peut-être qu’une révision de leur statut syntaxonomique. De plus, Nerium oleander est une espèce adaptée aux fortes perturbations liées aux crues et donc à un « rajeunissement » régulier de ses écosystèmes. Les différents stades de recolonisation des milieux seront aussi à prendre en compte et à analyser pour comprendre la dynamique de ces formations et caractériser les différentes successions végétales.
3.7. Menaces (carte 1)
La population de Laurier-rose sauvage est peu importante en Corse et uniquement localisée dans le Cap Corse. Ses effectifs sont relativement faibles sur l’île.
Les incendies ont, à plusieurs reprises, affecté la ripisylve des ruisseaux de la Strutta et de Luri. Mais le Nerium est capable de rejeter de souche et donc de se régénérer après le passage du feu si son intensité et sa fréquence ne sont pas trop fortes.
Dans la région de Saint-Florent, la mise en valeur viticole de la plaine de Patrimonio semble avoir modifié, par endroits, l’hydrologie des ruisseaux de Poggio et de la Strutta, ce qui a eu pour conséquence la disparition d’une partie du peuplement et son fractionnement. Conrad indiquait en 1979 que les « deux stations près de Saint-Florent sont en voie de disparition : celle proche du pont de Stretti a été victime d’un défrichage et celle de Poggio ne bénéficie plus du voisinage de la petite rivière ; elle a été captée » (Conrad, 1980).
Les crues violentes entraînent un rajeunissement des formations végétales présentes au niveau des ripisylves. Mais N. oleander est adapté à ces phénomènes de type catastrophique et profite en général de l’ouverture du milieu pour coloniser rapidement les berges des ruisseaux et ses abords. Il peut, dans un premier temps, devenir nettement dominant. Puis il régresse lorsque la ripisylve à Populus nigra subsp. neapolitana, Alnus glutinosa ou Alnus cordata gagne en hauteur et se densifie. C’est ce qui se produit actuellement sur le ruisseau du Fium’Albino, suite aux fortes crues de 2016.
Le Laurier-rose présente une grande variabilité de formes, de tailles et de couleurs. Ses feuilles peuvent être ou non panachées, ses fleurs simples ou doubles, de couleurs très variées, odorantes ou non. Pour cela, il a été, et est toujours, largement utilisé comme plante ornementale. En Corse, il a été massivement planté dans les jardins, les parcs et en alignement le long des routes. De fait, des cultivars se sont naturalisés et sont assez dynamiques, dans plusieurs cours d’eau du sud-est de la Corse (Osu, Cavu, Solenzara) et dans le Fango, à l’ouest de l’île (carte 1). Des cultivars ont également été plantés à proximité des zones de présence du Nerium indigène (régions de Luri et de Saint-Florent). Des phénomènes d’introgression sont donc possibles entre les populations sauvages et les cultivars. C’est peut-être déjà le cas sur le ruisseau du Fium’Albino, puisque trois individus aux fleurs de couleur rose foncé ont été observés au sein de la population sauvage. Ce phénomène sera à surveiller dans les années à venir et à caractériser.
4. État des lieux des sous-populations corses en 2024
4.1. Historique des découvertes en Corse (planche 6)
Comme l’indiquent Briquet & de Litardière (1955), l’espèce est connue dans le bassin calcaire de Saint-Florent depuis la première moitié du xixe siècle. Le premier signalement a été fait par Soleirol, en 1823 : « Golfe de Saint-Florent près des marais », ce qui correspond probablement à la sous-population du ruisseau de Poggio (Herbier MNHN Paris, n° MNHN-P-P04533833), qui sera, à nouveau, signalée par de Litardière en 1937 et par Deschâtres en 1976 (Deschâtres 1989). Briquet et de Litardière (1955) indiquent deux autres localités : 1/ celle du Fium’Albino signalée par Rikli en 1926, mais déjà observée sur ce ruisseau par Rotgès en 1907 (Herbier MNHN Paris, n° MNHN-P-P04533804), puis par Hibon en 1908 (Herbier MNHN Paris, n° MNHN-P-P04220994) et 2/ celle du ruisseau de la Strutta, signalée par de Litardière en 1937.
En 1970, une importante sous-population a été découverte sur la côte est du Cap Corse, sur la commune de Luri, par Conrad (1971) : « abondant sur les rives plus ou moins broussailleuses du ruisseau de Luri, entre Piazza et l’embranchement de la route de Tufo » (commune de Luri). En 1983, Gamisans observera le taxon beaucoup plus en aval, jusqu’à environ un kilomètre de l’embouchure du ruisseau, au niveau du lieu-dit Cullicine (Gamisans, 2004).
Récemment, deux autres petites sous-populations ont été trouvées dans le secteur de Saint-Florent sensu lato : 1/ sur la commune de Farinole, entre l’embouchure du ruisseau du même nom et le pont sur la RD 80, par Paradis en 2005 (Paradis, 2006) et 2/ sur la commune de Piève, sur le ruisseau de Morello, au niveau du pont sur la RD 62, par Delage & Suberbielle, en 2017 (BDD-CBNC).
4.2. Statut des sites
À l’échelle de la Corse, la population de Nerium oleander (planche 6) ne bénéficie que de très peu de protections ou de réglementations. La sous-population de Poggio est, en partie, intégrée au réseau Natura 2000 (site FR9400599 « Strette de Saint-Florent ») et est entièrement classée en zone naturelle d’intérêt écologique faunistique et floristique (ZNIEFF) de type I, n° 940013101 « Défilé des Strettes et collines de Saint-Florent »). Cette ZNIEFF intègre également la totalité de la sous-population du ruisseau de la Strutta. La sous-population du Fium’Albino se trouve dans la ZNIEFF 940031071 « Ponte Albinu et ses abords » et celle de Luri dans la ZNIEFF 940031052 « Basse vallée du ruisseau de Luri ».
Les ruisseaux de Farinole et de Morello ne bénéficient d’aucun statut.
4.3. Étude des sites
Côte est du Cap Corse (planches 6 à 8)
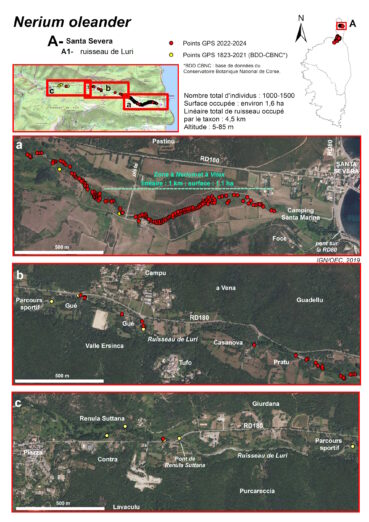
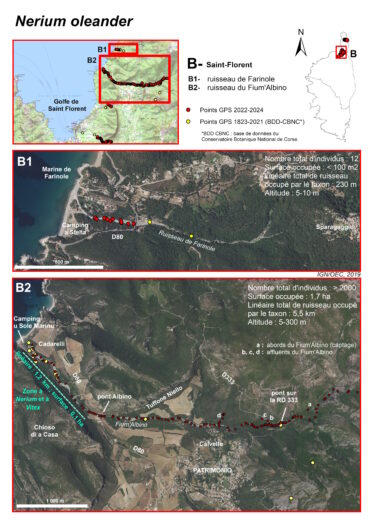
Ruisseau de Luri (commune de Luri) (planches 6 à 8 ; annexes 1 et 2 : tableau 1, relevés 9 à 12)
Le ruisseau de Luri résulte de la convergence de plusieurs ruisseaux à forte pente et à régime torrentiel, prenant leur source près des crêtes qui entourent la vallée du même nom : en rive droite, le monte Alticcione (1 139 m), le monte Grofiglieta (836 m) et le monte Rottu (650 m), en rive gauche, le monte Populu (514 m), la punta di a Filetta Suprana (590 m) et le monte Acutu (364 m).
Ces ruisseaux se rejoignent au niveau du hameau de Piazza, à moins de 100 m d’altitude, puis la vallée s’élargit progressivement pour atteindre près de 500 m de large dans sa section terminale, tandis que la pente du cours d’eau s’amenuise considérablement. La longueur totale du ruisseau de Luri est d’environ 6 km et la superficie de son bassin versant de 113 km2. Il coule d’ouest en est et se jette 200 m au sud du port de Santa Severa.
De 90 à 20 m d’altitude, l’écoulement est subpermanent. Les Nerium sont d’abord présents de façon ponctuelle, sur près de 3 km, entre le hameau de Piazza (vers le pont de Renula Suttana) et le lieu-dit Pratu. Puis, ils forment des peuplements plus denses entre le lieu-dit Pratu et la piste face au hameau de Pastinu, sur environ 1 km. Dans ces secteurs, la ripisylve est constituée principalement d’Alnus glutinosa, du moins lorsque celle-ci n’a pas été détruite par les incendies.
Dans la partie aval du ruisseau, à partir de la piste face au hameau de Pastinu à 20 m d’altitude et jusqu’au lieu-dit Foce à 5 m d’altitude, soit sur plus d’1 km, l’écoulement devient saisonnier (oued). Les Nerium oleander sont relativement denses et présents de façon continue le long du ruisseau. Ils forment dans ce secteur un peuplement mixte avec les Vitex agnus-castus. En période de floraison, ces deux taxons marquent le paysage de la basse vallée et il est d’ailleurs surprenant qu’aucun botaniste n’ait signalé cette localisation de Nerium avant 1970 (Conrad, 1971).
Le peuplement mixte de Nerium oleander et de Vitex agnus-castus n’est donc localisé que dans le secteur où le ruisseau est à sec une partie de l’année, sur une superficie d’environ 1,1 ha. Sa présence a motivé l’inscription de la basse vallée en ZNIEFF de type I « 940031052 – Basse vallée du ruisseau de Luri ». C’est le peuplement mixte le plus étendu de Corse.
La superficie totale occupée par les Nerium, dans la vallée de Luri, est d’environ 1,6 ha, et leur nombre total d’individus est compris entre 1 000 et 1 500.
Le ruisseau de Luri peut être soumis à de fortes crues, qui ont été particulièrement catastrophiques en 1920 et 1947. Sa vallée a été parcourue par de nombreux incendies, dont le dernier, en août 2007, s’est propagé aux boisements de la ripisylve. Mais la plupart des Lauriers-roses et Gattiliers se sont régénérés à partir de leurs souches.
Actuellement, cette sous-population de Nerium n’est pas très dynamique et est constituée presque exclusivement d’individus adultes. Très peu de germinations et de jeunes plants ont été observés en 2024. La stabilité du milieu depuis plusieurs années (pas de crues importantes, ni d’incendies récents) peut sans doute expliquer l’absence de recrutement. Pourtant, globalement, cette sous-population est en bon état et ne semble plus subir de pressions particulières.
Saint-Florent sensu lato (planches 6, 9 et 13)
Ruisseau de Farinole (commune de Farinole) (planches 6, 9, 10 ; annexes 1 et 2 : tableau 3, relevé 8 et tableau 4, relevés 7, 8)
Le ruisseau de Farinole coule d’est en ouest. Il draine un bassin versant très pentu et très boisé, constitué en amont de schistes lustrés et en aval de molasses et calcaires du miocène (SOGREAH, 2004). Il résulte de la réunion de plusieurs autres ruisseaux prenant naissance sur les crêtes qui entourent la vallée de Farinole (monte Pinzutu, 708 m ; monte Pinatelle, 984 m ; monte San Leonardo, 968 m ; cima di Gratera, 1024 m). Sa longueur est de moins de 3 km. Dans sa partie amont, le lit du Farinole est bien individualisé, sinueux et très étroit, ce qui a pour effet d’accélérer les écoulements. En aval, l’embouchure du ruisseau est barrée par un cordon de galets et forme, en l’absence de crue, un petit étang bordé de Tamarix africana. En période de crue, les vitesses d’écoulement sont assez importantes pour évacuer très rapidement ce bouchon qui n’a ainsi pas d’incidences sur les écoulements (SOGREAH, 2004). Les crues peuvent être très destructrices. Lors de celle de 1993, l’ouvrage de franchissement de la RD 333, au droit du hameau de Poggio, sur le Farinole, a été détruit (SOGREAH, 2004). En novembre 2016, une autre crue a fortement impacté la partie aval du ruisseau et sa végétation. La ripisylve à Alnus glutinosa a été en partie détruite, notamment en aval du pont sur la RD 80.
Les Nerium ont été observés pour la première fois sur ce site, en 2005, par Paradis (2006). À cette époque, une quinzaine d’individus a été dénombrée, la plupart de petite taille, sur un linéaire d’environ 200 m, entre le pont sur la RD 80 et l’arrière de l’étang à Tamarix africana (à près de 150 m de l’embouchure). En 2024, les prospections ont été étendues. Aucun individu n’a été observé dans le secteur situé en amont du pont sur la RD 80, car le ruisseau est très encaissé et la végétation relativement dense. Sur la partie aval, seuls douze individus étaient présents, la plupart de petite taille (sept individus de 0,2 à 1 m de hauteur) et seulement cinq individus reproducteurs de taille inférieure à 2 m. Dans ce secteur, le lit mineur, à sec une partie de l’année, est constitué de blocs, de dalles et de galets, colonisés essentiellement par Dittrichia viscosa subsp. viscosa et quelques rares jeunes Nerium. Les blocs et galets situés le plus haut topographiquement constituent le lit majeur et sont exceptionnellement mobilisés par l’eau courante. En rive droite, une partie de la ripisylve à Alnus glutinosa a été emportée lors de la crue de 2016. La végétation est aujourd’hui constituée principalement de chaméphytes et d’hémicryptophytes (Dittrichia viscosa subsp. viscosa, Eupatorium cannabinum subsp. corsicum, Foeniculum vulgare, Hypericum hircinum subsp. hircinum, Oloptum miliaceum, Saponaria officinalis, Smyrnium olusatrum…) et de quelques rares phanérophytes (Ficus carica, Fraxinus ornus subsp. ornus et Populus nigra subsp. neapolitana). Un peu plus haut sur la berge se trouvent des Olea europaea. En rive gauche, la berge est érodée et en contact direct avec les formations des Quercetea ilicis (Myrtus communis, Olea europaea, Pistacia lentiscus, Quercus ilex, Rhamnus alaternus, Viburnum tinus), au sein desquels se trouvent quelques éléments de la ripisylve (Alnus glutinosa, Fraxinus ornus subsp. ornus, Populus nigra subsp. neapolitana) et d’autres phanérophytes arbustives et lianescentes (Crataegus monogyna, Clematis flammula, Cytisus scoparius, Lonicera implexa, Osyris alba, Rosa canina, Rubus ulmifolius, Smilax aspera, Vitis vinifera) et des espèces herbacées (Lotus rectus, Mentha aquatica, Parietaria judaica…).
Nerium oleander n’est donc présent que dans la partie terminale du ruisseau de Farinole, sur un linéaire d’environ 200 m. Il occupe une surface totale de moins de 100 m2. On trouve le taxon sur les deux rives et quelques rares individus se situent dans le lit mineur du ruisseau. Il s’agit d’une très petite sous-population, découverte récemment et qui a peu évolué entre 2005 (Paradis, 2006) et 2024, malgré l’ouverture du milieu liée à la crue de 2016. En raison du manque de données anciennes, il est difficile de savoir si la présence des Nerium sur ce site est ou non récente et si son aire de présence était ou non plus étendue par le passé. Par ailleurs, nous manquons de données pour statuer sur l’origine de cette sous-population. La morphologie des fleurs (forme des écailles et insertion des étamines dans le tube) et la situation du taxon dans l’aire de présence du Nerium indigène pourraient indiquer qu’il s’agit d’individus sauvages. Mais par ailleurs, plusieurs espèces exotiques provenant de jardins voisins (Paraserianthes lophantha, Sesbania punicea) se naturalisent dans la partie aval du ruisseau et des cultivars de Nerium sont présents dans les jardins environnants. Ainsi, seules des études plus complètes (morphologie, génétique…) pourraient permettre d’en savoir plus. Quoi qu’il en soit, le nombre restreint d’individus reproducteurs peut, aujourd’hui, expliquer la faible dynamique des Nerium sur ce site.
Ruisseau du Fium’Albino (commune de Patrimonio et ponctuellement commune de Farinole) (planches 6, 9, 11, 12 ; annexes 1 et 2 : tableau 1, relevés 1 à 8 et tableau 2)
Le Fium’Albino coule également d’est en ouest et naît de la convergence de plusieurs ruisseaux prenant leur source en altitude, sur la façade ouest des crêtes du Cap Corse, au niveau de la Serra di Pigno (Pigno, 960 m d’altitude ; monte Mussone, 930 m ; monte San Columbana, 839 m ; cima di Gratera, 1 024 m). Il se situe presque intégralement sur la commune de Patrimonio, mais une petite partie du champ d’inondation à l’exutoire est située sur celle de Farinole. La partie haute de son bassin versant présente de très fortes pentes. Dans cette zone, il traverse des terrains constitués de roches magmatiques (serpentinites), recouvertes d’un maquis dense. Le Fium’Albino traverse ensuite une vallée constituée de molasses du Miocène, restée naturelle et utilisée localement pour la viticulture (SOGREAH, 2004). Sa longueur est d’environ 6 km. La pente du Fium’Albino décroît très progressivement. Ce cours d’eau peut être découpé en trois parties (SOGREAH, 2004) :
- partie amont ; le ruisseau est un véritable torrent à caractéristiques montagneuses, avec une pente moyenne de 26 %, qui se termine par un tronçon à 9 %. La puissance des écoulements dans ce secteur confère au torrent une grande capacité de transports solides. Une partie des volumes transportés sont déposés dans le secteur à faible pente. L’amont du cône de déjection du Fium’Albino peut être localisé au droit du lieu-dit Calvella ;
- partie moyenne ; entre l’ancien moulin de Patrimonio (à environ 1,2 km en amont de la RD 80) et le pont du Fium’Albino sur la RD 80, la pente moyenne est de 3 %. La vallée commence alors à s’élargir, témoignant des anciens dépôts ;
- extrémité aval ; au droit du camping U Sole Marinu, situé à l’embouchure du ruisseau, les hauteurs d’eau en lit majeur peuvent atteindre jusqu’à 1 m et d’éventuelles divagations du lit mineur peuvent se produire, ce qui a conduit le propriétaire du camping à édifier des enrochements pour protéger ses bungalows.
Le ruisseau du Fium’Albino, comme celui de Farinole, a un caractère torrentiel. Ses crues peuvent être brutales. L’activité érosive du cours d’eau dans sa partie amont a entrainé, lors des crues catastrophiques du 23 au 26 novembre 2016, le transport de quantités importantes de sédiments (sables, blocs) qui se sont déposés dans la partie aval. La ripisylve à Populus nigra subsp. neapolitana et à Alnus cordata, qui depuis plusieurs décennies était très dense, a été en grande partie détruite par le courant et les sédiments, blocs et troncs charriés par les eaux.
La végétation de l’extrémité aval du cours d’eau a été décrite par Paradis (2006). À 150 m de l’embouchure du ruisseau et sur un linéaire de près d’un kilomètre, le long du ruisseau : 1/ le lit mineur est surtout colonisé par Dittrichia viscosa subsp. viscosa, Foeniculum vulgare, Helichrysum italicum subsp. italicum et, principalement dans la partie amont de la zone, par de jeunes plants de Nerium (de 5 cm de hauteur à plus d’1 m) ; 2/ la basse terrasse fluviatile et les rives du lit mineur abritent un peuplement mixte à Nerium oleander et Vitex agnus-castus, classable dans le Nerio oleandri-Viticetum agni-casti. Cette formation s’étend sur environ 0,1 ha. Les espèces les plus fréquentes sont des espèces du maquis (Myrtus communis, Olea europaea, Pistacia lentiscus, Rhamnus alaternus…), des espèces des fruticées basses et claires (Cistus creticus et C. monspeliensis, Cytisus spinosus, Euphorbia linifolia et E. pithyusa, Glaucium flavum, Globularia alypum, Gomphocarpus fruticosus, Salvia rosmarinus, Spartium junceum, Stachys glutinosa, Teucrium flavum). Arundo donax peut aussi être abondant par endroits.
Plus en amont, entre le pont sur la RD 80 et le pont sur la RD 333, les Vitex disparaissent et les Nerium sont associés à Alnus cordata et Populus nigra subsp. neapolitana. On trouve fréquemment : 1/ dans la strate arbustive, Ficus carica, Fraxinus ornus subsp. ornus, Laurus nobilis…, 2/ dans la strate herbacée, Brachypodium sylvaticum, Eupatorium cannabinum subsp. corsicum, Equisetum ramosissimum, Hypericum hircinum subsp. hircinum, Mentha aquatica, et 3/ des lianoïdes (Clematis vitalba, Smilax aspera, Rubus ulmifolius…) et, au contact de la ripisylve, des espèces des Quercetea ilicis. Lhote (1985) nomme cette formation « aulnaie ripicole méditerranéenne neutrophile et thermophile (Corse), faciès à Aulnes cordés (Eupatorio-Alnetum sous-association à Nerium oleander) », nom corrigé par Gamisans (1991) en Hyperico-Alnetum Litard. 1928 nerietosum (Lhote 1985) Gamisans 1991.
Vers 100 m d’altitude (au niveau du pont sur la RD 333) et jusqu’à l’extrémité amont du ruisseau, les gorges deviennent étroites et la pente s’accentue. Le peuplier noir disparaît, tandis que l’Aulne cordé se maintient dans des proportions moindres et que les espèces des Quercetea ilicis prennent le dessus.
Le Laurier-rose est connu sur le site depuis le début du xxe siècle. Rotgès semble être le premier à l’avoir observé, en 1907 (Herbier MNHN Paris, n° MNHN-P-P04533804). Mais, jusqu’à présent, il était surtout signalé dans la partie aval du ruisseau, de l’embouchure jusqu’au pont sur la RD 80. Ainsi, Roger Molinier (1959) a effectué des relevés de végétation vers l’embouchure du ruisseau ; Lhote (1985) en a réalisé à 40 m d’altitude, probablement vers le pont sur la RD 80, et Paradis (2006) a également étudié ce même tronçon. Certains habitants de Patrimonio (Christian Andreani et Isabelle Guyot, comm. pers.) avaient signalé, depuis plusieurs années, la présence du Laurier-rose près du pont de Molino Sutano et en amont du pont sur la RD 333, près des captages de la commune. Mais ces secteurs n’avaient pas été étudiés jusqu’à aujourd’hui et la limite amont du Nerium n’était pas connue.
La crue de 2016 a eu pour conséquence une ouverture importante du milieu (planche 11). Depuis huit ans, le Nerium, espèce plutôt héliophile, a largement profité des espaces laissés vacants pour coloniser la totalité du ruisseau. Il a ainsi été observé, en 2023-2024, depuis la confluence du Fium’Albino avec les ruisseaux provenant de Monti Lividi, à près de 300 m d’altitude, jusqu’à 150 m de l’embouchure (planche 9), de façon quasi continue, sur un linéaire de près de 5,5 km. L’aire de présence du taxon est estimée à environ 1,7 ha, ce qui fait de cette sous-population l’une des plus importantes de Corse avec celle de Luri. L’espèce a également été trouvée sur plusieurs petits affluents du Fium’Albino, en rive droite : sous la RD 333 (points notés « b » et « c » sur la planche 9) et au niveau du pont de Molino Sutano (point noté « d » sur la planche 9). Enfin, elle est présente, toujours en rive droite, à plus de 100 m du ruisseau, près d’un captage, à environ 450 m en amont de la RD 333 (point noté « a » sur la planche 9).
La population est très dynamique. Elle compte au moins 2 000 individus, dont 800 reproducteurs. Toutes les classes d’âge sont représentées, sur les berges et dans le lit du ruisseau. On trouve ainsi de très nombreux jeunes plants de quelques centimètres de hauteur jusqu’à des individus adultes dont les plus hauts peuvent atteindre 6 m. Certains sujets adultes de plusieurs mètres de haut, présents avant 2016, ont été couchés dans le ruisseau par la crue et présentent actuellement de nombreuses tiges orthotropes sur leur tronc. Aujourd’hui, la ripisylve est en train de se reconstituer. Les peupliers, également très dynamiques, atteignent 2-3 m de hauteur et le milieu commence à se refermer. Il sera intéressant de suivre l’évolution de cette sous-population de Nerium, dans les années à venir.
Toute la basse vallée, depuis l’embouchure du ruisseau, jusqu’au pont Albino sur la RD 80 est classée en ZNIEFF de type I « 940031071 « Ponte Albinu et ses abords ». Celle-ci englobe aussi la partie du littoral rocheux située au sud-ouest de la plage de Cadarelli (Punta di Saeta, Punta Vecchiaia) qui abrite le rare Limonium patrimoniense Arrigoni & Diana, 1993.
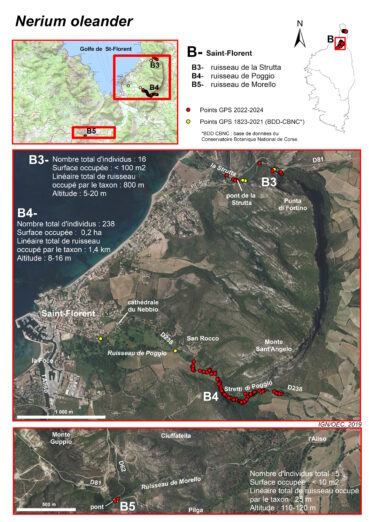
Ruisseau de la Strutta (commune de Patrimonio et ponctuellement communes de Barbaggio et de Saint-Florent) (planches 6, 13, 14 ; annexes 1 et 2 : tableau 3, relevés 2 à 7 ; tableau 4 relevés 1, 3, 4, 6)
Ce ruisseau se trouve dans le défilé des Strette, entre les collines calcaires de la Teia au nord et celles du monte Sant’Angelo au sud. Il résulte de la convergence des ruisseaux de Vaccareccia, de Natio et de Forci, qui prennent leur source sur la façade ouest des crêtes du Cap Corse (jusqu’à plus de 700 m d’altitude pour le Lucitello, affluent du Natio). Ces ruisseaux traversent la vaste plaine viticole de Patrimonio et se rejoignent à l’entrée est du défilé des Strette.
La sous-population de Nerium de la Strutta est connue depuis longtemps (Molinier René, 1954 ; Briquet & de Litardière, 1955). Roger Molinier (1959, 1962-1963) et Lhote (1985) y ont effectué des relevés de végétation. Molinier (1959, tableau VII-Nériaie, relevé 1), pour un relevé de 100 m2 de surface, attribue un coefficient de recouvrement de 3 au Nerium. De plus, la cartographie des « groupements végétaux terrestres et des biocénoses et biotopes marins » du Cap Corse, réalisée par ce même auteur (in Molinier, 1959), montre un « groupement des lits de torrents à Laurier-rose » continu entre la confluence des ruisseaux de Vaccareccia, de Natio et de Forci et l’embouchure du ruisseau de la Strutta (mais cette carte est à l’échelle de 1/80 000 et donc peu détaillée). Plus tard, le relevé de Lhote (1985), de 150 m2, donne un coefficient de 1 pour Nerium et Conrad (1980) indique que « les deux stations naturelles près de Saint-Florent sont en voie de disparition : celle du pont de Stretti a été victime d’un défrichage ». Ainsi, cette sous-population, qui semble avoir été plus importante par le passé, paraît avoir décliné, au moins à partir des années 1980, en lien avec les activités humaines et le développement de la plaine viticole de Patrimonio (défrichage, remblaiement, comblements partiels et modification du tracé des berges, dépôts divers…). Aujourd’hui, elle n’est plus constituée que de quelques pieds isolés : sept (dont cinq reproducteurs) dans le défilé des Strette, deux reproducteurs, juste en amont du pont sur la RD 81, et sept (dont trois reproducteurs) en aval du pont. Au total, cette sous-population compte seize individus, dont huit reproducteurs, tous de taille inférieure à 2-3 m. Sa surface est inférieure à 100 m2. Il s’agit aujourd’hui d’une station relictuelle.
Les individus isolés de Nerium se trouvent actuellement dans des groupements composés de restes de ripisylve à Alnus glutinosa et Populus nigra subsp. neapolitana, de rares espèces des Quercetea ilicis et surtout d’espèces de milieux rudéralisés (Arundo donax, Dittrichia viscosa subsp. viscosa, Oloptum miliaceum, Parietaria judaica, Smyrnium olusatrum, Urtica dioica subsp. dioica…). Les formations à Nerium du ruisseau de Strutta se situent à plus de 500 m de son embouchure et ne comportent pas Vitex agnus-castus. Elles ne sont pas classables dans le Nerio oleandri-Viticetum agni-casti. Lhote (1985) nomme cette formation « aulnaie ripicole méditerranéenne neutrophile et thermophile (Corse), faciès à Aulnes glutineux (Eupatorio-Alnetum sous-association à Nerium oleander », nom corrigé par Gamisans (1991) en Hyperico-Alnetum Litard. 1928 nerietosum (Lhote 1985) Gamisans 1991. Cette formation a été très fortement dégradée au cours du temps par les activités anthropiques.
Ruisseau de Poggio (communes de Poggio-d’Oletta et de Saint-Florent) (planches 6, 13, 15 ; annexes 1 et 2 : tableau 3, relevé 1 ; tableau 4, relevé 5)
Ce ruisseau se localise dans le défilé des Stretti di Poggio, entre le monte Sant’Angelo au nord et le monte Silva Mala au sud. Il résulte de la convergence des ruisseaux de Brietta, Raticcio, Frescajo, Olivella et Mezzano, qui prennent leur source, à plus de 700 m d’altitude pour certains, sur la façade ouest des crêtes du Cap Corse, entre le col de Teghime au nord et la cime du Zuccarello au sud. De forte pente dans leur partie amont, ces ruisseaux traversent ensuite la plaine viticole d’Oletta, dont l’altitude décroît progressivement d’environ 100 m, à moins de 20 m. Ils convergent ensuite à l’entrée des Stretti di Poggio. Le ruisseau de Poggio se jette dans le golfe de Saint-Florent, au niveau du port. Il longe la ville dans sa partie terminale.
Les Nerium ont été signalés pour la première fois sur ce site, en 1937, par de Litardière : « rivière de Stretto (ou de Focajolo) ; surtout abondant dans le défilé, le peuplement offrant sa densité maximum un peu en amont du pont de Stretto » (Briquet & de Litardière, 1955). La sous-population se trouve actuellement à plus de 1,5 km de l’embouchure du ruisseau. Elle forme un peuplement peu dense, mais quasi continu, sur 1,4 km, jusqu’à la sortie est des Stretti di Poggio. Son altitude est toujours inférieure à 20 m. Elle occupe (a) le lit mineur du ruisseau, à sec en été et constitué de galets et de limon, (b) les berges, (c) mais elle peut aussi s’éloigner ponctuellement du ruisseau et occuper le lit majeur. Un individu adulte est notamment situé à 40 m du ruisseau. La population est estimée à plus de 200 individus, sur une surface d’environ 0,2 ha.
La végétation du lit mineur comprend des espèces herbacées, dont Amaranthus deflexus, Chenopodium album, Convolvulus arvensis, Cynodon dactylon, Dittrichia viscosa subsp. viscosa, Hypericum hircinum, Mentha aquatica, Mercurialis annua, Oloptum miliaceum, Polygonum aviculare, Pulicaria dysenterica, Saponaria officinalis, Verbascum sinuatum… et des Nerium de tailles variables, avec quelques gros sujets et de nombreux jeunes de hauteur inférieure à 20-30 cm. Dans la partie aval de la station, avant l’entrée dans les Stretti di Poggio, sur les berges et là où le lit majeur est relativement large, les Nerium se trouvent en mosaïque avec de vieux oliviers. Le cortège floristique comprend, en plus d’Olea europaea, d’autres phanérophytes (Crataegus monogyna, Ficus carica, Pistacia lentiscus, Prunus spinosa, Rhamnus alaternus…) et des espèces herbacées des friches (Carlina corymbosa, Daucus carota, Dipsacus fullonum, Dittrichia viscosa subsp. viscosa, Foeniculum vulgare, Scolymus hispanicus…). Plus en amont, dans la partie la plus resserrée des Stretti di Poggio, Rubus ulmifolius est nettement dominant le long des berges, en contrebas des falaises. Cette formation pourrait s’apparenter au Rubo ulmifolii-Nerietum oleandri (Rubo ulmifolii-Nerion oleandri, Nerio oleandri-Viticetalia agni-casti, Nerio-Tamaricetea). Enfin, en amont des Stretti, le lit majeur s’agrandit à nouveau. Les Nerium se trouvent soit avec Olea europaea, soit au sein de la ripisylve à Populus nigra subsp. neapolitana et Alnus glutinosa, lorsque celle-ci n’a pas été détruite lors de la mise en valeur viticole de la plaine. Cette formation n’est, là non plus, pas classable dans le Nerio oleandri-Viticetum agni-casti, mais plutôt dans ce que Lhote (1985) nomme « aulnaie ripicole méditerranéenne neutrophile et thermophile (Corse), faciès à Aulnes glutineux (Eupatorio-Alnetum sous-association à Nerium oleander) », nom corrigé par Gamisans (1991) en Hyperico-Alnetum Litard. 1928 nerietosum (Lhote 1985) Gamisans 1991. Conrad (1980) indique que « les deux stations naturelles près de Saint-Florent sont en voie de disparition : celle de Poggio ne bénéficie plus du voisinage de la petite rivière ; elle a été captée ». Cette formation a certes été dégradée au cours du temps par les activités anthropiques, mais elle semble se maintenir et est toujours dynamique, puisque de jeunes individus sont visibles, notamment dans le lit mineur du ruisseau.
NB : Les agents du syndicat mixte du Grand Site de France « Conca d’Oru, vignoble de Patrimonio, golfe de Saint-Florent », dans le cadre de la réhabilitation de plusieurs sentiers de randonnées sur leur territoire d’intervention, ont indiqué au CBNC la présence de Nerium oleander sur le ruisseau de Frescajo, à mi-chemin entre le pont sur la RD 238 et le pont sur la RD 38. Pour vérifier cette donnée, le secteur a été prospecté le 20/09/2023, sans résultat pour l’instant.
Ruisseau de Morello (commune de Pieve) (planches 6, 13, 16 ; annexes 1 et 2 : tableau 4, relevé 2)
En 2017, A. Delage et N. Suberbielle (BDD-CBNC) ont observé un Nerium en fleurs, sur le ruisseau de Morello, juste en amont du pont sur la RD 62. Les caractéristiques morphologiques des fleurs pourraient correspondre à celles d’une population naturelle. En 2023, nous avons pu dénombrer cinq pieds de part et d’autre du pont, quatre en amont (un individu fleuri de 2,5 m de hauteur et trois non fleuris de 20 à 70 cm de hauteur) et un individu non fleuri de 1 m en aval du pont.
En aval du pont, de gros blocs anguleux sont visibles. Leur présence fait suite aux travaux de stabilisation de la route de part et d’autre du pont. Le milieu a donc été récemment remanié. Mais cela ne semble pas avoir eu de conséquence notable sur cette micro-population. Comme pour la sous-population de Farinole, des études complémentaires seraient nécessaires pour confirmer qu’il s’agit bien d’individus sauvages et le ruisseau devra être prospecté dans sa totalité.
4.4. Synthèse des données (annexe 1)
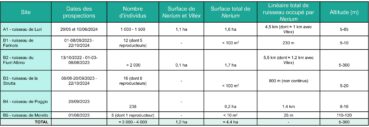
Six sous-populations ont été signalées en Corse. Toutes ont été recherchées entre octobre 2022 et octobre 2024 et toutes ont été revues. Pour la plupart, aucun changement notable par rapport à l’étude de Paradis (2006) n’est à signaler. Par contre, l’aire de présence du Nerium sur le Fium’Albino a été considérablement étendue grâce aux nouvelles prospections et sa limite amont semble être à 300 m d’altitude. Deux localisations peu précises restent à rechercher. La première, « à Patrimonio, en remontant un petit torrent au-dessus de la route de Bastia à 2 km en amont du village, quelques pieds dans le lit du torrent et entre les rochers voisins, 250 m » (Deschâtres, 1988 et Herbier CJB de la ville de Genève, n° G00239366). La seconde, sur le ruisseau de Frescajo (comm. écrite du 08/09/2023, Clémence Quenot, chargée de mission Développement et ingénierie de projets, syndicat mixte du Grand Site de France « Conca d’Oru, vignoble de Patrimonio-golfe de Saint-Florent »). L’annexe 1 synthétise les données pour chacune des sous-populations. La population totale de l’île est estimée à 3 000-4 000 individus, occupant une surface de moins de cinq hectares.
Concernant les six sous-populations où le taxon a été revu, une se trouve (pour partie) dans un périmètre Natura 2000 (ruisseau de Poggio), quatre sont classées en ZNIEFF de type I (ruisseau de Luri pro parte, ruisseau du Fium’Albino pro parte, ruisseau de la Strutta, ruisseau de Poggio pro parte), deux ne bénéficient d’aucun statut (ruisseau de Farinole et ruisseau de Morello). Aucune d’entre elles n’appartient au Conservatoire du littoral, aucune ne bénéficie d’un arrêté préfectoral de protection de biotope et aucune ne se trouve en réserve naturelle. Ainsi, les sous-populations de Nerium ne bénéficient pas, pour la plupart, de réglementation forte.
5. Conclusions et perspectives (planche 17)
Dans la BDD du CBNC, le taxon est signalé dans six mailles de 5 km ´ 5 km, entre les années 1823 et 2021. Entre 2000 et 2021, période retenue dans le cadre du travail sur la stratégie de conservation « flore » pour la Corse, du CBNC, on dénombre également six mailles de présence, ce qui a contribué au classement du taxon dans la catégorie d’enjeu de conservation « fort ». Enfin, sept mailles de présence sont notées en 2024, soit une de plus que sur les autres périodes considérées. Cette maille supplémentaire correspond à la partie amont du ruisseau du Fium’Albino qui n’avait pas été prospectée dans sa totalité ou qui l’avait été partiellement par deux d’entre nous (Isabelle Guyot et Guilhan Paradis), mais qui n’avait pas fait l’objet d’une publication. Quelle que soit la période de référence (1823-2021, 2000-2021 ou 2022-2024) et selon la méthodologie retenue, le taxon reste évalué en enjeu de conservation « fort ».
Nerium oleander, espèce protégée au niveau national, n’est pas endémique de Corse, mais il est rare sur l’île et il ne compte que peu de sous-populations. Au cours des dernières décennies, certaines d’entre elles ont été soumises à de fortes pressions (incendies, défrichage, modification des conditions hydrologiques, remblaiement des berges et dépôts divers…), qui ont pu conduire à un fractionnement de leur superficie, à une réduction de leur effectif (Strutta) et à des modifications de leurs habitats. Aujourd’hui, la situation semble s’être stabilisée dans les zones les plus impactées : 1/ Luri, où les incendies sont moins fréquents depuis une vingtaine d’années, 2/ Poggio et la Strutta, où la mise en valeur viticole des plaines de Patrimonio et d’Oletta est stoppée de fait, au niveau des Strette, par le rempart naturel que constituent les falaises calcaires des monte Sant’Angelo, monte Silva Male et Teia. À l’exception de la sous-population du Fium’Albino (dont la connaissance de l’aire de présence a été considérablement étendue en 2022-2024, grâce à l’effort de prospection), peu de différences ont été observées par rapport à ce qu’a décrit Paradis en 2005 (2006). Néanmoins, si les impacts liés aux activités humaines semblent moindres, l’évaluation en « VU » (vulnérable) dans la Liste rouge régionale de la flore vasculaire de Corse (Delage & Hugot, 2015) nous semble toujours justifiée. La vulnérabilité de ses habitats, le faible nombre d’individus et de sous-populations, mais aussi l’introgression possible par les cultivars plantés massivement ou encore les changements globaux ou de nouvelles atteintes portées aux cours d’eau et à leur environnement proche sont autant de facteurs qui pourraient fragiliser le taxon, d’autant plus que les protections sont peu nombreuses et partielles. Il conviendrait donc d’accroître ces protections, que ce soit au niveau réglementaire ou au niveau foncier. Actuellement, seule une partie de la sous-population de Nerium de Poggio est classée en Natura 2000 (environ 40 %). La possibilité d’étendre ce périmètre à l’ensemble de la station, en y intégrant également celle de la Strutta doit être étudiée, de même que la création d’arrêtés de protection de biotope ou l’achat de certaines parcelles sensibles par des collectivités locales ou des organismes publics.
Des mesures d’amélioration des connaissances doivent également être envisagées. Il s’agit de :
- la prospection systématique de tous les ruisseaux du Cap Corse et des alentours de Saint-Florent (affluents de l’Aliso dont le ruisseau de Morello), affluents du ruisseau de Poggio dont les ruisseaux de Brietta, Raticcio, Frescaja, Olivella et Mezzano, affluents du Fium’Albino dont le ruisseau de Culaia, ruisseaux entre Patrimonio et Barbaggio, ruisseau d’u Guadu Grande entre Ogliastro et Albo, ruisseaux de la marine de Giottani, du golfu d’Aliso, de Tollare, de l’Acqua Tignese… ;
- la réalisation d’études phytosociologiques et écologiques complémentaires et, si besoin, la révision du statut syntaxonomique des groupements à Nerium oleander;
- pour le Fium’Albino, la mise en place du suivi de l’évolution de la population de Nerium au cours du temps et la réalisation d’études sur la dynamique de recolonisation des berges après la crue de 2016 et sur la caractérisation des différentes successions végétales ;
- la recherche et la cartographie fine des stations de Nerium exogènes et subspontanées le long des cours d’eau ;
- la mise en place d’une opération de veille sur l’apparition de cultivars ou d’hybrides dans les stations naturelles.
Plus globalement, la réalisation d’un bilan stationnel réactualisé des sous-populations du sud de la France permettrait de vérifier la pertinence du classement du Nerium en « LC » (préoccupation mineure) dans la Liste rouge de la flore vasculaire de France métropolitaine. Enfin, concernant le taxon, une étude génétique réalisée sur l’ensemble des populations sauvages, à l’échelle de son aire de présence, pourrait peut-être permettre de régler le problème taxonomique et de savoir, à l’échelle de la Corse, si les sous-populations de Farinole et de Morello sont bien indigènes.
Notes
Note 1. « Bilan stationnel (site inventory) d’un taxon, des taxons ou d’une communauté végétale : méthode d’inventaires spécifiques de terrain pour toutes les stations avérées et historiques ou pour un nombre représentatif de stations (si N > 20), avec relevé des informations précises sur l’état des populations ou des communautés végétales (Le Berre et al., 2019). Cet état des lieux sert également à évaluer l’état de conservation d’une espèce ou d’une communauté végétale » (RESEDA-FLORE (coord.), 2024).
Note 2. Les coefficients de recouvrement (CR) ont été légèrement modifiés pour les coefficients 2a et 2b, c’est-à-dire en donnant les valeurs suivantes (quantités moyennes) aux coefficients d’abondance-dominance : 5 = 87,5 ; 4 = 62,5 ; 3 = 37,5 ; 2b = 18,5 ; 2a = 8,5 ; 1 = 2,5 ; + = 0,2 ; r = 0,1. Ainsi, dans chaque relevé, la quantité moyenne des coefficients d’abondance-dominance a été additionnée pour chacun des taxons et la somme obtenue a été divisée par le nombre total des relevés du tableau, puis multipliée par 100 pour obtenir le CR.
Annexe 1
Annexe 2 : Tableaux phytosociologiques
Les taxons ne figurant que dans un seul relevé ont été retirés des tableaux. La liste de ces taxons est donnée en fin d’annexe.
Rel. 1 : Farinole, lit de l’Albino (FA), en aval du pont, Molinier 1959 p. 42 ; rel. 2 : embouchure de l’Albino (FA) à Farinole, Molinier 1959 p. 42 ; rel. 3 à 8 : Fium’Albino (FA), août 2005, Paradis, 2006, p. 83 ; rel. 9 à 12 : Luri (LU), août 2005, Paradis, 2006, p. 83.
Rel. 1 : fiche 24, Fium’Albino (FA), 22 mai 1985, Lhote, 1985 p. 112 ; rel. 2 : Farinole, lit de l’Albino (FA), en aval du pont, Molinier 1959, p. 42 ; rel. 3 : Fium’Albino (FA), 150 m en aval du pont de la RD 333, 01/08/2023, C. Piazza ; rel. 4 : Fium’Albino (FA), 50 m en amont du pont de la RD 333, 09/08/2023, C. Piazza ; rel. 5 : Fium’Albino (FA), à environ 800 m en amont du Pont Albino, berge érodée, en limite du maquis, 01/08/2023, C. Piazza ; rel. 6 et 7 : Farinole, lit de l’Albino (FA), en amont du pont, Molinier 1959 p. 42.
Rel. 1 : extrémité amont du ruisseau de Poggio, peu après la jonction entre les ruisseaux de Brietta et de Mezzano, 20/09/2023, C. Piazza ; rel. 2 : embouchure du Natio, à la sortie ouest du défilé des Strette à Saint-Florent (ST), Molinier, 1959 p. 39-40 ; rel. 3 : ruisseau de la Strutta, rive gauche, à quelques mètres en aval du pont de la RD 81, 22/10/2024, C. Piazza ; rel. 4 : ruisseau de la Strutta, en aval du pont sur la RD 81, rive gauche, sur un talus parallèle au ruisseau, 22/10/2024, C. Piazza ; rel. 5 : fiche 16, la Strutta (ST), 22 mai 1985, Lhote, 1985 p. 103 ; rel. 6 : Saint-Florent, défilé des Strette (ST), Molinier, 1959 p. 42 ; rel. 7 : ruisseau de la Strutta, au pied de la falaise, à environ 550 m en amont du pont de la RD 81, 08/08/2023, C. Piazza ; rel. 8 : marine de Farinole, en aval du pont sur la D 80, en rive gauche, 08/08/2023, C. Piazza.
Rel.1 : ruisseau de la Strutta (ST), juste en amont du pont sur la RD 81,rive gauche, 22/10/2024, C. Piazza ; rel. 2 : ruisseau de Morello (MO), juste en amont du pont, en rive droite, 08/08/2023, C. Piazza ; rel. 3 : Saint-Florent, défilé des Strette (ST), Molinier, 1959 p. 42 ; rel. 4 : ruisseau de la Strutta (ST), en aval du pont sur la RD 81, rive gauche, sur un talus parallèle au ruisseau, 22/10/2024, C. Piazza ; rel. 5 : Stretti di Poggio (PO), en rive gauche, 20/09/2023, C. Piazza ; rel. 6 : Saint-Florent, défilé des Strette (ST), Molinier, 1959 p. 42 ; rel. 7 : marine de Farinole (FAR), en aval du pont sur la D 80, en rive droite, 08/08/2023, C. Piazza ; rel. 8 : marine de Farinole (FAR), juste en aval du pont sur la D 80, 08/08/2023, C. Piazza.
Les taxons ne figurant que dans un seul relevé ont été retirés des tableaux.
Tableau 1 – rel. 1 : liane ou lianoïde compagne : Convolvulus sepium (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Mentha aquatica (1), Eupatorium cannabinum subsp. corsicum (+), Glaucium flavum, (+), Mentha insularis (+), Pulicaria dysenterica (+) ; autre espèce des portions dégradées et des friches : Gomphocarpus fruticosus (+) ; rel. 2 : phanérophyte compagne des ripisylves : Alnus cordata (+) ; phanérophyte compagne des maquis : Phillyrea angustifolia (+) ; autre espèce des portions dégradées et des friches : Asphodelus ramosus subsp. ramosus (+) ; rel. 4 : phanérophyte compagne des ripisylves : Populus nigra subsp. neapolitana (+) ; phanérophyte compagne des maquis : Myrtus communis (+) ; rel. 8 : phanérophyte compagne des maquis : Coronilla valentina (+) ; rel. 9 : autres espèces des portions dégradées et des friches : Dipsacus fullonum (1), Scolymus hispanicus (+) ; rel. 11 : autre espèce des ripisylves et des bancs de sable et graviers : Melissa officinalis subsp. altissima (+) ; rel. 12 : phanérophyte compagne des maquis : Malva olbia (+) ; liane ou lianoïde compagne : Clematis vitalba (+).
Tableau 2 – rel. 1 : phanérophytes compagnes des ripisylves : Laurus nobilis (1), Salix alba (+) ; lianes et lianoïdes compagnes : Convolvulus sepium (1), Smilax aspera (1), Asparagus acutifolius (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Allium triquetrum (2a), Melica minuta (2a), Parietaria officinalis (2a), Viola reichenbachiana (2a), Carex pendula (1), Equisetum ramosissimum (1), Prunella vulgaris (+), Ranunculus lanuginosus (+), Helleborus argutifolius (+) ; autres espèces des portions dégradées et des friches : Borago officinalis (1), Galium mollugo (1), Oloptum miliaceum (1), Galium aparine (+) ; rel. 2 : autres espèces des ripisylves et des bancs de sable et graviers : Cyperus rotundus (+), Pulicaria dysenterica (+) ; autre espèce des portions dégradées et des friches : Dittrichia graveolens (+) ; rel. 3 : phanérophyte compagne des ripisylves : Platanus orientalis (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Bellium bellidioides (+), Carex distachya (+) ; rel. 5 : autres espèces des ripisylves et des bancs de sable et graviers : Arundo donax (2a), Bituminaria bituminosa (1), Foeniculum vulgare (1), Daucus carota (+) ; rel. 6 : phanérophytes compagnes des ripisylves : Populus alba (+), Salix purpurea (+) ; rel. 7 : autres espèces des ripisylves et des bancs de sable et graviers : Juncus articulatus (+), Scrophularia auriculata (+).
Tableau 3 – rel. 1 : autre espèce des ripisylves et des bancs de sable et graviers : Pulicaria dysenterica (+) ; rel. 2 : phanérophyte compagne des ripisylves : Platanus orientalis (+) ; lianes et lianoïdes compagnes : Clematis flammula (+), Rubia peregrina (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Alisma plantago-aquatica (+), Cyperus rotundus (+) ; rel. 3 : autre espèce des portions dégradées et des friches : Dipsacus fullonum (1) ; rel. 4 : autres espèces des portions dégradées et des friches : Dysphania ambrosioides (+), Euphorbia characias (+), Mercurialis annua (+) ; rel. 5 : phanérophyte compagne des ripisylves : Salix atrocinerea (+) ; phanérophyte compagne des maquis : Sambucus nigra (+) ; autre espèce des portions dégradées et des friches : Silene latifolia (+) ; rel. 6 : liane ou lianoïde compagne : Dioscorea communis (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Potentilla reptans (2a), Carex microcarpa (+), Mentha insularis (+), Scrophularia auriculata (+), Symphytum bulbosum (+) ; rel. 7 : liane ou lianoïde compagne : Vitis vinifera (2a) ; autre espèce des portions dégradées et des friches : Gomphocarpus fruticosus (+) ; rel. 8 : phanérophytes compagnes des maquis : Quercus ilex (2b), Viburnum tinus (2a), Cistus creticus (+), Myrtus communis (+), Pistacia lentiscus (+) ; autre : Paraserianthes lophantha (+) ; liane ou lianoïde compagne : Rosa canina (+) ; autre espèce des ripisylves et des bancs de sable et graviers : Melissa officinalis subsp. altissima (1) ; autres espèces des portions dégradées et des friches : Bituminaria bituminosa (1), Papaver rhoeas (1), Andryala integrifolia (+).
Tableau 4 – rel. 1 : phanérophyte compagne des ripisylves : Platanus orientalis (+) ; autres espèces des portions dégradées et des friches : Arundo donax (1), Dipsacus fullonum (1) ; rel. 3 : phanérophyte compagne des ripisylves : Ulmus minor (+) ; rel. 4 : phanérophyte compagne des ripisylves : Laurus nobilis (2a) ; phanérophytes compagnes des maquis : Cistus creticus (1), Spartium junceum (1) ; rel. 5 : phanérophyte compagne des ripisylves : Rhamnus alaternus (+) ; autres espèces des ripisylves et des bancs de sable et graviers : Rumex crispus subsp. crispus (+), Arum italicum (r) ; rel. 6 : phanérophyte compagne des ripisylves : Hypericum hircinum (+) ; rel. 7 : phanérophyte compagne des ripisylves : Viburnum tinus (1) ; autre : Sesbania punicea (+) ; liane ou lianoïde compagne : Asparagus acutifolius (+) ; autres espèces des portions dégradées et des friches : Daucus carota (1), Andryala integrifolia (+), Kickxia commutata subsp. commutata (+), Papaver rhoeas (+).
Bibliographie
Aboucaya A., 2000. Recensement du Laurier-rose botanique dans les cours d’eau londais. Préconisations de gestion pour préserver ce patrimoine biologique exceptionnel. Commande n° 7747. Rapport Conservatoire botanique national méditerranéen/commune de La Londe-les-Maures, 17 p. + annexes.
Angius R. & Bacchetta G., 2009. Boschi e boscaglie ripariali del Sucis-Iglesiente (Sardegna Sud-Occidentale, Italia. Braun-Blanquetia 45 : 3-63.
Anonyme, 1999. Natura 2000. Manuel d’interprétation des habitats de l’Union européenne. EUR 15/2. Commission européenne. DG Environnement. Protection de la nature, zones côtières et tourisme, 127 p.
Anonymous, 2007. Interpretation Manual of European Union Habitats – EUR 27. European Commission DG Environment – Nature and Biodiversity, 142 p.
Arrigoni P.V., 2013. Flora dell’Isola di Sardegna, 4. Società Botanica Italiana, Carlo Delfino editore, 584 p. (Nerium oleander, p. 175).
Bardat J., Bioret F., Botineau M., Boullet V., Delpech R., Géhu J.-M., Haury J., Lacoste A., Rameau J.-C., Royer J.-M., Roux G. & Touffet J., 2004. Prodrome des végétations de France. Patrimoines naturels 61 (Publications scientifiques du Muséum national d’histoire naturelle, Paris), 171 p.
Bensettiti F. & Lacoste A., 1999. Les ripisylves du nord de l’Algérie : essai de synthèse synsystématique à l’échelle de la Méditerranée occidentale. Ecologia mediterranea 25 (1) : 13-39.
Biondi E., Vagge I., Fogu M.-C. & Mossa L., 1995. La vegetazione del letto ciottoloso dei fiumi della Sardegna meridionale (Italia). Colloques phytosociologiques XXIV, Fitodynamica : 813-825.
Bolòs O. (de), 1985. A proposit de les comunitats de Nerium oleander. Collectanea Botanica (Barcelona) 16 : 227-228.
Bolòs O. (de) & Vigo J., 1995. Flora dels Països Catalans (Pirolàcies – Compostes), III, 1230 p. (Nerium oleander, p. 131-132).
Briquet J. & de Litardière R., 1955. Prodrome de la flore corse, III, partie 2. Lechevalier, Paris, 264 p. (Nerium oleander, p. 58-59).
Brullo S. & Spampinato G., 1997. Indagine fitosociologica sulle ripisilve della Calabria (Italia meridionale). Lazaroa 18 : 105-151.
CBNC (Conservatoire botanique national de Corse), 2016. EUNIS – Liste pour la Corse. Système d’information européen sur la nature. Classification des habitats. Office de l’environnement de la Corse-CBNC, Corte, 32 p.
CBNC (Conservatoire botanique national de Corse), 2020. Atlas biogéographique de la flore de Corse. Albiana – Office de l’environnement de la Corse, Ajaccio : 607 p. (Nerium oleander, p. 346).
Conrad M., 1971. Contributions à l’étude de la flore de la Corse (suite). Le Monde des plantes 370-371 : 1-14 (Nerium oleander, p. 14).
Conrad M., 1980. Contributions à l’étude de la flore de la Corse (suite). Le Monde des plantes, 401 : 1-7 (Nerium oleander, p.14).
Coste H., 1906. Flore descriptive et illustrée de la France, de la Corse et des contrées limitrophes. Albert Blanchard, Paris, 2, nouveau tirage (1998), 627 p. (Nerium oleander, p. 545).
Davis P.H., 1978. Flora of Turkey and the East Aegean Islands. Edinburgh, University Press, 6, 825 p. (Nerium oleander : p. 159).
Delage A. & Hugot L., 2015. Liste rouge régionale de la flore vasculaire de Corse. Conservatoire botanique national de Corse, Office de l’environnement de la Corse, Corte, 72 p.
Deschâtres R., 1988. Nerium oleander L. subsp. oleander. In D. Jeanmonod & H.-M. Burdet, Notes et contributions à la flore de Corse III, Candollea 43 : 334-408 (Nerium oleander, p. 355).
Deschâtres R., 1989. Carex pendula Hudson. In D. Jeanmonod & H.-M. Burdet, Notes et contributions à la flore de Corse IV, Candollea 44 : 337-401 (Nerium oleander, p. 347).
Devillers P., Devillers-Terschuren J., Ledant J.-P. (& collab.), 1991. CORINE biotopes manual. Habitats of the European Community. Data specifications – Part 2. EUR 12587/3 EN. European Commission, Luxembourg, 300 p.
Dinarvand M., 2002. Apocynaceae. In M. Assadi, M. Khatamsaz & A.A. Maassoumi (eds.), Flora of Iran (n°. 41). Research Institute of Forests and Rangeland Publication.
Ebrahimi F., Ghorbani Nohooji M. & Miri S.M., 2021. First karyotype analis of Nerium oleander populations in Iran. Rosaniha 22 (2) : 186-193.
Eggenberger R. & Eggenberger M.H., 1996. The Handbook on Oleanders. Tropical Plant Specialist, Cleveland, Georgia, US., 156 p., https://archive.org/details/lbg.635.9.ric.2451/page/n9/mode/2up.
ENGREF, 1997. Nomenclature CORINE Biotopes. Types d’habitats français (travail réalisé par M. Bissardon & L. Guibal, sous la direction de J.-C. Rameau). Muséum national d’histoire naturelle, Paris, 217 p.
Foucault B. (de), Bensettiti F., Noble V. & Paradis G., 2012. Contribution au prodrome des végétations de France : les Nerio oleandri –Tamaricetea africanae Braun-Blanq. et O. Bolòs 1958. Journal de botanique 58 : 41-54.
Gamisans J., 1991. La végétation de la Corse. In D. Jeanmonod & H.M. Burdet (eds), Compléments au prodrome de la flore corse, annexe 2, 391 p.
Gamisans J., 2004. Nerium oleander L. subsp. oleander. In D. Jeanmonod & A. Schlussel, Notes et contributions à la flore de Corse XX, Candollea 59 (1) : 65-94 (Nerium oleander, p. 74).
Gamisans J., 2013. Forêts marécageuses, ripisylves et fruticées ripicoles de Corse. Bulletin de la Société botanique du Centre-Ouest, n. s., 44 : 383-452.
Garcia Martin F., 1987. Nerium oleander. In B. Valdès, S. Talavera & E. Fernández-Galiano, Flora Vascular de Andalucía Occidental, 2, Ketres Editora S.A., 640 p. (Nerium oleander, p. 346).
Gargominy O., Tercerie S., Regnier C., Ramage T., Dupont P., Daszkiewicz P. & Poncet L., 2022. TAXREF, référentiel taxonomique pour la France : méthodologie, mise en œuvre et diffusion. Rapport PatriNat (OFB-CNRS-MNHN), Muséum national d’histoire naturelle, Paris, 47 p.
Géhu J.-M., 2006. Dictionnaire de sociologie et synécologie végétales. J. Cramer, Berlin-Stuttgart, 899 p.
Géhu J.-M. & Rivas-Martínez S., 1981. Notions fondamentales de phytosociologie. Berichte der Internationalen Symposien der Internationalen Vereinigung für Vegetationskunde, Syntaxonomie : 5-33.
Herrera J., 1991. The reproductive biology of a riparian Mediterranean shrub, Nerium oleander L. (Apocynaceae). Botanical Journal of the Linnean Society 106 : 147-172.
https://data.nhm.ac.uk/dataset/collection-specimens/resource/05ff2255-c38a-40c9-b657-4ccb55ab2feb/record/4695840 [13/11/2024].
https://inpn.mnhn.fr/espece/cd_nom/109584/tab/statut [13/11/2024]
https://inpn.mnhn.fr/espece/cd_nom/109584/tab/taxo [13/11/2024]
http://www.iucnredlist.org [13/11/2024]
http://www.iucnredlist.org/initiatives/europe [13/11/2024]
https://science.mnhn.fr/institution/mnhn/collection/p/item/list?full_text=nerium+oleander [13/11/2024]
https://www.universalis.fr/encyclopedie/contortales/ : Contortales, un type, l’oléandre ou Laurier-rose, article écrit par C. Bernard-Nenault [13/11/2024]
https://www.ville-ge.ch/musinfo/bd/cjb/chg/result.php?type_search=simple&lang=fr&criteria=Nerium+oleander&mode=toutt [13/11/2024]
IGN, 2019. Cartes à 1 : 25 000, TOP 25 (4347 OT-Cap Corse). Institut national de l‘information géographique et forestière.
IGN/OEC, 2019. Photographies aériennes, mission Corse. Institut national de l’information géographique et forestière.
Jasprica N., Ruščić M. & Kovačić, 2007. The Chrysopogono grylli-Nerietum oleandri association in Croatia as compared with other Rubio ulmifolii-Nerion oleandri communities (Tamaricetalia, Nerio-Tamaricetea) in the Mediterranean. Plant Biosystems 141 (1) : 40-50.
Jeanmonod D. & Gamisans J., 2013. Flora Corsica, 2e éd. Bulletin de la Société botanique du Centre-Ouest, n. s., n° sp. 39, 1074 p. (Nerium oleander : p. 625).
Kumar D., Al Hassan M, Naranjo M.A., Agrawal V., Boscaiu M. & Vicente O., 2017. Effects of salinity and drought on growth, ionic relations, compatible solutes and activation of antioxidant systems in oleander (Nerium oleander L.). PLoS ONE 12 (9) : e0185017, 1-22, https://doi.org/10.1371/ journal.pone.0185017.
Lafon P., Argagnon O., Belaud A. Catteau E., Causse G., Corriol G., Culat A., Delassus L., Dumoulin J., Gaudillat V., Goret M., Mangeat M., Millet J., Noble V., Paulin D. & Soucanye de Landevoisin C.-A., 2024. Catalogue de la végétation de France métropolitaine (CatVeg). Harmonisation jusqu’au rang de la sous-alliance et répartition départementale. Bulletin de la Société botanique du nord de la France, numéro spécial 1 : 1-372.
Lavagne A. & Moutte P., 1971. Premières observations chorologiques et phénologiques sur les ripisylves à Nerium oleander (Nériaies) en Provence. Annales de l’Université de Provence 45 : 135-155.
Le Berre M., Pires M. & Diadema K., 2019. Typification des actions – Que faire pour quelle espèce en région Provence-Alpes-Côte d’Azur ? Rapport inédit, CBNMéd, région PACA, 17 p. + ann.
Leeuwenberg A.J.M., 1984. Part XII, notes of Nerium L. and Tabernaemontana L. Mededelingen Landbouwhogeschool Wageningen 83-7 : 57-60.
Linnaeus C., 1737. Hortus Cliffortianus. Amstelaedami (Amsterdam). 76.
Linnaeus C., 1753. Species Plantarum. Holmiae (Stockholm). Laurentius Salvius. I : 209.
Linnaeus C., 1774. Systema Vegetabilium. Gottingae (Göttingen) et Gothae (Gotha), Jo. Christ. Dietrich. Ed. 13.
Lhote P., 1985. Étude écologique des aulnes dans leur aire naturelle en France. IDF-ENGREF – Université Franche-Comté, Laboratoire de taxonomie et de phytosociologie, 120 p. + cartes 1 à 8.
Marhold K. & Kucera J., 2016. Reports. In IAPT/IOPB Chromosome data 22. Taxon 65 (5) : 1200-1207 (Nerium oleander : p. 1206), https://www.jstor.org/stable/taxon.65.5.1200 [20/11/2024].
Mercier D. P., 2022. Noms français normalisés de la flore vasculaire de France métropolitaine. Evaxiana 9 : 5-570.
Miller P., 1768. The Gardener’s Dictionary. London, J. & F. Rivington et al., ed. 8 : 2-3.
Molinier R., 1954. Les climax côtiers de la Méditerranée occidentale. Vegetatio IV : 284-308.
Molinier R., 1959. Étude des groupements végétaux terrestres du Cap Corse. Bulletin de la Société et du musée d’histoire naturelle de Marseille 19 : 75 p.
Molinier R., 1962-1963. Notice explicative de la carte des groupements végétaux terrestres et des biocénoses et biotopes marins du Cap Corse. 10 p., carte en couleurs, Institut géographique national.
Mouterde P., 1983. Nouvelle Flore du Liban et de la Syrie, 3. Dar El-Machreq SARL, Beyrouth, 578 p. (Nerium oleander, p. 24).
Olivier L., Galland J.-P., Maurin H. & Roux J.-P., 1995. Livre rouge de la flore menacée de France, I – Espèces prioritaires. Muséum national d’histoire naturelle, service du Patrimoine naturel, Conservatoire botanique national de Porquerolles, ministère de l’Environnement, Paris, IXXXVI + 486 + CLIX (Nerium oleander, p. 318).
Ortis P.L. & Arista M., 2012. Nerium oleander. In P.L. Ortis, Arista S. et al. (eds.), Flora Iberica – plantas vasculares de la Península Ibérica e Islas Baleares, XI – Gentianaceae-Boraginaceae, Real Jardín Botánico, CSIC, Madrid, 672 p. (Nerium oleander, p. 103-105).
Pagen F.J.J., 1987. Series of revisions of Apocynaceae, part XX – Oleanders, Nerium L. and the oleander cultivars. Agricultural University Wageningen Papers, 87-2, NL : 1-113.
Paradis G., 2006. Répartition en Corse et description phytosociologique des stations des deux espèces protégées Nerium oleander et Vitex agnus-castus. Journal de botanique de la Société botanique de France 33 : 49-91.
Piazza C., Spinosi P., Quiquerez I., Delage A. & Hugot L., 2021. Stratégie de conservation de la flore vasculaire de Corse, 1re partie – Hiérarchisation des taxons et détermination des enjeux de conservation. Conservatoire botanique national de Corse/Office de l’environnement de la Corse, 102 p.
Piazza C., Spinosi P., Delage A. & Hugot L., 2022. Stratégie de conservation de la flore vasculaire de Corse, 2e partie – Typification des actions, priorisation et choix des projets. Conservatoire botanique national de Corse/Office de l’environnement de la Corse, 104 p.
Pignatti S., 1982. Flora d’Italia, volume secondo. Edagricole, Bologna, 732 p. (Nerium oleander, p. 348).
Pignatti S., 2017. Flora d’Italia, seconda edizione, in 4 volumi , volume terzo. Edagricole, Milano, 1287 p. (Nerium oleander, p. 131).
Pons A. & Quézel P., 1985. The history of the flora and vegetation and past and present human disturbance in the Mediterranean région. In C. Gomez-Campo (éd.), Plant conservation in the Mediterranean area, Geobotany 7 : 25-43.
Portis E., Comino C., Lenzi A., Lombardi P. & Tesi R., 2004. Amplified fragment length polymorphism for variety identification and genetic diversity assessment in oleander (Nerium oleander L.). Euphytica 136 : 125-137.
Post G.E., 1932. Flora of Syria, Palestine and Sinai, second edition, extensively revised and elarged by John Dinsmore, American University of Beirut, Publications of the Faculty of arts and sciences, Natural sciences series, Number 1), Volume 2. Beyrouth, American Press, 928 p. + cartes.
POWO, 2024. Plants of the World Online, https://powo.science.kew.org/taxon/urn:lsid:ipni.org:names:80460-1 [13/11/2024].
Quézel P., 1995. La flore du bassin méditerranéen : origine, mise en place, endémisme. Ecologia Mediterranea XXI (1-2) : 19-39.
Rechinger K.H., 1974. Apocynaceae. In K.H. Rechinger (ed.), Flora Iranica (n° 103), Akademische Drucku. verlagsanstalt.
Reseda-Flore (coord.), 2024. Glossaire pour la conservation de la flore et des milieux naturels méditerranéens. Version 2. CBNMED, CBNA, CBNC, CBNMC, CEFE-CNRS, AMAP, IMBE, ISEM, LESSEM, Tour du Valat, 15 p.
Reymann J., Panaïotis Ch. & Bioret F. (coord.), 2016. Prodrome des végétations de Corse. Documents phytosociologiques, série 3, 4 : 175 p.
Roofigar A.A., Avaz Zadeh A.M. & Hamzeh B., 2024. Morphological diversity and numerical taxonony of Nerium L. populations in Iran. Taxonomy and Biosystematics 16 (58) : 47-60.
Sciandrello S., Angiolini C., Bacchetta G., Cutini M., Dumoulin J., Fois M., Gabellini A., Gennai M., Gianguzzi L., Landi M., Minissale P., Panaïotis Ch., Puglisi M., Spampinato G., Tavilla G., Tomaselli V., Viciani D. & Giusso del Galdo G., 2023. Alnus glutinosa riparian woodlands of Italy and Corsica: phytosociological classification and floristic diversity. Land 12 (88) : 1-44.
SOGREAH Consultants, 2004. Plan de prévention du risque inondation de la commune de Farinole. Rapport n° 103781, réalisé pour le compte de la Direction départementale de l’équipement de Haute-Corse, 10 p. + annexe.
TaxRef (eds), 2024. TAXREF v. 17.0, référentiel taxonomique pour la France. PatriNat (OFB-CNRS-MNHN-IRD), Muséum national d’Histoire naturelle, Paris. Archive de téléchargement contenant 8 fichiers générés le 10 janvier 2024, https://inpn.mnhn.fr/telechargement/referentielEspece/taxref/17.0/menu.
Tison J.-M. & de Foucault B. (coords), 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1196 p. (Nerium oleander, p. 371).
Tison J.-M., Jauzein Ph. & Michaud H., 2014. Flore de la France méditerranéenne continentale. Naturalia publications, 2 078 p. (Nerium oleander, p. 1279).
UICN France, FCBN, AFB & MNHN, 2018. La Liste rouge des espèces menacées en France, chapitre Flore vasculaire de France métropolitaine. Paris, France, 31 p.
UMS PatriNat, 2021.Table des syntaxons de la déclinaison du Prodrome des végétations de France (PVF2). UMS PatriNat (OFB-CNRS-MNHN) / INPN, octobre 2021.
Valdès B., Talavera S. & Fernández-Galiano E., 1987. Flora Vascular de Andalucía Occidental. Ketres Editora S.A., 2, 640 p.
Vanden Berghen C., 1982. Initiation à l’étude de la végétation. Jardin botanique national de Belgique, Meise, 263 p.