Indigène ou introduite, telle est la question ; une réflexion illustrée par deux espèces observées dans l’Hérault
Title
Native or introduced, that is the question; a discussion based on two species observed in southern France (département Hérault)
Résumé
Ononis ornithopodioides et Verbascum orientale, deux espèces considérées comme exogènes, ont été observées sur la commune de Villeneuve-lès-Maguelone (Hérault, France). Leur indigénat est évalué à partir d’une analyse bibliographique, de relevés phytosociologiques, de critères proposés en littérature ou encore de scénarios d’arrivée sur le territoire. Une méthode d’évaluation du statut d’indigénat d’espèces végétales est proposée.
Abstract
Ononis ornithopodioides and Verbascum orientale, two species considered to be exogenous, have been observed in the commune of Villeneuve-lès-Maguelone (Hérault, France). Their native status was assessed using a bibliographical analysis, phytosociological relevés, criteria proposed in the literature and arrival scenarios. A method for assessing the native status of plant species is proposed.
« Les décisions sur le statut indigène ou étranger des plantes […] sont trop souvent basées sur des critères inappropriés, sur des émotions non pertinentes telles que le patriotisme local, ou sur une mauvaise interprétation des données fossiles, ou encore sur l’acceptation non critique d’opinions antérieures » (Webb, 1985).
1. Préambule
Dans le cadre de l’actualisation du plan de gestion de la ZAC Charles-Martel, un site compensatoire dans l’Ouest montpelliérain, un inventaire floristique visant l’exhaustivité a été réalisé. Ces recherches détaillées ont permis de recenser plusieurs espèces jusqu’alors inconnues dans le site :
- le glaïeul douteux (Gladiolus dubius), une espèce protégée sur l’ensemble du territoire national ;
- la bugrane pied-d’oiseau (Ononis ornithopodioides ; photo 1), taxon anciennement déterminant ZNIEFF en Languedoc-Roussillon (Collectif, 2010) mais ayant récemment perdu ce statut lors de l’actualisation des listes ZNIEFF pour la région Occitanie (Collectif, 2019-2024) ;
- la molène d’Orient (Verbascum orientale ; photo 2), historiquement désignée comme exotique par Loret (1864 : 106) et Loret & Barrandon (1886 : 350). Depuis, cet avis a été suivi par l’ensemble des botanistes français.
Notamment, le changement de statut de la bugrane m’a intrigué dans la mesure où le document de gestion doit prendre en compte les espèces aussi bien patrimoniales qu’exotiques. Ces dernières sont considérées d’une part comme une concurrence donc une menace potentielle pour les espèces autochtones, et d’autre part comme un élément dégradant l’état de conservation des habitats naturels (p. ex. Schmitz et al., 1997 ; Klesczewski et al., 2010 ; Maciejewski et al., 2015).
Par conséquent, un changement de statut ferait basculer une gestion conservatoire du taxon vers une non-considération, voire même des actions défavorables à l’espèce, si jamais un impact sur la biodiversité du site était avéré. Il nous a semblé important d’analyser la situation avant de décider d’une telle inversion de stratégie (voir à ce sujet Pereyra & Guiaşu, 2020). C’est pourquoi je suis retourné sur le site dans l’objectif de compléter les pointages par des prospections complémentaires et de documenter finement les contextes de végétation dans lesquelles les deux espèces se développent, grâce à des relevés phytosociologiques ciblés.
2. Contexte
2.1. Le site de la ZAC Charles-Martel
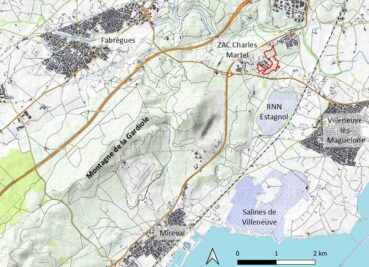
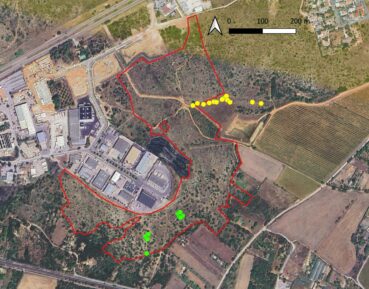
La zone d’aménagement concerté (ZAC) Charles-Martel est située dans le département de l’Hérault, au sud-ouest de l’agglomération montpelliéraine, sur la commune de Villeneuve-lès-Maguelone (lieu-dit du Larzat ; carte 1). Dans le cadre du projet d’agrandissement de cette ZAC, Montpellier Méditerranée Métropole doit mettre en place des mesures compensatoires aux impacts résiduels des travaux, sur 36 espèces de faune majoritairement liées à des habitats de pelouses méditerranéennes à brachypodes (Martin Pigeonnier et al., 2024). Le site de compensation est localisé entre la zone d’activités, les lotissements du pont de Villeneuve et les anciennes routes départementales RM 185E4 à l’est et RM 185 au sud.
2.2. Le plan de gestion du site de compensation
D’après le Guide d’élaboration des plans de gestion des espaces naturels (Collectif, 2021), un plan de gestion est un document stratégique qui définit pour le site une vision à long terme, ainsi qu’une programmation opérationnelle à court/moyen terme. À partir de l’analyse de l’état des lieux, le plan de gestion définit les enjeux pour lesquels le site porte une responsabilité, les objectifs de gestion à long terme et le plan d’action (objectifs opérationnels et programme d’actions). Dans ce cadre, l’inventaire et la hiérarchisation des enjeux constituent deux étapes centrales sur lesquelles est basée la stratégie de gestion conservatoire déterminée pour le site.
Un premier plan de gestion du site de compensation a été élaboré pour la période 2019-2024 (Lépine et al., 2019). Les inventaires floristiques réalisés pour ce document étaient centrés sur les géophytes protégées signalées à proximité du site (Allium chamaemoly, Gagea sp., Romulea columnae) ; deux autres espèces à statut ZNIEFF ont également été recensées à l’occasion (Romulea ramiflora, Tripodion tetraphyllum). Par contre, les trois espèces mentionnées plus haut (Gladiolus dubius, Ononis ornithopodioides, Verbascum orientale) étaient restées inaperçues. De ce fait, elles ne figurent pas dans le premier plan de gestion et n’ont pas fait l’objet d’actions spécifiques.
2.3. Définitions et concepts
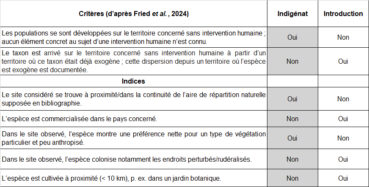
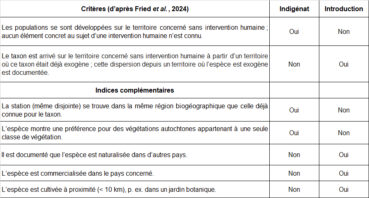
Dans la mesure où l’objectif consiste à analyser le statut indigène ou introduit de deux espèces recensées dans le site (Ononis ornithopodioides, Verbascum orientale), la clarification préalable des termes et concepts employés paraît primordiale. Pour ceci, voici les définitions très récemment proposées par Fried et al. (2024).
Indigène : se dit d’un taxon dont les populations se sont développées sur le territoire concerné sans intervention humaine ou qui ont migré sur le territoire concerné sans intervention humaine depuis un territoire voisin où le taxon est considéré comme indigène. Nota bene : cette définition inclut les taxons présents depuis longtemps sur le territoire, mais aussi les taxons néo-indigènes arrivés de manière spontanée à n’importe quelle date par des vecteurs de dispersion naturelle, sans l’aide directe des humains. Pour qu’un taxon puisse être considéré comme indigène en France hexagonale, au moins une population de son aire de répartition naturelle doit y être présente.
Néo-indigène : se dit d’un taxon dont les populations sont apparues spontanément dans le territoire concerné, par extension de l’aire de répartition car le taxon est considéré indigène dans un territoire voisin et aucun facteur anthropique direct n’est impliqué dans l’extension d’aire.
Exogène : se dit d’un taxon dont la présence sur le territoire concerné est due à une intervention humaine directe (qu’elle soit intentionnelle ou accidentelle) ou qui est arrivé sur le territoire concerné sans intervention humaine à partir d’un territoire où ce taxon était déjà exogène (dispersion/ propagation secondaire naturelle post-introduction).
Cryptogène : se dit d’un taxon dont les modalités d’arrivée d’individus ou de populations sur le territoire étudié ne sont pas explicites et pour lequel il n’est donc pas possible d’attribuer un statut d’indigénat sur le territoire étudié.
Spontané : se dit d’un taxon indigène ou exogène croissant naturellement, sans intervention intentionnelle des humains sur le territoire considéré.
À noter finalement que les auteurs préviennent qu’« en l’absence de preuves d’un vecteur d’introduction anthropique direct il peut être délicat de statuer sur le statut néo-indigène ou exogène d’un taxon, surtout si le territoire considéré est proche de l’aire de répartition naturelle du taxon ».
3. La bugrane pied-d’oiseau (Ononis ornithopodioides)
3.1. Historique des connaissances
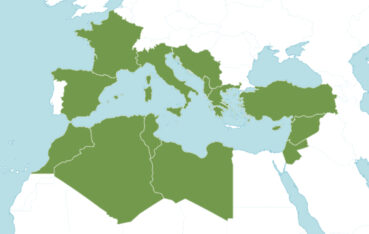
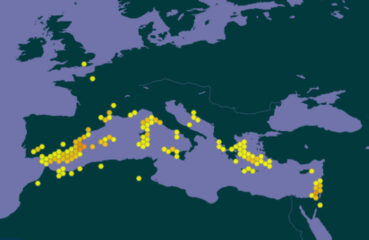
La bugrane pied-d’oiseau est une espèce à répartition circum-méditerranéenne à l’exception de l’Égypte (carte 2). Pendant longtemps, cette espèce n’était indiquée par les flores françaises qu’en Corse (p. ex. Grenier & Godron, 1850 ; Coste, 1937). En effet, sa première observation sur le continent date de 2005 : Romain Lejeune l’observe en quantités importantes sur les communes de La Palme et Port-la-Nouvelle dans l’Aude, sur des parcelles de garrigue ayant subi un incendie auparavant (R. Lejeune, comm. pers.).
Suite à cette observation dans l’Aude, l’espèce est désignée par le Conservatoire botanique national (CBN) méditerranéen de Porquerolles comme « déterminante » dans le cadre de la modernisation des zones naturelles d’intérêt écologique, faunistique et floristique (ZNIEFF) en Languedoc-Roussillon (Collectif, 2010). L’espèce fait par ailleurs l’objet d’une fiche dans l’Atlas de la flore patrimoniale de l’Aude (Plassart et al., 2016).
En 2011, l’espèce est découverte dans l’Hérault par Jean-Marie Coste, Claude Castelain et Michèle Aubrun dans le massif calcaire de la Gardiole, sur la commune de Mireval, « sur un terrain antérieurement dégagé lors de la création d’un coupe-feu » (Coste, 2011 ; voir aussi https://herbier.s2hnh.org/20.htm). À noter qu’à cette époque le massif de la Gardiole n’est plus pâturé par un troupeau ovin notable depuis une cinquantaine d’années.
Dans le tome 3 de leur Monographie des Leguminosae de France, Coulot et Rabaute (2013) évaluent ces deux observations ponctuelles de la façon suivante : « En France continentale, elle n’est pas indigène, seulement occasionnelle ou en voie de naturalisation localement ». De manière équivalente, Jauzein (2014 : 705) considère Ononis ornithopodioides comme « adventice dans l’Aude et dans l’Hérault », en voie de « possible naturalisation », sans autre précision. Dans Flora Gallica, Tison (2014a : 744) se montre un peu plus prudent et commente la station dans l’Aude par « naturalisé ? ».
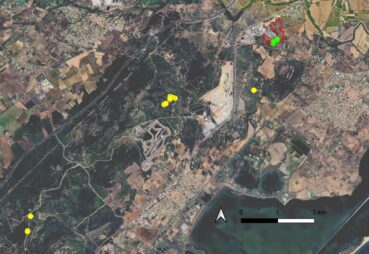
En 2015, Hugo Fontès détecte une nouvelle station à Villeneuve-lès-Maguelone, dans le prolongement du massif de la Gardiole dans l’Hérault (carte 3), non loin des stations recensées auparavant (Coste, 2011), sur une petite pente rocailleuse au milieu des fourrés, paraissant peu anthropisée (H. Fontès, comm. pers.).
Peu après, Croze (2017) décrit ses observations de l’espèce dans le pays niçois et conclut ainsi : « Sa découverte dans les falaises littorales calcaires thermoméditerranéennes de la Riviera, qui l’accueillent avec une certaine constance au sein de groupements stables et bien spécifiques, semble pouvoir apporter un éclairage nouveau sur la nature de son occurrence en France méditerranéenne continentale. La singularité de sa position bioclimatique, topo-édaphique et des formations végétales dans lesquelles la bugrane s’inscrit pourrait en effet plaider en faveur d’un indigénat ancien dans les Alpes-Maritimes au moins. […] En l’état des connaissances, la bugrane pied-d’oiseau peut être considérée comme une plante très rare du littoral méditerranéen continental français où elle trouve l’extrémité septentrionale de son aire de répartition. […] Ce nouveau jalon vient renforcer l’hypothèse du caractère indigène de cette plante qui semble pouvoir être considérée à présent comme faisant partie intégrante de la flore méditerranéenne continentale française ». Coulot et Rabaute (2017 : 12) partagent cette analyse : « Nous traiterons donc l’espèce comme faisant partie intégrante de la flore des départements de l’Aude, de l’Hérault et des Alpes-Maritimes, où elle ne peut pas raisonnablement être considérée comme une occasionnelle ».
De manière quelque peu contradictoire, Ononis ornithopodioides a été « déclassée » lors de l’établissement de la liste des espèces déterminantes pour l’actualisation des ZNIEFF en Occitanie (Collectif, 2019), car « considérée comme naturalisée » (F. Andrieu, comm. pers.). Toutefois, l’espèce a été retenue dans le cadre du travail intitulé Hiérarchisation des taxons – Stratégie de conservation de la flore vasculaire en région méditerranéenne coordonné par le CBN Méditerranéen (Le Berre & Diadema, 2021), avec un niveau de priorité « 2 = fort ».
Une autre découverte récente concerne le département des Pyrénées-Orientales, où Lewin et al. (2020 : 41) ont observé la bugrane pied-d’oiseau sur la commune de Cases-de-Pène. Les auteurs émettent l’hypothèse suivante : « Présente également en Espagne, l’origine des plantes peut s’expliquer par ornithochorie ». Cette hypothèse paraît peu convaincante dans la mesure où le transport par les oiseaux n’est pas un mode de dispersion mis en évidence pour le genre Ononis. Dans leur ouvrage de référence sur la biologie de dispersion des plantes vasculaires d’Europe moyenne, Bonn et Poschlod (1998) n’évoquent pour ce genre que la ballochorie (dispersion balistique par effet de catapulte) avec une distance maximale connue de 60 cm, ainsi que la myrmécochorie (dispersion par les fourmis).
Finalement, Andrieu et al. (2022 : 62) font état d’une troisième population héraultaise observée en 2020 par Jean-René Garcia sur la commune de Fabrègues, toujours sur le massif de la Gardiole.
Les stations à Villeneuve-lès-Maguelone recensées sur le site compensatoire de la ZAC Charles-Martel s’ajoutent à la série de points connus sur et à proximité de la montagne de la Gardiole (carte 3). Les sous-populations inventoriées comprennent chacune quelques dizaines d’individus.
3.2. Situation observée dans le site de compensation
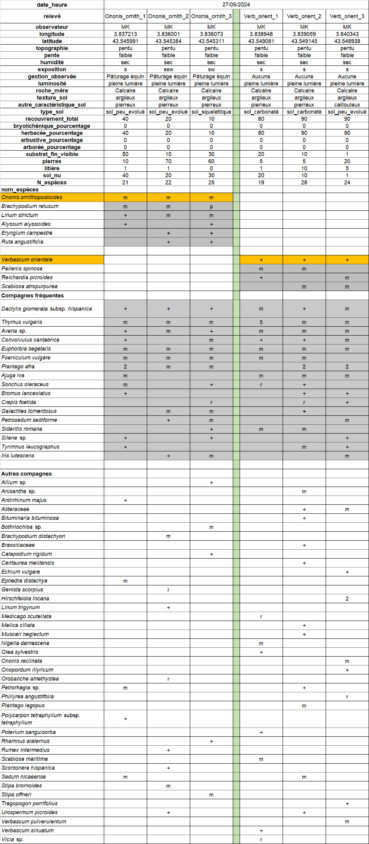
Afin de proposer une description précise du contexte phytocénotique de l’espèce dans le site, un relevé phytosociologique a été réalisé à trois endroits distincts (taille 3 m * 3 m ; échelle de Londo, voir Klesczewski et al., 2024 ; tableau 1). À ma connaissance, il s’agit là des premiers relevés avec Ononis ornithopodioides publiés, en provenance de la région Occitanie.
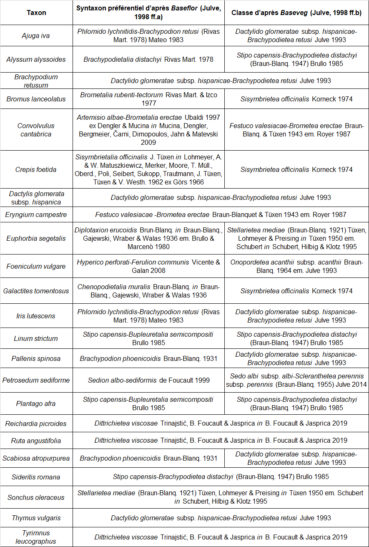
Les stations relevées sont constituées de pelouses à brachypode rameux et thym commun somme toute assez classiques, mais peu recouvrantes et avec une part importante (60 à 90 %) de sol nu et de pierres visibles (photos 4 et 5).
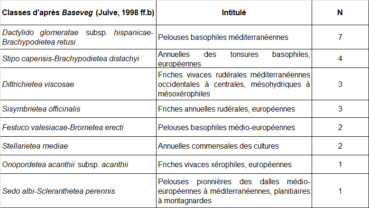
Dans l’objectif d’une analyse objective des relevés, les syntaxons indiqués comme préférentiels dans les référentiels de Ph. Julve (1998 ff., a, b) ont été extraits pour tous les taxons présents dans au moins trois relevés du tableau 1. Au total, huit classes de végétation sont représentées (tableau 2). Les espèces attribuées aux « pelouses basophiles méditerranéennes » et « annuelles des tonsures basophiles, européennes » sont majoritaires (tableau 3).
Au vu du cortège observé, la partie herbacée vivace du groupement à Ononis ornithopodioides peut être rattachée sans ambiguïté à l’alliance du Phlomido lychnitidis-Brachypodion retusi. Il est à souligner que cette phytocénose héraultaise diffère assez fortement du cortège à Ononis ornithopodioides décrit par Croze (2017) de la Riviera, plus nettement dominé par les espèces annuelles.
Il est également important de signaler que les relevés ont été réalisés sur l’ensemble de trois sous-populations recensées du site. Ainsi, les données peuvent être considérées comme représentatives du type de stations occupées par l’espèce dans le site. Celle-ci est totalement absente des milieux plus perturbés par les travaux et des zones plus fortement rudéralisées en périphérie de la zone d’activités (voir carte 4).
3.3. Analyse du statut de l’espèce
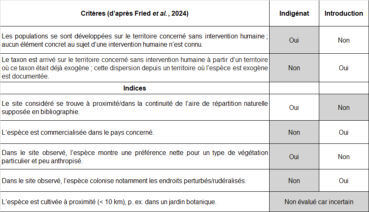
Concernant l’argumentation en faveur ou défaveur de l’indigénat d’une espèce dans un site donné, il m’a paru utile de réunir dans un tableau les critères essentiels formulés par Fried et al. (2024) d’une part et de l’autre des indices complémentaires qui paraissent intéressants à considérer dans le cadre d’une réflexion plus locale (tableau 4). Ce type de tableau permet de visualiser l’évaluation argumentée du statut de l’espèce pour chaque site étudié.
Pour la bugrane pied-d’oiseau, l’ensemble des critères et indices plaide en faveur de l’indigénat dans le secteur de la Gardiole. Dans la mesure où la description des stations dans les départements de l’Aude et des Pyrénées-Orientales est équivalente à celles observées dans l’Hérault, le résultat de l’évaluation sera le même pour ces trois départements. Sur cette base, j’arrive à la conclusion qu’Ononis ornithopodioides est indigène dans l’ensemble de la région méditerranéenne française. Cette conclusion concorde avec la décision du CBN méditerranéen de réinstaurer le statut d’espèce déterminante ZNIEFF en Occitanie à l’occasion de la prochaine actualisation des listes de taxons à statut ZNIEFF (F. Andrieu, comm. pers.). Dans le cadre du plan de gestion du site de la ZAC Charles-Martel, ce taxon sera par conséquent traité comme d’intérêt patrimonial. De ce fait, les stations de bugrane pied-d’oiseau feront l’objet d’une gestion conservatoire adaptée et d’un suivi scientifique régulier et détaillé.
4. La molène d’Orient (Verbascum orientale)
4.1. Historique des connaissances
Présentation du taxon
Verbascum orientale (L.) All., 1785 (= Celsia orientalis L.) est une molène strictement annuelle à fleurs majoritairement solitaires (photo 2), à quatre étamines, et à feuilles découpées en fines lanières (photos 6 et 7). Son port grêle ainsi que sa floraison précoce (avril-mai) et fugace en font une espèce « peu visible » (Tison, 2014b) et par conséquent plutôt difficile à détecter.
Le taxon a été validement décrit par le botaniste italien Carlo Allioni dans sa flore du piémont italien (Allioni, 1785 ; photo 8). Ce protologue est d’autant plus remarquable qu’il cite comme localité type les alentours de la ville d’Aoste, dans le piémont alpin au nord-ouest de l’Italie. Or, les ouvrages et référentiels italiens (Parlatore & Caruel, 1848 ; Cesati et al., 1867 ; Arcangeli, 1894 ; Béguinot, 1900-1902 ; Pignatti, 1982 ; Portal to the Flora of Italy, 2024) ne mentionnent ni le taxon ni la station observée près d’Aoste par Petrus Cornalia (in Allioni, 1785). À signaler également que Lamarck et Candolle, dans leur Flore française (1805 : 599), citent cette donnée sans la mettre en cause : « Cette plante [Celsia orientalis], regardée jusqu’ici comme originaire de l’Orient, croît dans le Piémont, aux environs d’Aouste, d’après le témoignage d’Allioni » (voir aussi Coste, 1903 ; photo 9).
Répartition globale
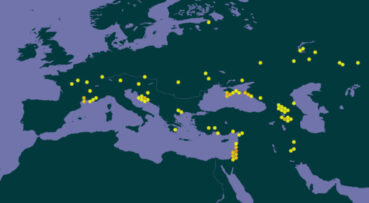
À l’échelle européenne, les indications données par les différents auteurs et référentiels diffèrent quelque peu : dans Flora Europaea, Ferguson (1972) cite comme seules zones de présence de l’espèce la péninsule des Balkans et la Crimée. La base de données en ligne Euro+Med Plantbase (Marhold, 2011+) propose une liste euro-méditerranéenne des pays avec présence de Verbascum orientale. La France y figure comme seul pays où le taxon aurait été introduit, d’après Guinochet & Vilmorin (1975) qui la donnent « naturalisée dans l’Hérault et les Bouches-du-Rhône ». Côté Balkans occidentaux, l’indigénat de l’espèce n’est pas mis en cause en Croatie (Nikolić, 2024) ni en Bosnie-Herzégovine (Maslo, 2023 : 82). La carte de répartition présentée par Plants of the world online (POWO, 2025 ; carte 5) reprend les pays listés par Euro+Med Plantbase (Marhold, 2011+), mais ne retient pas l’Italie en dépit du fait que le protologue se base sur un échantillon récolté dans ce pays, comme évoqué plus haut.
Données disponibles en Europe occidentale
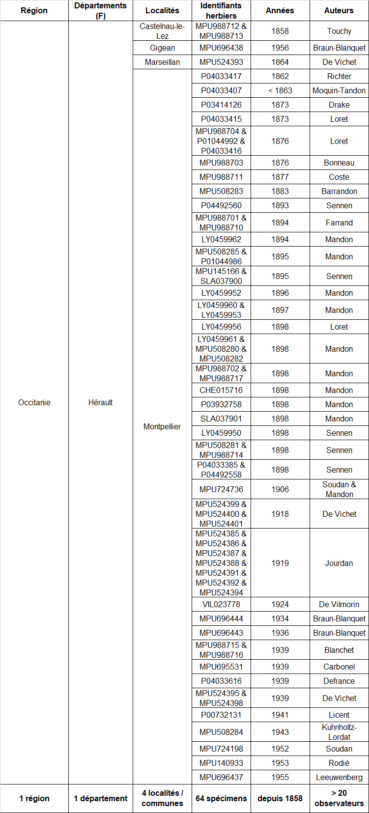
Afin de préciser l’historique des découvertes en France, j’ai mené grâce au site internet ReColNat (https://www.recolnat.org/fr/) une recherche approfondie de spécimens conservés dans les herbiers référencés dans ce site (tableau 5). 64 spécimens (datés et localisés) de Verbascum orientale au sein de cette collection numérique ont été recensés, tous en provenance du département de l’Hérault. La première ligne du tableau 5 est particulièrement intéressante puisqu’elle concerne la première observation connue de l’espèce en France.
Cette observation a été réalisée par le docteur Aimant Touchy, conservateur du patrimoine de la faculté de médecine de Montpellier de 1840 à 1875 (Loup & Munzinger, 2021). Le texte de l’étiquette du spécimen MPU988712 précise : « Découvert à l’état spontané, sur le petit chemin qui va de Castelnau en ligne droite au mas de Caze, près de l’angle. Mai 1858 ». En 1862, Richter découvre la station à la Colombière, au nord de Montpellier « dans une vigne et dans une olivette ». Peu après, cette observation est publiée par Loret (1864 : 106), sans mentionner la découverte initiale par Touchy quatre ans plus tôt. Loret formule le commentaire suivant : « Le modeste et sagace observateur dont nous venons de parler [M. Richter] a découvert aussi, près de la Colombière, le Celsia orientalis L., plante qui ne peut à aucun titre être admise dans une Flore de Montpellier. Elle figure dans la liste des plantes semées par Sauvages, et nous avons lieu, en effet, de la considérer comme un rare représentant des funestes semis pratiqués alors ici par tout le monde, et dont la mode est heureusement passée ». Il paraît assez incompréhensible que Loret désigne la molène d’Orient comme une « plante qui ne peut à aucun titre être admise dans une Flore de Montpellier ». D’après l’hypothèse du semis opéré par François Boissier de Sauvages (avant son décès en 1767), l’espèce se maintiendrait localement depuis plus d’un siècle. Elle serait donc clairement naturalisée et devrait à ce titre être mentionnée dans tout ouvrage s’intéressant à la flore héraultaise.
L’activité de semeur par Sauvages est décrite par Candolle (1855 : 799) : « Boissier de Sauvages, dit son neveu, M. Hombres-Firmas […] lorsqu’il venait visiter ses frères et son pays, portait toujours des paquets de graines et de plantes qu’il croyait utile ou curieux de propager ». Loret et Barrandon développent l’histoire des botanistes montpelliérains avec cette « regrettable manie des semis » dans l’introduction de leur Flore de Montpellier (Loret & Barrandon, 1876 : XI), mais ne citent plus le nom de Sauvages. Sauvages (1751 : 248) mentionne en effet Verbascum orientale dans sa Méthode Pour connoître les Plantes par les Feuilles, mais sans apporter d’autre précision.
Gouan et Amoreux, deux autres botanistes de l’époque, sont connus pour avoir semé un certain nombre d’espèces allochtones dans l’Hérault et le Gard. Planchon (1864 : 31) décrit leur activité ainsi : « En 1767, Gouan commença des expériences analogues : il sema ou planta plus de 800 espèces dans les environs immédiats de Montpellier ; tandis qu’Amoreux, s’associant à cet essai, en répandait 99 dans les bois de l’Aigoual, aux plus hauts sommets des Cévennes du Gard ». Planchon (1864) dresse la liste d’espèces semées par Amoreux à l’Aigoual, la molène d’Orient y est mentionnée. Candolle (1855 : 800) écrit au sujet des semis de Gouan et Amoreux : « Les essais datent de 1767 à 1771 ; or je crois pouvoir dire qu’à l’époque où mon père [A.P. de Candolle] résidait à Montpellier, en 1810 à 1816, on n’en voyait plus guère les traces ». Il est également certain que Verbascum orientale n’a jamais été observé sur le massif de l’Aigoual (voir p. ex. Braun-Blanquet, 1933 ; Klesczewski, 2010). Concernant les semis réalisés dans l’Hérault, Gouan (1796) a publié des listes d’espèces en précisant les années et des lieux. Verbascum orientale n’y figure pas.
Au sujet d’une éventuelle culture de l’espèce au jardin des plantes de Montpellier, elle n’est citée dans aucune liste historique actuellement accessible (Gouan, 1762 ; Candolle, 1813 ; Raffeneau-Delile, 1849 ; Martins, 1856). Deux de ces listes évoquent bien le genre Celsia, mais il s’agit d’autres taxons (Candolle : arcturus et cretica ; Raffeneau-Delile : abyssinica). Pour autant, il n’est évidemment pas exclu qu’elle ait été cultivée à une époque dans un jardin montpelliérain. Il est notamment à signaler que le spécimen P04033407 de l’herbier Moquin-Tandon porte la mention « Monspelii – culta » ce qui peut être traduit par « cultivée à Montpellier ».
Au vu des éléments actuellement avérés, il ne peut guère être question d’introduction volontaire et réussie de l’espèce en France.
Dans leur Flore de Montpellier, Loret et Barrandon (1876 : 468) mentionnent la molène d’Orient dans la rubrique « espèces à exclure » et précisent : « Celsia orientalis L., plante exotique introduite à La Colombière ». Rappelons dans ce contexte que Loret (1864) ne disposait d’aucun élément concret indiquant une éventuelle introduction de l’espèce dans cette station visitée jusqu’aujourd’hui par des générations de botanistes. Cet avis non argumenté est très largement adopté par ses successeurs, qui se contentent de citer les travaux de Loret (p. ex. Murbeck, 1925 ; Andrieu et al., 2022).
Sur son échantillon récolté en 1876 (P01044992), Loret a commenté : « Primitivement semé ». En absence d’éléments concrets, il nous semble que cette annotation doit être considérée comme un simple avis non argumenté. Celui-ci est d’ailleurs subtilement contredit par Thellung (1912 : 470) qui affirme : « Il est à présumer, d’après l’opinion de M. Daveau (que je suis porté à partager entièrement), que ce Celsia est sorti du Port-Juvénal (où il n’a, cependant, jamais été signalé positivement), dont Castelnau est très voisin, et qu’il s’est répandu de là à la Colombière ». En effet, l’espèce n’a jamais été observée au Port-Juvénal, site qui a été longtemps prospecté par de nombreux botanistes (dont Touchy qui connaissait Verbascum orientale) et qui a fait l’objet de publications détaillées (Touchy, 1857a, b ; Cosson, 1859, 1864). Dans sa Flora Juvenalis, Godron (1854 : 100) cite Celsia cretica uniquement. Rioux et Quézel (1950) font le point sur la flore du Port-Juvénal en 1950, ils évoquent un Celsia, mais ne précisent pas l’espèce.
Plus loin dans sa Flore adventice de Montpellier, Thellung (1912 : 637) commente ainsi la station de la molène d’Orient à la Colombière : « Et si certains auteurs disent dit qu’une plante naturalisée doit « se multiplier de plus en plus, s’étendant dans tous les sens », c’est peut-être une exigence un peu trop rigoureuse. Quelques espèces adventices, qu’on qualifie d’« envahissantes », répondent en effet à cette condition ; mais il en est d’autres qui se comportent à la façon de certaines plantes regardées généralement comme indigènes vu qu’elles se maintiennent à leur station primitive pendant de longues années, sans toutefois s’étendre beaucoup : ainsi le Celsia orientalis, plante naturalisée à la Colombière près Montpellier, mais n’y occupant qu’une place très restreinte, ressemble parfaitement par son mode d’existence à quelques espèces annuelles de nos bois et de nos garigues, qui sont également très localisées et ne se rencontrent qu’en un petit nombre d’individus ».
Plus récemment, d’autres stations à proximité du coteau « historique » de la Colombière ont été recensées, par exemple par Blanchet (1963 : 8) et d’autres botanistes sur le terrain du CEFE-CNRS (p. ex. Meunier, 2024).
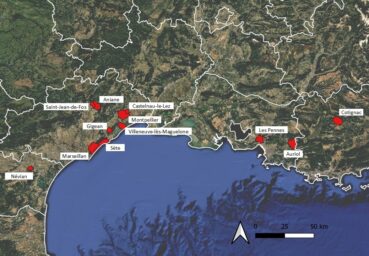
La seconde ligne du tableau 5 a également attiré toute notre attention dans la mesure où ce spécimen récolté par Josias Braun-Blanquet dans une pelouse à brachypode rameux (« Brachypodietum ramosi ») provient de la commune de Gigean située en périphérie du massif de la Gardiole. Cet endroit se trouve qu’à une douzaine de kilomètres à vol d’oiseau de la ZAC Charles-Martel. Il est à souligner que l’espèce se trouve toujours dans les garrigues à proximité de ce village, elle y a été revue par Xavier Fortuny en 2018, dans une pelouse à brachypode rameux rudéralisée (X. Fortuny, comm. pers.).
Le spécimen suivant (MPU524393) a été récolté en 1864 par de Vichet « dans une vigne près Marseillan ». Ce secteur de présence proche de l’étang de Thau a récemment été confirmé par plusieurs botanistes à Sète, dans le quartier Pierres Blanches et au mont Saint-Clair (Garcia, 2019 ; Andrieu et al., 2022 ; Aubrun, 2024 ; photo 9). L’habitat de l’espèce sur le mont Saint-Clair est très bien illustré sur une des excellentes photos prises lors de l’excursion de la Société d’horticulture et d’histoire naturelle de l’Hérault en 2019 (https://s2hnh.org/wp-content/uploads/2019/05/Verbascum-orientale-ENSEMBLE.jpg) : comme sur Gigean, il s’agit d’une pelouse à brachypode rameux sur substrat rocailleux (photo 10).
Deux autres communes héraultaises abritent des populations de Verbascum orientale : l’espèce a été découverte en 1989 à Aniane (Salabert & Gastesoleil, 1991), sur talus de route et dans la garrigue adjacente, et en 2020 par G. Fried dans une friche récente à Saint-Jean-de-Fos (Andrieu et al., 2022).
Assez récemment, en 2013, une station de molène d’Orient a été découverte dans le département de l’Aude par Dominique Barreau, sur la commune de Névian (voir aussi Barreau & Coirié, 2025). Cette localité constitue la station la plus occidentale de l’espèce connue actuellement (carte 6).
La molène d’Orient est également connue depuis longtemps en région Provence-Alpes-Côte-d’Azur. Pour le département des Bouches-du-Rhône, Marnac et Reynier (1910 : 78) font état d’une première station dans un champ en jachère (Les Pennes[-Mirabeau]). Une seconde donnée est fournie par Samat (1939) qui commente : « Cette Scrofulariacée semble naturalisée à Auriol. […] De la façon dont elle est disséminée sur ce coteau, tout porte à croire qu’elle habite là depuis assez longtemps, éloignée des cultures ». Les catalogues plus récents (Molinier & Martin, 1981 ; Pavon & Pires, 2020) ne relatent aucune donnée plus récente.
L’Inventaire national du patrimoine naturel (OpenObs ; MNHN & OFB, 2003-2024b) affiche par ailleurs des données de Verbascum orientale en dehors de la région méditerranéenne. Un point situé sur la commune de Sainte-Colombe au sud de Lyon provient d’un catalogue intitulé Flore du département du Rhône dont l’auteur n’est pas précisé (Anonyme, 1853 : 109). Dans cette liste figure un taxon appelé « Verbascum orientale Bieb. » qui est un synonyme de Verbascum chaixii subsp. orientale (M. Bieb.) Hayek. Cette donnée issue d’une confusion de synonymes figure d’ailleurs aussi dans le Catalogue de la flore vasculaire de la région Rhône-Alpes (CBNA & CBNMC, 2011). En conclusion, la molène d’Orient peut être considérée comme actuellement inconnue en région Rhône-Alpes.
Deux données de l’INPN sont situées en région Centre-Val de Loire. La première, issue de l’Inventaire forestier national, est située sur la commune de Villiers. La station étant décrite comme « hydromorphe » et sur « sol siliceux meuble », ce qui ne correspond absolument pas à la niche écologique connue de Verbascum orientale, cette observation doit être considérée comme erronée. L’autre observation a été réalisée en 2010 par P. Hugueny sur la commune de Vignoux-sous-les-Aix dans le département du Cher. Nous n’avons pas réussi à obtenir des informations sur cette station.
Une autre donnée située en partie centrale du pays est localisée sur la commune de Lucenay-l’Évêque en région Bourgogne-Franche-Comté et provient d’un compte-rendu d’excursion (Anonyme, 1888) qui cite le nom « Verbascum orientale Schrad. ». Cette combinaison étant inconnue dans les référentiels existants, nous supposons qu’il ne s’agissait pas de la molène d’Orient telle que visée ici.
Finalement, une dernière mention concerne le port de Strasbourg, où l’espèce aurait été observée plusieurs fois au cours des années 1908 à 1910 (Krause, 1917 : 144). Une erreur de synonymie est ici exclue dans la mesure où l’auteur cite la planche correspondante à Verbascum orientale (L.) All. dans Reichenbach (1862).
Reste à examiner les mentions du taxon dans les flores françaises. D’après nos recherches, la molène d’Orient apparaît pour la première fois dans la Flore descriptive et illustrée de la France de l’abbé Coste en 1903 (tome 2 ; photo 11). Peu après et de façon plutôt surprenante, Rouy (1909) omet de mentionner le taxon dans le tome XI de sa Flore de France, ouvrage pourtant très complet.
Les flores de France de Fournier (1934-1940) et Guinochet & de Vilmorin (1975) la signalent naturalisée dans l’Hérault et adventice dans les Bouches-du-Rhône. Dans le septième supplément à cette « Flore du C.N.R.S. », Jovet et Kerguélen (1990 : 763) annoncent que « Verbascum orientale (L.) All. = Celsia o. L. est éteint dans son unique localité française (G. Bosc in litt.) ».
Dans Flora Gallica et la Flore de la France méditerranéenne continentale, Tison (2014b, c) considère la molène d’Orient comme « naturalisée ». L’Inventaire national du patrimoine naturel (MNHN & OFB, 2003-2024b) la considère également comme « introduite ».
En conclusion, l’espèce est connue dans douze communes de France méditerranéenne : huit dans l’Hérault, une dans l’Aude et trois en région Provence-Alpes-Côte d’Azur (carte 6). Les stations sont relativement distantes les unes des autres : l’espèce se développe toujours de façon ponctuelle, localisée, sous forme de populations de quelques dizaines jusqu’à un millier d’individus. Aucun lieu ni vecteur d’introduction n’est avéré. L’ensemble des auteurs la considère comme exogène, sans argumentation ou analyse de scénario.
Très récemment, l’espèce a fait l’objet de recherches approfondies en Bosnie-Herzégovine, un pays où elle est considérée comme autochtone (Maslo, 2023). Avec la Croatie, ce pays constitue la limite occidentale de l’aire de répartition actuellement retenue pour Verbascum orientale par POWO (2025 ; carte 4). L’auteur met en avant les éléments suivants : « L’espèce a une distribution limitée en Bosnie-Herzégovine ; ses habitats ne se trouvent que dans la partie méditerranéenne du pays, dans des populations fragmentées. Il est important de noter que toutes les populations confirmées sont pauvres et ne comptent que quelques individus. La plus grande population a été identifiée à Blagaj, dans les crevasses des roches calcaires à la source de la rivière Buna ; une douzaine d’individus ont été recensés le 21 avril » (Maslo, 2023 : 82).
4.2. Situation observée à Villeneuve-lès-Maguelone
Comme pour l’espèce précédente et dans l’objectif de proposer une description précise du contexte phytocénotique de l’espèce dans le site, j’ai réalisé un relevé phytosociologique à trois endroits distincts (tableau 1). À ma connaissance, il s’agit là des premiers relevés avec Verbascum orientale publiés, en provenance de France.
Dans le site de la ZAC Charles-Martel, la population de vingt à trente individus est localisée sur la partie basse d’une pente rocailleuse occupée par une garrigue calcicole classique. Comme pour la bugrane pied-d’oiseau, les relevés ont été réalisés sur l’ensemble du secteur avec présence de Verbascum orientale dans le site. Ainsi, les relevés peuvent être considérés comme représentatifs du type de stations occupées par l’espèce dans le site. Celle-ci est totalement absente des milieux plus perturbés par les travaux et des zones plus fortement rudéralisées en périphérie de la zone d’activités (carte 5).
Les stations relevées sont constituées de pelouses à dactyle d’Espagne et thym commun assez recouvrantes (80 à 90 %) et avec une faible part de sol nu (1 à 20 %) et de pierres (5 à 20 %) visibles (photos 12 et 13). L’aspect général de la végétation est dominé par des espèces relativement hautes comme les avoines et le fenouil. Le groupement à Verbascum orientale est caractérisé par trois espèces plutôt rudérales (Pallenis spinosa, Reichardia picroides, Scabiosa atropurpurea), mais partage un bloc important d’espèces compagnes fréquentes avec le groupement à Ononis ornithopodioides. Au vu du cortège observé, la partie herbacée vivace du groupement à Verbascum orientale peut être rattaché à l’alliance du Brachypodion phoenicoidis au sens de Braun-Blanquet et al. (1952 : 141) qui décrivent ces végétations de la façon suivante : « pelouses permanentes […] des plaines méditerranéennes […] sur le flanc des collines […] où la terre fine s’accumule entraînée par le ruissellement ».
En conclusion, Verbascum orientale occupe dans le site étudié une niche écologique qu’on pourrait qualifier de mésoxérophile, au sein des pelouses rocailleuses calcicoles typiquement méditerranéennes exposées au sud, en partie rudéralisées.
4.3. Synthèse des stations connues en région méditerranéenne française
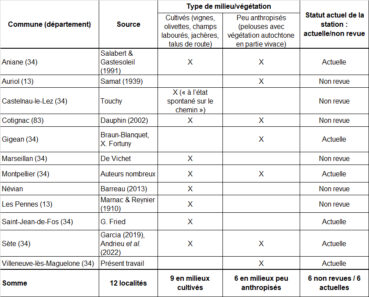
À partir de l’inventaire des stations connues en France, une synthèse des descriptions stationnelles fournies par les auteurs nous a semblé pertinente, pour la région méditerranéenne française. Pour cela, deux types de milieux ont été distingués dans le tableau 6 :
– les milieux cultivés, avec travail de sol régulier (griffage, labour) ou fortement anthropisés (jachères, talus de route) ;
– les milieux peu anthropisés, majoritairement occupés par une végétation autochtone de pelouses vivaces.
L’espèce est majoritairement observée en milieux anthropisés. Le résumé des stations de Verbascum orientale dans la Flore méditerranéenne (« cultures, friches, talus » ; Tison, 2014b : 1381) mériterait toutefois d’être complété par « pelouses méditerranéennes rocailleuses à brachypodes ».
Il nous paraît également important de souligner que l’espèce n’était abondante que dans une seule de ses stations françaises (Cotignac, plus de mille individus ; Dauphin, 2002). Six des douze stations connues n’ont pas été revues récemment et mériteraient faire l’objet de prospections ciblées.
4.4. Analyse du statut de l’espèce
Comme pour la bugrane pied-d’oiseau, nous avons tenté d’évaluer le statut d’indigénat de la molène d’Orient dans le site de la ZAC Charles-Martel à l’aide des critères proposés par Fried et al. (2024) et d’autres indices qui nous paraissent intéressants à considérer (tableau 7).
Concernant la molène d’Orient, la quasi-totalité des critères et indices évalués plaide en faveur de l’indigénat dans le secteur de la Gardiole, à l’exception de la proximité de l’aire de répartition naturelle supposée en bibliographie (p. ex. POWO, 2025).
Par ailleurs, il est à noter que le premier critère a été noté « oui » malgré la tentative d’introduction de l’espèce dans les « bois de l’Aigoual » par Amoreux au cours de la seconde moitié du xviiie siècle (voir § 4.1). Cette tentative d’introduction constitue sans doute un échec certain, et les populations de France méditerranéenne ne peuvent pas s’être développées à partir de ce semis ponctuel réalisé au sommet du massif siliceux du mont Aigoual, à l’étage montagnard donc au sein d’une région biogéographique très différente.
4.5. Étude des scénarios d’arrivée sur le territoire français
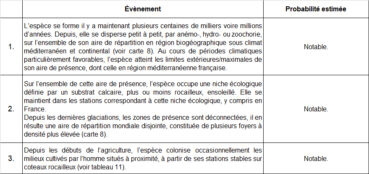
La synthèse des données disponibles ci-dessus montre qu’il existe différents scénarios d’arrivée de Verbascum orientale en France. Ces différents scénarios peuvent être formalisés par la description des évènements successifs indispensables pour obtenir la situation actuellement observée. Finalement, une telle formalisation permet une estimation de probabilité pour chaque scénario. Pour ce faire, nous avons dressé la liste des évènements constitutifs de chaque scénario et attribué à chaque étape un niveau de probabilité estimé.
Scénario 1 « Loret »
Scénario 2 « Deveau & Thellung »
Scénario 3 « Foyers d’introductions multiples »
Un scénario mentionné par aucun auteur mais envisageable serait basé sur des introductions indépendantes les unes des autres, dans plusieurs foyers. Depuis ses stations naturelles [Balkans, Asie], la molène d’Orient arrive sous forme de graines dans différentes stations en France et se disperse ensuite aux alentours. Compte tenu de l’absence totale de populations intermédiaires le long des potentielles voies de dispersion, ce scénario paraît également très improbable.
Scénario 4 « Indigénat »
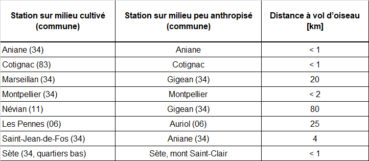
Dans l’objectif de vérifier l’hypothèse de dispersion de l’espèce formulée en tableau 10 (point 3), nous avons mesuré la distance la plus courte entre chaque station avérée en milieu cultivé et la population sur coteau rocailleux la plus proche connue (tableau 11).
Le tableau 11 met en évidence les distances relativement faibles entre stations en milieux cultivés et la station peu anthropisée la plus proche. Concernant les stations de Marseillan, Névian, Les Pennes et Saint-Jean-de-Fos, il serait intéressant de prospecter les garrigues alentours en période de floraison de l’espèce (mois de mai) afin de détecter d’éventuelles populations en milieux peu anthropisés situées plus à proximité.
Étude des scénarios : conclusion
Les scénarios 1 à 3 sont peu convaincants, au vu du manque total d’étapes de dispersion intermédiaires et du temps de dispersion très réduit, entre arrivée supposée en France et implantation dans les différentes stations aujourd’hui connues et très isolées pour certaines.
C’est ce facteur temps qui distingue à l’extrême le scénario 4 : on passe de deux siècles à plusieurs centaines de milliers (voire quelques millions) d’années (voir à ce sujet p. ex. Médail et al., 2012). D’après ce scénario, la molène d’Orient se trouverait en limite d’aire de répartition occidentale, et ce depuis fort longtemps.
Au vu de l’ensemble des éléments détaillés ci-dessus, le scénario de l’indigénat paraît a minima possible. Les modalités d’arrivée du taxon en France n’étant pas explicites, il me paraîtrait pertinent de considérer Verbascum orientale comme taxon cryptogène en France. Cette évaluation induit des conséquences pour le plan de gestion du site de la ZAC Charles-Martel : dans le doute, ce taxon sera considéré comme original, très localisé et potentiellement d’intérêt patrimonial. De ce fait, le secteur avec présence de Verbascum orientale fera l’objet d’une gestion conservatoire par une utilisation pastorale adaptée et d’un suivi scientifique régulier.
4.5. Évaluation du niveau de menace (critères UICN – Liste rouge)
À condition que son indigénat soit envisagé, le taxon Verbascum orientale peut faire l’objet d’une évaluation du niveau des menaces qui pèsent sur lui, à l’échelle de la France. La méthode la plus connue et appliquée mondialement est celle de l’Union internationale pour la conservation de la nature (UICN) (= IUCN International Union for Conservation of Nature). Depuis 1994, cette organisation publie et actualise les « Lignes directrices pour l’utilisation des catégories et critères de la Liste rouge de l’UICN » (UICN, 2012 ; IUCN Standards and Petitions Committee, 2024). Cette méthode utilise cinq critères quantitatifs pour déterminer si un taxon est menacé ou non et, s’il est menacé, à quelle catégorie de menace il appartient (En danger critique, En danger ou Vulnérable) :
- Réduction des effectifs (passé, présente et/ou prévue)
- Étendue de l’aire de répartition géographique et fragmentation, localités peu nombreuses, déclin ou fluctuations
- Effectifs réduits et en déclin, et fragmentation de la population, fluctuations ou sous-populations peu nombreuses
- Effectifs très réduits ou répartition très restreinte
- Analyse quantitative du risque d’extinction (par exemple, analyse de viabilité de la population).
L’application des critères détaillés par UICN (2012) désignerait Verbascum orientale comme taxon vulnérable (VU, critère D1) en France : « Un taxon est dit vulnérable lorsque les meilleures données disponibles indiquent qu’il remplit l’un des critères suivants (A à E) et, en conséquence, qu’il est confronté à un risque élevé d’extinction à l’état sauvage : D. Population très petite ou limitée, sous l’une ou l’autre des formes suivantes : 1. Population estimée à moins de 1000 individus matures ».
Ce résultat, même théorique et issu d’une démarche d’évaluation non officielle, nous conforte en tant que gestionnaire du site dans l’idée de maintenir la zone avec molène d’Orient en état favorable à l’espèce. Cet objectif de gestion conservatoire est cohérent avec l’objectif général visé pour ce secteur, à savoir le maintien d’une mosaïque de milieux typiquement méditerranéens, avec une majorité de végétations dites « ouvertes » (= non boisées).
5. Discussion
De manière très générale, la gestion de sites avec objectif de conservation du patrimoine naturel doit d’abord reposer sur une très bonne connaissance des syn-/taxons présents et ensuite se baser sur des référentiels pertinents pour l’évaluation et la hiérarchisation de ces enjeux. Les deux exemples développés ci-dessus montrent l’importance majeure des référentiels consultés : leur statut actuel désigné comme naturalisé donc exogène sera certainement ajusté en indigène pour la bugrane pied-d’oiseau. Pour la molène d’Orient, le statut pourrait a minima être modifié en « douteux » ou « actuellement inconnu ». Par conséquent, le gestionnaire n’aurait plus à considérer ces espèces comme potentiels éléments de dégradation de l’état de conservation des écosystèmes. En 2019, Pereyra a évoqué ces risques et appelé à une considération critique des arguments avant de désigner un taxon comme exogène. Compte tenu de l’impact de l’appréciation sur l’indigénat d’une espèce, il me semble en effet primordial de discuter les éléments clés qui peuvent faire pencher la balance dans un sens ou dans l’autre.
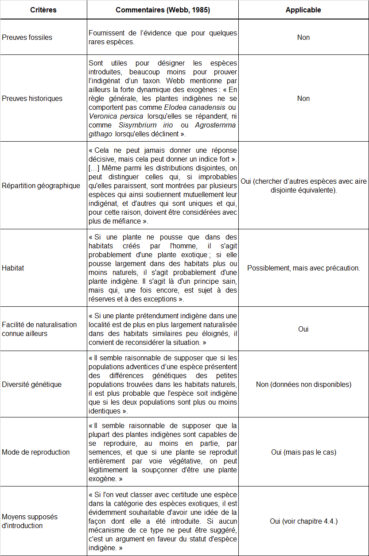
En 1985, Webb a proposé une première liste de critères en faveur de l’indigénat de plantes vasculaires et commenté : « Huit critères sont proposés ici ; il est très rare qu’un seul d’entre eux donne une réponse définitive, mais si plusieurs d’entre eux fournissent des preuves circonstancielles allant dans le même sens, il est raisonnable de les considérer comme décisifs ». En tableau 12, ces critères sont listés, les commentaires de l’auteur sont résumés et leur applicabilité dans le contexte de la ZAC Charles-Martel est évaluée :
À la lumière de ce travail essentiel, il nous reste à évaluer les critères paraissant applicables dans le présent contexte :
5.1. Aspects biogéographiques
Pour répondre précisément au critère de Webb (1985), il fait nul doute qu’il existe bon nombre d’autres espèces avec une aire disjointe équivalente à celles de Verbascum orientale et d’Ononis ornithopodioides. Il est d’ailleurs intéressant à noter que les aires de ces deux taxons montrent déjà certaines similitudes (cartes 7 et 8) et soutiennent ainsi mutuellement leur probabilité d’indigénat au sens de cet auteur.
Le tableau 7 met en évidence l’unique élément concret qui plaide contre l’indigénat de Verbascum orientale en France, à savoir son éloignement de l’aire de répartition naturelle supposée en bibliographie. Dans ce contexte, notre capacité à dessiner/définir cette aire de présence naturelle d’une espèce est cruciale. Le concept d’une aire qu’il est possible de délimiter sous-entend l’existence de limites relativement nettes. À y réfléchir, il peut même paraître assez hasardeux de définir une limite d’aire par un unique trait car les exemples sont légion où les zones périphériques de l’aire de présence d’espèces sont floues, disjointes, voire disloquées. Ce constat est parfaitement logique dans la mesure où ces organismes y atteignent la limite de leur niche écologique : elles y sont par définition moins vigoureuses, moins compétitives et de ce fait moins présentes. Ce fait biologique classique et reconnu invite à une prudence particulière lors de l’évaluation du statut exo-/indigène d’une espèce en limite d’aire de répartition reconnue ou supposée.
Les deux espèces étudiées ici se trouvent en limite d’aire. Pour Ononis ornithopodioides, à condition de faire abstraction des points douteux au nord de la France et en Angleterre, il s’agit de l’extrémité septentrionale. Il est à souligner que des stations en Croatie sont situées à une latitude équivalente (carte 7). L’aire de la bugrane pied-d’oiseau paraît nettement disjointe, avec différentes zones de présence autour de la Méditerranée. La présence en France méridionale s’insère de façon cohérente au sein de cette aire sténo-méditerranéenne.
Quant à Verbascum orientale, son aire de répartition est encore plus nettement disjointe (carte 8). Ses zones de présence reconnues comme indigènes sont dispersées depuis l’Iran jusqu’en Bosnie-Herzégovine (Murbeck, 1925 ; Maslo, 2023). Les stations françaises sont localisées aux mêmes latitudes que les populations en Bosnie et en Croatie et celles situées sur les rives nord de la mer Noire. Les distances entre les différentes zones de présence sont parfois importantes, de ce point de vue la région méditerranéenne française ne fait pas figure d’exception.
Au vu des considérations sur Verbascum orientale en France, il est indéniable que l’espèce a subi ce que Pereyra et Guiaşu (2020) appellent « l’approche de la culpabilité jusqu’à preuve de l’innocence » (« guilty-until-proven-innocent approach ») : en résumé, Loret (1864) a déclaré l’espèce comme exogène et l’ensemble des auteurs se réfère à lui depuis (« acceptation non critique d’opinions antérieures » ; Webb, 1985).
Pour la bugrane pied-d’oiseau, l’historique est plus complexe car comprenant plus de revirements, mais le raisonnement est identique : si l’espèce n’a pas été observée auparavant, il a été considéré qu’elle a dû arriver récemment, et ce en dépit d’une absence totale de sources avérées de diaspores et de stations intermédiaires qui pourraient documenter une dispersion anthropogène récente. Notre proposition vise à inverser cette démarche : s’appliquerait alors la règle ancestrale « dans le doute en faveur de [l’accusé] l’indigénat ».
5.2. Habitat (préférence phytocénologique)
Un argument particulier en faveur de l’indigénat d’un taxon ressort de nos analyses ci-dessus : la préférence de l’espèce pour un type de végétation autochtone. Des relevés phytosociologiques centrés sur des stations des espèces considérées permettent le rattachement du cortège observé à des classes de végétation bien définies, par exemple à l’aide des bases de données de Julve (1998 ff.a, b). Le fait qu’une espèce se montre significativement liée à des végétations naturelles appartenant à une seule classe de végétation plaide en faveur de l’indigénat. Pour autant, et comme la majorité des plantes autochtones, notamment annuelles, l’espèce peut tout de même être trouvée dans des végétations rudéralisées.
Les deux espèces étudiées ici sont liées aux pelouses méditerranéennes xériques à brachypode rameux et elles apparaissent aussi dans divers milieux perturbés attenants.
Ce critère paraît pertinent mais son évaluation nécessite le relevé et l’analyse quoique grossière de données phytosociologiques, ce qui représente un supplément de temps de travail non négligeable.
5.3. Facilité de naturalisation connue ailleurs
Ce critère intéressant mérite en effet d’être évalué. Ni Ononis ornithopodioides ni Verbascum orientale sont considérés comme « naturalisé » dans un autre pays (POWO, 2025).
5.4. Moyens supposés d’introduction
Ce critère paraît également tout à fait pertinent. En parties 3 et 4, différentes façons d’arrivée des deux taxons sur le territoire français ont été discutées. Aucun scénario d’arrivée récente n’a pu être envisagé de façon convaincante.
6. Indigène ou introduite ? Synthèse des critères
Il me semble que les critères proposés par Fried et al. (2024), les indices complémentaires proposés plus haut et les arguments listés par Webb (1984) pourraient être réunis en un seul outil d’évaluation de l’indigénat d’une espèce végétale (tableau 13).
Les critères d’après Fried et al. (2024) sont décisifs. Seul un résultat favorable à l’indigénat selon ces deux critères mène à l’étape de l’évaluation des indices complémentaires. En accord avec Webb (1985), il est à préciser qu’aucun d’entre eux ne donne une réponse définitive. Si la majorité, donc au moins trois d’entre eux, fournit des arguments allant dans le même sens, on devrait les considérer comme décisifs.
7. Perspectives
Compte tenu des découvertes récentes de stations des deux taxons évoqués, il me paraît probable que des prospections ciblées, avec les deux espèces à l’esprit, permettent de détecter d’autres populations encore inconnues. Il serait par ailleurs intéressant de mieux prospecter les alentours de stations fortement anthropisées (p. ex. Névian, Saint-Jean-de-Fos) afin de détecter d’éventuelles populations « sources » en milieu rocailleux. Finalement, les populations non revues récemment mériteraient d’être revisitées pour actualiser le statut disparu ou non de ces localités.
Dans ce contexte, Romain Lejeune a formulé une suggestion très pertinente qui vise à améliorer la détectabilité de la molène d’Orient. D’une part, au vu de sa floraison fugace, il est recommandé de prévoir des prospections plutôt matinales. D’autre part, il peut évidemment être très utile de savoir reconnaître l’espèce au stade végétatif. C’est pourquoi nous présentons ci-dessous quelques photos de l’espèce au stade feuilles. À noter les feuilles glanduleuses et la largeur des lobes qui diminue sensiblement au fil de la saison.
Reste à souligner que les germinations et rosettes même adultes sont faciles à obtenir (photos 14 à 16), mais tous les individus que j’ai pu cultiver sont morts au cours de l’hiver. On pourrait en déduire que l’espèce a des exigences stationnelles particulières en termes d’ensoleillement, de type de substrat ou autre. Cette observation paraît cohérente avec la circonscription assez frappante des stations de molène d’Orient actuellement connues.
Bibliographie
Allioni C., 1785. Flora Pedemontana sive enumeratio methodica stirpium indigenarum pedemontii. Tomus Primus. I.M. Briolus, Turin, 344 p., https://www.biodiversitylibrary.org/bibliography/74568.
Andrieu F., Delaumone P. & Fried G., 2022. Cinquième contribution à la flore de l’Hérault. Annales de la Société d’horticulture et d’histoire naturelle de l’Hérault 161 : 54-70.
Anonyme, 1853. Flore du département du Rhône. Annales de la Société linnéenne de Lyon, années 1852-53, nouvelle série, tome premier : 81-128, https://www.biodiversitylibrary.org/page/3487215.
Anonyme, 1888. Excursions de la section du Creusot en 1886-87. Herborisation à Lucenay (vallée de la Gagère) le 17 juillet 1887. Bulletin de la Société d’histoire naturelle d’Autun 1 : 293-296.
Arcangeli G., 1894. Compendio della flora italiana ossia manuale per la determinazione delle piante che trovansi selvatiche od inselvatichite nell’Italia e nelle isole adiacenti. Edizione seconda. E. Loescher, Torino, Roma, 836 p., https://bibdigital.rjb.csic.es/records/item/10287-compendio-della-flora-italiana-edizione-seconda.
Association pour l’inventaire de la flore du Var, 2021. Atlas-catalogue de la flore vasculaire du Var. Naturalia, Turriers, 1184 p.
Aubrun M., 2024. Herbier Michèle Aubrun, fiche de Verbascum orientale (L.) Allioni, 1785. https://herbier.s2hnh.org/09.htm.
Barreau D. & Coirié G., 2025. Verbascum orientale (L.) All. L’herbiel de Gabriel. Société d’études scientifiques de l’Aude, Flore du département de l’Aude, http://www.herbier.sesa-aude.fr/Verbascum-orientale [29/01/2025].
Béguinot A., 1900-1902. Celsia L. In A. Fiori & G. Paoletti, Flora analitica d’Italia ossia descrizione delle piante vascolari indigene inselvatichite e largamente coltivate in Italia disposte per quadri analitici / dei dottori Adriano Fiori e Guilio Paoletti continuata dai dottori Adriano Fiori, Prof. nel R. Instituto Forestale di Vallombrosa, ed Augusto Béguinot, Primo Ass. Inst. Bot. dell’Univ. di Padova ; II – Tipografia del seminario, Padova : 417.
Benedí C., 2009. Verbascum L. In C. Benedí, E. Rico, J. Güemes & A. Herrero (eds.), Flora Iberica – Plantas vasculares de la Península Ibérica e Islas Baleares, XIII – Plantaginaceae-Scrophulariaceae, Real Jardín Botánico, CSIC, Madrid : 49-97.
Blanchet G., 1963. Quelques observations sur la flore de Montpellier et du Languedoc méditerranéen (Hérault et Gard). Le Monde des Plantes 339 : 7-9.
Boissier de la Croix de Sauvages F., 1751. Methodus foliorum, seu plantae Florae Monspeliensis, juxta foliorum ordinem, ad juvandam specierum cognitionem digestae. Méthode Pour connoître les Plantes par les Feuilles. La Haye, 143 p. et annexes, https://www.biodiversitylibrary.org/page/58194470.
Bonn S. & Poschlod P., 1998. Ausbreitungsbiologie der Pflanzen Mitteleuropas. Grundlagen und kulturhistorische Aspekte. Quelle & Meyer, Wiesbaden, 404 p.
Braun-Blanquet J., 1933. Catalogue de la flore du massif de l´Aigoual et des contrées limitrophes. Mémoires de la Société d’étude des sciences naturelles de Nîmes 4 : 1-352 (Communication S.I.G.M.A. 20).
Braun-Blanquet J., Roussine N. & Nègre R., 1952. Les groupements végétaux de la France méditerranéenne. CNRS, Paris, 297 p.
Candolle A. P. (de), 1813. Catalogus plantarum Horti Botanici Monspeliensis, addito observationum circa species novas aut non satis cognitas fasciculo. J. Martel, Montpellier & Am. Koenig, Paris et Strasbourg, 155 p., https://www.biodiversitylibrary.org/bibliography/71681.
Candolle A. (de), 1855. Géographie botanique raisonnée ; ou Exposition des faits principaux et des lois concernant la distribution géographique des plantes de l’époque actuelle (vol. 2). Libr. V. Masson, Paris, Libr. J. Kessmann, Genève, 607-1365, https://www.biodiversitylibrary.org/page/41036152#page/203/mode/1up.
CBNA & CBNMC, 2011. Catalogue de la flore vasculaire de la région Rhône-Alpes. Document Conservatoire botanique national alpin, Conservatoire botanique national Massif central, DREAL Rhône-Alpes, Région Rhône-Alpes, 52 p. et annexes.
Cesati V., Passerini G. & Gibelli G., 1867. Compendio della flora italiana, vol. 2-3. F. Vallardi, Mila, 912 p.
Collectif, 2010. Modernisation de l’inventaire ZNIEFF – Zones naturelles d’intérêt écologique faunistique et floristique, Région Languedoc-Roussillon, Edition 2009-2010. Listes des espèces et habitats naturels déterminants et remarquables validées par le Conseil scientifique régional du patrimoine naturel. Document ministère de l’Écologie, de l’Aménagement et du Développement durables, Conservatoire des espaces naturels du Languedoc-Roussillon, Conservatoire botanique national méditerranéen de Porquerolles, 41 p.
Collectif, 2019. Vers des ZNIEFF « troisième génération » en Occitanie, https://www.occitanie.developpement-durable.gouv.fr/vers-des-znieff-troisieme-generation-en-occitanie-a24635.html [24/11/2024].
Collectif, 2021. Guide d’élaboration des plans de gestion des espaces naturels. Collection Cahiers techniques 88, OFB, http://ct88.espaces-naturels.fr/printpdf/book/export/html/1309.
Cosson E., 1859. Appendix florulae Juvenalis (1), ou Liste des plantes étrangères récemment observées au Port-Juvénal, près Montpellier, précédée de quelques considérations sur le Port-Juvénal, sur l’origine et les conditions de développement des plantes qui y sont introduites par les laines. Bulletin de la Société botanique de France 6 : 605-615.
Cosson E., 1864. Appendix florulae Juvenalis altera, ou deuxième liste de plantes étrangères récemment observées par M. Touchy au Port-Juvénal, près Montpellier. Bulletin de la Société botanique de France 11 : 159-164.
Coste H., 1903. Flore descriptive et illustrée de la France de la Corse et des contrées limitrophes, 2, premier tirage. Librairie des Sciences naturelles P. Klincksieck, Paris, 627 p., https://bibdigital.rjb.csic.es/records/item/14892-flore-descriptive-et-illustree-de-la-france-tome-deuxieme.
Coste H., 1937. Flore descriptive et illustrée de la France de la Corse et des contrées limitrophes, 1, second tirage. Librairie des Sciences et des Arts, Paris, 416 p.
Coste J.-M., 2011. À propos de la présence en France continentale d’Ononis ornithopodioides L. Annales de la Société d’horticulture et d’histoire naturelle de l’Hérault 151 (2) : 44-45.
Coulot P. & Rabaute Ph., 2013. Ononis ornithopodioides. In Monographie des Leguminosae de France, 3 – Tribu des Trifolieae. Bulletin de la Société botanique du Centre-Ouest, n. s., n° sp. 40 : 109-111.
Coulot P. & Rabaute Ph., 2017. Deuxièmes compléments à la Monographie des Leguminosae de France. Le Monde des plantes 516 [2015] : 11-35.
Croze T., 2017. La bugrane pied-d’oiseau (Ononis ornithopodioides L., 1753) : une espèce nouvelle pour la flore du sud-est de la France nichée dans les corniches de la Riviera (Alpes–Maritimes). Bulletin de la Société linnéenne de Provence 68 : 101-110.
Dauphin J.-P., 2002. Découverte dans le Var de Verbascum orientale (L.) All. (Celsia orientalis L.). Le Monde des plantes 476 : 14-15.
Ferguson I.K., 1972. In T.G. Tutin, V.H. Heywood, N.A. Burges, D.M. Moore, D.H. Valentine, S.M. Walters, D.A. Webb, P.W. Ball, A.O. Chater, R.A. DeFilipps, I.K. Ferguson & I.B.K. Richardson (eds.), Flora Europaea, 3 – Diapensiaceae to Myoporaceae. Cambridge University Press, Cambridge, London, New York, Melbourne : 205-216.
Fournier P., 1934-1940. Les Quatre Flores de la France, Corse comprise (Générale, Alpine, Méditerranéenne, Littorale), 1934-1940. Chez l’auteur, Poinson-lès-Grancey, 1092 p.
Fried G., Affre L., Albert A., Antonetti Ph., Bretagnolle F., Caillon A., Chabrol L., Cottaz C., Dao J., Delangue B., Dortel F., Decocq G., Dommanget F., Geslin J., Girod C., Gourvil J., Kessler F., Molina J., Petit Y., Perriat F., Tison J.-M., Toussaint B., Van Es J., Vuillemenot M., Zech-Matterne V. & Brun C., 2024. Analyse de la terminologie relative aux plantes vasculaires exogènes : application à l’inventaire des archéophytes et néophytes de France hexagonale. Naturae 2024 (4) : 69-97, https://doi.org/10.5852/naturae2024a4.
Garcia J.-R., 2019. Sortie botanique SHHNH le 22 mai 2019 à Sète, https://s2hnh.org/articles/2019/05/sortie-botanique-shhnh-le-22-mai-2019-a-sete#more-6339.
GBIF Secretariat, 2024a. Verbascum orientale (L.) All. in GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei [18/11/2024].
GBIF Secretariat, 2024b. Ononis ornithopodioides L. in GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei [18/11/2024].
Godron D.-A., 1854. Florula juvenalis ou énumération des plantes étrangères qui croissent naturellement au Port-Juvénal, près de Montpellier ; précédé de Considérations sur les migrations des végétaux, seconde édition. Grumblot et veuve Raybois, Nancy, 116 p.
Gouan, A., 1762. Hortus Regius Monspeliensis, sistens plantas tum indigenas tum exoticas n.° MM. CC. ad genera relatas, cum nominibus specificis, synonymis selectis, nominibus trivialibus, habitationibus indigenarum, hospitiis exoticarum, secundum sexualem methodum digestas. In gratiam Philiatrorum Monspeliensium. Lyon : Sumptibus Fatrum De Tournes, https://www.biodiversitylibrary.org/bibliography/71709.
Gouan A., 1796. Herborisations des environs de Montpellier, ou guide botanique à l’usage des élèves de l’École de santé ; ouvrage destiné à servir de supplément au Flora Monspeliaca. Impr. G. Izar et A. Ricard, Montpellier, 274 p.
Grenier C. & Godron D.-A., 1850. Flore de France ou description des plantes qui croissent naturellement en France et en Corse, 2. Sainte-Agathe Aîné, Besançon, 760 p.
Guinochet M. & de Vilmorin R., 1975. Verbascum L. In M. Guinochet & R. de Vilmorin, Flore de France 2, CNRS, Paris, 609-613.
IUCN Standards and Petitions Committee, 2024. Guidelines for Using the IUCN Red List Categories and Criteria. Version 16. Prepared by the Standards and Petitions Committee. Downloadable from https://www.iucnredlist.org/documents/RedListGuidelines.pdf [10/12/2024].
Jauzein Ph., 2014. Ononis L. In J.-M. Tison, Ph. Jauzein & H. Michaud, 2014. Flore de la France méditerranéenne continentale, Naturalia Publications, Turriers : 705-709.
Jovet P. & Kerguélen M., 1990. Flore descriptive et illustrée de la France par l’Abbé Coste, septième supplément. Librairie scientifique et technique Albert Blanchard, Paris, 128 p.
Julve Ph., 1998 ff.a Baseflor. Index botanique, écologique et chorologique de la flore de France, https://www.tela-botanica.org/projets/phytosociologie/porte-documents/ [15/10/2024].
Julve Ph., 1998 ff.b Baseveg. Répertoire synonymique des groupements végétaux de France, https://www.tela-botanica.org/projets/phytosociologie/porte-documents/ [15/10/2024].
Klesczewski M., 2010. 77 ans après : actualisation du catalogue de la flore du massif du mont Aigoual (Cévennes, Massif central méridional). Actes des premières Rencontres végétales du Massif central, 28-30 avril 2010, Le Puy-en-Velay : 89-97.
Klesczewski M., Barret J., Baudot C. & Fleury J., 2010. Évaluer l’état de conservation des habitats naturels à l’échelle du terrain : approches dans le Languedoc-Roussillon. Revue forestière française 62 (3-4) : 417-427, https://hal.science/hal-03449686/document.
Klesczewski M., Sulmont É. & Le Borgne E., 2024. Carex oedipostyla Duval-Jouve dans l’est de l’Occitanie (Gard, Hérault). Carnets botaniques 233 : 1-16, https://doi.org/10.34971/664Z-KD50.
Krause E.H.L., 1917. Die Korb- und Röhrenblütler (Syngenesistae und Tubatae) Elsaβ-Lothringens. Beihefte zum botanischen Centralblatt 35 (1) : 1-221.
Lamarck J.-B. (de) & de Candolle A.P., 1805. Flore française, ou Descriptions succinctes de toutes les plantes qui croissent naturellement en France, disposées selon une nouvelle méthode d’analyse, et précédées par un Exposé des principes élémentaires de la Botanique, troisième édition, tome troisième. H. Agasse, Paris, 731 p.
Le Berre M. & Diadema K. (coord.), 2021. Hiérarchisation des taxons – Stratégie de conservation de la flore vasculaire en région méditerranéenne. Rapport d’étude. CBNMED, CBNC, CBNA, CBNMC, RESEDA-FLORE, 23 p. + annexes. https://reseda-flore.eu/data/res/STRATEGIE_CONSERV/Hi%C3%A9rarchisation%20especes%20
RESEDA%202021.pdf.
Lépine F., Bossaert M., Guéniot P., Hiessler N., Klesczewski M., Rondeau A. & Tanné M., 2019. Réalisation de la zone d’aménagement concertée de Charles-Martel extension : mise en œuvre des mesures compensatoires. « Garrigues de la Madeleine », Villeneuve-lès-Maguelone (34). Plan de gestion 2019-2024 n°1. Rapport CEN Occitanie, Montpellier Méditerranée Métropole, 82 p. et annexes
Lewin J.-M., Schwab Ph., Bouteloup R. & Nicolas S., 2020. Nouvelles contributions à la connaissance de la flore des Pyrénées-Orientales : observations 2019-2020. Mycologie et botanique 35 : 39-52.
Loret H., 1864. Mes herborisations au Bousquet d’Orb et au Caylar (Hérault), en 1864, avec des considérations sur la flore de Montpellier. Bulletin de l’Académie des sciences et des lettres de Montpellier 6 : 97-106, https://gallica.bnf.fr/ark:/12148/bpt6k209723v/f116.item.
Loret H. & Barrandon A., 1876. Flore de Montpellier comprenant l’analyse descriptive des plantes vasculaires de l´Hérault, l’indication des propriétés médicinales, des noms vulgaires et des noms patois, et un vocabulaire explicatif des termes de botanique, tome second. C. Coulet, Montpellier, A. Delahaye, Paris : 419-918.
Loup C. & Munzinger J., 2021. Puis-je donner des spécimens à un herbier d’Occitanie ? Carnets botaniques 65 : 1-23, https://doi.org/10.34971/4dpm-w289.
Maciejewski L., Seytre L., Van Es J. & Dupont P., 2015. État de conservation des habitats agropastoraux d’intérêt communautaire, Méthode d’évaluation à l’échelle du site. Guide d’application, version 3. Rapport SPN 2015 – 43, Service du patrimoine naturel, Muséum national d’histoire naturelle, Paris, 194 p.
Marhold K., 2011+. Verbascum. In Euro+Med Plantbase – the information resource for Euro-Mediterranean plant diversity. http://ww2.bgbm.org/EuroPlusMed/PTaxonDetailOccurrence.asp?NameId=34244&PTRefFk=7200000 [01/12/2024].
Marnac É. & Reynier A., 1910. Flore phanérogamique des Bouches-du-Rhône. Première partie : Préliminaires : plantes subspontanées, adventices, naturalisées. Impr. Monnoyer, Le Mans, 131 p. https://bibdigital.rjb.csic.es/en/records/item/12716-flore-phanerogamique-des-bouches-du-rhone?offset=1.
Martin Pigeonnier S., Bossaert M., Chirossel C., Lépine F., Klesczewski M., Le Borgne E., Olivier B. & Vollot B., 2024. Réalisation de la zone d’aménagement concertée de Charles-Martel extension : mise en œuvre des mesures compensatoires. « Garrigues de la Madeleine », Villeneuve-lès-Maguelone (34). Plan de gestion 2024-2029 n°2. Rapport CEN Occitanie, Montpellier Méditerranée Métropole, 121 p. et annexes.
Martins M. Ch., 1856. Des espèces exotiques naturalisées spontanément dans le jardin des plantes de Montpellier. Bulletin de La Société botanique de France 3 (3) : 153-158, https://doi.org/10.1080/00378941.1856.10826095.
Maslo S., 2023. Four rare taxa of the genus Verbascum (Scrophulariaceae) for the vascular flora of Bosnia and Herzegovina. Phytologia Balcanica 29 (1) : 77-86, http://www.bio.bas.bg/~phytolbalcan/PDF/29_1/PhytolBalcan_
29-1_2023_08_Maslo.pdf.
Médail F., Baumel A., Diadema K. & Migliore J., 2012. La biodiversité végétale méditerranéenne, organisation et évolution. Regard R38 du 7 nov. 2012, SFE, 11 p., https://sfecologie.org/wp-content/uploads/2012/11/R38-Medail-al-2012.pdf.
Meunier J., 2024. Observation de Verbascum orientale à Montpellier. https://www.inaturalist.org/observations/
208680141.
MNHN & OFB [eds], 2003-2024a. Fiche de Ononis ornithopodioides L., 1753. Inventaire national du patrimoine naturel (INPN), https://inpn.mnhn.fr/espece/cd_nom/110212 [21/11/2024].
MNHN & OFB [eds], 2003-2024b. Fiche de Verbascum orientale (L.) All., 1785. Inventaire national du patrimoine naturel (INPN), https://inpn.mnhn.fr/espece/cd_nom/128623 [21/11/2024].
MNHN & OFB [eds], 2003-2024c. Inventaire national du patrimoine naturel. Fiche-habitat 6220 – Parcours substeppiques de graminées et annuelles du Thero-Brachypodietea, https://inpn.mnhn.fr/habitat/cd_hab/1126 [28/11/2024].
Molinier R. & Martin P., 1981. Catalogue des plantes vasculaires des Bouches-du-Rhône (ouvrage publié à titre posthume avec la participation de Paul Martin). Imprimerie municipale de Marseille, 375 p.
Murbeck S., 1925. Monographie der Gattung Celsia. Lunds Universitets Årsskrift., N.F. Avd. 2, 22 (1) : 1-237.
Nikolić T. (éd.), 2024. Flora Croatica Database. Vascular Plants Taxonomy & Bibliography of Croatian Flora. University of Zagreb, Faculty of Science, Department of Botany and Botanical Garden, Zagreb, https://hirc.botanic.hr/fcd/DetaljiFrame.aspx?IdVrste=26257&taxon=Verbascum+orientale+(L.)+All [01/12/2024].
Parlatore F. & Caruel T., 1848. Flora italiana; ossia, Descrizione delle piante che crescono spontanee o vegetano come tali in Italia e nelle isole ad essa aggiacenti; disposta secondo il metodo naturale, VI – Corolliflore. Le Monnier successori, Firenze, 971 p., https://www.biodiversitylibrary.org/page/64000668.
Pavon D. & Pires M., 2020. Flore des Bouches-du-Rhône. Naturalia, Turriers, 351 p.
Pereyra P.J., 2019. Rethinking the native range concept. Conservation Biology 34 : 373-377, https://doi.org/10.1111/cobi.13406.
Pereyra P.J. & Guiaşu R.C., 2020. Debate over the importance and meaning of native range in invasion biology: reply to Courchamp et al. Conservation Biology 34 (4) :1044-1046, https://doi.org/10.1111/cobi.13529.
Pignatti S., 1982. Flora d’Italia,2. Edagricole, Bologna, 732 p.
Planchon G., 1864. Des modifications de la flore de Montpellier depuis le xvie siècle jusqu’à nos jours. Savy, Paris, Impr. Boehm et fils, Montpellier, 57 p.
Plassart C., Barreau D. & Andrieu F. (coord.), 2016. Atlas de la flore patrimoniale de l’Aude. Biotope, Mèze, 432 p.
Portal to the Flora of Italy, 2024. Available at https://dryades.units.it/floritaly/ [01/12/2024]
POWO, 2025. Plants of the World Online, facilitated by the Royal Botanic Gardens, Kew, published on the Internet, http://www.plantsoftheworldonline.org/ [28/01/2025].
Raffeneau-Delile, 1849. Index seminum horti regii botanici Monspeliensis, Anno 1849. J. Martel, Montpellier, 7 p. https://seedlists.naturalis.nl/content/index-seminum-horti-botanici-monspeliensis-anno-1849.
Reichenbach H.G., 1862. Icones florae Germanicae et Helveticae simul Pedemontanae, Lombardovenetae, Istriacae, Dalmaticae, Hungaricae, Transsylvanicae, Borussicae, Danicae, Belgicae, Hollandicae, Alsaticae, ergo mediae Europae. Iconographia et supplementum ad opera Willdenowii, Schkuhrii, Persoonii, Decandollii, Gaudini, Kochii aliorumque nuperrime detectis novitiis additis exhibens collectionem compendiosam imaginum characteristicarum omnium generum atque specierum quas in Flora Germanica excursoria recensitarum auctoribus L. Reichenbach et H.G. Reichenbach filio, XX. Abel Ambrosi, Leipzig, 120 p. & annexes, https://doi.org/10.5962/bhl.title.6353, https://www.biodiversitylibrary.org/page/6052835#page/235/mode/1up.
Rioux J. & Quézel P., 1950. La “Flora Juvenalis” en 1950. Le Monde des plantes 272 : 73-74.
Rouy G., 1909. Flore de France ou description des plantes qui croissent spontanément en France, en Corse et en Alsace-Lorraine, XI. Société des sciences naturelles de la Charente-Inférieure, 429 p.
Salabert J. & Gastesoleil J., 1991. Contribution à l’inventaire de la flore de l’Hérault. Le Monde des plantes 442 : 16-18.
Samat L., 1939. Celsia orientalis Lin. dans les Bouches-du-Rhône. Le Monde des plantes 235 : 5.
Schmitz D.C., Simberloff D., Hofstetter R.H., Haller W. & Sutton D., 1997. The ecological impact of nonindigenous plants. In D. Simberloff, D.C. Schmitz & T.C. Brown (éds.), Strangers in Paradise, Island Press, Washington DC. : 39-61.
Sibthorp J., Smith J.E., Hawkins J., Lindley J., Bauer F., Sowerby J., Sowerby J. de C. et al., 1806. Flora Graeca, sive, Plantarum rariorum historia, quas in provinciis aut insulis Graeciae, 7. Typis Richardi Taylor et socii, in Vico Shoe-Lane, London, 88 p., https://www.biodiversitylibrary.org/page/54122915.
Thellung A., 1912. La Flore adventice de Montpellier. Emile Le Maout, 728 p. ; https://www.biodiversitylibrary.org/bibliography/74009.
Tison J.-M., 2014a. Ononis L. In J.-M. Tison & B. de Foucault (coords.), Flora Gallica, Flore de France, Biotope, Mèze : 744-746.
Tison J.-M., 2014b. Verbascum L. In J.-M. Tison, Ph. Jauzein & H. Michaud, Flore de la France méditerranéenne continentale, Naturalia, Turriers : 1380-1383.
Tison J.-M., 2014c. Verbascum L. In J.-M. Tison & B. de Foucault (coords.), Flora Gallica, Flore de France, Biotope, Mèze : 1054-1056.
Touchy A., 1857a. Rapport de M. le Dr. Touchy sur l’herborisation faite, le 10 juin, au bois de la Moure et au Port-Juvénal, et dirigée par MM. Chatin et Touchy. Bulletin de la Société botanique de France 4 : 592-594.
Touchy A., 1857b. Sur quelques plantes étrangères à la flore de Montpellier, trouvées aux environs de cette ville. Bulletin de la Société botanique de France 4 : 626-627.
UICN, 2012. Catégories et critères de la Liste rouge de l’UICN, version 3.1, 2e édition. Gland, Suisse et Cambridge, Royaume-Uni : UICN. vi + 32pp. Originalement publié en tant que IUCN Red List Categories and Criteria: Version 3.1. Second edition. (Gland, Switzerland and Cambridge, UK: IUCN, 2012). https://portals.iucn.org/library/sites/library/files/documents/RL-2001-001-2nd-Fr.pdf.
Webb, D. A., 1985. What are the criteria for presuming native status? Watsonia 15 : 231-236.
Remerciements
Je tiens à remercier chaleureusement les personnes suivantes : Guillaume Fried (ANSES ; présentation des stations de Verbascum orientale à Saint-Jean-de-Fos, relecture critique et approfondie du manuscrit ayant permis son amélioration significative), Sarah Silvéréano et Frédéric Andrieu (Conservatoire botanique national méditerranéen ; envoi d’informations), Rafaël Govaerts (Royal Botanic Gardens, Kew ; échanges sur les aires de répartition), Elsa Le Borgne, Océane-Lou Chapas, Lili-Rose Saint-Pierre, Gauthier Durney (CEN Occitanie ; aide lors des prospections), Gisèle Archipoff (directrice de l’Herbier de l’Université de Strasbourg ; recherches dans l’herbier et envoi de scans), Florence Tessier (Bibliothèque de botanique, Muséum national d’histoire naturelle ; envoi de scans), Patricio J. Pereyra (envoi de bibliographie), Jean-Paul Dauphin (Conservatoire d’espaces naturels PACA ; envoi de bibliographie et d’informations), Romain Lejeune (envoi de photos et d’informations, relecture), Xavier Fortuny (envoi de photos et d’informations), Michèle et Jean-Louis Aubrun, Marie-Thérèse Goupil (SHHNH ; envoi de photos et autorisations d’utilisation), Aurélie Genries (CEN Occitanie ; insistance au sujet de la réalisation d’un inventaire floristique exhaustif), Clémentine Plassart (CEN Occitanie et SESA ; recherches et envoi d’informations), Louis Clouet (auddicé ; relecture), Guilhem Dessailly, Aude Langlais, Fabien Lépine (CEN Occitanie ; envoi d’informations sur l’historique du pâturage sur la Gardiole), Romain Bartheld, Christophe Girod, Mathias Pires (discussion au sujet des aires de répartition), Caroline Loup (responsable de l’herbier de Montpellier ; recherche de spécimens et aide à la traduction), Bruno de Foucault (relecture et corrections).
Merci aussi à ReColNat (ANR-11-INBS-0004 ; https://www.recolnat.org/fr/) qui nous a permis la recherche efficace de spécimens en ligne, ainsi qu’à la Biodiversity Heritage Library (BHL) at Smithsonian Libraries and Archives (Washington, D.C., USA) dont le site www.biodiversitylibrary.org rend les références bibliographiques anciennes si facilement et librement accessibles.