Compte rendu de mission en Nouvelle-Calédonie, 1-18 octobre 2023
Title
Report on mission to New Caledonia, October 1-18, 2023
Résumé
Une mission de trois semaines a eu lieu en Nouvelle-Calédonie en octobre 2023, visant principalement l’observation et la collecte des Lauraceae, Rutaceae, Balanopaceae, Sapindaceae et Clusiaceae (Garcinia), en cours d’étude. D’autres espèces ont été collectées opportunement au gré des hasards des rencontres sur le terrain. Dix-huit sites ont été prospectés, chacun d’entre eux est présenté chronologiquement, avec les objectifs initiaux, la liste des récoltes réalisées ou observations d’intérêt et les principaux résultats obtenus jusqu’alors. Des photos de terrain sont également fournies pour certaines espèces d’intérêt. Au moins quinze espèces nouvelles ont été récoltées lors de cette mission, permettant d’avancer sur la description de plusieurs d’entre elles.
Abstract
A three-week mission took place in New Caledonia in October 2023, mainly to observe and collect Lauraceae, Rutaceae, Balanopaceae, Sapindaceae and Clusiaceae (Garcinia), currently under study. Other species were collected opportunistically through chance encounters in the field. Eighteen sites have been surveyed, each presented chronologically, with initial objectives, a list of collections made or observations of interest, and the main results obtained to date. Field photos are also provided for certain species of interest. At least fifteen new species were collected during this mission, enabling progress to be made on the description of several of them.
1. Objectifs de la mission
La mission se faisait dans le cadre de la révision des Lauraceae (NC-Laurac), entreprise depuis plusieurs années pour la Flore de Nouvelle-Calédonie, qui a déjà permis la description de cinq espèces dans le genre Cryptocarya (Munzinger & McPherson, 2016, 2021), trois espèces dans le genre Endiandra (Gâteblé et al., 2018 ; Munzinger et al., 2024) et la redéfinition du genre Litsea sur le territoire (Munzinger & McPherson 2017 ; Munzinger et al., 2022).
Le deuxième objectif était la famille des Rutaceae, dont nous avons commencé la révision (Bruy et al., 2023 ; Munzinger & Bruy, 2023), suite au décès en 2016 de T.G. Hartley, spécialiste de la famille. Dans ce cadre-là, une collaboration est en cours avec M. Appelhans car les phylogénies moléculaires montrent que la délimitation de plusieurs genres pose problème et doit être revue (Appelhans et al., 2014). Nous visions plus précisément pour cette mission le genre Zanthoxylum. En effet, une semaine de travail à l’herbier du Muséum de Paris en août 2023 nous a permis d’émettre des hypothèses taxonomiques sur le nombre d’espèces présentes sur le territoire. La mission visait donc à prospecter des localités d’intérêt pour le genre, que ce soit pour compléter le matériel de potentielles espèces nouvelles (fleurs et/ou fruits inconnus pour certaines) ou bien de compléter l’inventaire dans certaines zones peu connues, et plus généralement de nous familiariser avec ce genre et de confronter nos hypothèses, basées sur les herbiers, avec le terrain. Le nouveau matériel s’ajoute à celui existant et a servi de base à la révision, qui a été le sujet d’un stage de six mois début 2024, à l’Herbier de Nouvelle-Calédonie (NOU).
Le troisième objectif visait le genre Balanops, en cours d’étude, notamment à travers une étude moléculaire, en collaboration avec les jardins botaniques de Kew, s’appuyant sur le kit Angio353.
Le quatrième objectif était de compléter l’échantillonnage de la famille des Sapindaceae, à l’étude depuis de nombreuses années, avec un focus particulier sur les genres Gongrodiscus et Alectryon, également à l’étude en collaboration avec Kew, et qui ont été étudiés en juillet 2023 par deux étudiants de licence de l’Université de Montpellier.
Le cinquième objectif était de compléter l’échantillonnage du genre Garcinia pour la révision du genre en cours. Une nouvelle espèce a été décrite récemment (Munzinger et al., 2021) et un travail de phylogénie moléculaire (Gaudeul et al., 2024) a permis de valider l’endémisme des espèces de Nouvelle-Calédonie (versus des noms du Vanuatu et de Fidji), mais la délimitation taxonomique au sein de certains complexes d’espèces et la nomenclature ne sont pas encore bien comprises.
Enfin, au hasard des rencontres : matériel en fleur ou fruits, taxons d’intérêt (nouvelles localités), genres en cours de révision (ou révision nécessaire), des récoltes diverses sont réalisées dans le cadre plus général de l’inventaire de la flore de Nouvelle-Calédonie.
2. Zones prospectées
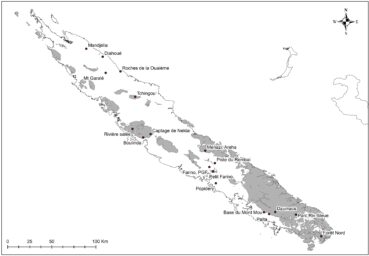
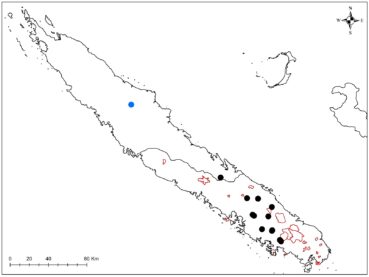
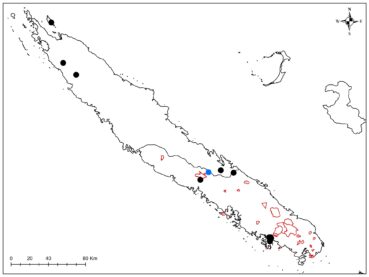
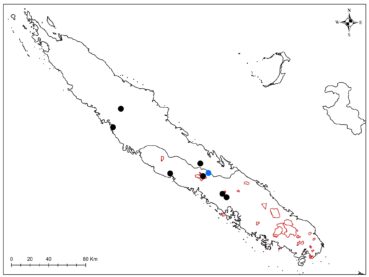
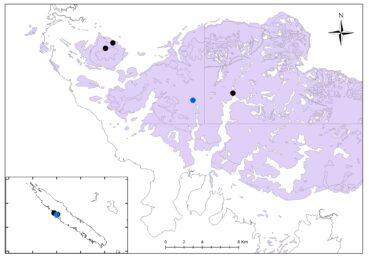
Au total dix-huit sites couvrant la Grande-Terre ont fait l’objet d’au moins une récolte (carte 1).
3. Méthodes de travail
La méthode de travail est la même que celle décrite dans un précédent rapport publié dans les Carnets botaniques (Munzinger & Bruy, 2023).
Sophie Gonzalez (IRD, Herbier de Cayenne ; photo 1) et Christian Laudereau (photo 2) nous ont accompagnés sur de nombreux sites et ont fourni de nombreuses photos présentes dans ce rapport. Le montage et la numérisation des spécimens à l’herbier de Montpellier ont été réalisés par Caroline Loup, Clarisse Costa-Pothin, Elsa Le Brigand, Mehdi Mouana (MPU), Chantal Geniez (UMR AMAP), ainsi que par les bénévoles et permanents lors des journées de montage. L’informatisation des spécimens à l’Herbier NOU a été réalisée par Emmanuelle Vanhalle, le montage par Williams Nigote et Emmanuelle Vanhalle et la numérisation par Mathieu Donnat et Emmanuelle Vanhalle.
L’identification s’est faite principalemenet en utilisant la Flore de Nouvelle-Calédonie (Aubréville et al., 1967-2024) et par comparaison avec les spécimens déposés à MPU, NOU (Bruy et al., 2021) et P (Le Bras et al., 2017) (codes selon Thiers, 2024). Nous avons également étudié les collections virtuelles de l’initiative Global Plants (https://plants.jstor.org/) et utilisé l’infrastructure Recolnat (https://www.recolnat.org/ fr/).
4. Résultats
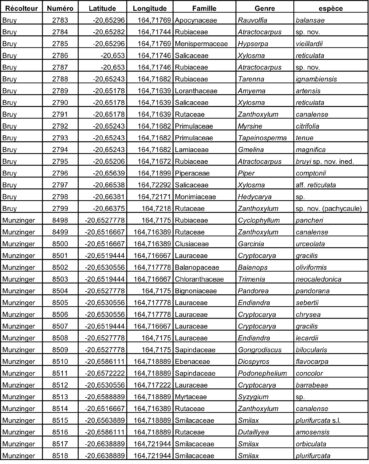
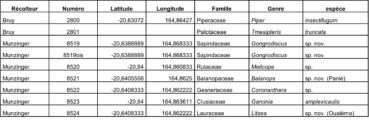
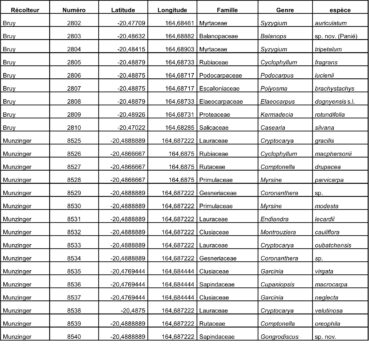
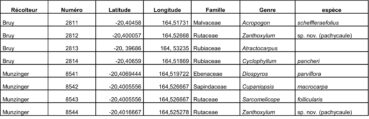
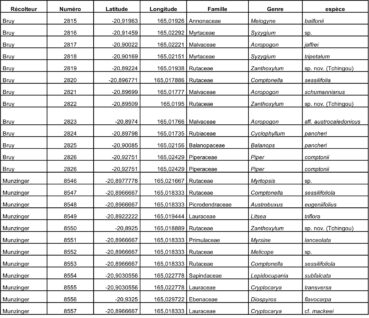
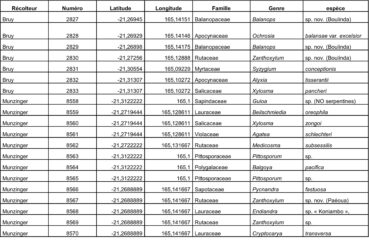
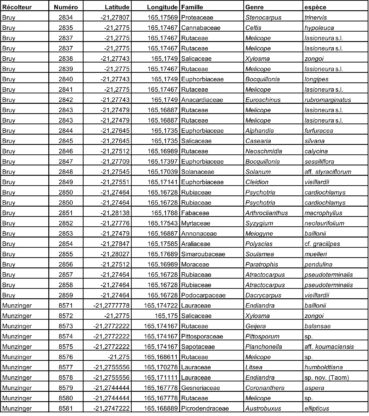
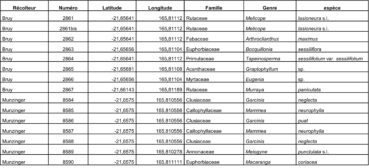
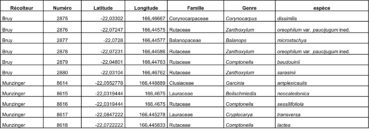
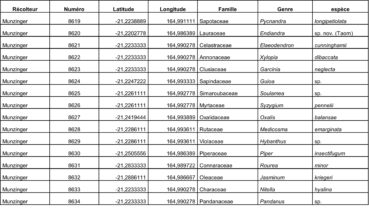
Au total, 237 récoltes ont été réalisées lors de cette mission, par J. Munzinger (nos 8498 à 8636, soit 139 récoltes) et D. Bruy (nos 2783 à 2880, soit 98).
Chaque site est présenté chronologiquement, avec les objectifs initiaux et les principaux résultats, ainsi que la liste complète des récoltes réalisées. Les données des herbiers déposés à MPU et P sont accessibles sur le site des herbiers de France en suivant ce lien. Les spécimens déposés à Nouméa sont visibles via le site de l’herbier NOU. Les photos de 39 plantes qui n’ont pas été récoltées ont été déposées sur iNaturalist dans le projet « Mission_NC_10_2023 » et sont accessibles en suivant ce lien. Ce projet regroupe des photos de S. Gonzalez, Ch. Laudereau et J. Munzinger.
5. Sites visités
5.1. Mt. Garalé, 1 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau)
Objectifs principaux
Parmi les taxons nouveaux hypothétiques repérés dans le genre Zanthoxylum, l’un d’entre eux, dont les fleurs femelles sont inconnues, semble être limité dans sa distribution au massif du Panié au sens large. Les fleurs femelles d’un Balanops nouveau du même secteur sont inconnues. De même un Alectryon, dont le genre est en cours d’étude, n’est connu que d’une récolte vers haut Coulna.
Résultats principaux ; tableau 1
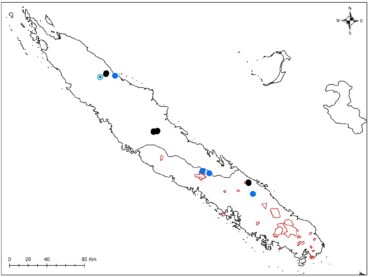
Rutaceae : Le Zanthoxylum a été trouvé, remarquable par ses tiges très épaisses (photos 3 à 5), Garalé est une nouvelle localité pour ce taxon et permettra d’avoir du matériel récent pour les travaux de phylogénie moléculaire, ainsi que pour Z. canalense, qui était en fleurs et en fruits (photos 6 et 7). Dutaillyea amosensis (VU) a été récolté pour la première fois sur ce site, ce qui complète la carte de distribution de l’espèce (carte 2).
Lauraceae : cinq espèces de Cryptocarya ont été rencontrées sur le site, dont C. gracilis (photo 8) en pleine fleurs, montrant bien ses neuf étamines fertiles (photo 9). Cryptocarya chrysea a été décrite en n’étant connu que de trois localités (Munzinger & McPherson, 2016) ; sept ans plus tard cet arbre a été récolté dans quatre localités supplémentaires, auxquelles s’ajoute Garalé (photo 10 ; carte 3). Nous avons également noté la présence de C. macrodesme, C. oubatchensis (photo 11) et C. longifolia (photo 12). Deux espèces d’Endiandra étaient présentes, dont E. lecardii en fleur (photo 13), avec les trois étamines fertiles typiques du genre (photo 14). Endiandra sebertii présente des feuilles très révolutées (photo 15) dans la partie nord de l’île, nous ne savons pas si ce caractère mérite de distinguer un taxon infraspécifique.
Concernant les collectes généralistes, l’espèce assez rare Tapeinosperma tenue a été collectée pour la première fois dans cette localité, un Hedycarya à toutes petites feuilles n’a pu être rattaché à aucune espèce décrite, et plusieurs récoltes attribuées à Xylosma reticulata nous font penser que celui-ci correspond à un complexe qui pourrait comporter au moins deux entités différentes.
5.2. Roches de la Ouaième, 2 octobre (participants : J. Munzinger, Ch. Laudereau, S. Gonzalez)
Objectif principal
Un Endiandra de cette localité se différencie de toutes les autres récoltes, notamment par ses très longs pétioles, nous l’avions vu en avril 2022 en jeunes fruits (Munzinger & Bruy, 2023), nous souhaitions documenter les fleurs de cette espèce. Nous avons également un Litsea nouveau, qui se distingue par les données moléculaires (Munzinger et al., 2022), mais que nous ne connaissons qu’en boutons ; nous avons besoin de fleurs et fruits pour décrire cette espèce. Un Gongrodiscus probablement nouveau est également connu de ce site.
Résultats principaux ; tableau 2
L’Endiandra (photo 16), bien qu’abondant, ne présentait aucun élément de fertilité. La plupart des pieds de Litsea étaient également sans fertilité, sauf un individu avec de très jeunes boutons et de très vieilles fleurs sèches (photos 17 et 18), qui aideront peut-être à l’étude de l’espèce. Un Melicope a été rencontré en fleurs (photo 19), ainsi que le Gongrodiscus en jeunes fruits (photo 20). À la descente nous avons traversé une population de Garcinia puat, qui était en fleurs, y compris des fleurs femelles pour lesquelles nous avions peu de photos (photo 21).
5.3. Diahoué, 3 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau)
Objectif principal
Ce troisième site de la chaîne du Panié avait les mêmes objectifs que les précédents.
Résultats principaux ; tableau 3
Lauraceae : Cryptocarya velutinosa, C. gracilis, C. oubatchensis, Endiandra lecardii ont été récoltés. Un Balanops nouveau, connu uniquement du massif du Panié et des roches de la Ouaième, en cours de description, a été trouvé en fruits (photo 22). Dans les Rubiaceae, Cyclophyllum macphersonii (photo 23), décrit récemment et uniquement connu du Colnett (Mouly & Achille, 2015), n’était pas encore documenté avec des photos sur le terrain.
Un Elaeocarpus a été ramassé en boutons et jeunes fruits (photo 24) ; en suivant le traitement de Tirel (1982), nous arrivons à E. dognyensis, cependant notre matériel semble parfaitement se rattacher au E. prunifolius de Schltr. et nous nous interrogeons sur la synonymie de ce taxon avec E. dognyensis.
5.4. Mandjélia, 4 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau)
Objectif principal
Autre site de la chaîne du Panié avec les mêmes objectifs.
Résultats principaux ; tableau 4
Dans les Rutaceae, Sarcomelicope follicularis a été récolté en fruits (photo 25) ; plusieurs individus de Zanthoxylum sp. nov. (« pachycaule ») ont été localisés, la plante se distinguant bien par son port en mouchet (photo 26). Chez les Sapindaceae, le genre Cupaniopsis reste problématique, notamment le statut de C. macrocarpa var. polyphylla, que nous avons rencontré en fruits (photo 27) et que nous suspectons d’être une espèce à part entière.
D’après une étude morphologique et moléculaire en cours, la seule espèce à feuilles composées du genre endémique Acropogon Schltr. (Malvaceae) peut être séparée en au moins cinq entités distinctes. La population du Mandjélia, l’une des dernières à ne pas encore avoir été séquencées, a pu être échantillonnée pour la première fois depuis 1991 (photo 28). Les graines mûres de Gardenia oudiepe n’étaient pas documentées, nous avons pu les mesurer (photo 29). Enfin, dans le cadre des travaux en cours sur les Diospyros de Nouvelle-Calédonie, nous avons prélevé Diospyros parviflora en fruits (photo 30), Mandjélia étant la localité type de l’espèce. Des graines ont été prélevées pour être mises en culture en Nouvelle-Calédonie dans le cadre du projet DiosAdapt.
5.5. Tchingou, 5 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau)
Objectif principal
Un Zanthoxylum considéré comme nouveau par T. Hartley n’est connu que de récoltes en fruits de ce massif. Hartley a utilisé deux noms provisoires dans les herbiers (“unifoliatum”) et dans son manuscrit non publié (”tchingou”). La fleur n’ayant jamais été documentée, il faudrait la retrouver pour pouvoir confirmer le statut de nouveauté et pouvoir décrire l’espèce le cas échéant.
Deux Syzygium (Myrtaceae) d’intérêt sont connus du Tchingou : une espèce non décrite connue de peu de récoltes (N. Snow, comm. pers.) et une espèce proche de S. malaccense mais présentant des fleurs blanches et dont le fruit n’est pas connu. La collecte de matériel fertile supplémentaire est nécessaire pour une révision de la famille en cours.
Résultats principaux ; tableau 5
Rutaceae : le Zanthoxylum était en pleine floraison (photo 31), la plante est clairement dioïque, avec des individus entièrement mâles (photo 32) ou femelles, les fleurs femelles de cette espèce peuvent être tétra- ou pentamères (photo 33). Les observations de terrain nous ont montré que la plante est majoritairement à feuilles unifoliolées, mais que chacun des individus rencontrés présente au moins quelques feuilles à deux-trois folioles, une épithète spécifique à peu de folioles « paucifoliolatum » serait donc plus judicieux. Des individus des genres Myrtopsis (photo 34), Comptonella (photo 35) et Melicope (photo 36), dont la taxonomie est à revoir, ont été collectés.
Lauraceae : le Litsea triflora, dont la délimitation est en cours d’étude, a été rencontré en pleine floraison (photo 37), ainsi que Cryptocarya transversa (photo 38). Un Cryptocarya stérile a été rencontré, qui n’avait jamais été signalé de ce massif. Son pétiole très élargi (photo 39) semble le rapprocher de Cryptocarya mackeei, ce qui élargirait considérablement la distribution de l’espèce, jusqu’alors uniquement connue du sud du territoire, avec comme limite le nord de Canala (photo 40 ; carte 4).
Balanopaceae : une collecte du Balanops pancheri, espèce variable en cours d’étude, a été réalisée. Elle sera incluse au travail de phylogénie moléculaire en cours.
Myrtaceae : l’espèce nouvelle de Syzygium en cours de description aurait été collectée en fruit (photo 41) et la seconde espèce de Syzygium recherchée a été observée mais pas à l’état fertile.
Malvaceae : dans le genre Acropogon, l’espèce appartenant au complexe « austrocaledonicus » et considérée comme nouvelle par Morat (Acropogon gigantifolius Morat ined.) a été collectée avec des fleurs passées. L’espèce en danger d’extinction A. jaffrei a été collectée pour la première fois sur le massif du Tchingou. Enfin une forme atypique arborescente à feuilles entières de A. schumannianus a été collectée en fleur, elle sera intégrée à l’étude moléculaire en cours sur ce genre.
5.6. Boulinda, 6 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau)
Objectifs principaux
Un Zanthoxylum sp. « Boulinda » que nous supposons nouveau n’est connu que de récoltes du Paéoua et du Boulinda, nous souhaitons avoir plus de matériel de ce taxon. Une récolte de Litsea (Morat 5049) semble proche de L. ovalis, mais s’en distingue par ses cicatrices foliaires très en relief et son écologie forestière ; ce taxon supposé nouveau n’étant connu que de cette seule récolte, il nous faut plus de matériel pour pouvoir statuer. Un Balanops a très grandes feuilles est connu de ce massif, que Carlquist (1980) a inclus dans B. pancheri mais qui nous semble distinct, les fleurs mâles de ce taxon nous sont inconnues.
Résultats principaux ; tableau 6
Rutaceae : le Zanthoxylum a été récolté en boutons (photo 42) et en fleurs mâles (photo 43). Medicosma subessilis a été récolté en fleurs (photo 44).
Lauraceae : un Beilschmiedia en fleurs a été observé (photo 45), appartenant au complexe neocaledonica/oreophila en cours d’étude. Un Endiandra sp. « Koniambo », proche de E. lecardii mais à pétioles plus longs, que nous ne connaissons que du Koniambo et du Boulinda, a été vu en boutons (photo 46). Cryptocarya transversa a été récolté en boutons, cette espèce n’était pas signalée au nord de Bourail dans la Flore (Kostermans 1974), nous essayons de mieux comprendre sa distribution (photo 47).
Le Balanops recherché a été récolté en vieilles inflorescences mâles (photo 48), qui aideront peut-être à la description de l’espèce ; des individus en fruits assez avancés ont également été vus (photo 49).
Pycnandra fastuosa tel qu’actuellement reconnu correspond à un complexe d’espèces dont une espèce cryptique (Swenson & Munzinger, 2016). Au sein de ce complexe, deux entités se distinguent par l’espacement (large ou étroit) entre les nervures secondaires. Contrairement à ce que Swenson et Munzinger (2016) avaient conclu, le lectotype de P. fastuosa, Balansa 1323 (P00292407), désigné par Vink (1957 : 102) correspond à la forme à nervures larges, que nous avons récoltée (photo 50), l’espèce cryptique à décrire restant toujours à trouver en fleurs, ce taxon étant visiblement restreint au grand massif ultramafique du sud.
Un Syzygium (Myrtaceae) (Bruy 2831 ; photo 51) est semblable à la récolte MacKee 26895 du Kopéto, celle-ci a été déterminée par J. Dawson comme S. conceptionis. Nous l’avons donc rattaché à ce taxon, mais la délimitation de cette espèce nous semble peu claire et mérite probablement une révision.
Un Guioa (Sapindaceae) appartenant au complexe « gracilis » a été fréquemment rencontré en pleine floraison dans les maquis sur sol hyper-magnésiens (photo 52), cette morpho-espèce « NO serpentines » n’avait visiblement pas été encore ramassée au moment de la révision du genre par van Welzen (1989), nous ne savons donc pas à quoi il correspond selon sa conception des espèces. Ce genre nécessite selon nous une profonde révision.
Balgoya pacifica (Polygalaceae ; photo 53) est signalé pour la première fois d’un massif nord-ouest et n’était pas connu sur serpentinites (Morat & van der Meijden, 1991).
Ochrosia balansae var. excelsior (Apocynaceae), micro-endémique du Boulinda et du Me Maoya, a été récolté en fruit. À notre connaissance ce n’est que la cinquième collecte pour cette variété.
5.7. Captage de Nekliaï, 7 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau, H. Vandrot, A. Nekliaï)
Objectif principal
Ce site n’a pratiquement jamais été prospecté, alors qu’il est géographiquement intéressant pour plusieurs de nos groupes d’étude et pour compléter la connaissance de la flore en général. Grâce à l’aide de Hervé Vandrot, la tribu de Nekliaï ayant accepté de nous accueillir, et Arnold Nekliaï de nous accompagner, nous avons pu accéder à ce site méconnu.
Résultats principaux ; tableau 7
Rutaceae : Geijera balansae est signalé pour la première fois de cette localité (photo 54), un Melicope du complexe « lasioneura » a été récolté en fleur (photo 55). Neoschmidia calycina, espèce micro-endémique menacée d’extinction, a été collecté en fleur.
Lauraceae : un Endiandra sp. « Fridoline » que nous supposons nouveau, très caractéristique par son écorce très claire et sa nervure primaire rouge-orangé (photo 57), a été récolté, cette nouvelle localité étend plus au sud la distribution de cette espèce. Endiandra baillonii, au revers de feuilles très glauque, a été récolté (photo 58). Litsea humboldtiana a été observé (photo 59), c’est une nouvelle localité de cette espèce, connu désormais de six stations.
Sapotaceae : un Planchonella, affine de P. koumaciensis, a été trouvé stérile. Le statut de ce taxon est problématique (espèce distincte ou taxon infraspécifique de P. koumaciensis ?). Cette nouvelle population va aider à la compréhension du groupe. Pycnandra acuminata ou « sève bleue », nom commun faisant référence au latex vert-bleuté (photo 60) dû au fort pourcentage de nickel, a été observé.
Austrobuxus ellipticus (Picrodendraceae) a été rencontré en fruits (photo 61), ce qui complète la distribution connue de l’espèce (McPherson & Tirel, 1987).
Solanaceae : un Solanum en fleur a été récolté (photo 62). Il rentre dans le large concept de Heine (1976) de Solanum styraciflorum, mais cette entité a été revue et découpée en plusieurs espèces (McClelland et al., 2020). Notre récolte semble bien correspondre à d’autres spécimens de ce complexe (Veillon 8125, Munzinger 4959), mais semble s’en distinguer et n’ont pas été traités par McClelland et al.
Simaroubaceae : Soulamea muelleri a été récolté en fleur mâle (photo 56). Cette collecte étend l’aire de répartition de l’espèce vers le sud, et notamment sur le massif du Boulinda où l’espèce micro-endémique S. rigaultii est présente. La présence en sympatrie de ces deux espèces morphologiquement proches pose question sur les délimitations spécifiques au sein du genre.
5.8. Popidéry, 8 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez)
Objectif principal
David Bruy s’était engagé à animer une sortie botanique dans une forêt sèche classée par la Province Sud sur une propriété privée de Popidéry. Nous comptions en profiter pour prospecter certaines espèces rares de Rutaceae de forêt sèche.
Résultats principaux ; tableau 8
Les végétations visitées se sont révélées très dégradées (photo 63) et la diversité végétale faible. Un Aleurites a été récolté, très similaire par son port et ses fleurs (photo 64) à A. mollucanus (L.) Willd., mais à feuilles très orbiculaires (photo 65), que nous n’avions jamais vu auparavant. Après recherches bibliographiques, il existe une var. circulatus (circulata) décrite par Langeron, uniquement connue de la récolte type Balansa 3443 du village d’Ouroué. Wheeler (1939) précise que les variétés de Langeron ont été négligées par les différents auteurs, comme c’est le cas dans la révision du genre de Stuppy et al. (1999), le traitement de la Flore de Nouvelle-Calédonie par McPherson & Tirel (1987) ou le référentiel Florical (Munzinger et al., 2023). Cette seconde récolte, identique au type de la var. circulatus et provenant d’une localité très éloignée, interroge sur la validité de cette variété tombée dans l’oubli. Un Nitella (Characeae, algue verte), dont la famille nécessite une révision, a été récolté.
5.9. Petit Farino, 8 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez)
Objectif principal
Il existe dans la région de Petit Farino une zone de forêt sur serpentinites géographiquement isolée des autres et présentant une biodiversité végétale originale. Une population de Zanthoxylum y a été repérée par D. Bruy en 2022, qui semble intermédiaire entre Z. canalense et Z. pancheri. Nous souhaitions retrouver cette population et compléter l’échantillonnage.
Résultats principaux ; tableau 9
Rutaceae : le Zanthoxylum recherché a été observé, mais sans organes reproducteurs. Un Melicope à feuilles pennées (photo 66), caractère inédit pour le genre en Nouvelle-Calédonie, a été récolté en fruit. Murraya paniculata a été collecté en fleur. Un Graptophyllum (photo 67), s’apparentant au G. macrostemon uniquement connu des massifs nord-ouest, a été collecté en fleurs, ce taxon requière des études complémentaires. Un Eugenia nouveau, collecté une seule fois auparavant, a été récolté en bouton ; la population, très localisée géographiquement, semble très affectée par la rouille des Myrtaceae (photo 68).
Deux Garcinia ont été récoltés, G. puat (photo 69) et G. neglecta (photo 70). Un rameau de G. neglecta avait été cueilli sur le chemin de retour du captage de Nekliaï, la comparaison des deux montre une grande hétérogénéité chez cette espèce, avec des fleurs blanches pédicellées et à calice vert dans le nord-ouest, alors que les individus de Farino présentent des fleurs jaunes plus petites, sessiles ou à pédicelle très court (photo 71) ; la révision de ce taxon apparaît nécessaire.
Mammea neurophylla a été rencontré en pleine floraison ; cette espèce étant dioique, des récoltes d’un individu mâle (photo 72) et d’un femelle (photo 73) ont été réalisées. Un Meiogyne punctulata s.l., qui rentre dans ce que nous pensons être un complexe d’espèces devant être révisé, a été récolté en fleurs (photo 74).
5.10. Rembai, 9 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez)
Objectif principal
Ce site est connu comme présentant le Cryptocarya aff. velutinosa en cours d’étude, que nous avons du mal à distinguer végétativement de C. macrocarpa, et l’Endiandra trichogyna, récemment décrit.
Résultats principaux ; tableau 10
Rutaceae : Zanthoxylum sarasinii a été collecté en bouton (photos 75 et 76), ce qui nous aidera à mieux comprendre cette espèce polymorphe. Le Melicope à feuilles composées pennées a été vu (photo 77), c’est une nouvelle localité pour ce taxon en cours d’étude. Zanthoxylum canalense a été récolté en fruits.
Sapindaceae : Elattostachys incisa a été récolté en fruits, c’est une nouvelle localité pour cette espèce peu commune (photo 78 ; carte 5). Cette espèce se distingue bien par son feuillage denté (photos 78 et 79), mais également par son fruit tomenteux extérieurement et dont les loges sont presque glabres (photo 78) en comparaison avec E. apetala dont les loges sont très velues (photo 80 ; Adema, 1993). Podonephelium subaequilaterum (photo 81), peu commun lui aussi, a également été récolté pour la première fois sur ce site (carte 6).
5.11. Kouaoua, massif du Menazi, 10 octobre (participants : J. Munzinger, S. Gonzalez)
Objectif principal
Un Beilschmiedia, dont la pubescence est remarquable, n’est connu que de quelques récoltes de la localité Areha. Nous avions visité le site en 2019 et repéré des individus d’intérêt, mais nous n’avions pas trouvé de fruits, qui restent inconnus et qui pourraient aider pour définir le statut de ce taxon.
Résultats principaux ; tableau 11
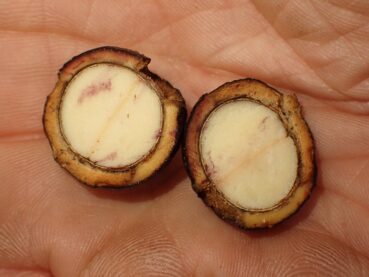
Le Beilschmiedia sp. « Areha » est toujours bien présent, tous les individus portent bien cette pubescence laineuse (photo 82), quoique rapidement caduque sur la face abaxiale des feuilles (photo 83). La plante était en fruit, dont certains étaient noirs (donc mûrs), la graine est beige en coupe (photo 84).
5.12. Parc des Grandes Fougères, 11 octobre (participants : J. Munzinger, S. Gonzalez)
Objectif principal
Un Cryptocarya très proche de C. velutinosa et C. macrocarpa, mais à fruit restant pubescent, existe dans ce secteur. Mais, si les spécimens en fruits se distinguent très bien, les individus stériles ou en fleurs semblent très difficiles à différencier. Afin d’être certain de bien comparer les fleurs des deux espèces, il faudrait être sûr d’avoir des fleurs de l’espèce à fruit velu. Nous avons donc pour objectifs de marquer des arbres afin de les suivre et de collecter les fleurs et les fruits du même individu.
Résultats principaux ; tableau 12
Rutaceae : deux espèces de Zanthoxylum étaient en fleurs sur le site, Z. sarasinii et Z. canalense, permettant leur comparaison sur le frais. Les fleurs et boutons se distinguent par leur taille et le nombre de carpelles, mais également par les glandes sur les sépales, très développées chez Z. sarasinii par rapport à Z. canalense (photo 85).
Lauraceae : trois individus de Cryptocarya aff. velutinosa ont été marqués et géoréférencés pour pouvoir être suivis. Les arbres étaient en pleine floraison (photos 86 et 87) et des fleurs ont été prélevées en alcool. Quatre espèces de Cryptocarya, C. pluricostata, C. barrabeae, C. macrodesme, C. aff. velutinosa, ont été vues et leurs feuilles sont illustrées (planche 1).
5.13. Parc de la Rivière bleue, 12 octobre (participants : J. Munzinger, S. Gonzalez, A. Lespes)
Objectif principal
Collecter des fleurs d’une Burseraceae inconnue (voir Munzinger & Bruy, 2023).
Résultats principaux ; tableau 13
La Burseraceae ne présentait que de très jeunes boutons (photo 88), mais cela indique qu’elle devrait fleurir bientôt.
Lauraceae : un Beilschmiedia oreophila sensu Kostermans a été récolté en boutons (photo 89) et le Cryptocarya sp. (McPherson 4408) non décrit (photo 90) a été rencontré plusieurs fois.
5.14. Forêt Nord, 13 octobre (participants : J. Munzinger, D. Bruy, A. Mathieu)
Objectif principal
Plusieurs récoltes du sud de la Grande-Terre du genre Zanthoxylum s’apparentent à Z. canalense, mais semblent s’en distinguer, notamment par le fruit de forme obovoïde et non globuleux. Plusieurs de ces récoltes venant de la Forêt Nord, l’objectif était de retrouver ce taxon.
Résultats principaux ; tableau 14
Rutaceae : le Zanthoxylum aff. canalense recherché n’a pas été retrouvé. Par contre un autre taxon du genre Zanthoxylum a été trouvé en boutons pourpres (photo 91), correspondant à ce que Hartley a annoté dans l’herbier de Paris comme Zanthoxylum oreophilum var. paucijugum ined. (cf. P05299656), en cours d’étude. Comptonella sessilifoliola a été récolté en fleurs (photo 92) et Melicope lasioneura en fruits.
Malvaceae : une étude moléculaire en cours montre une grande proximité génétique entre Acropogon francii, A. chalopiniae et A. bosseri. La première de ces espèces a été observée (photo 93) et collectée dans cette localité, ce qui nous aidera à mieux comprendre la différence entre les espèces.
Lauraceae : le Cryptocarya sp. (« Koghi », McPherson 4408) non décrit (photo 94) a été rencontré plusieurs fois, ainsi que Cryptocarya cf. obcordicarpa (photo 95) ; tous deux stériles, ils n’ont pas fait l’objet d’une récolte.
Sapotaceae : Pycnandra caeruleilatex, l’une des trois espèces hyper-accumulatrices de nickel et donc à sève bleue, a été rencontrée (photo 96).
Sapindaceae : van Welzen (1989) a considéré Guioa villosa dans un concept très large, incluant en synonymie des taxons d’autres auteurs comme Guioa villosa f. subsericea. Nous avons rencontré du matériel très similaire à cette variété qui semble se distinguer du matériel de la variété type. Comme précisé plus haut, le genre mérite une révision en Nouvelle-Calédonie.
5.15. Monts Dzumacs, 14 octobre (participants : J. Munzinger, D. Bruy, S. Gonzalez, Ch. Laudereau, L. Laudereau, H. Cazé, J. Bourget)
Objectif principal
Le type de Zanthoxylum leratii, que nous n’avons curieusement pas retrouvé à l’Herbier P, a pour localité les Dzumacs. L’objectif des prospections était d’investiguer la diversité des Zanthoxylum présents dans cette localité bien connue.
Résultats principaux ; tableau 15
Rutaceae : Le Zanthoxylum oreophilum var. paucijugum ined. de T.G. Hartley a été collecté en bouton. Zanthoxylum sarasinii a été collecté en fruit (photo 97). Trois Comptonella ont été récoltés fertiles, C. sessilifoliola (photo 98), C. lactea (photo 99) et C. baudouinii.
Lauraceae : Cryptocarya transversa a été récolté en pleine floraison (photo 100), ainsi que Beilschmiedia neocaledonica (photo 101).
Sapindaceae : la troisième espèce d’Elattostachys présente en Nouvelle-Calédonie, E. dzumacensis, a été rencontrée, permettant une comparaison des loges du fruit, qui sont subglabres (photo 102), comme ceux d’E. subincisa (photo 78, p. 21) et au contraire d’E. apetala (photo 80, p. 22).
Balanopaceae : un Balanops en arbre avec son écorce typique avec des lenticelles (photo 103) a été récolté, celui-ci était stérile, mais l’espèce la plus probable semble être B. microstachya, qui n’est connu que du type récolé en 1869 près de Canala, avec des doutes sur du matériel stérile récolté il y a peu de la Ouinné.
Nous avons récolté Garcinia amplexicaulis, avec sa forme à fleurs rouges (photo 104), contrastant avec celles des populations du nord à fleurs très beiges.
Les conditions météorologiques ont limité la prise de photos sur le terrain (photo 105).
5.16. Rivière la Salée, 16 octobre (participants : J. Munzinger, H. Vandrot, U. Vandrot)
Objectif principal
H. Vandrot nous avait signalé l’Endiandra à grandes feuilles qu’il avait trouvé avec D. Fleurot à la base du Taom et s’est proposé de nous accompagner pour retrouver la population. Ce serait une nouvelle station d’intérêt pour cette espèce nouvelle à décrire, qui se distingue également par les données moléculaires (Munzinger & Gemmill, in press).
Résultats principaux ; tableau 16
Lauraceae : l’Endiandra a été trouvé en pleine floraison (photo 106), ce qui va permettre d’avancer sur sa description.
Rutaceae : Medicosma emarginata a été récolté en fleurs (photo 107).
Myrtaceae : Syzygium pennelii, appartenant aux quelques espèces du genre à sépales soudés en un opercule pointu circumscissile (photo 108), a été récolté en fleur.
Celastraceae : un Elaeodendron à très longs pétioles a été récolté en fleurs. Müller (1996) indiquait que la seule espèce dont le pétiole pouvait atteindre 3,5 cm de longueur était E. cunninghamii. Notre échantillon ayant des pétioles de 3,8 à 4,5 cm, il semblait susceptible d’être en dehors de cette espèce. Cependant, la récolte Tirel 1294 (P00497059), identifiée par Müller comme appartenant bien à ce taxon, a des pétioles atteignant 3,9 cm. Notre récolte rentre donc bien dans cette espèce et complète les dimensions possibles pour cette dernière.
Sapotaceae : Pycnandra longipetiolata, à face abaxiale des feuilles rousse (photo 109) et à très longs pétioles (photo 110), a été récolté en jeunes fruits, cette espèce a été décrite à partir de matériel de deux localités seulement, base nord du plateau de Tiéa et Oua Péoué (Swenson & Munzinger, 2009). C’est donc une troisième localité pour cette espèce, qui reste cantonnée aux basses altitudes du massif du Boulinda-Kopéto-Paéoua et du plateau de Tiéa (carte 7).
5.17. Base du mont Mou, 17 octobre (participant : J. Munzinger)
Objectif principal
Afin de mieux comprendre le complexe des « bois moustiquaires », c’est-à-dire Cryptocarya macrocarpa/velutinosa/aff. velutinosa, nous aurions besoin de fleurs bien préservées de ces trois espèces (et le lien avec des fruits).
Résultats principaux ; tableau 17
Cryptocarya macrocarpa était en très jeunes boutons (photos 111 à 113), un prélèvement a été réalisé mais il faudrait avoir des fleurs plus avancées.
5.18. Païta, 18 octobre (participants : J. Munzinger, Ch. Laudereau)
Objectif principal
Dans le cadre du projet DiosAdapt, nous avons des Diospyros en culture dans la pépinière de
Jean-Jacques Villegente. Nous avions besoin de faire des prélèvements pour analyses.
Résultats principaux ; tableau 18
Les prélèvements des plants en culture (photo 114) ont pu être réalisés avec l’aide de Ch. Laudereau. La forme des cotylédons, inconnue jusqu’alors, pourrait être d’intérêt pour la taxonomie (photos 115 et 117).
Sur le site est présent un Alectryon carinatus (photo 116) ; originaire de l’île Lepredour, celui-ci a été prélevé pour l’intégrer dans la phylogénie en cours.
Bibliographie
Adema F., 1993. Elattostachys (Blume) Radlk. (Sapindaceae) in New Caledonia. Bulletin du Muséum national d’histoire naturelle, 4e série, section B, Adansonia 15 : 141-151, https://biostor.org/reference/247800.
Appelhans M.S., Wen J. & Wagner W.L., 2014. A molecular phylogeny of Acronychia, Euodia, Melicope and relatives (Rutaceae) reveals polyphyletic genera and key innovations for species richness. Molecular Phylogenetics and Evolution 79 : 54-68, https://doi.org/10.1016/j.ympev.2014.06.014.
Aubréville A., Leroy J.-F., MacKee H.S. & Morat Ph. (eds) 1967-2024. Flore de la Nouvelle-Calédonie et dépendances. Muséum national d’histoire naturelle, Paris.
Bruy D., Barrabé L., Birnbaum P., Dagostini G., Donnat M., Fambart-Tinel J., Girardi J., Hequet V., Isnard S., Jaffré Th., Munzinger J., Nigote W., Pillon Y., Rigault F., Vandrot H., Veillon J.-M. & Zaiss R., 2021. L’Herbier de Nouvelle-Calédonie. UMR AMAP, IRD, CIRAD, CNRS, INRAE, Univ. Montpellier, Nouméa, https://doi.org/10.23708/HERBIER-NOUVELLE-CALEDONIE.
Bruy D., Lannuzel G., Gâteblé G. & Munzinger J., 2023. Three new species threatened by mining activity in New Caledonia. Phytotaxa 578 : 228-240, https://doi.org/10.11646/phytotaxa.578.3.2.
Carlquist S., 1980. Anatomy and systematics of Balanopaceae. Allertonia 2 : 191-246, http://www.jstor.org/stable/
23186109.
Gâteblé G., Barrabé L., McPherson G., Munzinger J., Snow N. & Swenson U., 2018. One new endemic plant species on average per month in New Caledonia, including eight more new species from Ile Art (Belep Islands), a major micro-hotspot in need of protection. Australian Systematic Botany 31 : 448-480, https://doi.org/10.1071/SB18016.
Gaudeul M., Sweeney P. & Munzinger J., 2024. An updated infrageneric classification of the pantropical species-rich genus Garcinia L. (Clusiaceae) and some insights into the systematics of New Caledonian species, based on molecular and morphological evidence. Phytokeys 239 : 73-105, https://doi.org/10.3897/phytokeys.239.112563.
Heine H., 1976. Solanacées. In A. Aubréville & J.-F. Leroy (eds.), Flore de la Nouvelle-Calédonie et dépendances, Muséum national d’histoire naturelle, Paris, 7 : 119-205.
Kostermans A., 1974. Lauracées. In A. Aubréville & J.-F. Leroy (eds.), Flore de la Nouvelle-Calédonie et dépendances, Muséum national d’histoire naturelle, Paris, 5 : 120 p.
Le Bras G., Pignal M., Jeanson M., Muller S., Aupic C., Carré B., Flament G., Gaudeul M., Gonçalves C., Invernón V., Jabbour F., Lerat E., Lowry II P., Offroy B., Pimparé E., Poncy O., Rouhan G. & Haevermans T., 2017. The French Muséum national d’histoire naturelle vascular plant herbarium collection dataset. Scientific Data 4 : 170016, https://doi.org/10.1038/sdata.2017.16.
McClelland D.H.R., Nee M. & Knapp S., 2020. New names and status for Pacific spiny species of Solanum (Solanaceae, subgenus Leptostemonum Bitter; the Leptostemonum Clade). PhytoKeys 145 : 1-36, https://doi.org/10.3897/phytokeys.145.48531.
McPherson G. & Tirel C., 1987. Euphorbiacées, I. In Ph. Morat & H.S. MacKee (eds.), Flore de la Nouvelle-Calédonie et dépendances, Muséum national d’histoire naturelle, Paris, 14 : 226 p.
Morat Ph. & van der Meijden R., 1991. Balgoya (Polygalaceae trib. Moutabeeae), a new genus from New Caledonia. Bulletin du Muséum national d’histoire naturelle, Section B, Adansonia: Botanique Phytochimie, sér. 4, 13 : 25-46, https://www.biodiversitylibrary.org/item/49409.
Mouly A. & Jeanson M., 2015. Specialization to ultramafic substrates and narrow endemism of Cyclophyllum (Rubiaceae) in New Caledonia: contribution of novel species to the understanding of these singular patterns. Acta Botanica Gallica: Botany Letters 162 : 173-189, http://www.tandfonline.com/loi/tabg20.
Müller I.H., 1996. Celastraceae. In Ph. Morat (ed.), Flore de la Nouvelle-Calédonie et Dépendances, Muséum national d’histoire naturelle, Paris, 20 : 3-74.
Munzinger J. & McPherson G., 2016. Novitates neocaledonicae IV: three new species of Cryptocarya R. Br. (Lauraceae). Adansonia, série 3, 38 : 165-174, http://dx.doi.org/10.5252/a2016n2a3.
Munzinger J. & McPherson G., 2017. Typification of the name Litsea mackeei (née Lauraceae) and its reassignment to the synonymy of Osmanthus austrocaledonicus var. austrocaledonicus (Oleaceae). Phytotaxa 331 : 137-143, https://doi.org/10.11646/phytotaxa.331.1.13.
Munzinger J., Bruy D. & Pignal M., 2021. Novitates neocaledonicae XI: a new endemic species of Garcinia L. (Clusiaceae), with an emended description of G. virgata Vieill. ex Guillaumin. Adansonia, série 3, 43 : 49-60, https://doi.org/10.5252/adansonia2021v43a6.
Munzinger J. & McPherson G., 2021. Novitates neocaledonicae XII: two additional new species of Cryptocarya from New Caledonia. Adansonia, série 3, 43 : 151-161, http://adansonia.com/43/13.
Munzinger J., McPherson G., Meyer S. & Gemmill C.E., 2022. Phylogenetic study of the New Caledonian endemic genus Adenodaphne (Lauraceae) confirms its synonymy with Litsea. Botany Letters 170 : 479-487, https://doi.org/10.1080/23818107.2022.2088613.
Munzinger J. & Bruy D., 2023. Compte rendu de mission en Nouvelle-Calédonie, 7-30 avril 2022. Carnets botaniques 150 : 1-25, https://doi.org/10.34971/DXQ7-EE25.
Munzinger J., Morat Ph., Jaffré Th., Gâteblé G., Pillon Y., Rouhan G., Bruy D., Tronchet F., Veillon J.-M. & Chalopin M., 2023 [continiously updated]. FLORICAL: checklist of the vascular indigenous Flora of New Caledonia, http://publish.plantnet-project.org/project/florical.
Munzinger J., McPherson G. & Bruy D., 2024. Novitates neocaledonicae XV: two new species of Endiandra from New Caledonia. Adansonia, série 3, 46 : 19-28, http://adansonia.com/46/3.
Munzinger J. & Gemmill C.E., in press. Molecular insights into species and generic delimitations of Cryptocarya, Endiandra, and Beilschmiedia (Lauraceae) in New Caledonia and neighbouring islands. Phytotaxa.
Stuppy W., van Welzen P.C., Klinratana P. & Posa M.C.T., 1999. Revision of the genera Aleurites, Reutealis and Vernicia (Euphorbiaceae). Blumea 44 : 73-98, https://repository.naturalis.nl/pub/524645.
Swenson U. & Munzinger J., 2009. Revision of Pycnandra subgenus Pycnandra (Sapotaceae), a genus endemic to New Caledonia. Australian Systematic Botany 22 : 437-465, http://dx.doi.org/10.1071/SB09029.
Swenson U. & Munzinger J., 2016. Five new species and a systematic synopsis of Pycnandra (Sapotaceae), the largest endemic genus in New Caledonia. Australian Systematic Botany 29 : 1-40, http://dx.doi.org/10.1071/SB16001.
Thiers B., 2024 [continuously updated]. Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium, http://sweetgum.nybg.org/ih/.
Tirel C., 1982. Eléocarpacées. In A. Aubréville & J.-F. Leroy (eds.), Flore de la Nouvelle-Calédonie et dépendances, Muséum national d’histoire naturelle, Paris, 11 : 126 p.
van Welzen P.C., 1989. Guioa Cav. (Sapindaceae): taxonomy, phylogeny and historical biogeography. Leiden Botanical Series 12, 315 p., https://repository.naturalis.nl/pub/508231.
Vink W., 1957. Revision of the Sapotaceae of the Malaysian area in a wider sense, X – Leptostylis, XII – Pycnandra. Nova Guinea, n. s., 8 : 87-124.
Wheeler L.C., 1939. Notes on the genus Aleurites. Botanical Museum Leaflets, Harvard University 7 : 119-122, https://www.jstor.org/stable/41762728.
Remerciements
Nous remercions chaleureusement Sophie Gonzalez et Christian Laudereau, qui nous ont accompagnés sur une bonne partie de la mission et nous ont permis d’utiliser leurs photos. Nous remercions Christophe Schall et son équipe pour l’aide à l’accès du Parc des Grandes Fougères. L’accès au captage de la rivière Nekliaï a été rendu possible grâce à la mise en relation par Hervé Vandrot avec le clan Nekliaï qui ont autorisé la prospection et nous ont accompagnés sur le terrain (Arnold Nekliaï). Nous remercions l’Association pour la sauvegarde de la nature néo-calédonienne pour l’organisation de la sortie à la Popidéry. Nous remercions chaleureusement la Province Sud, et notamment Tyffen Read, Alice Mathieu et Julika Bourget, pour l’accompagnement des gardes natures à forêt Nord et aux Dzumacs. Merci à Mr. Bolliet pour l’accès au Boulinda via forêt Français. Un grand merci à Dominique Fleurot et à la tribu de Bopope pour nous avoir permis l’accès au massif du Tchingou. L’accès au parc de la Rivière Bleue a été facilité grâce à l’aide de Jean-Marc Meriot et nous avons été accompagnés par Arnaud Lespès que nous remercions chaleureusement. Nos profonds remerciements vont à Jean-Jacques Villegente, qui nous a permis de récolter chez lui et prend soin de nos Diospyros qu’il cultive. Nous remercions Martin Callmander, Mathieu Donnat, Nathan Eltabet, Arnaud Mouly et Yohan Pillon pour des identifications ou confirmations dans leurs groupes d’intérêt respectifs. Les personnels des herbiers NOU et MPU sont grandement remerciés pour leur soutien dans le traitement du matériel. Nous remercions les Provinces Nord et Sud pour les autorisations de récolte.