Botrychium simplex E. Hitchc., une nouvelle fougère pour les Alpes-Maritimes
Title
Botrychium simplex E. Hitchc., a new fern for Alpes-Maritimes
Résumé
Botrychium simplex E. Hitchc. est nouvellement signalé dans le département des Alpes-Maritimes, à la suite d’inventaires floristiques et de cartographies de la végétation de zones humides dans le Parc national du Mercantour. La description de l’espèce, sa répartition et son écologie sont présentées. Son habitat dans les Alpes-Maritimes, étayé par des relevés phytosociologiques, est analysé et comparé avec les autres localités méridionales connues de Corse et des Pyrénées. Sa conservation à l’échelle des Alpes est abordée.
Abstract
Botrychium simplex E. Hitchc. is reported as new in the Alpes-Maritimes (French department). This discovery came from a study for the Mercantour National Park aiming for the conservation of wetlands, using floristic inventories and vegetation mapping. A description of the species, its distribution and its ecology are examined. Its habitat in the Alpes-Martimes is analysed, using phytosociological relevés, and compared with other southern locality records from Corsica and the Pyrenees. Issues relating to conservation in the Alps are discussed.
1. Introduction
Botrychium simplex est une fougère rare, protégée au niveau national et européen (directive Habitats-Faune-Flore, annexe II). Dans le cadre d’une étude financée par le Parc national du Mercantour et l’Agence de l’eau Rhône-Méditerranée-Corse, visant à mettre en place un plan de restauration et de suivi des zones humides d’altitude sur le territoire du Parc, des inventaires floristiques et des cartographies de la végétation ont été menés durant les étés 2018, 2019 et 2020. Lors de ces investigations, cinq localités de Botrychium simplex, espèce non encore signalée dans les Alpes-Maritimes, ont été découvertes fortuitement dans les hautes vallées du Var, de la Tinée, de la Vésubie et de la Roya.
2. Description
Cette fougère (photos 1 à 3) est haute de un à dix centimètres (Prelli, 2001), vert jaunâtre, munie d’une fronde feuillée stérile (trophophore) et d’une fronde fertile portant l’épi sporangifère (sporophore). La fronde stérile présente un limbe variable, entier à pennatipartite, normalement divisé une fois en lobes arrondis, disposés en pennes peu nombreuses. La fronde fertile a un épi simple ou à rameaux courts, dépassant longuement la fronde stérile. À l’optimum phénologique (début août dans les Alpes-Maritimes), juste avant la sporulation, l’espèce se repère assez aisément par sa couleur jaune pâle et mate qui tranche avec le vert du tapis herbacé. Botrychium simplex est un géophyte à rhizome et le nombre de sporophytes observés, quand ceux-ci sont rapprochés, n’égale pas forcément le nombre d’individus, car plusieurs sporophytes peuvent émerger d’un même rhizome souterrain commun. Une particularité de cette espèce, en commun avec les autres membres du genre, est sa relation symbiotique entretenue avec un champignon mycrorhizien arbusculaire (Anderson, 2006). En effet, le prothalle souterrain des botryches, non chlorophyllien, reçoit des nutriments de la part d’un champignon, vraisemblablement pendant plusieurs années avant le développement des sporophytes. Toutefois, le rôle et l’importance de cette symbiose vis-à-vis de l’installation et du maintien de l’espèce dans ses stations sont encore largement méconnus.
On peut facilement confondre cette espèce avec le commun Botrychium lunaria. Un critère discriminant qui est donné dans les flores françaises (Prelli, 2001 ; Tison & de Foucault, 2014) est la séparation bien visible dès le niveau du sol de la partie fertile et de la partie stérile chez B. simplex, tandis que chez B. lunaria, les frondes stérile et fertile sont soudées en un pétiole commun qui s’élève au-dessus du sol. Cependant, si ce critère a bien été observé dans la majorité des stations des Alpes-Maritimes, nous avons remarqué dans deux localités des populations de B. simplex où les individus, qui croissent sur des tapis de sphaignes, sont tous pourvus d’un long pied commun. Cette morphologie est décrite sous le nom de Botrychium simplex var. tenebrosum (A.A. Eaton) R.T. Clausen (photo 4), signalée notamment dans l’est des États-Unis (Anderson, 2006). B. lunaria est quant à elle une espèce de plus grande taille (10-15 cm), d’un vert foncé brillant, dont les lobes ont une forme caractéristique évoquant un rein.
3. Répartition mondiale et européenne
Botrychium simplex est une espèce circumboréale connue d’Europe (Corse comprise), Islande, Groenland, Amérique du Nord (États-Unis et Canada), (Anderson, 2006). En Asie, elle n’est pas confirmée au Japon, mais a été signalée récemment dans les montagnes himalayennes en Chine (Tibet) et en Inde (Kholia, 2012). En Europe, elle présente une aire principale nordique : Danemark, Norvège, Suède, Finlande, Pays Baltes, Biélorussie, Russie, Ukraine (Parnikoza & Celka, 2016), avec des avant-postes en Belgique, France et Allemagne (Bennert, Sonneborn, Sonneborn et Horn, 2003), et une aire montagnarde où elle fait figure de relique glaciaire dans les Alpes, les Pyrénées, la Corse et les Balkans, en France, Suisse, Italie, Autriche, Slovénie, Bosnie-Herzégovine (Käsermann & Moser, 1999 ; de Litardière, 1927). Elle est en outre présumée éteinte en Belgique, Slovénie, République tchèque, Pologne et Estonie (Pawlaczyk et al., 2004 ; Parnikoza & Celka, 2016 ; Christenhusz et al., 2017).
4. Répartition nationale
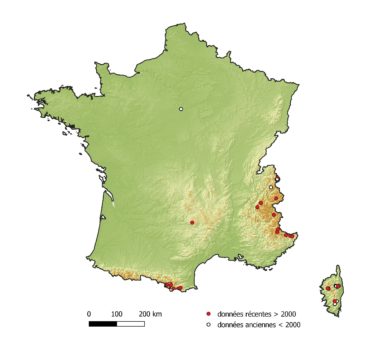
Botrychium simplex a été observé pour la première fois en France en 1845 à Malesherbes dans le Loiret (Franchet, 1897a, 1897b). La population, aussitôt découverte, fut entièrement décimée et intégralement mise en herbier le même jour par différents botanistes collectionneurs (Bouby, 1963). L’espèce aurait ensuite été découverte en 1848 en Haute-Savoie des environs de Chamonix (de Vergnes, 1911), localité considérée avec doute par Bouby (1963) en raison de l’absence de part d’herbier typique. Sa présence est toutefois avérée à Chamonix par des parts d’herbier postérieures (récoltes en 1901, 1920, 1921). Au vingtième siècle, elle fut découverte en 1927 en Haute-Corse dans le massif du San Pedrone (de Litardière, 1927) et en 1929 en Corse-du-Sud dans le massif de l’Incudine (de Litardière, 1930). Plus tard, Bouby (1963) découvre l’espèce en 1962 à Mont-Louis dans les Pyrénées-Orientales. Ces dernières décennies, plusieurs localités nouvelles ont été découvertes en France. Actuellement, l’espèce est confirmée par des données récentes dans les départements suivants (figure 1) : Alpes-Maritimes (nouvelles localités), Aveyron, Corse-du-Sud, Hautes-Alpes, Haute-Corse, Isère, Haute-Savoie, Savoie, Pyrénées-Orientales (Bonnet, 2017 ; Delage & Hugot, 2020 ; Delay, 2012 ; Dentant et al., 2012).
5. Statut
Botrychium simplex bénéficie de plusieurs statuts de protection en France :
– annexe I de la Convention de Berne (Convention relative à la conservation de la vie sauvage et du milieu naturel de l’Europe, 19/09/1979, Berne) ;
– annexes II et IV de la directive 92/43/CEE du 21 mai 1992, dite directive Habitats-Faune-Flore ;
– protection nationale (arrêté du 20 janvier 1982, modifié par l’arrêté du 31 août 1995, article 1).
C’est une espèce en régression sur le territoire européen. Elle est classée en danger (EN) dans la Liste rouge européenne des fougères et lycopodes de l’Union internationale pour la conservation de la nature (García Criado et al., 2017), qui estime que sa population a décliné d’au moins 50% au cours des trois dernières générations (60-90 ans ; (Christenhusz et al., 2017). De plus l’espèce est sujette à des fluctuations extrêmes de ses populations. Elle est menacée dans tous les pays d’Europe : catégorie en danger (EN) en Autriche, Biélorussie, Finlande, Lettonie, Lituanie, Norvège, Suède, en danger critique (CR) en Allemagne, Danemark, Italie, Suisse, Russie, présumée éteinte (RE) en Belgique, Slovénie, République tchèque, Pologne et Estonie. Elle est quasi menacée (NT) en Islande. En France, elle a le statut de vulnérable (VU) d’après la Liste rouge nationale (Union internationale pour la conservation de la nature [UICN] France, Fédération des conservatoires botaniques nationaux [FCBN], Agence française pour la biodiversité [AFB], Muséum national d’histoire naturelle [MNHN], 2018), avec un effectif évalué à moins de deux cents individus. En région Provence-Alpes-Côte d’Azur (PACA), elle est classée en danger critique (CR) d’après la Liste rouge régionale de PACA (Noble et al., 2015).
6. Écologie
Botrychium simplex se rencontre depuis le niveau de la mer dans le nord de l’Europe, jusqu’à 2 500 m dans les Alpes (Dentant et al., 2012). C’est une espèce héliophile, mésophile à mésohygrophile, acidicline à acidiphile. Compte tenu de sa répartition, elle vit dans une grande gamme de milieux différents, ayant cependant en commun les traits suivants : formations herbacées courtes ou rases maintenues par des processus naturels, comme la dynamique torrentielle, ou artificiels (pâturage), sol pauvre en nutriments, sableux ou tourbeux, humide au moins une partie de l’année. Elle s’observe par exemple en Scandinavie sur des pelouses oligotrophiles développées sur dalles rocheuses humides en bord de mer (Engan, 2001), ainsi que sur sol humide sablonneux dans des pelouses ouvertes, pâturages, et landes (Milde, 1869). Dans le nord de l’Allemagne, B. simplex se rencontre dans le Juncetum squarrosi Nordh. 1921, pelouse boréo-atlantique mésohygrophile sur substrat tourbeux (Bennert et al., 2003). Dans les Alpes autrichiennes (Horn & Korneck, 2003), l’espèce se développe au sein de bas-marais de pentes sur vires rocheuses suintantes, sur gneiss (Caricetum frigidae Rübel 1911), ou au sein d’une nardaie mésophile du Geo montani-Nardetum strictae Lüdi 1948 nom. mut. Dans les Alpes françaises (Haute-Savoie, Savoie, Isère, Hautes-Alpes), B. simplex vit dans des pelouses alpines hygrophiles à Nardus stricta et Carex nigra, dans des zones humides de pente, en bordure de cours d’eau ou de lac (Bonnet, 2017).
6.1. Les pozzines, milieu préférentiel de simplex en contexte méridional ?
En France, les localités les plus méridionales (Corse, Pyrénées-Orientales et Alpes-Maritimes) s’observent depuis l’étage montagnard jusqu’à la base de l’étage alpin, entre 1 100 et 2 430 m, et sont liées à des systèmes marécageux appelés pozzines. Le terme pozzine a été introduit par Briquet (1910) pour décrire un paysage végétal typique de la montagne corse, correspondant à un bas-marais tourbeux acide, à la végétation peu élevée ou rase (« tourbière de pelouse » ; Chouard, 1935), développé sur des substrats issus du comblement de lacs d’origine glaciaire, souvent interrompu par des trous d’eau profonds (pozzi signifiant puits en Corse) pouvant s’assécher en été et parcouru par un réseau de ruisselets. Par extension, des « pozzines de pente » ont été définies. Elles sont floristiquement semblables mais ont pour origine une sédimentation torrentielle (Malcuit, 1951). Elles se localisent en bordure de ruisseaux, occupent de plus petites surfaces et sont plus sèches du fait de leur position topographique. La dynamique torrentielle contribue à les rajeunir. Décrites initialement en Corse (de Litardière & Malcuit, 1926 ; Gamisans, 1977), des pozzines ont ensuite été observées dans les Pyrénées centrales (Chouard, 1935) et dans les Alpes-Maritimes en Haute-Tinée (Guinochet, 1936), sur substrats calcaire et siliceux. Elles ont par la suite été reconnues également dans la Sierra Nevada espagnole (Soutadé & Baudière, 1970), le Haut Atlas marocain (Alaoui et al., 2009) et en Iran (Klein & Lacoste, 1995).
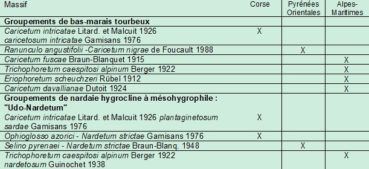
Chouard (1935) et Guinochet (1936) ont été frappés par la ressemblance entre les pozzines corses, pyrénéennes et alpines, sur les plans physionomique, dynamique et, dans une moindre mesure, floristique. Sur le plan de la végétation, ces pozzines (surtout les pozzines de fond) sont caractérisées par la cohabitation de deux ensembles végétaux, à déterminisme hydrique : un bas-marais à Cyperaceae et Juncaceae (souvent une cariçaie), qui occupe les niveaux les plus humides, et une pelouse mésohygrophile à Nardus stricta (appelée Udo-Nardetum par certains auteurs, du latin udus: humide, mouillé), de niveau topographique supérieur. Ces formations se retrouvent dans ces trois massifs montagneux, mais avec des associations différentes (tableau 1). Botrychium simplex semble particulièrement inféodé à la nardaie humide. En Corse, celle-ci se décline en deux associations : le Caricetum intricatae Litard. & Malcuit 1926 caricetosum intricatae Gamisans 1977 à l’étage subalpin et l’Ophioglosso azorici–Nardetum strictae Gamisans 1975 (Gamisans, 1976, 1977) à l’étage montagnard, dont Botrychium simplex est une des caractéristiques. Dans les Pyrénées, c’est le Selino pyrenaei-Nardetum strictae Braun-Blanq. 1948 (Chevallier, 2009) et dans les Alpes-Maritimes le Trichophoretum caespitosi alpinum Berger 1922 nardetosum strictae Guin. 1938 (Guinochet, 1938).
6.2. Contexte stationnel des nouvelles localités des Alpes-Maritimes
Botrychium simplex a été découvert dans cinq nouvelles localités du département des Alpes-Maritimes, toutes situées dans le Parc national du Mercantour.
– Entraunes, l’Estrop, alt. 2 370 m. 7 août 2019, observateurs Benoît Offerhaus et Pauline Bravet
L’Estrop est un large vallon creusé par l’érosion des glaciers quaternaires, présentant des cuvettes d’excavation occupées par des lacs et plusieurs grandes cuvettes tourbeuses (Julian, 1966), abritant un complexe de zones humides jalonnées de ruisseaux et parsemées de trous d’eau, représentant des pozzines typiques (photo 5). Une population de B. simplex se trouve en bordure d’une petite pièce d’eau totalement asséchée, à une altitude de 2 370 m, dans une pelouse rase mésophile pâturée, sur replat, dominée par Nardus stricta et Plantago alpina (photo 6 ; tableau 2, relevé 5), sur substrat calcaire. On note ici l’absence d’espèces électives des bas-marais et la présence de Salix herbacea, espèce caractéristique des combes à neige, indiquant une durée d’enneigement du milieu importante. B. simplex croît en trois groupes de plusieurs dizaines d’individus chacun. Au total, 98 sporophytes ont été dénombrés, ce qui constitue une population importante, au regard des autres stations alpines de l’espèce (Bonnet, 2017). Si les plus grands pieds atteignent cinq centimètres de hauteur (photo 1), la plupart sont très petits, d’environ 1-2 cm.
– Saint-Martin-Vésubie, Plan de Prals, alt. 2 100 m. 1er août 2018, observateurs Benoît Offerhaus et Antoine Carrouée
Le vallon de Prals dans la vallée de la Vésubie, également modelé par l’action glaciaire, présente dans sa partie haute, vers 2 250 m. une succession de cinq petits lacs occupant de petits cirques emboîtés. En aval du verrou glaciaire, sur des dépôts morainiques gneissiques, s’écoulent les ruisseaux se déversant des lacs dans une combe orientée vers l’ouest (photo 7). Sur ce Plan de Prals, pâturé assez intensivement par un troupeau bovin, les bas-marais (Trichophoretum caespitosi alpinum) sont peu développés, les zones humides se localisant le long des ruisseaux et s’apparentant à des pozzines de pente. B. simplex est présent en bas d’une pente, sur un replat, en bordure d’un ruisselet à écoulement lent dans une pelouse tourbeuse rase (photo 8 ; tableau 2, relevé 2), dominée par Carex nigra et Nardus stricta. On remarque un mélange d’espèces des pelouses acidiphiles alpines (Nardetea strictae et Caricetea curvulae) et de nombreuses espèces de bas-marais (Caricion nigrae). La strate muscinale est également recouvrante, avec des sphaignes. Ce milieu est proche du Trichophoretum caespitosi alpinum nardetosum strictae, bien que Trichophorum cespitosum soit absent dans le relevé. Des trichophoraies typiques se trouvent en revanche non loin de là. Dans cette station, seulement six pieds ont été détectés, tous de très petite taille (figure 2).
– Valdeblore, vallon des Millefonts, alt. 2 083 m. 28 juillet 2020, observateurs Benoît Offerhaus et Pauline Bravet
Le vallon des Millefonts est un vallon glaciaire prenant naissance à l’interface des terrains cristallins du massif du Mercantour-Argentera et de sa bordure sédimentaire permienne (photo 9), entre 1 800 et 2 400 m. Le fond du vallon est composé de dépôts morainiques. Un groupe de cinq lacs de surcreusement situé dans la partie amont alimente le réseau hydrique en aval. L’aspect totalement asylvatique du paysage est dû à une longue action anthropique, à la fois pastorale et sidérurgique, remontant à l’âge du fer (Suméra & Geist, 2010). De part et d’autre du torrent principal se développe un complexe de bas-marais acidiphiles à basiphiles se rattachant au Caricion nigrae et au Caricion davallianae. B. simplex a été observé en rive droite du vallon, dans un bas-marais à Carex nigra, Trichophorum caespitosum riche en Nardus stricta et sphaignes, sur une légère pente et au sommet d’une butte plane (photo 10 ; tableau 2, relevé 3). Un total de trente frondes individus a été dénombré dans cette station. Il est à noter que tous les spécimens observés présentent la morphologie de la variété tenebrosum, avec un long pied commun (photo 3).
– Saint-Dalmas-le-Selvage, crête de l’Alpe, alt. 2 430 m. 7 août 2020, observateurs Pauline Bravet et Benoît Offerhaus
Non loin du col de la Bonnette, la crête de l’Alpe est située sur la bordure sédimentaire calcaréo-gréseuse du massif du Mercantour, dans la haute vallée de la Tinée. Du col de Colombart à 2 539 m, sur calcaire, un vallon prend naissance suivant une orientation ouest-est. Le ruisseau principal est alimenté par plusieurs sources, en bordure duquel des zones humides sont établies dans les zones planes, avec des communautés du Cratoneurion commutati et du Caricion davallianae (photo 11). Trois pieds de B. simplex ont été observés en périphérie de bas-marais, dans une formation dominée par Nardus stricta, riche en cypéracées : Eleocharis quinqueflora, Carex nigra, Carex capillaris (tableau 2, relevé 1). C’est ici la localité la plus haute des Alpes-Maritimes.
– Tende, le lac Long inférieur, alt. 2 100 m. 13 août 2020, observateurs Pauline Bravet et Benoît Offerhaus
La partie amont du vallon de la Minière de Tende, au-dessus de 2 100 m, s’ouvre sur un réseau de lacs naturels d’origine glaciaire dont plusieurs ont été surélevés par des barrages au début du xxe siècle pour la production hydroélectrique. Ces lacs sont bordés par des zones humides abritant des bas-marais acidiphiles à Carex nigra et à Trichophorum caespitosum (Caricion nigrae). Des analyses palynologiques effectuées en bordure du lac Long supérieur par carottage permettent d’attester la mise en place de ces communautés riches en Cyperacées dès la fin du Dryas récent (Kharbouch & Gauthier, 2000). Le lac Long inférieur est alimenté en eau par la surverse du lac Long supérieur, ce dernier étant doté d’un barrage. C’est en bordure du lac Long Inférieur que le développement des bas-marais est le plus important, avec une belle communauté à Carex nigra riche en Sphagnum spp. (photo 12). Un seul individu de B. simplex présentant la morphologie de la var. tenebrosum a été observé au sein de ce bas-marais, dans une zone moyennement hygrophile riche en Nardus stricta (photo 4 ; tableau 2, relevé 4).
7. Conservation
À l’échelle des Alpes françaises, le massif du Mercantour apparaît comme une zone importante pour la conservation de Botrychium simplex. Avec cinq localités nouvellement découvertes dans les Alpes-Maritimes, c’est autant que toutes les autres localités actuellement confirmées dans le reste des Alpes françaises. L’effectif total est aussi plus important dans les Alpes-Maritimes avec 132 pieds dénombrés entre 2018 et 2020 contre 99 pieds comptés dans les Hautes-Alpes, l’Isère, la Savoie et la Haute-Savoie entre 2012 et 2017 (Bonnet, 2017).
Toutefois, l’on peut s’interroger sur la rareté apparente de l’espèce, que l’on peut attribuer en partie à sa réputée difficile détection sur le terrain et certainement à un défaut de prospection couplés à une méconnaissance de l’espèce. Les cinq localités où l’espèce a été découverte faisaient partie d’un ensemble de sites à prospecter imposé par le gestionnaire (Parc national du Mercantour), identifiés comme pouvant poser des problèmes de conservation du fait d’une gestion pastorale inadaptée, en particulier un pâturage et/ou un stationnement trop important des troupeaux.
Le point commun entre ces sites est la présence de zones humides planes assez larges composées de bas-marais à cypéracées aux étages subalpin et alpin (entre 2 083 et 2 430 m) pâturées plus ou moins intensivement dans un passé proche. Dans deux sites (Plan de Prals et Estrop), l’espèce a été découverte par hasard en progressant dans la zone humide. Les observations dans les trois autres sites ont été faites dans le cadre de la mise en œuvre d’un suivi de la végétation des zones humides. Pour ce faire, au sein de chacun de ces sites, un ou deux transects de plusieurs dizaines de mètres (entre 33 et 102 m) traversant les zones humides préalablement cartographiées ont été tracés au hasard sur un logiciel SIG (Qgis). Une fois les transects matérialisés sur le terrain, cinq à six placettes non jointives de 2 x 2 m² ont été positionnées in situ le long de chaque transect et, dans chaque placette, un inventaire floristique exhaustif quantifié a été réalisé, d’une durée moyenne de quinze minutes. Sur 49 placettes ainsi inventoriées dans des milieux potentiellement favorables à B. simplex, l’espèce a été contactée dans trois placettes.
Le Plan de Prals est pâturé par un troupeau de bovin et les quatre autres sites par des troupeaux ovins. Un piétinement trop important sur les stations de botryche et un enrichissement du sol en matière organique dû aux excréments risquent de modifier notablement la flore par une prolifération d’espèces nitrophiles, comme Veratrum album, Cirsium spinosissimum, et d’entraîner un déclin voire une disparition des populations. Nos observations montrent que ce phénomène affecte toutefois préférentiellement la végétation des microphorbiaies de bord de ruisseau (Montio–Cardaminetea), les bas-marais étant moins affectés. La situation actuelle semble être assez profitable à Botrychium simplex : le prélèvement herbacé est assez important pour maintenir une hauteur du tapis herbacé optimale, sans que le raclage soit trop destructeur. L’enjeu est donc de trouver le bon équilibre et de le maintenir.
8. Conclusion
Botrychium simplex est une fougère rare et menacée en Europe. En France, elle se localise essentiellement dans les massifs montagneux des Alpes, des Pyrénées et de la Corse. Les nouvelles stations découvertes dans les Alpes-Maritimes représentent les localités les plus méridionales des Alpes. L’analyse de ses préférences écologiques et de son habitat d’espèce dans les nouvelles stations, comparée à son écologie dans les autres massifs, fait ressortir sa fidélité à un type de paysage végétal de bas-marais acidiphile d’altitude à la végétation rase, typique de Corse, des Pyrénées et des Alpes : les pozzines. Dans ces milieux, Botrychium simplex semble se localiser sur les bordures de ces bas-marais, dans un type de pelouse acidiphile hygrocline à mésohygrophile pâturée dominé par Nardus stricta (nardaie hygrophile), déclinée en plusieurs associations selon les massifs. L’état de conservation de ces nouvelles populations semble bon, au moins pour l’une d’entre elles (l’Estrop), mais dépend d’une gestion pastorale particulièrement équilibrée, sans doute difficile à maintenir dans la durée. Il est permis de penser que d’autres stations de Botrychium simplex peuvent être encore découvertes, notamment dans les Alpes du Sud et les Pyrénées, en ciblant les recherches sur les marges des pozzines, à l’optimum phénologique (fin juillet et début août dans les Alpes-Maritimes).
Bibliographie
Alaoui Haroni S., Alifriqui M. & Simonneaux V., 2009. Recent dynamics of the wet pastures at Oukaimeden plateau (High Atlas mountains, Morroco). Biodiversity and Conservation 18 : 167-189.
Anderson D.G., 2006. Botrychium simplex E. Hitchcock (little grapefern): a technical conservation assessment. Rapport inédit, USDA Forest Service, Rocky Mountain Region, 75 p.
Bennert H.W., Sonneborn I., Sonneborn W. & Horn K., 2003. Bestandsdynamik, Ökologie und Soziologie von Botrychium simplex in der Senne (Nordrhein-Westfalen). Abhandlungen aus dem Westfälischen Museum für Naturkunde 65: 31-42.
Bonnet V., 2017. État des lieux des populations de Botrychium simplex dans les Alpes françaises. Rapport inédit, CBNA, 9 p.
Bouby H., 1963. Botrychium simplex Hitchc., fougère nouvelle pour la moitié sud de la France. Bulletin du Muséum national d’histoire naturelle, 2e série, 35 : 654-661.
Briquet J., 1910. Prodrome de la flore corse, comprenant les résultats botaniques de six voyages exécutés en Corse sous les auspices de M. Émile Burnat, I. Georg, Genève, 656+LVI p.
Chevallier H., 2009. Guide des milieux pastoraux et milieux associés. Fiche ALTI.P8. Office national des forêts 66. Parc naturel régional des Pyrénées catalanes. Association gestionnaire de la Réserve naturelle de Nohèdes. En ligne : https://pnrpc.centredoc.fr/doc_num.php?explnum_id=196
Chouard P., 1935. Les tourbières de pelouses, ou pozzines, dans lesPyrénées, formations homologues des pozzines de Corse. Bulletin de la Société botanique de France 82 (5) : 632-642.
Christenhusz M., Bento Elias R., Dyer R., Ivanenko Y., Rouhan G., Rumsey F. & Väre H., 2017. Botrychium simplex: e.T161906A85446630. The IUCN Red List of Threatened Species.
Delage A. & Hugot L. (coord.), 2020. Atlas biogéographique de la flore de Corse. Conservatoire botanique national de Corse / Office de l’environnement de la Corse, Éd. Albiana, 608 p.
Delay F., 2012. Document d’objectifs du site Natura 2000 FR9402007 : Site à Botrychium simplex et châtaigneraies du Bozio. Rapport inédit, Biotope, Direction régionale de l’environnement [DREAL] Corse, 108 p.
Dentant C., Le Driant F., Van Es J., Ferrus L., Garraud L., Abdulhak S. & Douzet R., 2012. Actualisation de la flore du territoire des Hautes-Alpes. Le Monde des Plantes 508 : 3-26.
Engan G., 2001. Dvergmarinokkel Botrychium simplex funnet to steder i Hvaler i Ostfold. Blyttia 59: 177-181.
Franchet M.A., 1897a. Un Botrychium nouveau pour la flore de France. Bulletin de la Société botanique de France 44 : 64-69.
Franchet M.A., 1897b. À propos du Botrychium simplex trouvé à Malesherbes. Bulletin de la Société botanique de France 44 : 319-320.
Gamisans J., 1976. La végétation des montagnes corses, I. Phytocoenologia 3 (4) : 425-498.
Gamisans J., 1977. La végétation des montagnes corses, II. Phytocoenologia 4 (1): 35-131.
García Criado M., Väre H., Nieto A., Bento Elias R., Dyer R., Ivanenko Y., Ivanova D., Lansdown R., Molina J.A., Rouhan G., Rumsey F., Troia A., Vrba J. & Christenhusz M.J.M., 2017. European Red List of Lycopods and Ferns. Brussels, Belgium, IUCN, iv + 59 p.
Guinochet M., 1936. Sur la présence dans les Alpes sud-occidentales d’ensembles physionomiquement comparables aux « pozzines » corses. Bulletin de la Société botanique de France 83 (6-7) : 437-442.
Guinochet M., 1938. Études sur la végétation de l’étage alpin dans le bassin supérieur de la Tinée (Alpes-Maritimes). Thèse, Lyon, 458 p.
Horn K. & Korneck D., 2003. Die Einfache Mondraute (Botrychium simplex E. Hitchcock) in Tirol. Wulfenia 10: 145-169.
Julian M., 1966. Les montagnes du Haut Var. Esquisse morphologique. Méditerranée 7 (3) : 185-206.
Käsermann C. & Moser D.M., 1999. Fiches pratiques pour la conservation – Plantes à fleurs et fougères. Berne, OFEFP, 316 p. + ann.
Kharbouch M. & Gauthier A., 2000. Nouvelles analyses polliniques dans la région de la vallée des Merveilles. Étude du lac Long supérieur. Quaternaire 11 (3-4) : 243-256.
Kholia B.S., 2012. Botrychium simplex E. Hitchcock: a new moonwort for the Indian Himalayan Mountains. American Fern Journal 102 : 86-91.
Klein J.-C. & Lacoste A., 1995. Les pozzines à Carex orbicularis Boott subsp. kotschyana de l’Alborz central (Iran) : groupement à la charnière des régions eurosibérienne et irano-touranienne. Ecologia Mediterranea XXI (3-4) : 75-86.
Litardière R. (de), 1927. Le Botrychium simplex Hitchc. en Corse, Bulletin de la Société botanique de France 74 : 729-734.
Litardière R. (de), 1930. Nouvelles contributions à l’étude de la flore de Corse. Archives de botanique, mémoires 4 (2) : 1-16.
Litardière R. (de) & Malcuit G., 1926. Contribution à l’étude phytosociologique de la Corse : le massif du Renoso. Paris, 143 p.
Malcuit G., 1951 Contribution à l’étude phytosociologique de la Corse. Esquisse de la végétation du plateau d’Ese. Bulletin de la Société botanique de France 98, suppl. 1 : 10-16.
Milde J., 1869. Botrychiorum Monographia. Verhandlungen der Zoologisch-Botanischen Gesellschaft in Wien 19 : 55-190.
Noble V., Van Es J., Michaud H. & Garraud L. (coord.), 2015. Liste rouge de la flore vasculaire de Provence-Alpes-Côte d’Azur – Version mise en ligne. Conservatoire botanique national méditerranéen [CBNMed], Conservatoire botanique national alpin [CBNA], Direction régionale de l’environnement Provence-Alpes-Côte d’Azur [DREAL PACA], région Provence-Alpes-Côte d’Azur, 14 p.
Parnikoza I.Y. & Celka Z., 2016. Botrychium simplex E. Hitchc. (Ophioglossaceae), a new species for the native flora of Ukraine. Biodiversity Research and Conservation 43 : 7-12.
Pawlaczyk P., Kepel A., Jaros R., Dzięciołowski R., Wylegała P., Szubert A. & Olaf Sidło P., 2004. Natura 2000 Shadow List in Poland. Warsawa, WWF, 178 p.
Prelli R., 2001. Les fougères et plantes alliées de France et d’Europe occidentale. Belin, Paris, 431 p.
Soutadé G. & Baudière A., 1970. Végétation et modelés des hauts versants septentrionaux de la Sierra Nevada. Annales de géographie, 79, (436) : 709-736.
Suméra F. & Geist H., 2010. Exploitation de la haute montagne du Mercantour et impact sur l’environnement depuis l’âge du Fer. Étude de cas : l’exemple du vallon de Millefonts, commune de Valdeblore (Alpes-Maritimes). Actes de la table ronde internationale de Gap, Archéologie de la montagne européenne, 29 septembre-1er octobre 2008 : 45-55.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1195 p.
Union international pour la conservation de la nature [UICN] France, Fédération des conservatoires botaniques nationaux [FCBN], Agence française pour la biodiversité [AFB], Muséum national d’histoire naturelle [MNHN], 2018. La Liste rouge des espèces menacées en France, § Flore vasculaire de France métropolitaine. Paris, UICN France, 32 p.
Vergnes M.-L. (de), 1911. Deuxième note sur les Botrychium des environs de Chamonix (Haute-Savoie). Bulletin de la Société botanique de France 58 : 222-224.
Remerciements
Nous remercions Maëlle le Berre pour ses recherches bibliographiques et Antoine Carrouée pour son aide sur le terrain.