Ageratina adenophora (Spreng.) R.M. King & H. Rob. (Asteraceae) : une plante exogène au potentiel invasif sous-estimé ?
Title
Ageratina adenophora (Spreng.) R.M. King & H. Rob. (Asteraceae): an alien plant with underestimated invasive potential?
Résumé
À partir d’observations récentes de populations envahissantes d’Ageratina adenophora sur la Riviera française, nous proposons de mettre à jour le statut de cette plante en France métropolitaine. L’eupatoire glanduleuse semble avoir été introduite en France durant la première moitié du xixe siècle où elle est mentionnée dans divers jardins botaniques et fait l’objet de conseils pour sa culture dans des traités d’horticulture. Les premières mentions de la plante échappée dans la nature remontent au début du xxe siècle. Elle semble s’être étendue dans les années 1980 et, aujourd’hui, elle est naturalisée de Nice à Menton. Elle colonise différents milieux rudéraux (murs plus ou moins humides, bords de route, jardins abandonnés, décombres), mais elle affectionne plus particulièrement les bords de ruisseaux dans les vallons côtiers entre la moyenne corniche et le littoral de la Riviera. Elle y forme des peuplements denses sur plusieurs centaines de mètres carrés. Nous suggérons de placer ce taxon sur la liste d’alerte en région PACA afin que botanistes et gestionnaires y portent une attention plus précise et prennent si besoin les dispositions nécessaires pour limiter ses nuisances.
Abstract
Based on recent observations of invasive populations of Ageratina adenophora on the French Riviera, we propose to update the status of this plant in metropolitan France. Croftonweed seems to have been introduced into France during the first half of the 19th century where it is mentioned in various botanical gardens and is the subject of advice for its cultivation in horticultural treatises. The first mentions of the plant escaping into the wild date back to the beginning of the 20th century. It seems to have spread in the 1980s and today it is naturalized from Nice to Menton. It colonises various ruderal environments (more or less damp walls, roadsides, abandoned gardens, rubble) but it is particularly associated to the banks of streams in the coastal valleys between the middle cornice and the Riviera coast. It forms dense stands over several hundred square metres. We suggest that this taxon be placed on the alert list in the PACA region so that botanists and managers can pay more precise attention to it and take the necessary measures to limit its nuisance if necessary.
1. Contexte
L’eupatoire glanduleuse (Ageratina adenophora (Spreng.) R.M. King & H. Rob.) est une plante de la famille des Asteraceae originaire du Mexique[1] et localement naturalisée en France métropolitaine, dans les Alpes-Maritimes et en Corse. Lorsqu’elle est fleurie, la réunion de ces nombreux capitules de fleurs blanches la rend très gracieuse. Ces qualités ornementales lui ont valu d’être introduite aux quatre coins du monde au cours du xixe siècle. Aujourd’hui, elle est naturalisée dans de nombreuses régions subtropicales, en particulier en Asie du Sud-Est, en Afrique (notamment en Afrique du Sud), en Macaronésie (Açores, Canaries, Madère) et en Océanie (Australie, Nouvelle-Zélande). Dans nombre de ces territoires, elle est considérée comme une plante invasive majeure (Weber, 2003 ; CABI, 2022).
Ageratina adenophora a aussi été introduite dans le bassin méditerranéen et elle y est naturalisée en Algérie (Meddour et al., 2020), au Maroc (Greuter, 2006+), au Portugal (Plantas invasoras em Portugal, 2020), en Espagne (Burton, 1970 ; Gonzalez-Martinez, 2017), en France (Tison & de Foucault, 2014), en Italie (Del Guacchio, 2013), en Croatie (Greuter, 2006+) et en Grèce (Arianoutsou et al., 2010). Les botanistes européens connaissent surtout la plante à travers leurs voyages en Macaronésie, l’espèce étant largement naturalisée et envahissante à Madère, aux Açores et aux Canaries (e.g. Perrier, 2010). Cette situation explique que l’espèce soit classée officiellement comme espèce envahissante et réglementée à ce titre au Portugal (décret-loi n° 92/2019 du 10 juillet 2019) et en Espagne (décret royal 630/2013). Ailleurs en Europe et dans le bassin méditerranéen, ses capacités invasives semblent plutôt être négligées.
Durant l’hiver et le printemps 2022, j’ai observé l’eupatoire glanduleuse dans plusieurs stations de la Riviera où elle formait des peuplements denses, notamment dans les vallons humides du littoral. Cela m’amène à proposer cette courte note pour attirer l’attention des botanistes sur ce taxon et actualiser son statut.
2. Description
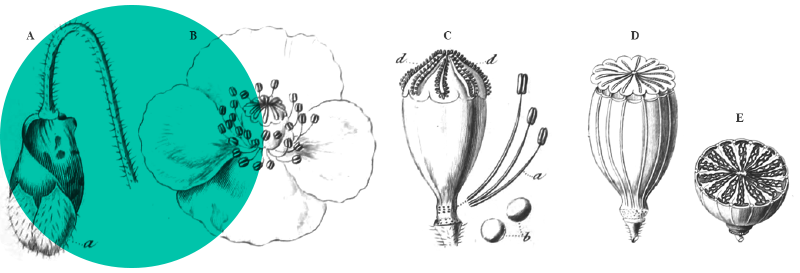
Dans ce paragraphe, nous synthétisons les descriptions d’Ageratina adenophora (Spreng.) R.M. King & H. Rob., 1970 (Asteraceae) [syn. : Eupatorium adenophorum Spreng., 1826] données dans différentes flores, dans la zone d’origine (Espinosa, 2001) et dans les zones d’introduction (Nesom, 1993 ; Wu & Raven 1994 ; Beentje et al., 2015). L’épithète spécifique adenophora vient du grec aden signifiant « glande » et phora signifiant « portant », en référence aux nombreuses glandes portées notamment par les tiges et les feuilles.
Ageratina est un genre américain qui comprend environ 320 espèces. Dans la famille des Asteraceae, le genre appartient à la sous-famille des Asteroideae Lindl. et à la tribu des Eupatorieae Cass. Longtemps classé au sein du genre Eupatorium, le genre Ageratina en a été séparé notamment sur la base de la cytologie (x = 17 chez Ageratina, x = 10 chez Eupatorium s. s.) et de la morphologie : Ageratina se distingue d’Eupatorium s. s. par des lobes de corolle papilleux glanduleux ou poilus et non lisses, par la base du style glabre et non poilue, par la présence d’un carpophore discret mais distinct, par la présence de glandes sur de nombreuses parties de la plante (alors que chez Eupatorium s. s., ces glandes sont réduites à la corolle et aux akènes) et par les soies du pappus en pointe aiguë (King & Robinson, 1970 ; Robinson & King, 1985). En Europe, seules deux espèces du genre Ageratina se sont échappées. Outre A. adenophora qui fait l’objet de cet article, on notera la présence d’A. altissima (L.) R.M. King & H. Rob. qui est signalé dans plusieurs pays (Allemagne, Autriche, Belgique, Hongrie, Italie, Pologne, République Tchèque) comme espèce occasionnelle (Greuter, 2006+).
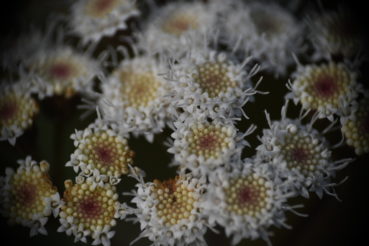
A. adenophora est une plante pérenne ou un arbrisseau de 30 cm à 220 cm de haut. La tige est érigée, violacée quand elle est jeune, quelque peu ligneuse, de 2-3 mm de diamètre vers le haut, avec des rameaux opposées et obliquement ascendants (photo 1). La tige est couverte de poils glanduleux courts, devenant plus densément pubescents vers l’apex et inversement plus glabres vers la base. Les feuilles sont opposées, avec un pétiole de 10-25 mm et des limbes triangulaires-ovales ou rhombiques-ovales de (1,5-)2,5-7,5(-8) cm de long et 1,5-3 cm de large (photo 2) ; la base du limbe est tronquée ou légèrement cordée, le bord grossièrement crénelé, l’apex aigu à acuminé ; les deux faces du limbe sont quelque peu pubérulentes, plus densément sur la face inférieure (qui est pâle) et sur les nervures (la face supérieure est plus verte). Les synflorescences sont terminales, quelque peu feuillées, en corymbes ou corymbes composés, jusqu’à 12 cm de diamètre (photo 3). Les capitules sont nombreux, composés de 40-50(-72) fleurs (photo 4) ; ils sont portés par des pédoncules de 5-12 mm de long, densément glanduleux et parfois aussi légèrement visqueux-pubérulents. Les involucres sont largement campanulés, environ 3 × 4 mm ; les phyllaires sont bi-sériés, linéaires ou linéaires-lancéolés, de 3,5-5 mm. La corolle mesure 3,5 mm de long, blanche à crème, avec un tube filiforme et un limbe campanulé, le tube est nettement à cinq nervures, les lobes triangulaires, de ± 0,2 mm de long, épaissis, peu poilus à l’extérieur ; les anthères mesurent ± 1 mm de long, sont basalement sagittées, apicalement avec des appendices ovales ; le style mesure 3,5-4,5 mm de long, bifide sur 0,5-1,5 mm, bras du style exsudés sur ± 1,5 mm, papilleux ; les cypsèles sont brun-noir, étroitement elliptiques, 1-1,5 mm, à cinq angles, glabres ; les soies du pappus sont coniques à la base, blanches, fines, égales à la corolle. La floraison a lieu de (mars) avril à octobre (novembre). 2n = 3x = 51.
3. Historique de l’introduction en France
Une tentative de synthèse mondiale de son historique d’introduction a été proposée par Poudel et al. (2019). Ageratina adenophora aurait été introduite pour la première fois en dehors de son aire d’origine comme plante ornementale au Royaume-Uni en 1826 (Auld & Martin, 1975). Toujours au xixe siècle, son introduction se poursuit d’abord aux Éats-Unis, en Californie en 1849 et à Hawaï en 1860 (Muniappan et al., 2009), puis en Australie en 1875 (Auld & Martin, 1975). Elle aurait ensuite été introduite dans le sud de l’Inde dès 1914, puis au nord du pays en 1924 (Tripathi et al., 2012). Il est admis qu’A. adenophora s’est disséminée naturellement en Chine dans les années 1940 depuis la Birmanie, le long de l’autoroute internationale (Wang & Wang, 2006). Elle a été signalée pour la première fois en Nouvelle-Zélande en 1931 (Webb, 1987), au Népal en 1952 (Tiwari et al., 2005), en Afrique du Sud en 1958 (Henderson, 2006) et plus récemment en Italie en 2013 (Del Guacchio, 2013).
Dans cette synthèse globale de l’historique d’invasion d’A. adenophora, l’Europe est à peine mentionnée et la France ne l’est pas, ce qui est symptomatique de la discrétion de la plante dans la littérature botanique européenne. Pourtant, comme ailleurs dans le monde, l’eupatoire glanduleuse est connue dans les jardins botaniques depuis plus d’un siècle.
3.1. Une espèce cultivée dans les jardins botaniques au xixe siècle
En épluchant la littérature ancienne, on découvre qu’Ageratina adenophora est mentionnée (sous Eupatorium adenophorum) dans plusieurs jardins botaniques durant la seconde moitié du xixe siècle. Dans son Énumération des plantes cultivées dans les jardins de la Provence et de la Ligurie, Émile Sauvaigo ne la note explicitement qu’au jardin de la Villa Thuret à Antibes (Sauvaigo, 1899) où l’on sait qu’elle était cultivée depuis au moins 1859 d’après un échantillon de l’herbier de Gustave Thuret (Herbier Villa Thuret, VTA010350). Mais d’autres sources la mentionnent au jardin de Monte Carlo (Jeannel, 1890), au jardin botanique de Montpellier (L’Indépendant : journal du Midi, 1848), et même dans des jardins botaniques hors de la région méditerranéenne comme à Grenoble (Verlot, 1857). Elle était aussi probablement cultivée dans des jardins privés puisqu’elle est mentionnée dans divers ouvrages d’horticulture avec des conseils de culture et d’entretien (e.g. Dupuis & Hérincq, 1884 ; Bois, 1893-99). Dans son Dictionnaire d’horticulture, Bois (1893-99) indique par exemple qu’elle se cultive en orangerie ou en serre froide.
La mention datée la plus ancienne pour la France métropolitaine remonte à 1846 où Rantonnet (1847), horticulteur à Hyères, indique que la plante a péri lors d’un hiver rigoureux. Toutefois, sur l’étiquette d’une part de l’herbier de Georges Rouy, il est indiqué « introduit en France en 1826 » (Herbier Université de Lyon, LY0713282), sans que l’on ait pu recouper cette date avec d’autres informations (hormis qu’il s’agit de la même date donnée pour le Royaume-Uni, cf. supra). Quoi qu’il en soit, Sauvaigo (1899) semble indiquer qu’à la fin du xixe siècle elle est beaucoup moins cultivée dans les jardins « où elle avait autrefois une bonne place » parmi les espèces cultivées. Cependant, il note dans le même temps qu’elle est déjà naturalisée dans certains jardins de Nice (Sauvaigo, 1899). Cette mention correspond bien à nos observations au jardin de la Villa Les Cèdres à Saint-Jean-Cap-Ferrat, où A. adenophora n’est plus présente dans des massifs de plantes cultivées, mais se trouve dans le parc (photo 6) à l’état naturalisé à proximité d’une serre désaffectée (Fried, 2022). À partir de ces jardins botaniques et autres jardins d’exception de la Riviera, A. adenophora va poursuivre plus largement sa naturalisation.
3.2. …et naturalisé dès le début du xxe siècle
Les premières mentions de l’espèce en dehors d’un jardin remontent au tournant du xxe siècle. L’espèce a été récoltée le 4 avril 1899 sur des vieux murs à Cabbé, lieu-dit de la commune de Roquebrune-Cap-Martin (Muséum national d’histoire naturelle, Paris (France), collection Plantes vasculaires (P), spécimen P04372652). Cette observation reste ambiguë car la part d’herbier comporte aussi la mention « cultivée » sans que l’on puisse dire si cela se rapporte à l’échantillon collectée. De façon plus explicite, dans son inventaire de la colline du Château de Nice, Mader (1910) cite Eupatorium adenophorum parmi les espèces naturalisées et l’indique comme très commune sur le versant ouest de la colline, près des cascades. Quelques années plus tard, Chevalier (1918) la trouve « abondamment naturalisée sur les terrains dominant le Pont Saint-Louis à Menton et à Monaco, le long du Ravin de Sainte-Dévote ». Cette situation est confirmée par une part de l’herbier de Georges Hibon (Muséum national d’histoire naturelle, Paris (France), collection Plantes vasculaires (P), spécimen P03724023) qui indique « abondamment naturalisé » pour un échantillon récolté le 30 mars 1920 à Menton. Dans les années 1930, Paul Jovet la récolte dans un caniveau empierré devant la gare de Villefranche-sur-Mer (Muséum national d’histoire naturelle, Paris (France), collection Plantes vasculaires (P), spécimen P04185072). Malgré ces diverses observations des premières populations naturalisées au début du xxe siècle, il semble que la plante soit restée discrète et seulement connue des botanistes locaux, car les flores de France de cette période (Coste, 1906 ; Fournier, 1947) n’en font aucune mention.
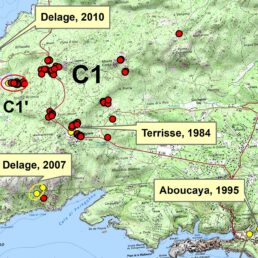
C’est en Corse que l’histoire se poursuit. La plante a été découverte pour la première fois sur l’île en 1952 dans le vallon de Lupino près de Bastia par le professeur Th. Marchioni. Ageratina adenophora y a été observée dans les rocailles (schistes lustrés) du lit du ruisseau et sur les rives abruptes, entre le pont de Lupino (proche de la mer) et le gué de Falconaja (Conrad, 1961a ; Gamisans & Jeanmonod, 1998). Au moment de sa découverte, l’espèce avait déjà conquis le ruisseau sur un kilomètre de long (Conrad, 1961a). En 1961, Marcelle Conrad (1961b) la trouve à Ajaccio où elle envahit les berges du canal de la Gravona près du « Château des Anglais » et jusqu’au chemin de Carrosaccia.
Au début des années 1980, Alziar (1984) constate que l’espèce s’est considérablement développée sur la Riviera. Il observe qu’elle est maintenant présente partout dans les zones rudérales (murs, jardins abandonnés) entre Menton et Monaco. Des signalements plus récents, au cours des années 2010-2020 (Conservatoire botanique national méditerranéen, 2023), confirment cette tendance à l’expansion, avec plusieurs nouvelles localisations couvrant la zone plus à l’est, entre Monaco et Nice : à Cap-d’Ail au cap Rognoso (obs. K. Diadema & F. Médail, 2010, puis C. Casiez, 2020) et aux Pissarelles (obs. C. Casiez, 2020), à Beausoleil (obs. M. Le Berre & A. Granger, 2017), à Roquebrune-Cap-Martin (obs. L. Thébault, 2018, puis A. Besnault-Clerice, 2021), à Eze (obs. G. Fried, 2022), à Beaulieu-sur-Mer (obs. G. Fried, 2022), à Saint-Jean-Cap-Ferrat (obs. G. Fried, 2022) et à Nice (obs. M. Pires & S. Richaud, 2022). Il semble donc que l’espèce occupe désormais l’ensemble du littoral de la Riviera entre Nice et Menton.
4. Biologie, écologie et potentiel envahissant en France
4.1. Phénologie, cycle de vie, reproduction et dispersion
Sur la Riviera, A. adenophora fleurit assez tôt au printemps. Les nouvelles tiges feuillées sont déjà visibles et font plusieurs décimètres en février, et la plante est en bouton en mars (obs. pers., 2022). Elle commence à fleurir en avril (obs. pers. ; Tison & de Foucault, 2014) et des individus fructifiés sont visibles dès la mi-mai (obs. pers., 2022). En Corse, Conrad (1961b) notait la plante en fleur le 8 avril 1961 et en fruits au début de juin. On peut observer des individus en fleurs à d’autres périodes de l’année (Tison et al., 2014, donnent une plage de floraison de mars à novembre) et Jeannel (1890) rapporte que les individus cultivés au jardin de Monte-Carlo étaient en fleurs en décembre.
Ageratina adenophora se reproduit principalement par voie sexuée, mais les graines sont produites de manière apomictique sans fécondation (Parsons & Cuthbertson, 2001). Dans des conditions favorables, un individu peut produire sept mille à dix mille cypsèles. Celles-ci étant très légères et munies de soies plumeuses sur le pappus, elles sont facilement dispersées par le vent et peuvent aussi flotter sur l’eau (Wang et al., 2011). L’anémochorie et la flottabilité des cypsèles ont facilité la dispersion d’A. adenophora le long des routes, des voies ferrées et des cours d’eau, dans les territoires où la plante est invasive (Wang et al., 2011). A. adenophora se reproduit également de manière végétative par des fragments de tiges ou à partir des réserves de la racine, notamment si les plantes sont cassées (Parsons & Cuthbertson, 2001 ; Wang et al., 2011). Cela peut faciliter la propagation sur de courtes distances et l’expansion des populations à l’échelle locale. Dans les stations suffisamment humides, au niveau des nœuds des tiges, des racines adventives peuvent être produites au contact du sol, ce qui permet à la plante de former des fourrés denses composés de tiges entrelacées (Weber, 2003).
4.2. Facteurs climatiques
Globalement, A. adenophora est une espèce des régions chaudes, humides et sans gel (Tererai & Wood, 2014). Les facteurs climatiques qui expliquent le mieux les limites de sa distribution mondiale sont la température du trimestre le plus froid (absence de gel) et les précipitations du trimestre le plus chaud (besoin d’humidité suffisante). Au cours de son invasion à travers le globe, des études ont montré une expansion de sa niche écologique par rapport à son aire d’origine mexicaine (Dellinger et al., 2016 ; Datta et al., 2019). Plus précisément, ces derniers auteurs ont montré que les limites de la niche sont restées très similaires à l’extrémité de l’axe lié à l’aridité. Le besoin en eau, notamment au moment de la germination, est une contrainte très forte pour A. adenophora (Lu et al., 2006). En revanche, à l’autre extrémité de cet axe, une expansion de la niche a été observée vers des climats plus humides (par rapport à la zone d’origine au Mexique) et, sur l’axe des températures, l’espèce s’est étendue aussi bien vers des zones aux climats plus chauds que plus frais. Compte tenu de la biologie de l’espèce (apomixie), la modification de la niche écologique n’est probablement pas due à un processus d’évolution rapide dans la zone d’introduction. D’autre part, si l’accumulation de mutations peut en principe conduire à de la diversité génétique et à une évolution adaptative, le temps écoulé depuis son introduction est jugée trop court pour que cela ait pu se produire (Datta et al., 2019). On assiste donc plutôt à un changement dans la niche réalisée restant dans l’enveloppe de la niche fondamentale de l’espèce.
Les exigences hydrothermiques de l’eupatoire glanduleuse expliquent que, bien qu’elle ait été cultivée ailleurs en France (au moins aux jardins botaniques de Grenoble, Montpellier et Nancy), A. adenophora ne s’est pour l’instant naturalisée que sur la Riviera. Elle y trouve des températures suffisamment importantes, un nombre de jours de gel très faible, et semble compenser le manque de précipitation (estivale) du régime climatique méditerranéen par une association plus régulière avec des milieux humides. Les modèles de prédiction d’établissement d’A. adenophora basés sur ses affinités climatiques indiquent que le domaine sud-atlantique et le Pays basque sont aussi à risque (Changjun et al., 2021).
4.3. Habitats
En France, l’espèce est décrite des « rochers et [des] vieux murs humides ou frais [et des] décombres » (Tison et al., 2014) ainsi que des « bords de torrents » (Tison & de Foucault, 2014). Alziar (1984) la note dans différents habitats rudéraux : murs, escaliers mal entretenus, jardins abandonnés, décombres et rochers. Il précise qu’elle est beaucoup plus vigoureuse dans les endroits frais. En Corse, elle est notée sur les rives abruptes et les rocailles du lit d’un ruisseau (Conrad, 1961a), dans un vallon frais (Jeanmonod & Gamisans, 2013) et sur les bords d’un canal (Conrad, 1961b). On note presque systématiquement une association avec un milieu frais à humide. Les observations récentes (cf. 3.2.) indiquent que l’optimum de l’espèce se trouve au bord des ruisseaux côtiers situés dans des vallons encaissés. Comme le suggérait Alziar (1984), c’est dans ces conditions qu’elle forme des populations envahissantes.
Sur la base des quinze relevés floristiques incluant Ageratina adenophora disponibles dans la base de données Simethis du Conservatoire botanique national méditerranéen (2023), les espèces co-occurentes peuvent aider à apprécier l’écologie de l’espèce en France (listées par ordre de fréquence décroissante ; (**) : espèce protégée ; (*) : espèce végétale exogène envahissante) :
Hedera helix L., 1753
Parietaria judaica L., 1756
Sambucus nigra L., 1753
Ailanthus altissima (Mill.) Swingle, 1916 (*)
Rubus ulmifolius Schott, 1818
Senecio angulatus L. f., 1782 (*)
Smilax aspera L., 1753
Acanthus mollis L., 1753
Adiantum capillus-veneris L., 1753
Arundo donax L., 1753
Asplenium onopteris L., 1753
Bidens pilosa L., 1753
Bituminaria bituminosa (L.) C.H. Stirt., 1981
Cardamine hirsuta L., 1753
Clematis vitalba L., 1753
Ficus carica L., 1753
Fraxinus ornus L., 1753
Juniperus oxycedrus L. subsp. oxycedrus, 1753
Lavandula dentata L., 1753 (*)
Ligustrum lucidum W.T. Aiton, 1810 (*)
Lotus ornithopodioides L., 1753
Mercurialis annua L., 1753
Oloptum miliaceum (L.) Röser & Hamasha, 2012
Oxalis pes-caprae L., 1753 (*)
Pistacia lentiscus L., 1753
Solanum nigrum L., 1753
Tropaeolum majus L., 1753 (*)
Urtica membranacea Poir., 1798
Alnus glutinosa (L.) Gaertn., 1790
Araujia sericifera Brot., 1818 (*)
Atriplex halimus L., 1753
Biscutella cichoriifolia Loisel., 1810
Brachychiton populneus (Schott & Endl.) R. Br., 1844
Brachypodium retusum (Pers.) P. Beauv., 1812
Brachypodium sylvaticum (Huds.) P. Beauv., 1812
Buddleja davidii Franch., 1887 (*)
Cardamine impatiens L., 1753
Carex pendula Huds., 1762
Carpinus ostrya L., 1753
Cerastium glomeratum Thuill., 1799
Chamaerops humilis L., 1753
Cirsium vulgare (Savi) Ten., 1838
Convolvulus althaeoides L., 1753
Cornus sanguinea L., 1753
Corylus avellana L., 1753
Crepis sancta (L.) Bornm., 1913
Crepis vesicaria subsp. taraxacifolia (Thuill.) Thell., 1914
Crithmum maritimum L., 1753
Delairea odorata Lem., 1844 (*)
Dittrichia viscosa (L.) Greuter, 1973
Erigeron sumatrensis Retz., 1810
Eupatorium cannabinum L. subsp. cannabinum, 1753
Euphorbia dendroides L., 1753
Fragaria vesca L., 1753
Fraxinus angustifolia Vahl, 1804
Fumaria capreolata L., 1753
Galium aparine L. subsp. aparine, 1753
Galium mollugo L., 1753
Geranium molle L., 1753
Geranium purpureum Vill., 1786
Geranium robertianum L., 1753
Hypericum androsaemum L., 1753
Impatiens balfourii Hook. f., 1903 (*)
Ipomoea indica (Burm.) Merr., 1917 (*)
Iris germanica L., 1753
Lantana strigocamara R.W. Sanders, 2006 (*)
Lapsana communis L. subsp. communis, 1753
Laurus nobilis L., 1753
Ligustrum vulgare L., 1753
Limonium cordatum (L.) Mill., 1768
Lotus cytisoides L., 1753
Malva sylvestris L., 1753
Matthiola incana (L.) W.T. Aiton, 1812
Medicago arborea L., 1753 (*)
Nicotiana glauca Graham, 1828 (*)
Olea europaea L., 1753
Persicaria maculosa Gray, 1821
Pinus pinaster Aiton, 1789
Pittosporum tobira (Thunb.) W.T. Aiton, 1811 (*)
Pteris vittata L., 1753
Pyracantha coccinea M. Roem., 1847
Quercus ilex L., 1753
Ranunculus repens L., 1753
Roldana petasitis (Sims) H. Rob. & Brettell, 1974 (*)
Samolus valerandi L., 1753
Sanicula europaea L., 1753
Sedum dasyphyllum L., 1753
Senecio deltoideus Less., 1832
Smyrnium olusatrum L., 1753
Solanum sisymbriifolium Lam., 1794
Sonchus oleraceus L., 1753
Sonchus tenerrimus L., 1753
Symphytum bulbosum K.F. Schimp., 1825 (**)
Syringa vulgaris L., 1753
Theligonum cynocrambe L., 1753
Ulmus minor Mill., 1768
Umbilicus rupestris (Salisb.) Dandy, 1948
Urospermum dalechampii (L.) Scop. ex F.W. Schmidt, 1795
Viburnum tinus L., 1753
Vinca major L., 1753
Viola alba Besser, 1809
Wigandia caracasana Kunth, 1819
On note un nombre non négligeable d’espèces qui, en région méditerranéenne, ont des affinités pour des stations à humidité édaphique et/ou atmosphérique suffisantes, qui tolèrent un certain ombrage, ainsi que des espèces rudérales.
On retrouve une écologie similaire ailleurs dans le sud de l’Europe. En Italie, on la trouve le long des côtes rocheuses humides ou sur les berges des rivières (Del Guacchio, 2013). Au Portugal, A. adenophora est établie sur « les falaises, les berges des cours d’eau et les bords de routes, ainsi que dans les zones perturbées et agricoles » (Plantas invasoras em Portugal, 2020). En Espagne, Menéndez Valderrey (2021) l’indique dans les endroits humides et ombragés, les prairies subnitrophiles et les roselières à côté d’oueds ou de fossés, ou à côté de chemins de fer, et sur les terres non cultivées, parfois dans des fourrés côtiers, sur substrats acides ou basiques, de 20 à 140(400) m. Sur les îles macaronésiennes, elle est de même répertoriée dans divers milieux riverains (systèmes de canaux, sources, suintements), mais aussi dans les « forêts » montagnardes hygrophiles (landes, fourrés d’arbres méso- à hygrophiles, laurisylves), les maquis, les zones urbanisées, les terres cultivées et les espaces verts artificiels (Catálogo Español de Especies Exóticas Invasoras, 2013).
4.4. Abondance et impacts
De nombreuses études ont mesuré l’impact d’Ageratina adenophora sur la biodiversité et les services écosystémiques en Chine, en Inde et au Népal. Il ressort de ces études qu’une fois installée A. adenophora peut rapidement former un peuplement dominant, exclure des espèces indigènes et modifier de manière significative les caractéristiques édaphiques des stations colonisées (Wan et al., 2010). Des études menées dans la province du Yunnan et la province du Sichuan en Chine ont montré qu’une invasion d’A. adenophora provoque un déclin significatif de la richesse spécifique dans différents habitats (Ding et al., 2007), une baisse de la diversité fonctionnelle et un changement dans la composition et l’abondance des espèces de sous-bois de Pinus yunnanensis (Fu et al., 2017).
En Europe, il n’existe pas à ce jour de mesures de son impact sur les communautés végétales dans les habitats envahis. Si l’on en juge par les densités de tige d’A. adenophora autour des ruisseaux de certains vallons de la Riviera, ces impacts sont probablement significatifs (photos 7 et 8).
4.5. Évaluation des risques et proposition d’un nouveau statut
En 1961, après sa découverte de l’eupatoire glanduleuse à Ajaccio, Marcelle Conrad s’interrogeait déjà : « dans de nombreux pays où elle est naturalisée, elle arrive à étouffer la végétation naturelle. N’en sera-t-il pas de même ici, dans quelques années? » (Conrad, 1961a). Pourtant, il semble que les deux stations corses citées plus haut soient les seules connues à ce jour (Gamisans & Jeanmonod, 1998) et que l’espèce ne s’est pas plus étendue depuis (Y. Petit – CBN Corse, comm. pers., 2023). De même, s’il y a clairement une augmentation des observations de l’espèce sur la Riviera, il est étonnant qu’elle ne se soit pas propagée plus rapidement depuis le début du xxe siècle où elle était déjà localement abondante (Mader, 1910 ; Chevalier, 1918).
Si Ageratina adenophora dispose indéniablement de traits biologiques lui conférant un potentiel d’expansion rapide, la topographie locale et la répartition des habitats favorables peuvent expliquer une vitesse de colonisation localement plus réduite. Sur la Riviera, les habitats favorables sont localisés au niveau des vallons côtiers qui ne sont pas connectés entre eux. Si l’espèce peut coloniser des habitats rudéraux plus secs comme des rochers (Alziar, 1984) ou des bords de routes (obs. pers.) elle s’y maintiendra mal et ne pourra que difficilement y constituer des populations sources de nouvelles propagules. L’expansion d’est en ouest le long de la côte est donc beaucoup plus lente que la colonisation des courts vallons de la corniche à la mer. En cultivant des individus, Del Gacchio (2013) montre que, soumis à trois semaines de sécheresse, les plantes sont capables de redémarrer après un arrosage en produisant de nouvelles pousses depuis la base de la tige ou depuis les racines. Mais une sécheresse prolongée leur est fatale (Lu et al., 2006 ; Del Gacchio, 2013). À ce titre, le climat méditerranéen représente sûrement des conditions suboptimales pour l’espèce. Il reste que, dans les milieux méditerranéens suffisamment humides, A. adenophora forme déjà des populations envahissantes (photos 7 et 8). Or ces milieux humides sont justement parmi les plus menacés. Les peuplements denses d’A. adenophora peuvent y menacer Symphytum bulbosum, espèce protégée au niveau national (Le Berre et al., 2019).
Dans un précédent travail de hiérarchisation des risques d’une longue liste d’espèces exogènes naturalisées en France (Fried, 2010), en utilisant la méthode de l’OEPP (Brunel et al., 2010), nous avions placé Ageratina adenophora sur « liste d’observation » car sans dynamique ni impacts connus à cette date. Cependant, nous obtenions un score de 32 (risque élevé) avec la méthode de Weber & Gut (2004), ce qui suggérait des traits intrinsèques présentant des risques avérés. Couplé à son statut d’invasive majeure ailleurs dans le monde, nous suggérions de surveiller ce taxon.
Nos observations de 2022 montrent que, si l’eupatoire glanduleuse est souvent présente sous forme de quelques individus dispersés (recouvrement < 5%, en situation rudérale sur substrat sec), elle forme déjà localement des populations denses avec des recouvrements importants (> 50% de couverture, en bord de ruisseau). Selon la stratégie régionale relative aux espèces végétales exotiques envahissantes en région PACA (Cottaz, 2020), cette situation, couplée à un risque potentiel élevé, impliquerait qu’Ageratina adenophora soit classée sur la liste d’alerte en région PACA, ce qui est déjà le cas en Corse (Petit & Hugot, 2019).
Ce nouveau statut devrait encourager les botanistes à faire un état des lieux plus précis de la présence de ce taxon sur la Riviera (probalement sous-estimée), à affiner les observations sur la biologie et le comportement de l’espèce en France, à évaluer les risques sur les milieux humides déjà fragilisés par ailleurs et si nécessaire à engager des actions appropriées.
[1] plus précisément des États du sud du pays : Colima, Hidalgo, Jalisco, Mexico D.F., Michoacan, Morelos, Oaxaca, Puebla et Queretaro (USDA-ARS, 2004).
Bibliographie
Alziar G., 1984. Sur quelques plantes naturalisées de la Côte d’Azur. Biocosme Mésogéen 1 : 57-69.
Arianoutsou M., Bazos I., Delipetrou P. & Kokkoris Y., 2010. The alien flora of Greece: taxonomy, life traits and habitat preferences. Biological Invasions 12 (10) : 3525-3549.
Auld B.A. & Martin P.M., 1975. The autecology of Eupatorium adenophorum Spreng. in Australia. Weed Research 15 (1) : 27-31.
Beentje H.J., Jeffrey C. & Hind, D.J.N., 2005. Flora of Tropical East Africa, Compositae (part 3). Royal Botanic Gardens, Kew, UK.
Bois D., 1893-1899. Dictionnaire d’horticulture illustré, 1. Paris, Librairie des sciences naturelles, P. Klincksieck éditeur, 640 p.
Brunel S., Branquart E., Fried G., van Valkenburg Y., Brundu G., Starfinger,U., Buholzer S., Uludag A., Joseffson M. & Baker R., 2010. EPPO Prioritization process for Invasive Alien Plants. EPPO Bulletin 40 : 407-422.
Burton R.M., 1979. Some plant records from southern Spain. Lagascalia 8 (2) : 183-187.
Catálogo Español de Especies Exóticas Invasoras, 2013. Ageratina riparia (Regel) R.M. King. & H. Rob., AGERIP/EEI/FL006
Changjun G., Yanli T., Linshan L., Bo W., Yili Z., Haibin Y., … & Bohao C., 2021. Predicting the potential global distribution of Ageratina adenophora under current and future climate change scenarios. Ecology and Evolution 11 (17) : 12092-12113.
Chevalier A., 1918. Observations sur la flore des Alpes maritimes. Bulletin de la Société botanique de France 63-65 : 24-34.
Conrad M., 1961a. Les plantes adventices de la Corse (II). Études corses, NS, 27-28 : 64-68.
Conrad M., 1961b. Contributions à l’étude de la flore de la Corse. Revue d’études corses : revue d’études historiques littéraires et scientifiques corses : 19-21.
Coste H., 1906. Flore descriptive et illustrée de la France, de la Corse et des contrées limitrophes, 3 volumes. Éditions P. Klincksieck, Paris.
Cottaz C. (coord.), 2020. Actualisation de la liste des espèces végétales exotiques envahissantes de la région Provence-Alpes-Côte d’Azur (PACA), avril 2020. Conservatoire botanique national méditerranéen de Porquerolles, 61 p.
Datta A., Schweiger O. & Kühn I., 2019. Niche expansion of the invasive plant species Ageratina adenophora despite evolutionary constraints. Journal of Biogeography 46 (7) : 1306-1315.
Del Guacchio E., 2013. Ageratina adenophora (Asteraceae), new species to the Italian alien flora and observations on its environmental threats. Hacquetia 12 (2) : 17-22.
Dellinger A.S., Essl F., Hojsgaard D., Kirchheimer B., Klatt S., Dawson W., … & Dullinger S., 2016. Niche dynamics of alien species do not differ among sexual and apomictic flowering plants. New Phytologist 209 (3) : 1313-1323.
Ding H., Xu H. & Liu Z.L., 2007. Impacts of invasion of Eupatorium adenophorum on vegetation diversity. Journal of Ecology and Rural Environment 23 (2) : 29-32.
Dupuis A. & Hérincq F., 1884. Végétaux d’ornement, donnant des notions générales sur l’horticulture florale, la culture et la description particulière à chaque plante. Éditions A. Pilon et Cie, Paris, 2 vol. dont un atlas (XCIX-382 p., 52 pl.-III p.).
Espinosa J. 2001. Eupatorium. In G. Calderón de Rzedowski & J. Rzedowski (eds.), Flora fanerogámica del Valle México, Instituto de Ecología y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad : 786-800.
Fournier P., 1947. Les quatre flores de France. Ed. Lechevalier, Paris, 1104 p.
Fried G., 2010. Prioritization of potential invasive alien species in France. In S. Brunel,A. Uludag, E. Fernandez-Galiano & G. Brundu (ed.), 2nd International Workshop Invasive Plants in the Mediterranean Type Regions of the World, 2010-08-02/06, Trabzon, Turkey : 120-138.
Fried G., 2022. Inventaire de la flore spontanée du jardin de la Villa Les Cèdres à Saint-Jean-Cap-Ferrat (Alpes-Maritimes, France). Évaluation des risques associés aux espèces exogènes et enjeux de conservation des espèces indigènes et des habitats. Rapport Anses, laboratoire de la Santé des Végétaux, Montferrier-sur-Lez, 63 p.
Fu D., Wu X. & Duan C., 2017. Effects of the invasive herb Ageratina adenophora on understory plant communities and tree seedling growth in Pinus yunnanensis forests in Yunnan, China. Journal of Forest Research, 23 (2) : 112-119.
Gamisans J. & Jeanmonod D., 1998. Compléments au prodrome de la flore corse ; Asteraceae, I. Ed. des Conservatoire et Jardin botaniques de la Ville de Genève, Genève, 340 p.
González-Martínez X.I., 2017. Contribución al conocimiento de la flora alóctona de Galicia, II (NO Península Ibérica, España). Botanica Complutense 41 : 53-67.
Greuter W., 2006. Compositae (pro parte majore). In W. Greuter & E. von Raab-Straube (ed.), Compositae, Euro+Med Plantbase – the information resource for Euro-Mediterranean plant diversity.
Henderson L., 2006. Comparisons of invasive plants in southern Africa originating from southern temperate, northern temperate and tropical regions. Bothalia 36 : 201-222.
Jeannel J., 1890. Le climat du littoral d’après la végétation ou la météorométrie botanique. Nice médical 4 : 49-55.
King R.M., & Robinson H., 1970. Studies in the Eupatorieae (Compositae), XIX – New combinations in Ageratina. Phytologia 19 : 208-229.
Le Berre M., Sorrentino M., Souriguère K. & Diadema K., 2019. Plan régional d’actions en faveur de Symphytum bulbosum Schimp. 2020-2030. Enjeux « eau », « biodiversité » et « risques ». Alpes-Maritimes et Var. Conservatoire botanique national méditerranéen de Porquerolles, Syndicat mixte pour les inondations, l’aménagement et la gestion de l’eau Maralpin, Agence de l’eau Rhône Méditerranée Corse, 114 p.
L’Indépendant : journal du Midi, 1848. Académie des Sciences et Lettres de Montpellier. Travaux de l’Académie pendant l’année 1846-1847. Section des Sciences, n° 597, édition du 25 mai 1848 : 2.
Lu P., Sang W. & Ma K., 2006. Effects of environmental factors on germination and emergence of Crofton weed (Eupatorium adenophorum). Weed Science 54 (3) : 452-457.
Mader F., 1910. La colline du Château de Nice, sa faune, sa flore. Annales de la Société des lettres, sciences et arts des Alpes-Maritimes 27 : 255-292.
Meddour R., Sahar O. & Fried G., 2020. A preliminary checklist of the alien flora of Algeria (North Africa): taxonomy, traits and invasiveness potential. Botany Letters 167 (4) : 453-470.
Muniappan R., Raman A. & Reddy G.V.P., 2009. Ageratina adenophora (Sprengel) King and Robinson (Asteraceae). In R. Muniappan, A. Raman & G.V.P. Reddy (eds), Biological Control of Tropical Weeds Using Arthropods, Cambridge University Press, Cambridge, UK : 63-73.
Parsons W.W.T. & Cuthbertson E.E.G., 2001. Noxious Weeds of Australia. Csiro Publishing, Canberra : 534-536.
Perrier Ch., 2010. Compte rendu de la session de la section de botanique à Ténérife (Islas Canarias, Espagne) du 18 au 25 avril 2009. Bulletin mensuel de la Société linnéenne de Lyon 79 (7-8) : 191-208, 241-260.
Petit Y. & Hugot L., 2019. Listes hiérarchisées des espèces végétales exotiques envahissantes et potentiellement envahissantes en Corse, cadre méthodologique, stratégie territoriale relative aux invasions biologiques végétales, 1. Conservatoire botanique national de Corse / Office de l’environnement de la Corse, 29 p. + 1 annexe.
Poudel A.S., Jha P.K., Shrestha B.B. & Muniappan R., 2019. Biology and management of the invasive weed Ageratina adenophora (Asteraceae): current state of knowledge and future research needs. Weed Research 59 (2) : 79-92, https://doi.org/10.1111/wre.12351.
Rantonnet V.B., 1847. Observations climatologiques. Revue horticole, 3e série, 1 : 27-30.
Robinson H. & King R.M., 1985. Comments on the generic concepts in the Eupatorieae. Taxon 34 : 11-16, https://doi.org/10.2307/1221557.
Sauvaigo E., 1899. Flora mediterranea exotica. Énumération des plantes cultivées dans les jardins de la Provence et de la Ligurie, avec un tableau des collections botaniques les plus importantes de Marseille à Gênes. Editions impr. de J. Ventre, Nice, 2 parties en 1 vol., 316 + 96 p.
Tererai F. & Wood A.R., 2014. On the present and potential distribution of Ageratina adenophora (Asteraceae) in South Africa. South African Journal of Botany 95 : 152-158.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Ed. Biotope, Mèze, xx + 1 196 p.
Tison J.-M., Jauzein Ph. & Michaud H., 2014. Flore de la France méditerranéenne continentale. Turriers, Naturalia publications.
Tiwari S., Adhikari B., Siwakoti M. & Subedi K., 2005. An Inventory and Assessment of Invasive Alien Species of Nepal. IUCN, Kathmandu, Nepal.
Tripathi R.S,. Yadav A.S., & Kushwaha S.P.S., 2012. Biology of Chromolaena odorata, Ageratina adenophora and Ageratina riparia: a review. In J.R. Bhatt, J.S. Singh, S.P. Singh, R.S. Tripathi & R.K. Kohli (eds), Invasive Alien Plants: An Ecological Appraisal for the Indian Subcontinent, CABI International, Wallingford, UK : 43- 56.
Verlot J.-B., 1857. Catalogue des plantes cultivées au jardin botanique de la ville de Grenoble, en 1856 ; avec l’indication de la patrie et de la durée des espèces ; destiné aux échanges. 100 p.
Wan F., Liu W., Guo J., Qiang S., Li B., Wang J., … & Wang W., 2010. Invasive mechanism and control strategy of Ageratina adenophora (Sprengel). Science China Life Sciences 53 : 1291-1298.
Wang R. & Wang Y.Z., 2006. Invasion dynamics and potential spread of the invasive alien plant species Ageratina adenophora (Asteraceae) in China. Diversity and Distributions 12 : 397-408.
Wang R., Wang J.F., Qiu Z.J., Meng B., Wan F.H., & Wang Y.Z., 2011. Multiple mechanisms underlie rapid expansion of an invasive alien plant. New Phytologist 191 (3) : 828-839.
Webb C.J., 1987. Checklist of dicotyledons naturalised in New Zealand, 18 – Asteraceae (Compositae), subfamily Asteroideae. New Zealand Journal of Botany 25 : 489-501.
Weber E., 2003. Invasive plant species of the world: a reference guide to environmental weeds. CABI, Wallingford, UK.
Weber E. & Gut D., 2004. Assessing the risk of potentially invasive plant species in central Europe. Journal for Nature Conservation 12 (3) : 171-179.
Sites internet
CABI. 2022. CABI Compendium. Wallingford, UK : CAB International. https://doi.org/10.1079/cabicompendium.23243.
Conservatoire botanique national méditerranéen, 2023. Simethis – module Flore [online], http://simethis.eu (accédé le 06/01/2023).
Menéndez Valderrey J.L., 2021. Ageratina adenophora. En asturnatura.com [en línea] Num. 834, 22/03/2021 [consultado el 12/2/2023].
Nesom, G.L. 1993. Ageratina adenophora. In Flora of North America Editorial Committee (ed.), Flora of North America North of Mexico [online], 22+ vols, New York and Oxford, 3, http://floranorthamerica.org/Ageratina_adenophora [accessed 29/11/2022].
Plantas invasoras em Portugal, 2020. Ageratina adenophora. Accessible en ligne : https://invasoras.pt/en/invasive-plant/phytolacca-americana [accessed 29/11/2022].
USDA-ARS, 2004. Germplasm Resources Information Network (GRIN). Online Database. Beltsville, Maryland, USA: National Germplasm Resources Laboratory. https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearch.aspx.
Remerciements
Je tiens à remercier Henri Michaud et Cyril Cottaz (CBN méditerranéen de Porquerolles) pour l’envoi de littérature ancienne et Yohan Petit (CBN Corse) pour les informations sur le statut actuel de la plante en Corse.