Nuttallanthus canadensis (L.) D.A. Sutton (Plantaginaceae), une nouvelle espèce exogène pour la flore française
Title
Nuttallanthus canadensis (L.) D.A. Sutton (Plantaginaceae), a new alien species for the French flora
Résumé
Deux populations de Nuttallanthus canadensis (L.) D.A. Sutton (= Linaria canadensis (L.) Chaz.) ont été découvertes en 2023 dans les Landes. Il s’agit d’une espèce originaire de l’est de l’Amérique du Nord et apparentée aux linaires. La taxonomie de l’espèce, puis la chorologie et l’écologie des populations indigènes et exogènes sont présentées. Dans les Landes de Gascogne, N. canadensis se comporte comme une espèce pionnière acidiphile, méso- à mésohygrophile qui colonise les milieux interstitiels ouverts au sein de la pinède de production. L’origine et le risque d’invasion des populations landaises sont ensuite explorés.
Abstract
Two populations of Nuttallanthus canadensis (L.) D.A. Sutton (= Linaria canadensis (L.) Chaz.) were discovered in 2023 in the Landes department. It comes from eastern North America and belongs to the Linaria clade. Taxonomy, then chorology and ecology of indigenous and exogenous populations are described. In the Landes de Gascogne area, N. canadensis is a pioneer acidophilous, meso- to meso-hygrophilous species, inhabiting open interstitial habitats within the pine plantations. Finally, the origin and invasive potential of the Landes populations are explored.
L’introduction de plantes exogènes dans de nouvelles contrées est un phénomène mondial et croissant (e.g. Seebens et al., 2023). En Nouvelle-Aquitaine, 1 264 espèces vasculaires exogènes ont été recensées lors de l’état des lieux publié fin 2022, dont 793 actuellement subspontanées ou spontanées (Caillon et al., 2022). Un an plus tard, la liste s’est enrichie de 14 nouvelles plantes exotiques et de 11 nouvelles plantes probablement naturalisées (A. Caillon, comm. pers.) ; parmi celles-ci, deux populations de Nuttallanthus canadensis viennent d’être découvertes dans les Landes.
1. Contexte de la découverte
La communauté de communes des Grands Lacs (CCGL), située dans le nord-ouest du département des Landes, a lancé en 2022 un Atlas de la biodiversité communale (ABC). Le Conservatoire botanique national Sud-Atlantique (CBNSA) a alors planifié des prospections sur des secteurs déficitaires en connaissances pour contribuer à l’inventaire de la flore vasculaire.
Au cours d’une mission de terrain dans la pinède de production le 12 avril 2023, l’auteur a repéré une « linaire » qui ne semblait correspondre à aucune des espèces connues dans les plaines aquitaines. Les plantes étant alors au stade végétatif ou en bouton pour les plus avancées, quelques individus ont été prélevés pour mise en culture. Deux nouvelles visites ont été planifiées les 27 avril et 4 mai pour revoir les plantes en période de floraison (avec prélèvement de quelques spécimens pour mise en culture et en herbier), apprécier l’étendue de la station et son statut local.
L’habitus des individus fleuris a permis de confirmer leur affinité avec le genre Linaria Mill. Les recherches préliminaires au sein de ce genre ont abouti à des impasses, jusqu’à la proposition de Sandrine Loriot (CBNSA) du genre voisin Nuttallanthus D.A. Sutton, ce qui a permis ensuite à l’auteur d’établir l’identité de la plante : Nuttallanthus canadensis (L.) D.A. Sutton.
Le 31 mai 2023, une nouvelle localité, située à 5 km de la première, a été découverte par Anaëlle Deveaud (CBNSA), toujours dans le cadre des prospections contribuant à l’ABC de la CCGL.
2. Taxonomie
Nuttallanthus canadensis a été décrit par Linné (1753) dans le genre Antirrhinum L. qui correspondait alors pour l’essentiel à la tribu actuelle des Antirrhinae (Sutton, 1988). À partir de la fin du xviiie siècle (de Chazelles, 1790), l’espèce est généralement incluse dans le genre Linaria Mill., bien qu’occasionnellement rattachée à Anarrhinum Desf. (Desfontaines, 1798-1799 ; Poiret, 1810). Au xxe siècle, les Linaria désignent alors généralement les plantes à feuilles sessiles entières et inflorescence terminale en grappe.
Le genre Nuttallanthus a été créé par Sutton (1988) pour distinguer les linaires américaines des Linaria s.s. paléarctiques, sur la base de la morphologie de la corolle et des graines, avec les espèces suivantes :
- Nuttallanthus canadensis (L.) D.A. Sutton, Rev. Antirr. : 457 (1988), espèce type du genre ;
- Nuttallanthus floridanus (Chapm.) D.A. Sutton, Rev. Antirrh. : 461 (1988) ;
- Nuttallanthus texanus (Scheele) D.A. Sutton, Rev. Antirrh. : 460 (1988) ;
- Nuttallanthus subandinus (Diels) D.A. Sutton, Rev. Antirrh. : 459 (1988).
Au sein du genre, N. subandinus était traité initialement comme une bonne espèce (Sutton, 1988 ; Freeman, 1993+), mais est considéré comme synonyme de N. canadensis dans certains référentiels récents (POWO, 2023 ; WFO, 2023).
Les études génétiques récentes supportent la monophylie du groupe Linaria-Nuttallanthus, mais montrent que Nuttallanthus constitue un sous-groupe au sein du genre Linaria, ce qui rend ce dernier paraphylétique (Fernàndez-Mazuecos et al., 2013 ; Ogutcen & Vamosi, 2016 ; Yousefi et al., 2017). Les auteurs suggèrent de traiter Nuttallanthus comme une section de Linaria (sect. Lectoplectron Penn). Cette proposition implique que N. canadensis soit dénommé Linaria canadensis ; cette option est suivie actuellement en Europe (Marhold, 2011+) mais n’est pas appliquée dans son aire d’origine ni dans les principaux référentiels internationaux (e.g. POWO, 2023 ; WFO, 2023).
3. Nuttallanthus canadensis (L.) D.A. Sutton, Rev. Antirr. : 457 (1988)
- Antirrhinum canadense L., Sp. Pl. : 618 (1753).
- Linaria canadensis (L.) Chaz., Suppl. Dict. Jard. 2 : 42 (1790).
- Linaria canadensis var. typica Munz, Proc. Calif. Acad. Sci., ser. 4, 15 : 328 (1926).
- Anarrhinum canadense Poir., Encycl. [J. Lamarck et al.] Suppl. 1 : 334, in obs. (1810)
- Antirrhinum canadense var. assurgens Raf., Autik. Bot. : 155 (1840).
- Antirrhinum pauciflorum Poepp. ex Chav., Monogr. Antirrh. : 149 (1833).
- Antirrhinum stellatum Larrañaga, Escritos D.A., Larrañaga 2 : 191 (1923).
- Linaria canadensis f. albina Fernald, Rhodora 45 : 476 (1943).
- Linaria canadensis f. cleistogama Fernald, Rhodora 38 : 443 (1936).
- Linaria subandina Diels, Bot. Jahrb. Syst. 37 : 427 (1906).
- Nuttallanthus canadensis f. albinus (Fernald) G. Wilh. & Rericha, Michigan Bot. 55 (3-4) : 95 (2016).
- Nuttallanthus subandinus (Diels) D.A. Sutton, Rev. Antirrh. : 459 (1988).
3.1. Description (e.g. Pennell, 1919 ; Sutton, 1988 ; Freeman, 1993+ ; Crawford, 2003 ; Conn & Murray, 2015a)
Plante annuelle (à bisannuelle), glabre à faiblement glanduleuse-pubérulente dans l’inflorescence, pouvant atteindre 70 cm de hauteur. Rameaux hypocotylaires ± couchés-étalés, à feuilles verticillées sessiles, obovales à lancéolées (planche 1 : A) ; 1-4 (7) tiges fertiles dressées, habituellement uniques, parfois à rameaux axillaires chez les grands individus, à feuilles ± verticillées à la base puis alternes, (étroitement lancéolées à) linéaires, à L = 5-43 mm (planche 1 : B). Inflorescence dressée, en grappe terminale (planche 2 : A et B), contractée en bouton, s’allongeant fortement à la fructification, habituellement à poils glanduleux épars ≤ 0,1 mm. Bractées ovales à lancéolées de 1-7 mm. Pédicelles dressés de 2-5,5 mm (planche 2 : C). Calice à 5 lobes lancéolés de 2-3,5 mm, ± égaux. Fleurs chasmogames à corolle bilabiée, de 8-14 mm, blanche à lilas-violet (plantes landaises lilas ± pâle, à palais clair). Lèvre inférieure trilobée, à L = 2-4,5 mm ; lèvre supérieure bilobée, à L = 1,2-3 mm ; éperon étroit, à L = 2-7 mm et Ø = 0,4-0,6 mm à la base, courbé vers le bas à presque droit ; palais assez peu développé, fermant à peine le tube. 4 étamines didynames, incluses, à filet glabre. Stigmate capité. Capsule ± oblongue, 2-3,9 mm, glabre, à déhiscence poricide, par 4-5 valves. Nombreuses graines prismatiques grises à noires, à L = 0,3-0,5 mm ; 4-7 crêtes angulaires nettes et entières ; faces ± lisses ou à tubercules faibles.
Floraison plutôt printanière à estivale (voire tardi-estivale), à préciser pour les populations françaises.
Les plantes trouvées dans les Landes étaient assez variables, avec de grands individus (50-60 cm) présentant plusieurs tiges fertiles et de nombreux rameaux hypocotylaires, des individus chétifs à tige unique et rares fleurs cléistogames n’atteignant pas 10 cm, ainsi que tous les intermédiaires possibles. Le même morphocline a été documenté par Villard et al. (1988) au Québec, possiblement en lien avec la densité de la végétation (compétition intra- et interspécifique). La forme cleistogama a été formalisée par Fernald (1936) mais il semble que ces formes soient régulières dans le genre et ne présentent pas de valeur taxonomique particulière (Crawford, 2003).
3.2. Identification
Nuttallanthus canadensis présente un habitus caractéristique (photo 1) : fleurs chasmogames lilas à lèvre inférieure nettement plus grande que la supérieure, palais peu marqué, éperon étroit, graines anguleuses, etc.
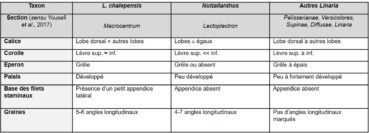
Les risques de confusion avec les autres linaires françaises sauvages paraissent faibles (tableau 1). L’espèce la plus proche est probablement Linaria chalepensis (L.) Mill., dont la forme de la corolle et les graines se rapprochent de celles de Nuttallanthus. Ce taxon occupe d’ailleurs une position phylogénique basale proche de Nuttallanthus au sein du clade Linaria (Fernàndez-Mazuecos et al., 2013 ; Yousefi et al., 2017). Toutefois L. chalepensis appartient à la section Macrocentrum D.A. Sutton, caractérisée par un calice à lobe dorsal court et un petit appendice latéral à la base des filets staminaux.
Au sein du genre Nuttallanthus, N. canadensis se distingue de N. floridanus par ses fleurs nettement éperonnées, plus courtement pédicellées (2-5,5 vs 6-14 mm), et le rachis droit (Sutton, 1988 ; Freeman, 1993+).
N. texanus, auparavant traité comme sous-espèce ou variété de N. canadensis, a des fleurs chasmogames un peu plus grandes (11-22 vs 8-14 mm ; éperon de 4,5-11 vs 2-7 mm) et une inflorescence parfois glabrescente (Sutton, 1988 ; Freeman, 1993+ ; Conn & Murray, 2015a). Les deux espèces sont toutefois régulièrement confondues, sans doute en partie du fait de l’évolution des traitements taxonomiques (inclusion infraspécifique ou distinction spécifique de N. texanus).
Enfin, N. canadensis présente des graines distinctes (planche 3) de celles de tous les autres taxons du genre (Sutton, 1988 ; Freeman, 1993+ ; Crawford, 2003), y compris N. subandinus : crêtes angulaires entières et bien marquées (vs dentées chez N. subandinus, plus ou moins arrondies chez N. floridanus et peu visibles à tuberculeuses chez N. texanus), faces lisses ou faiblement tuberculeuses (vs modérément à fortement tuberculeuses chez N. floridanus et N. texanus, les tubercules étant parfois plus ou moins confluents).
3.3. Chorologie
Nuttallanthus canadensis s.s. est originaire de l’est de l’Amérique du Nord, occupant la moitié orientale des États-Unis et le sud du Canada, de l’Ontario à la Nouvelle-Écosse (Sutton, 1998 ; USDA et al., 2023). L’espèce est fréquemment mentionnée ailleurs sur le continent américain, mais sa chorologie précise y est plus difficile à appréhender compte-tenu (e.g. Sutton, 1988 ; Freeman, 1993+ ; GBIF, 2023a, b ; USDA et al., 2023) i) de l’inclusion fréquente de N. texanus (ouest et sud de l’Amérique du Nord et possiblement Amérique du Sud tempérée) et N. subandinus (parties occidentales et tempérées de l’Amérique du Sud) au sein de N. canadensis ; ii) des confusions entre ces trois taxons ; iii) de la présence de plantes cultivées, occasionnelles et/ou naturalisées de N. canadensis au-delà de son aire d’indigénat.
L’espèce a aussi été introduite en Australie, en Extrême-Orient et en Russie ; des populations naturalisées existent ainsi :
– dans le sud-est de l’Australie au moins depuis le début du xxe siècle (ALA, 2023 ; Anonyme, 2023a) ; le genre Nuttallanthus semble être présent depuis le début des années 60, mais les données antérieures à 2001 sont majoritairement affectées à N. texanus (AVH, 2023), avec toutefois une ambiguïté sur le spécimen NSW823164, récolté en 1960 et attribué à N. texanus (AVH, 2023) ou à canadensis (Conn & Murray, 2015a) ;
– à partir de 1941 au Japon (Anonyme, 2023b) ;
– dans les environs de Moscou depuis la fin du xixe siècle (Petunnikov, 1900 et Mayorov et al., 2013 in Seregin, 2015).
Le statut de l’espèce en Chine est à préciser : non traitée dans la flore de Wu & Raven (1998), il existe des récoltes de 1950 et 2018 en milieu urbain, la seconde dans une friche (NPSRC, 2004-2020). N. canadensis a également été recensé comme occasionnel en Angleterre (J.G. Baker, 1880, in Groves, 1881 ; Dunn, 1905), Suède (Carl Blom, 1940, 1942, in Anonyme, 2023c) et Corée du Sud (Ji et al., 2012 ; Kim & Kil, 2016). Enfin, il existe d’autres signalements, mais de fiabilité incertaine, pour lesquels la présence de populations naturalisées et/ou l’identité spécifique serait à confirmer (voir par exemple l’analyse des limites des données issues des sciences participatives par López-Guillén et al., 2024).
3.4. Écologie
Dans son aire d’origine, Nuttallanthus canadensis colonise principalement les milieux herbacés et les boisements clairs des dunes et terrains sablonneux : prairies, boisements de conifères, bermes de routes, friches et terrains perturbés (Sutton, 1988 ; Freeman, 1993+ ; Crawford, 2003). Il peut également être adventice de cultures (Sutton, 1988 ; Crawford, 2003). Au Québec, l’espèce se retrouve dans des tourbières asséchées, brûlées ou défrichées et drainées à des fins agricoles (Raymond, 1950 ; Villard et al., 1988).
Une étude spécifique sur le microhabitat de l’espèce dans les tourbières des basses terres du Saint-Laurent (Villard et al., 1988) a montré que l’abondance de N. canadensis était liée à l’ouverture du couvert végétal et à la présence de sol nu. Il est considéré comme une espèce des sols pauvres et tolérant de fortes variations hygrométriques ; peu concurrentiel, il bénéficie des perturbations (feu, défrichement) qui permettent l’ouverture du milieu et est généralement associé aux stades pionniers et intermédiaires des successions écologiques.
Les populations naturalisées en Eurasie et Australie colonisent des terrains plus ou moins perturbés et anthropisés : bermes de routes, voies ferrées, servitude de lignes électriques, friches urbaines, pépinière, cultures, carrière réhabilitée, etc. (Syreishchikov & Petunnikov, 1906 ; NPSRC, 2004-2020 ; Ji et al., 2012 ; Conn & Murray, 2015b ; Anonyme, 2023b ; Blom, 1940, 1942, in Anonyme, 2023c ; AVH, 2023). En Russie, N. canadensis habite aussi les tourbières anciennement exploitées, soit une niche semblable à celle occupée au Québec ; le développement de l’exploitation a ensuite favorisé son expansion sur les sols sableux nus des bermes de pistes et pare-feu alentours (Seregin et al., 2012 ; Seregin, 2015).
4. Populations landaises
4.1. Localisation
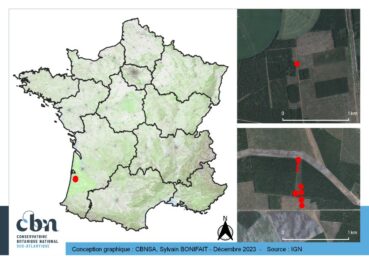
Nuttallanthus canadensis a été découvert à Ychoux, dans le département des Landes, au sein des Landes de Gascogne (carte 1). La première localité se trouve au lieu-dit « Montendreau » et la seconde au nord du « Crot du Parc ». Le contexte paysager est celui de la pinède de production, qui consiste en une mosaïque de cultures intensives de Pin maritime (Pinus pinaster Aiton) à différents stades d’exploitation, avec des formations semi-naturelles (pelouses, landes, etc.) dans les espaces interstitiels (layons, pare-feu, etc.). De grandes cultures céréalières (Maïs notamment) sont également présentes à proximité.
4.2. Habitat
Les habitats colonisés dans les Landes correspondent aux préférences de l’espèce : milieux ouverts (pelouses, landes et pinèdes claires) sur sols sablonneux. Nuttallanthus canadensis a ainsi été observé sur des layons forestiers, bordures de pistes et jeunes pinèdes ; de manière plus marginale, quelques pieds ont aussi été notés dans des pinèdes plus âgées.
Le substrat est constitué par les formations fluvio-éoliennes du Sable des Landes, avec des sols podzoliques hydromorphes (Platel & Dubreuilh, 1991). Le contexte édaphique local est oligo- à oligomésotrophe, acide et mésohydrique, avec un battement de nappe plus ou moins marqué selon les années et la proximité avec les drains des cultures proches.
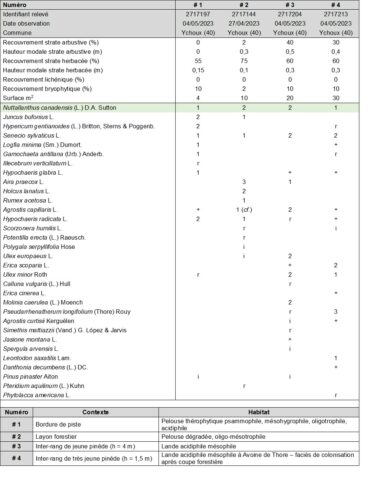
Quelques relevés phytosociologiques ont été réalisés dans la première localité, sur différents habitats (tableau 2 ; planches 4 et 5). Parmi les espèces compagnes notées, Senecio sylvaticus L. est l’espèce la plus fréquente. Sa présence constante dans les relevés permet de supposer une écologie locale proche, bien que N. canadensis tolère une plus forte hygrométrie.
Sur la base des stations landaises, qui concordent avec les indications de la littérature, N. canadensis apparaît donc comme un taxon pionnier psammophile, acidiphile, oligotrophile, mésohygro- à mésophile.
4.3. Abondance
Les stations n’ont pas fait l’objet de recensements précis, mais les effectifs sur la première localité dépassaient le millier d’individus. Sachant qu’il existe une seconde localité à 5 km et que les stations n’ont pas été délimitées en totalité, la population est potentiellement encore plus importante.
Comme de nombreuses thérophytes, Nuttallanthus canadensis peut présenter de fortes variations interannuelles d’abondance (Crawford, 2003).
5. Statut local
5.1. Mode d’introduction
Nuttallanthus canadensis est une espèce cultivée de longue date, signalée dans les ouvrages spécialisés anciens (e.g. de Chazelles, 1790 ; Dumont de Courset, 1802). Elle est commercialisée couramment en Amérique du Nord à des fins ornementales, mais a aussi été cultivée en Europe (Chater et al., 1972). Les populations naturalisées sont sans doute principalement d’origine horticole et secondairement issues du transport involontaire de graines (Randall, 2017), la dispersion anthropique directe ou indirecte apparaissant ainsi comme un important facteur d’expansion.
En France, l’espèce est citée dans les anciens ouvrages horticoles mais ne semble pas avoir signalée à l’état sauvage. Les principaux fournisseurs actuels semblent toutefois privilégier d’autres linaires ornementales (e.g. Linaria maroccana Hook. f., L. dalmatica (L.) Mill., L. purpurea (L.) Mill., etc., sous forme de divers cultivars).
N. canadensis a été cultivé au Jardin botanique de Talence (Gironde) en 1932, à partir de semences en provenance du Jardin botanique de Lexington (Massachusetts, USA), mais n’y a pas été cultivé ultérieurement ni proposé dans les Index seminum (Alain Badoc, comm. pers.). Les plantes récoltées à Talence ont été intégrées dans l’herbier d’Edmond-Jean Neyraut (MPU987687 ; planche 6).
Le mode d’introduction des populations landaises n’est pas connu avec certitude, aucune source évidente n’ayant pu être identifiée. Les éléments présentés ci-dessus permettent toutefois de supposer une origine horticole. L’ancienneté de l’introduction est difficile à évaluer : ailleurs, certaines populations n’ont été qu’occasionnelles ou sont demeurées relativement circonscrites tandis que d’autres se sont étendues. Comme il ne semble pas exister d’autre population sauvage actuellement en Europe de l’Ouest, l’implantation de Nuttallanthus canadensis est peut-être relativement récente (le hiatus temporel et spatial avec la culture du Jardin botanique de Talence ou avec les autres données européennes paraît trop important pour envisager un lien).
5.2. Risque d’invasion
Une pré-évaluation (Annexe 1) de l’espèce, suivant la méthode d’analyse proposée par Weber & Gut (2004), montre l’intérêt d’appréhender plus précisément le risque de prolifération de N. canadensis. L’analyse subséquente (Annexe 2) reprend le questionnaire de Weber & Gut (2004), adapté au niveau régional pour la rubrique n° 9 « Mode de dispersion » (Caillon et al., 2022). Nuttallanthus canadensis obtient un score de 22, indiquant un risque modéré de devenir une espèce exotique envahissante, susceptible de menacer la biodiversité locale.
Sachant qu’il existe deux stations de N. canadensis distantes de 5 km et que celles-ci n’ont pas été délimitées en totalité, il est possible de supposer une implantation plus importante que ce qui est rapporté ici. L’espèce présente une productivité importante ; les graines sont barochores (Crawford, 2003), mais petites, ce qui facilite leur transport par l’homme ou le bétail (Randall, 2017). Dans les Landes, l’étendue de la première population, sur plusieurs centaines de mètres, correspond probablement à une expansion naturelle progressive. Le secteur est toutefois assez fortement fréquenté – et labouré – par le Sanglier, ce qui pourrait faciliter une dispersion à plus grande distance ; de même, une dispersion par les engins d’exploitation forestière peut être attendue.
Il existe de fortes similitudes entre les habitats de N. canadensis dans son aire indigène et exogène avec les habitats des Landes de Gascogne, compte-tenu de l’existence de milieux sablonneux (cf. populations est-américaines ou australiennes), tourbeux et paratourbeux (cf. populations québécoises ou russes).
Cette proximité écologique se traduit aussi par la présence sur certaines stations d’espèces compagnes connues dans les Landes de Gascogne. Par exemple, l’une des stations australiennes correspond à une prairie sablonneuse en bord de route, avec Briza minor L. et Aira caryophyllea L. (AVH, 2023). Au Québec, Chenopodium album L. et Dichanthelium implicatum (Scribn.) Kerguélen sont associés aux populations de N. canadensis installées sur des friches en bordure de champs cultivés sur des enclaves tourbeuses (Villard et al., 1988). Les trois dernières espèces sont fréquentes sur le massif landais, B. minor étant également présente, mais plus localisée.
Malgré la découverte récente donc l’absence de suivi à moyen terme, l’observation des populations landaises en 2023 montre une intégration apparemment réussie dans le cycle sylvicole de la pinède de production : l’espèce profite des coupes forestières et jeunes plantations, ainsi que du réseau de layons et pistes sablonneuses, ce qui laisse présager un potentiel d’expansion notable au sein des Landes de Gascogne, à moins qu’il n’existe des facteurs limitants non identifiés. Une colonisation des sols organiques de milieux plus ou moins tourbeux, ainsi que des milieux plus anthropisés comme les friches et cultures existant alentour semble également possible.
Une surveillance de l’évolution des populations permettrait de préciser les possibilités d’expansion de l’espèce et le cas échéant, un éventuel risque d’invasion.
ANNEXE
Réponses et scores correspondants en gras
1. Pré-évaluation du risque d’invasion (Weber & Gut, 2004)
Identité : Nuttallanthus canadensis (L.) D.A. Sutton
→ Est-ce que l’espèce est présente dans le territoire ? Oui
→ Est-ce que l’espèce est largement présente dans le territoire ? Non
→ Est-ce que l’espèce fait l’objet de régulations (contrôles, quarantaines) ? Non
→ Est-ce que l’espèce est arrivée récemment ? Oui ?
→ Est-ce que l’espèce est uniquement une adventice de terrains cultivés ? Non
- Espèce à évaluer
2. Évaluation du risque d’invasion (Weber & Gut, 2004, adapté par Caillon et al., 2022)
1. Correspondance climatique : l’aire géographique connue de l’espèce comprend-elle des zones éco-climatiques similaires avec celles de la zone à risque ?
→ Oui – 2 (Kottek et al., 2006 ; GBIF, 2023a).
2. Statut du taxon en Europe : le taxon est-il indigène en Europe ?
→ Non – 2 (Sutton, 1988).
3. Distribution géographique en Europe : dans combien de pays le taxon est-il présent ?
→ 1 – 1 (Seregin, 2012 ; Mayorov et al., 2013).
4. Distribution mondiale : quelle est l’ampleur de l’aire de répartition mondiale (indigène et exogène) du taxon ?
Répartition mondiale grande (plus de 15° de longitude ou latitude) ou couvrant plus d’un continent – 3 (GBIF, 2023a ; cf. chapitre 3.3 Chorologie).
5. Connaissance du taxon comme exotique envahissant : le taxon a-t-il été signalé comme exotique envahissant ailleurs ?
→ Non ? – 0
NB. Le caractère a priori peu envahissant signalé par certaines sources (Groves et al., 2003 ; Randall, 2017) est peut-être à relativiser compte-tenu des limites de distinction entre N. canadensis et N. texanus, du caractère relativement récent de certaines populations et/ou des informations disponibles limitées sur le caractère envahissant des populations naturalisées.
6. Taxonomie : le taxon a-t-il des congénères envahissants ?
→ Oui – 2 (Randall, 2017).
7. Reproduction et viabilité des graines : de manière approximative, combien de semences produit un individu de la plante ?
→ Beaucoup de semences – 3 (obs. pers. ; Crawford, 2003).
8. Croissance végétative : quel type de multiplication végétative la plante pratique-t-elle ?
→ Pas de multiplication végétative – 0 (e.g. Crawford, 2003)
9. Mode de dispersion : quel est mode de dispersion du taxon ?
→ Barochorie & zoochorie – 4 (Crawford, 2003 : Randall, 2017).
10. Type biologique : quel est le type biologique du taxon ?
→ Thérophyte de petite taille (< 80 cm) – 0 (Sutton, 1988).
11. Habitat : quel habitat colonise le taxon ?
→ Prairie sèche & autre – 3 (cf. chapitres 3.4 Ecologie & 4.2 Habitat).
12. Densité de population : quelle est l’abondance locale du taxon ?
→Individus formant occasionnellement des noyaux de forte densité – 2 (obs. pers.).
- Score final : 22 = risque modéré.
Bibliographie
ALA, 2023. Nuttallanthus canadensis (L.) D.A. Sutton. Atlas of Living Australia [21/11/2023], https://bie.ala.org.au/species/https://id.biodiversity.org.au/node/apni/2917158.
Anonyme (CHAH), 2023a. Nuttallanthus canadensis (L.) D.A. Sutton. In CANBR, ANBG, ANH & ABRS, Australian Plant Census. [21/11/2023], https://id.biodiversity.org.au/instance/apni/717665.
Anonyme, 2023b. Nuttallanthus canadensis. In NIES, Invasive Species of Japan [21/11/2023], https://www.nies.go.jp/biodiversity/invasive/DB/detail/81480e.html.
Anonyme, 2023c. Sweden’s Virtual Herbarium: Specimen list [21/11/2023], http://herbarium.emg.umu.se/index.html.
AVH, 2023. The Australasian Virtual Herbarium. Council of Heads of Australasian Herbaria [24/11/2023], https://avh.chah.org.au.
Caillon A. (coord.), Bonifait S., Chabrol L., Dao J., Leblond N. & Ragache Q., 2022. Liste hiérarchisée des plantes exotiques envahissantes de Nouvelle-Aquitaine. Conservatoire botanique national Sud-Atlantique (coord.), Conservatoire botanique national du Massif central et Conservatoire botanique national des Pyrénées et de Midi-Pyrénées, 116 p. + annexes.
Chater A.O., Valdès B. & Webb D.A, 1972, Linaria. In T.G. Tutin, V.H. Heywood, N.A. Burges, D.M. Moore, D.H. Valentine, S.M. Walters & D.A. Webb (eds), Flora Europaea, 3 – Diapensiaceae to Myoporaceae, Cambridge University Press, Cambridge, xxxii + 381 p.
Chazelles L. (de)., 1790. Supplément au dictionnaire des jardiniers, II. Claude Lamort, Metz, 770 p.
Conn B.J. & Murray L.J., 2015a. An additional introduced species of Nuttallanthus (Plantaginaceae) in Australia. Telopea 18 : 145-149.
Conn B.J. & Murray L.J., 2015b. Nuttallanthus canadensis (L.) D.A. Sutton. In PlantNET (The NSW Plant Information Network System), Royal Botanic Gardens and Domain Trust [28/11/2023], https://plantnet.rbgsyd.nsw.gov.au/cgi-bin/NSWfl.pl?page=nswfl&lvl=sp&name=Nuttallanthus~canadensis.
Crawford P.T., 2003. Biosystematics of North American species of Nuttallanthus (Lamiales). University of Oklahoma, 133 p.
Desfontaines R., 1798-1799. Flora Atlantica, sive Historia plantarum quae in Atlante, agro Tunetano et Algeriensi crescunt, II. L.G. Desgranges, Paris, 458 p.
Dumont de Courset G.L.M., 1802. Le botaniste cultivateur, II. J.J. Fuchs, Paris, 828 p.
Dunn S.T., 1905. Alien flora of Britain. West, Newman & Co, London, 208 p.
Fernald M.L., 1936. Plants from the outer coastal plain of Virginia. Rhodora 38 : 376-452.
Fernàndez-Mazuecos M., Blanco-Pastor J.L. & Vargas P., 2013. A phylogeny of toadflaxes (Linaria Mill.) based on nuclear internal transcribed spacer sequences: systematic and evolutionary consequences. International Journal of Plant Sciences 174 (2) : 234-249.
Freeman C.C., 1993+. Nuttallanthus. In Flora of North America Editorial Committee (ed.), Flora of North America North of Mexico [online] 17, New York & Oxford, [08/09/2023], http://floranorthamerica.org/Nuttallanthus.
GBIF, 2023a. Nuttallanthus canadensis (L.) D.A. Sutton. Global Biodiversity Information Facility Backbone Taxonomy. [21/11/2023], https://doi.org/10.15468/39omei.
GBIF, 2023b. Nuttallanthus texanus (Scheele) D.A. Sutton. Global Biodiversity Information Facility Backbone Taxonomy. [21/11/2023], https://doi.org/10.15468/39omei.
Groves J., 1881. Report of the distributor for 1880. Botanical Exchange Club of the British Isles : 27-42.
Groves R.H., Hosking J.R., Batianoff G.N., Cooke D.A., Cowie I.D., Johnson R.W., Keighery G.J., Lepschi B.J., Mitchell A.A., Moerkerk M., Randall R.P., Rozefelds A.C., Walsh N.G. & Waterhouse B.M., 2003. Weed categories for natural and agricultural ecosystem management. Bureau of Rural Sciences, Canberra, 194 p.
Ji S.-J., Yang J.-C., Jung S.-Y., Chang C., Park S.-H., Kang Y.-S., Oh S.-H. & Lee Y.-M., 2012. Two newly naturalized plants in Korea: Nuttallanthus canadensis (L.) D.A. Sutton and Lamium purpureum var. hybridum (Vill.) Vill. Korean Journal of Plant Taxonomy 42 (1) : 91-97.
Kim C.G. & Kil J., 2016. Alien flora of the Korean Peninsula. Biological Invasions 18 : 1843–1852.
Kottek M., Grieser J., Beck C., Rudolf B. & Rubel F., 2006. World Map of Köppen-Geiger climate classification updated. Meteorologische Zeitschrift 15 (3) : 259-263.
Linné C., 1753. Species plantarum, exhibentes plantas rite cognitas, ad genera relatas, cum differentiis specificis, nominibus trivialibus, synonymis selectis, locis natalibus, secundum systema sexuale digestas. Holmiæ, Impensis Laurentii Salvii, 1 232 p.
López-Guillén E., Herrera I., Bensid B., Gómez-Bellver C., Ibáñez N., Jiménez-Mejías P., Mairal M., Mena-García L., Nualart N., Utjés-Mascó M. & López-Pujol J, 2024. Strengths and challenges of using iNaturalist in plant research with focus on data quality. Diversity 16 (42) : 1-22.
Marhold K., 2011+. Linaria. In Euro+Med, Euro+Med Plantbase. the information resource for Euro-Mediterranean plant diversity [09/11/2023], http://www.europlusmed.org.
Mayorov S.R., Bochkin V.D., Nasimovich Yu.A. & Shcherbakov A.V., 2013. Adventivnaya flora Moskvy i Moskovskoi oblasti [Alien Flora of Moscow and Moscow Oblast]. KMK, Moscow.
NPSRC, 2004-2020. Chinese Virtual Herbarium [28/11/2023], https://www.cvh.ac.cn/index.php.
Ogutcen E. & Vamosi J.C., 2016. A phylogenetic study of the tribe Antirrhineae: genome duplications and long-distance dispersals from the Old World to the New World. American Journal of Botany 103 : 1-11.
Pennell F.W., 1919. Scrophulariaceae of the local flora, II. Torreya 19 (8) : 143-152.
Petunnikov A.N., 1900. A critical review of the Moscow flora, 2 – Gamopetalae. Trudy S.-Peterburgskago Obshchestva Estestvoispytateleĭ: Otdelenie Botaniki 30 (3) : 21-162.
Platel J.-P. & Dubreuilh J., 1991. Notice explicative, carte géologique de la France (1/50000), feuille Parentis-en-Born (874). BRGM, Orléans, 63 p. [carte géologique par J.-P. Platel].
Poiret J.L.M., 1810. In J.-B. Lamarck (dir.), Encyclopédie méthodique, botanique, suppl. 1, Agasse, Paris, 761 p.
POWO, 2023. Plants of the World Online. The International Plant Names Index and World Checklist of Vascular Plants. Royal Botanic Gardens, Kew [08/09/2023], http://www.plantsoftheworldonline.org/.
Randall R.P., 2017. A Global Compendium of Weeds, 3rd ed. Perth, 3 653 p.
Raymond M., 1950. Esquisse phytogéographique du Québec. Mémoires du Jardin botanique de Montréal 5 : 1-147.
Seebens H., Meyerson L.A., Rahlao S.J., Lenzner B., Tricarico E., Aleksanyan A., Courchamp F., Keskin E., Saeedi H., Tawake A. & Pyšek P., 2023. Trends and status of alien and invasive alien species. In H.E. Roy, A. Pauchard, P. Stoett & T. Renard Truong (eds), Thematic Assessment Report on Invasive Alien Species and their Control, Chapter 2, IPBES secretariat, Bonn, 264 p.
Seregin A.P., 2015. Expansions of plant species to the Flora of Vladimir Oblast (Russia) in the last decade. Second Report. Russian Journal of Biological Invasions, 6 (3) : 202-221.
Seregin A.P. (coord.), Borovichev E.A., Glazunova K.P., Kokoshnikova Y.S. & Sennikov A.N., 2012. Flora of Vladimir Oblast, Russia: checklist and atlas. Grif i K, Tula, 620 p.
Syreishchikov D.P. & Petunnikov A.N., 1906. Illiustrirovannaia flora Moskovskoi gubernii. Torgovago Doma Lakhtin, Syreishchikov i Ko, 1 337 p.
Sutton D.A., 1988. A revision of the tribe Anthirrhineae. Oxford University Press, London & Oxford, 575 p.
USDA, ARS & NPGS, 2023. Germplasm Resources Information Network (GRIN Taxonomy). National Germplasm Resources Laboratory, Beltsville, Maryland [21/11/2023], https://npgsweb.ars-grin.gov/gringlobal/taxon/
taxonomydetail?id=409898.
Villard M.-A., Jean M. & Bouchard A., 1988. Microhabitat du Linaria canadensis (Scrophulariaceae) dans le Haut-Saint-Laurent (Québec). Canadian Journal of Botany 66 : 1142-1147.
Weber E. & Gut D., 2004. Assessing the risk of potentially invasive plant species in central Europe. Journal for Nature Conservation 12 : 171-179.
WFO, 2023. World Flora Online [08/09/2023], http://www.worldfloraonline.org.
Wu Z.Y. & P.H. Raven (eds), 1998. Flora of China, 18 – Scrophulariaceae through Gesneriaceae). Science Press, Beijing & Missouri Botanical Garden Press, St. Louis, 450 p.
Yousefi N., Heubl G. & Zarre S., 2017. Subgeneric classification of Linaria (Plantaginaceae; Antirrhineae): molecular phylogeny and morphology revisited. Progress in Biological Sciences 7 (1) : 53-65.
Remerciements
La découverte de N. canadensis a été effectuée au cours d’inventaires floristiques réalisés par le Conservatoire botanique national Sud-Atlantique dans le cadre de la contribution à l’ABC de la Communauté de communes des Grands Lacs (Landes). L’auteur remercie tout particulièrement Craig C. Freeman (Université du Kansas, U.S.A.) pour son aide bibliographique et son avis sur l’identification, Alain Badoc (Jardin botanique universitaire de Talence), Aurélien Caillon (CBNSA) et Jean-Marc Tison pour la relecture attentive du manuscrit et leur expertise respective sur la culture de N. canadensis au JBT, le risque d’invasion et l’identification. Merci également aux collègues du CBNSA consultés au cours de l’étude (Pauline Delbosc, Anaëlle Deveaud, Nicolas Leblond, Sandrine Loriot, Cécile Pontagnier).