Stachys maritima en Corse : état des connaissances en 2024
Title
Stachys maritima in Corsica: state of knowledge in 2024
Résumé
Stachys maritima Gouan (Lamiaceae) est en Corse un taxon rare, mais non protégé. Il est en déclin sur l’ensemble de son aire de présence (rive nord de la Méditerranée et pourtour de la mer Noire). Il constitue des groupements pionniers dans les milieux littoraux ouverts : cordons sableux, dunes, embouchures de ruisseaux ou d’étangs, entre 0 et 10 m d’altitude. Un bilan stationnel, réalisé entre 2021 et 2024, montre qu’il ne comprend, en Corse, que quatre sous-populations de plusieurs individus : plage au sud du port de Taverna et Asciaghju, sur la côte est de l’île, Mare è Sole et Saleccia sur la côte ouest. Deux autres sous-populations (Peru et Chiuni, sur la commune de Cargèse) semblent avoir disparu. Vingt-six autres sous-populations ont également été signalées sur l’île depuis 1822, mais elles ne sont constituées que d’un ou quelques individus et ne sont pas observées tous les ans. Seules trois d’entre elles ont été retrouvées (Pineto, Palombaggia et Mezzanu). Le nombre total d’individus est estimé à un millier, sur une superficie d’un peu plus d’un hectare.
Abstract
Stachys maritima Gouan (Lamiaceae) is a rare but unprotected taxon in Corsica. It is in decline throughout its range (northern Mediterranean and Black Sea shores). It forms pioneering communities in open coastal environments: sandy strips, dunes, mouths of streams and ponds, between 0 and 10 m. A station assessment carried out between 2021 and 2024 shows that it comprises only four sub-populations of several individuals in Corsica: the beach south of the port of Taverna and Asciaghju on the island’s east coast, and Mare è Sole and Saleccia on the west coast. Two other sub-populations (Peru and Chiuni, in the Cargèse commune) seem to have disappeared. Twenty-six other sub-populations have also been reported on the island since 1822, but they consist of only one or a few individuals and are not observed every year. Only three of them were found (Pineto, Palombaggia and Mezzanu). The total number of individuals is estimated at a thousand, over an area of just over one hectare.
1. Introduction
Le genre Stachys appartient à la famille des Lamiaceae Martinov, 1820. Il s’agit d’un genre des régions tempérées et chaudes d’environ trois cents espèces, dont une quinzaine est présente en France (Tison & de Foucault, 2014). Nous nous intéresserons dans cette étude à l’épiaire maritime (Stachys maritima Gouan, 1764). Cette plante est présente sur la rive nord de la Méditerranée et sur le pourtour de la mer Noire. Inféodée au littoral sableux, elle est en déclin dans tout le bassin méditerranéen. Elle est présumée disparue en Algérie et en Tunisie. Elle a perdu près de 99 % de son aire d’occurrence en Espagne (Massó et al., 2016) et sa situation sur le littoral méditerranéen français est tout aussi préoccupante (Ugo, 2019 ; Ugo et al., 2023).
Le taxon n’est pas protégé au niveau national et ne figure pas dans le tome 1 du Livre rouge (Olivier et al., 1995). Par contre, il est protégé au niveau régional en région Languedoc-Roussillon et en région Provence-Alpes-Côte-d’Azur. En Corse, il ne fait l’objet d’aucune réglementation, mais est inscrit sur la liste des espèces déterminantes de l’inventaire ZNIEFF (zones naturelles d’intérêt écologique, faunistique et floristique). Enfin, il a été évalué en « EN » (« en danger ») dans la Liste rouge des espèces menacées en France (UICN France et al., 2018) et en VU (« vulnérable ») dans la Liste Rouge régionale de la flore vasculaire de Corse (Delage & Hugot, 2015).
En 2021, le Conservatoire botanique national de Corse (CBNC), dans le cadre de la rédaction de la stratégie régionale de conservation pour la flore de Corse (Piazza et al., 2021), a réalisé une hiérarchisation des taxons selon trois critères : la rareté biogéographique, la rareté locale et les menaces (vulnérabilité de l’habitat et artificialisation). L’application de ces critères à l’ensemble des taxons de la flore corse (hors taxons exotiques) a permis d’attribuer une note à chacun d’entre eux, allant de 15 pour les taxons à enjeu de conservation le plus fort à 3 pour les taxons à enjeu de conservation le plus faible. Stachys maritima a obtenu, en l’état des connaissances en 2021, une note de vulnérabilité de 11 sur 15 (score de 2 pour la rareté biogéographique, de 4 pour la rareté locale, soit 12 mailles de présence de 5 × 5 km et de 5 pour la menace liée à la vulnérabilité/artificialisation de l’habitat). Il se classe, selon la méthodologie retenue, dans la catégorie d’enjeu « fort » sur l’île. Dans les étapes ultérieures de la stratégie, une action a été définie pour chaque taxon prioritaire de la stratégie régionale de conservation (c’est-à-dire pour les taxons à enjeu « fort », à score compris entre 9,5 et 11,29 et les taxons à enjeu « très fort », à score compris entre 11,3 et 15) (Piazza et al., 2022). Pour Stachys maritima, un « bilan stationnel » (Note 1) a été préconisé. Ce travail a été réalisé de 2021 à 2024. Il a eu pour objectifs de rechercher et de vérifier l’état de ses sous-populations dans les différentes localités où il a été signalé.
Après une présentation de la méthodologie dans la première partie de l’article, nous ferons dans la seconde partie un état des lieux des connaissances sur le taxon et nous présenterons dans la dernière partie les résultats de la campagne de terrain 2021-2024.
2. Méthodologie
Périodes de prospection. Le travail de terrain a été initié en septembre 2021 et s’est poursuivi jusqu’en mars 2024. Les prospections des différents sites ont été effectuées par Guilhan Paradis et Carole Piazza (CBNC) sur les sites de Peru et de Chiuni en 2022 et 2023, par Dominique Orsucci et C. Piazza sur le site de Figaretto et par C. Piazza sur les autres sites.
Localisation et cartographie des stations. Nous nous sommes appuyés sur la base de données floristiques Simethis, créée par le Conservatoire botanique national méditerranéen de Porquerolles et à laquelle le Conservatoire botanique national de Corse est associé (abrégé en « BDD-CBNC » dans le texte), sur la bibliographie et sur la consultation d’herbiers en ligne, dont l’herbier des Conservatoire et jardin botaniques de la ville de Genève (abrégé en « CBJ ville de Genève » dans le texte) et l’herbier de Zurich, pour la recherche des stations « historiques », c’est-à-dire anciennement connues. Toutes, à l’exception de celle signalée sur l’île Piana (Cerbicale), ont été visitées. Quelques sites potentiellement favorables à la présence du taxon et/ou situés dans la continuité de stations existantes ont également été prospectés. Chaque individu ou groupe d’individus observés a été pointé au GPS de façon à établir une cartographie précise de la répartition du taxon sur ses différents sites de présence (planches 7, 10, 13, 16 et 20).
Étude démographique et évolution des sous-populations. Le nombre d’individus a été compté dans chacune des sous-populations. De plus, afin d’améliorer les connaissances sur la biologie, l’écologie de l’espèce et sur la structure et la dynamique des populations, un site témoin a été retenu pour réaliser un suivi régulier, entre septembre 2021 et janvier 2024. Il s’agit du site de Mare è Sole, sur la côte ouest de l’île, dans le golfe d’Ajaccio. Sur ce site, la population a été dénombrée lors de chacun des passages et chaque individu a été décrit : diamètre, phénologie (pied fleuri, pied non fleuri, plantule avec ses deux cotylédons) (figure 2). Les espèces compagnes ont été notées, ainsi que les conditions écologiques, l’état du site et les éventuels impacts, tant d’origine anthropique que naturelle, pouvant affecter la station. Enfin, concernant la sous-population de Figaretto, constituée d’un individu unique, un suivi photographique a été réalisé par l’une de nous (Dominique Orsucci) entre le 19/04/2022 et le 02/11/2023, date où le pied s’est desséché (cf. annexe).
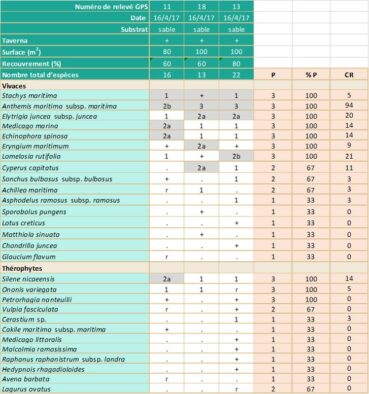
Relevés phytosociologiques. La description de la végétation se base sur quinze relevés, réalisés suivant la méthode phytosociologique sigmatiste (Géhu & Rivas-Martínez, 1981). Les divers relevés sont groupés dans les tableaux 1, 3 et 4. Les coefficients de recouvrement (CR) ont été calculés en suivant la pratique habituelle (Vanden Berghen, 1982 ; Géhu, 2006 ; Note 2). Les espèces ont été déterminées avec les flores de Coste (1906), de Jeanmonod & Gamisans (2013), de Tison & de Foucault (2014) et de Pignatti (2017). La nomenclature suit TaxRef v. 16 (Gargominy et al., 2022).
La nomenclature syntaxonomique est, en général, celle du Prodrome des végétations de France abrégé en PVF1 (Bardat et al., 2004) et celle de Reymann et al. (2016). La nomenclature des habitats suit CORINE Biotopes abrégé en CORINE B (Devillers et al., 1991 ; ENGREF, 1997), EUNIS (CBNC, 2016) et, dans quelques cas, le Manuel d’interprétation des habitats de l’Union européenne abrégé en EUR 28 (Anonyme, 1999 ; Anonymous, 2007).
Les supports topographiques utilisés ont été les cartes au 1 : 25 000 (IGN, 2019) et les photos aériennes (IGN/CdC, 2019).
3. Présentation de Stachys maritima
3.1. Taxonomie, caryologie et synonymes
Taxonomie : Stachys maritima Gouan, 1764 (Gargominy et al., 2022)
Caryologie : 2n = 34 (Aydin, 1978 ; Koeva-Todorovska, 1988)
Synonymes : Stachys maritima L., 1767 ; Stachys annua subsp. maritima Bonnier & Layens, 1894.
3.2. Description morphologique (planches 1 à 5)
Plante vivace de 10 à 40 cm de haut, « à souche épaisse émettant de nombreuses tiges étalées ascendantes » (Coste, 1906). L’épiaire maritime est considérée comme une hémicryptophyte (Jeanmonod & Gamisans, 2013), une hémicryptophyte scapeuse (de Bolòs & Vigo, 1995), une hémicryptophyte rampante et chaméphyte, à rhizome épais et tenace (Gonard, 2015) ou une hémicryptophyte/chaméphyte (Tison & de Foucault, 2014). Le système souterrain comprend une longue racine pivotante, orthotrope, plus ou moins épaisse, d’où partent de nombreuses racines secondaires, et, au haut de la racine pivotante, une courte tige orthotrope, assez épaisse. Les tiges aériennes (feuillées et florifères) sont issues des bourgeons de cette tige orthotrope. Les bourgeons les plus bas émettent des tiges d’abord souterraines et plagiotropes, qui deviennent aériennes et de direction oblique. Les bourgeons les plus hauts émettent des tiges feuillées quasiment verticales. Dans leurs parties proches de la tige orthotrope, les rameaux plagiotropes sont tomenteux-blanchâtres et émettent des racines, assurant à la plante un bon ancrage dans le sol, lui permettant ainsi d’assez bien résister au déchaussement et à de légers ensablements. Cette stratégie permet à la plante de se stabiliser dans un écosystème parfois mobile. L’ensemble des tiges aériennes florifères forme une touffe plus ou moins étalée sur le sable. Feuilles opposées-décussées, les inférieures à limbe ovale à elliptique-oblong, de 2-8 cm × 0,6-3 cm, mollement velu sur les deux faces, finement crénelé, à nervation réticulée, généralement atténué à la base en un pétiole très velu, de 1 à 6 cm de long. Inflorescences en épis compacts à plusieurs verticilles de 4-6 fleurs hermaphrodites, zygomorphes, d’un jaune très pâle, discrètement ponctuées de pourpre. Calice de 6-8,5 mm, tomenteux-blanchâtre, tubuleux en cloche, à dents triangulaires-aiguës et velues jusqu’au sommet, trois fois plus courtes que le tube. Corolle de 12-14 mm, d’un tiers plus longue que le calice, à tube inclus et à lèvre supérieure crénelée. Fruits : 4 nucules de couleur sombre, d’environ 2 mm de longueur, ovoïdes, aigus, papilleux, avec deux petites écailles, arrondis au sommet, bruns. Chaque nucule contient une seule graine.
3.3. Phénologie, cycle de vie et reproduction
Les pieds adultes sont visibles toute l’année sous forme de rosettes plaquées au sol, de diamètre plus ou moins important (jusqu’à 40-50 cm). Ils peuvent survivre quelques années (a minima 3-4 ans) et sont polycarpiques. Les inflorescences se développent à partir du mois d’avril dans la partie supérieure des tiges aériennes.
L’espèce, principalement allogame, peut être partiellement autocompatible (Blanché et al., 2010). La pollinisation est assurée par les insectes (López-Pujol et al., 2003). L’épiaire maritime fleurit de début mai à fin juillet et la fructification a lieu en juillet-août. La plante se multiplie par voie sexuée et la production de semences (nucules) est importante. Une inflorescence peut produire plusieurs centaines de nucules et un individu, qui peut présenter jusqu’à 30-40 inflorescences, peut en produire plusieurs milliers.
Son mécanisme de dispersion privilégié est la barochorie. La zoochorie ne semble pas possible, la plante ne présentant pas d’élaïosome. Par contre, il n’est pas impossible qu’exceptionnellement des nucules soient charriés par l’eau des ruisseaux et par la mer (hydrochorie et thalassochorie). En Corse, la germination a lieu essentiellement après les premières pluies d’automne, lorsque les parties aériennes des autres pérennes psammophiles (hémicryptophytes et géophytes) ont séché et que les espèces annuelles sont absentes, donc sur des milieux relativement ouverts. On observe alors de très nombreuses plantules, surtout à proximité des pieds mères. La plupart d’entre elles ne subsistent que peu de temps, en raison des conditions climatiques (températures élevées, manque d’eau…) ou d’impacts anthropiques trop importants (piétinement par le bétail et/ou le public, circulation motorisée, aménagements divers…). Lorsqu’ils survivent, les jeunes plants ne fleurissent généralement pas au premier printemps suivant, mais plutôt à celui d’après (année n+1).
Les tests de germination réalisés en laboratoire montrent que Stachys maritima présente une dormance embryonnaire qui peut être levée grâce à l’ajout d’acide gibbérellique (hormone de croissance naturellement présente chez les plantes, qui permet le développement de l’embryon). Les germinations in situ sont nombreuses en automne. Ugo et al. (2023) émettent l’hypothèse que la levée de dormance pourrait être liée à une succession de saisons aux conditions climatiques différentes et à une longue exposition au soleil. Cette dormance pourrait expliquer la non-apparition du taxon certaines années dans les sous-populations ne comprenant qu’un seul ou quelques individus.
L’épiaire maritime semble être, surtout dans les sous-populations à un seul ou quelques individus, une espèce à éclipses, ne se développant que si les conditions écologiques lui sont favorables. Dans le cas contraire, elle reste sous forme de réserve (nucules) en attendant de meilleures conditions. Il s’agit donc d’une espèce dont les observations visuelles sont difficiles à prédire d’une année sur l’autre. Ce trait démographique complexifie l’estimation et l’interprétation des tendances des populations (vers l’expansion ou vers l’extinction sur un site donné), ainsi que l’évaluation de l’efficacité des actions de conservation.
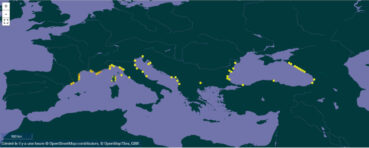
3.4. Chorologie (carte 1)
Le taxon est présent ponctuellement sur la rive nord de la Méditerranée (côte nord-ouest de l’Espagne, sud de la France, Italie, Croatie, Albanie) et sur le pourtour de la mer Noire (Bulgarie, Turquie, Géorgie). Il est présumé disparu en Algérie et en Tunisie et est absent des grandes îles de la Méditerranée (Baléares, Sardaigne, Sicile, Crête, Chypre). Par contre, il est présent en Corse.
3.5. Écologie
Dans l’ensemble de son aire de présence, Stachys maritima pousse principalement sur les dunes côtières et les cordons littoraux et généralement à faible altitude (0-10 m). Une mention existe pourtant à près de 150 m d’altitude, près de Marseille, à la sablière d’Anjarre, mais cette localisation ne comptait qu’un seul individu en 2022 (Ugo et al., 2023).
Il semble que l’espèce ait besoin d’un certain degré de perturbation pour apparaître et que certaines années elle n’apparaît pas (peut-être en raison de la dormance embryonnaire des semences dont la levée pourrait nécessiter plus d’une année). C’est le cas, notamment en Espagne (Carlos Alfredo Barriocanal, Université de Barcelone, 24 janvier 2024, comm. écrite) et en Corse, principalement sur la côte orientale de l’île.
Le taxon n’est connu, en Corse, que sur le littoral, à une altitude inférieure à 10 m. Il s’agit d’une espèce opportuniste et psammophile, qui s’installe généralement sur sable fin ou plus rarement sur sable plus ou moins grossier (L’Ovu Santu, Peru). Elle peut s’installer aussi bien à l’embouchure des cours d’eau que sur la dune active ou la dune fixée ou encore sur des cordons littoraux sablo-graveleux (lorsque le sable n’est pas trop tassé). Elle pousse principalement dans les ouvertures créées par des perturbations modérées, au sein de groupements classables dans le Sporobolo-Elymenion, ou dans le Crucianellion maritimae. Elle supporte assez mal la concurrence végétale. Aussi, on la trouve généralement dans les zones où le recouvrement par les autres plantes est faible, notamment sur les sentiers ou sur leur bordure.
L’inclusion syntaxonomique du taxon n’est donc pas exclusive, puisqu’il est possible de le rencontrer dans deux ordres et dans quatre associations détaillées ci-dessous (d’après Bardat et al., 2004 ; Reymann et al., 2016 ; Paradis & Piazza, 2020) :
. EUPHORBIO PARALIAE-AMMOPHILETEA AUSTRALIS Géhu & Géhu-Franck 1988 corr. Géhu 2004
Ammophiletalia australis Braun-Blanq. 1933
Ammophilion australis Braun-Blanq. 1921
Sporobolo arenarii-Elymenion farcti Géhu 1988
Echinophoro spinosae-Elymetum farcti Géhu 1988
Eryngio maritimi-Elymetum farcti Géhu 1986 (race corso-sarde)
Habitats – PVF1 : 25.0.1.0.2.2 ; CORINE B. : 16.21 ; EUR 28 : 2110 ; EUNIS : B1.312/ B1.322
Crucianelletalia maritimae G. Sissingh 1974
Crucianellion maritimae Rivas Goday & Rivas Mart. 1958
Pycnocomo rutifolii-Crucianelletum maritimae Géhu et al. 1987
Groupement à Lomelosia rutifolia et Anthemis maritima (Anthemido maritimae-Lomelosietum rutifoliae) Paradis & Piazza 2020
Habitats – PVF1 : 25.0.1.0.3 ; CORINE B. : 16.223 ; EUR 28 : 2210 ; EUNIS : B1.43
Dans la mesure où il supporte assez mal la concurrence végétale, il n’est pas rare de le voir dans des milieux très ouverts, sans autres végétaux ou en mosaïque avec les espèces des Malcolmietalia.
. HELIANTHEMETEA GUTTATI (Braun-Blanq. ex Rivas Goday 1958) Rivas Goday & Rivas Mart. 1963
Malcolmietalia ramosissimae Rivas Goday 1958
Laguro ovati-Vulpion fasciculatae Géhu & Biondi 1994
Sileno sericeae-Vulpietum fasciculatae Paradis & Piazza 1992
Sileno nicaeensis-Vulpietum fasciculatae (Paradis & Piazza 1991) Géhu & Biondi 1994
Habitats – PVF1 : 32.0.2.0.2 ; CORINE B. : 16.228 ; EUR 28 : 2230 ; EUNIS : B1.48
3.6. Menaces
L’espèce est en régression dans la quasi-totalité de son aire de présence (Barriocanal & Blanché, 2002 ; Blanché et al., 2010 ; Massó et al., 2016 ; Ugo, 2019 ; Ugo et al., 2023). Les principales causes de déclin sont liées aux activités touristiques et récréatives qui s’exercent sur le littoral sableux et aux aménagements qui leurs sont associées (urbanisation du littoral, circulation motorisée, surfréquentation…). Tout cela a conduit au fractionnement et à l’isolement des populations, jusqu’au phénomène de goulot d’étranglement lorsque les populations atteignent un effectif trop faible pour se maintenir. L’érosion marine peut également, par endroits, constituer un danger pour le taxon, mais cela n’a pas été constaté en Corse.
4. État des lieux des sous-populations corses en 2024
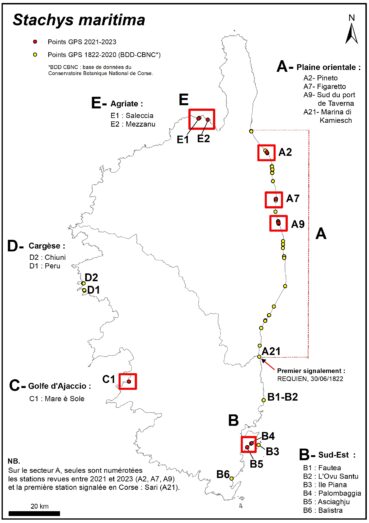
4.1. Historique des découvertes en Corse (carte 2)
Le taxon est connu en Corse, depuis la première moitié du xixe siècle (Briquet & de Litardière, 1955). Depuis sa découverte, il a été signalé dans cinq secteurs géographiques et dans trente-deux localités (Lauranceau, 1949 ; Briquet & de Litardière, 1955 ; Gamisans,1981, 1992 ; Jeanmonod & Burdet,1987 ; Piazza & Paradis, 2000 ; BDD-CBNC) : A/ sur la plaine orientale, entre l’Arinella (au sud de Bastia) et l’embouchure de la Solenzara (21 localités), B/ dans le sud-est de l’île, entre Fautea et Balistra (6 localités), C/ dans le golfe d’Ajaccio sensu lato, sur le site de Mare è Sole (1 localité), D/ à Cargèse, sur les cordons littoraux et les dunes de Peru et de Chiuni (2 localités), E/ dans l’Agriate, à Saleccia et à l’embouchure du ruisseau de Mezzanu (2 localités).
4.2. Statut des sites
Sur les vingt-et-une sous-populations signalées sur la plaine orientale, trois seulement appartiennent au Conservatoire du littoral (Cdl) : Pineto s. l. (pour partie), Mucchiatana et le lido d’Urbino. Ces trois sites font également partie du réseau Natura 2000 et sont classés en ZNIEFF de type I. Trois sites supplémentaires sont intégrés au réseau Natura 2000 et classés en ZNIEFF. Enfin, cinq sites sont uniquement classés en ZNIEFF et la Marina di Tovasinu est classée en ZNIEFF et dispose d’un arrêté préfectoral de protection de biotope (APPB). Sur les autres secteurs, le Cdl est propriétaire des sites de Fautea, de L’Ovu Santu, sur la commune de Zonza, et de Saleccia et de Mezzanu, dans l’Agriate. Toutes les autres sous-populations (sauf celle de Peru) sont incluses dans un périmètre Natura 2000 et/ou une ZNIEFF.
Par contre, près d’un tiers des sous-populations d’épiaire maritime de l’île (10 sur 32, soit 31 %) ne bénéficie d’aucun statut (neuf sur la plaine orientale et une sur la commune de Cargèse, Peru).
4.3. Étude des sites
Cette seconde partie présente les descriptions, en 2024, des différentes sous-populations retrouvées entre 2021 et 2024. Elles sont au nombre de huit : quatre constituées de plusieurs individus (plage du sud du port de Taverna, Asciaghju, Mare è Sole et Saleccia) et quatre constituées d’un seul individu (Pinetto sensu lato, Figaretto, Palombaggia et Mezzanu). À l’exception des stations à pied unique de la plaine orientale de l’île, toutes les autres localités connues, mais non retrouvées, seront également décrites (Fautea, L’Ovu Santu, île Piana, Peru et Chiuni).
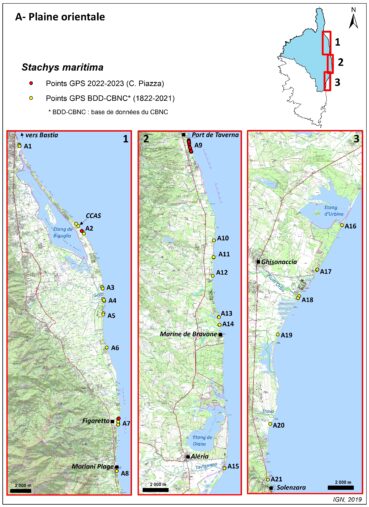
Plaine orientale (planche 6)
Le littoral de la plaine orientale de la Corse est un linéaire côtier d’une centaine de kilomètres de long, depuis Bastia (Haute-Corse) jusqu’à Solenzara (Corse-du-Sud). À l’exception de quelques affleurements rocheux, au niveau de petits caps, il est largement constitué de plages sableuses, à l’arrière desquelles se développent des dunes basses. On y trouve également de grands étangs et des lagunes littorales reliés à la mer par des graus. De nombreux fleuves ont leur embouchure sur cette côte, dont les plus importants sont le Golo, le Tavignano et le Fium’Orbu.
Depuis le xixe siècle, vingt-et-une sous-populations d’épiaire maritime ont été signalées sur la côte orientale, entre Bastia et Solenzara : A1 – Arinella (Bastia), A2 – Pineto s. l. (Borgo), A3 – Foce di Tanghiccia (Lucciana), A4 – Embouchure du Golo (Venzolasca), A5 – Mucchiatana (Venzolasca), A6 – Fosse Stabule (Penta-di-Casinca), A7 – Plage de Figaretto (Talasani), A8 – Moriani Plage (San Nicolao), A9 – Plage au sud du port de Taverna (Santa-Maria-Poggio et Valle-di-Campoloro), A10 – Fosse d’Acqua Viva (San-Giuliano), A11 – Plage d’Alistro (Alistro), A12 – A Chiosura (Linguizetta), A13 – Plage de l’embouchure d’u Stagnolu (Linguizzetta), A14 – Plage de l’embouchure de la Bravone (Linguizzetta), A15 – Marina d’Aléria (Aléria), A16 – Lido d’Urbino (Ghisonaccia), A17 – Perla di Mare (Ghisonaccia), A18 – Embouchure du Fium’Orbu (Ghisonaccia ?, Prunelli-di-Fiumorbo ? ou Serra-di-Fiumorbo ?), A19 – Nord de Palo (Serra-di-Fium’Orbu), A20 – Marina di Tovasinu (Solaro), A21 – Marina de Kamiesch (Solaro).
À l’exception de la station de la plage au sud du port de Taverna, il s’agit toujours de petites populations à éclipses. Elles ne comptent généralement qu’un seul individu (rarement plus) et ne sont pas observées tous les ans. Certaines n’ont pas été revues depuis longtemps et semblent avoir disparu. Malgré cela, il n’est pas rare de trouver, sur des sites où le taxon n’était pas connu, de nouveaux pieds isolés : embouchure du Golo (2012), A Chiosura (2012), Marina di Tovasina (2015), Fosse d’Aqua Viva (2017).
Toutes les sous-populations de la plaine orientale ont été recherchées en 2022 ou 2023. Seules trois ont été retrouvées : Pineto s. l., Figaretto et plage au sud du port de Taverna. Malgré cela, il n’est pas impossible que les stations non revues soient toujours présentes, il conviendra donc de rester vigilant, de poursuivre la veille et de signaler systématiquement aux collectivités et aux acteurs locaux la présence du taxon sur leur territoire pour les informer, les sensibiliser et tenter d’avoir des retours d’informations.
Une description des trois sites où l’espèce a été revue sera faite ci-dessous. Elle concerne deux sous-populations ne comprenant qu’un seul ou peu d’individus et la plus importante sous-population de l’île, Taverna.
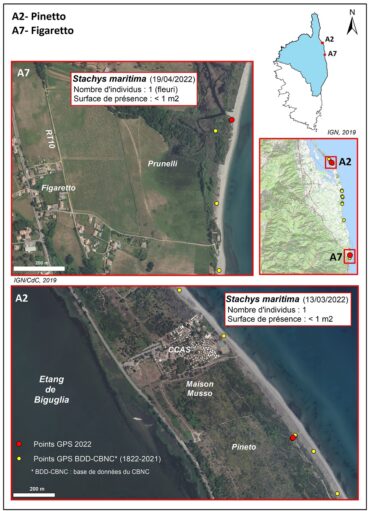
Pineto sensu lato (planches 6, 7 et 8)
L’étang de Biguglia, situé au sud de la ville de Bastia et classé en réserve naturelle, est isolé de la mer par un cordon littoral de près de seize kilomètres de long, dénommé lido de la Marana. Ce lido est constitué d’un vaste cordon sableux de 200 à 900 m de large.
L’épiaire maritime se trouve vers l’extrémité sud-est du lido au niveau du lieu-dit Pineto s. l. Cette localité est connue depuis le xixe siècle (Briquet & de Litardière, 1955). Elle a été revue régulièrement par Delage entre 2009 et 2022, au niveau du village de vacances de la CCAS (Caisse centrale des activités sociales des industries électriques et gazières), mais également au nord et au sud de cet établissement, sur un linéaire de plus d’un kilomètre. Toutes les observations sur le taxon sont ponctuelles et concernent des individus isolés qui se trouvent soit sur l’avant-dune, soit plus en arrière, sur la dune fixée, toujours sur sable peu tassé. Dans tous les cas, ils occupent les espaces plus ou moins perturbés, peu ou pas végétalisés. Les cortèges floristiques sont constitués d’espèces du Pycnocomo rutifolii-Crucianelletum maritimae et de l’Echinophoro spinosae-Elymetum farcti. On y trouve également des espèces annuelles dont beaucoup d’Ononis variegata et plus ponctuellement la thérophyte protégée Pseudorlaya pumila.
En 2022, seul un individu a été observé sur la totalité du secteur, le long d’un sentier, contre une ganivelle, dans la moitié sud du site. Cet individu a été observé à plusieurs reprises. Il a fleuri en 2021 et 2022, puis a disparu.
. Menaces – Depuis les années soixante, le lido de la Marana s’est ouvert au tourisme balnéaire et à une urbanisation parfois incontrôlée. Rançon de ce succès, la côte est en partie dénaturée par les constructions et divers aménagements (villas, lotissements, centres de vacances, campings « pieds dans l’eau », stationnements, plantations d’espèces exotiques…). Par ailleurs, le lido est également soumis à une forte fréquentation tout au long de l’année, du fait de sa proximité avec l’agglomération bastiaise. Des activités de plein air, pas toujours respectueuses des habitats naturels, s’y sont développées (création de pistes, circulation motorisée sur les dunes…). Enfin, les incendies sont fréquents. Néanmoins, de grands espaces naturels subsistent et certains d’entre eux ont été mis à l’abri, ce qui est le cas, pour partie du secteur de Pineto. Si la moitié nord du site est très anthropisée (constructions sur le front de mer, pistes sur les dunes, surfréquentation, présence d’espèces exotiques envahissantes [EEE], dont Carpobrotus edulis…), la moitié sud a, quant à elle, été acquise par le Cdl et a fait l’objet d’aménagements (pose de ganivelles, canalisation du public, campagnes d’éradication d’EEE…). Elle est gérée par les agents de la Collectivité de Corse. Malgré ces deux situations très différentes, le taxon n’est toujours présent que de façon ponctuelle et épisodique dans les deux zones.
. Protections – La moitié sud de la zone où Stachys maritima a été observé à Pineto s. l. se trouve sur une propriété du Cdl. Elle est intégrée dans le périmètre du site Natura 2000 – FR9400571 « Etang de Biguglia » et de la ZNIEFF de type I – 940004079 « Etang, zone humide et cordon littoral de Biguglia ». La moitié nord, n’est concernée que par le classement en ZNIEFF. Ainsi, le site bénéficie pour partie de protections importantes, à la fois réglementaire et foncière.
. Conclusions – Le lido de la Marana, bien que soumis à une forte pression anthropique, conserve de larges fenêtres naturelles. Certaines d’entre elles et notamment le site de Pineto (pour partie) ont été acquises et réhabilitées par le Cdl. Elles constituent des espaces de nature qui dénotent avec l’environnement urbain et qui seront peut-être favorables, à terme, à un développement plus important de l’épiaire maritime. Bien que peu importante en nombre d’individus, cette sous-population est connue depuis de très nombreuses années et reste visible par intermittence. Si des opérations de renforcement de population devaient être réalisées, la partie du site appartenant au Cdl pourrait constituer une zone d’expérimentation intéressante.
Figaretto (planches 6, 7 et 9)
Situé entre Folelli au nord et Moriani Plage au sud, le hameau de Figaretto se trouve sur la commune de Talasani. Cette commune possède une façade littorale étroite, de moins de deux kilomètres de long, entre deux fleuves, le Fium’Alto et le Fium’Olmo.
Stachys maritima a été signalé à trois reprises dans le tiers sud de ce cordon littoral, entre un petit marais au nord et l’embouchure du Fium’Olmo au sud, par de Litardière, en 1953 (Briquet & de Litardière, 1955), Néry, en 2015 et Piazza, en 2022 (in BDD-CBNC). Là encore, il s’agissait pour chaque observation d’un seul ou de quelques individus isolés.
Le taxon a été trouvé sur la dune active, donc sur sable fin, dans des milieux très ouverts (environ 20% de recouvrement) à Elytrigia juncea subsp. juncea, Echinophora spinosa et Anthemis maritima subsp. maritima dominants. Ces formations peuvent être classées dans l’Echinophoro spinosae-Elymetum farcti.
Le 19 avril 2022, seul un individu, d’environ un an, d’une vingtaine de centimètres de diamètre et non fleuri, a été observé sur le site. Il se situait en rive droite du petit marais, sur le haut d’une microfalaise d’érosion d’environ un mètre de hauteur et en avant du fourré littoral à Pistacia lentiscus dominant. Cet individu a été suivi par l’une de nous (D. Orsucci) entre le mois de mai 2022 et le mois de novembre 2023. Nous avons ainsi pu constater : 1/ qu’il a fleuri deux fois (mai 2022 et mai 2023) et a produit quatre hampes florales (soit environ 500 nucules) la première année et seulement deux hampes la seconde année (soit environ 250 nucules), 2/ qu’en octobre 2022 deux jeunes plants de 2 cm de diamètre et trois plantules étaient présents sur le site (mais qu’aucun n’a survécu) et enfin 3/ qu’il s’est desséché en novembre 2023. Sa durée de vie n’a donc été que de deux ans. Malgré la production de près 750 graines, le taxon n’a pas été revu sur le site pour l’instant.
. Protection – Le site ne bénéficie d’aucune protection, qu’elle soit réglementaire ou foncière.
. Menaces – Le cordon littoral est assez étroit sur cette portion de côte et pourrait être impacté par l’érosion du trait de côte ou par la modification des embouchures suite à des crues. Par ailleurs, la présence de l’espèce invasive Carpobrotus edulis est importante sur le site et pourrait concurrencer ponctuellement le taxon.
. Conclusions – Bien que peu importante en nombre d’individus et en superficie occupée, cette sous-population est, là encore, connue depuis longtemps (plus de soixante-dix ans) et régulièrement revue. Une opération de « veille régulière » sera suffisante pour vérifier son état de conservation et suivre son évolution au cours du temps.
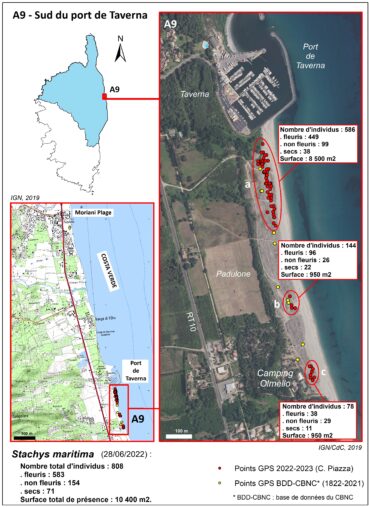
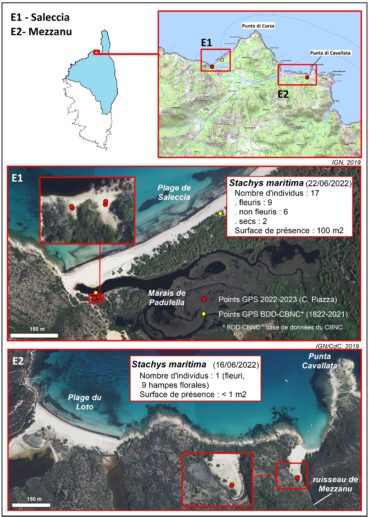
Plage au sud du port de Taverna (planches 10, 11 et 12 ; tableaux 1 et 2)
Situé au sud de Moriani Plage, le port de Taverna (commune de Santa-Maria-Poggio) a été construit en 1970-1971 pour les activités de plaisance. L’édification de la jetée méridionale du port a constitué un obstacle au courant de dérive littorale et bloqué le transit sédimentaire. Cela a provoqué une très forte érosion au nord du port et une sédimentation sableuse au sud, sur une longueur de 2 km et sur plus de 100 m de large par endroits, sur les communes de Valle-di-Campoloro et de Cervione. C’est l’un des rares et des plus spectaculaires cas de côte sableuse en accrétion de l’île.
On trouve ainsi sur ce site un vaste cordon sableux et à l’arrière une dune ancienne boisée (à Quercus ilex, Pistacia lentiscus et Quercus suber), très étroite, de disposition linéaire, atteignant 2 à 4 m de hauteur et donc nettement plus haute que le sable déposé depuis la construction du port. En arrière de cette dune ancienne, des terrains ont été déboisés pour installer des exploitations agricoles (lieu-dit Padulone). Deux ruisseaux de direction ouest-est, à écoulement temporaire, aboutissent à la mer : le ruisseau de Taverna, dont le cours terminal est adossé à la jetée sud du port, et le ruisseau de Terzanili, dont l’embouchure se situe à 1 km environ au sud du port, pas très loin du camping Olmello.
Depuis la plage jusqu’à la dune ancienne, on trouve les associations suivantes : (1) Salsolo kali-Cakiletum maritimae (Cakiletea maritimae) très clair, mais riche en été en Euphorbia peplis, (2) Echinophoro spinosae-Elymetum farcti (Euphorbio paraliae-Ammophiletea) comportant de nombreux pieds d’Anthemis maritima subsp. maritima et très étendu, (3) Anthemido maritimae-Lomelosietum rutifoliae (association des Helichryso-Cucianelletea) (Paradis & Piazza, 2020) de très vaste extension. Trois associations thérophytiques printanières des Malcolmietalia ramosissimae (Ononidetum variegatae, Cutandietum maritimae et Lolietum rigidi) sont présentes, mais avec une assez faible extension. La végétation ligneuse n’est bien représentée que sur la dune ancienne et en bordure de celle-ci (ourlet à Cistus creticus, manteau à Pistacia lentiscus, Quercus ilex et Quercus suber).
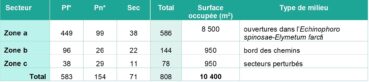
Stachys maritima a été signalé pour la première fois sur le site par Thiébaud, en 1981 (herbier, CJB ville de Genève, n° SIB 111/1). Il a ensuite été revu régulièrement entre 2009 et 2022. Sur ce site, le taxon se trouve majoritairement dans les ouvertures de l’Echinophoro spinosae-Elymetum farcti à Anthemis maritima subsp. maritima et/ou plus rarement dans les zones de transition entre le groupement précédent et l’Anthemido maritimae-Lomelosietum rutifoliae. Dans la mesure où il s’installe dans les milieux ouverts, on trouve également dans les relevés de végétation des espèces des Malcolmietalia. Trois secteurs de présence ont été identifiés (planche 10) : 1/ zone a, partie nord du site ; 2/ zone b, sur le bord des sentiers, dans la partie centrale du site ; 3/ zone c, au niveau du camping Olmello, à l’extrémité sud du site, dans les secteurs perturbés par les passages et les activités anthropiques.
L’effectif de Stachys maritima a été estimé sur ce site à environ un millier d’individu en 2019 (Paradis & Piazza, 2020). Un comptage plus précis, réalisé en juin 2022, a permis de recenser 808 individus, dont 583 individus fleuris (soit 72 %), 154 non fleuris (soit 19 %) et 71 secs (soit 9 %), sur une superficie d’environ 10 400 m2. Cette sous-population est très dynamique, puisque de nombreuses germinations sont régulièrement observées sur le site après les premières pluies d’automne. Toutes les classes de taille sont présentes et il n’est pas rare d’observer des individus de très gros diamètres (jusqu’à 40-50 cm).
. Protection – Le site ne bénéficie d’aucune protection qu’elle soit réglementaire ou foncière. Le cordon littoral se trouve dans sa quasi-totalité sur le domaine public maritime (DPM).
. Menaces – Globalement, le cordon littoral est en assez bon état dans sa partie nord. Depuis de nombreuses années la communauté de communes de la Costa Verde a engagé des actions de valorisation environnementale et patrimoniale pour tenter de favoriser un développement touristique harmonieux (création et/ou entretien de sentiers de randonnées, aménagement d’aires de pique-niques autour des parkings existants, installation de poubelles, mise en place d’une signalétique). Des platelages en bois ont été installés pour canaliser le public, d’une part vers la plage et d’autre part, parallèlement à la mer, en bordure de la dune ancienne, le long d’un sentier d’axe nord/sud.
Les parties centrale et sud du site sont plus soumises aux impacts d’origine anthropique. On note la présence de plusieurs pistes relativement larges, parallèles et perpendiculaires à la mer et de vastes dépressions colonisées par Cenchrus longispinus au niveau de l’arrière-dune, à l’extrémité sud-est de la grande parcelle agricole de Padulone. On trouve également de gros dépôts provenant du nettoyage de la plage (restes de posidonies, sables, bois flottés, troncs…). Ces travaux sont réalisés par des engins lourds et donc assez destructeurs de la végétation du haut de plage. Les dépôts sont ensuite entassés sur l’arrière-dune, mais également près du maquis de la dune ancienne, à proximité de l’embouchure des ruisseaux et sur le haut de plage. Au niveau du camping d’Olmello, la dune ancienne a été entaillée, en 2023, sur plusieurs dizaines de mètres linéaires pour permettre l’installation d’une ganivelle et la partie sableuse située à l’avant du camping, sur le cordon littoral, est régulièrement soumise à de fortes pressions anthropiques. Des espèces ont été volontairement introduites et tendent à s’étendre. Il s’agit de Pinus pinaster, dont de nombreux pieds ont été plantés sur le cordon littoral dans le groupement à Lomelosia rutifolia, et d’espèces exotiques d’origine américaine comme Agave americana ou d’origine sud-africaine comme Carpobrotus edulis. Malgré cela, Stachys maritima est, pour l’heure, présent aussi bien sur les zones impactées que sur les milieux plus préservés, mais la station la plus importante se trouve au nord du site.
. Conclusions – Nous ne disposions d’aucune donnée sur la flore et la végétation du site antérieurement à la création du port. Nous ne savons donc pas comment a évolué cette sous-population. La seule certitude est que le taxon a été signalé pour la première fois en 1981 et qu’il a été revu régulièrement entre 2009 et 2023. L’accroissement de la largeur du cordon littoral, lié à la phase rapide d’accrétion de la côte après la construction du port, lui a très probablement été bénéfique et a permis l’accroissement de son aire de présence. Cette sous-population est aujourd’hui la plus importante de l’île. Sa survie sur le site n’est pas menacée. Néanmoins, il sera nécessaire de suivre régulièrement les stations situées dans la moitié sud du site (zones b et c) qui subissent de fortes pressions anthropiques pour vérifier leur état de conservation et proposer, si besoin, des mesures de gestion adaptées.
Sud-est de l’île
Six sous-populations ont été signalées dans le sud-est de l’île : Fautea et L’Ovu Santu, sur la commune de Zonza, Palombaggia, Asciaghju et l’île Piana (Cerbicale), sur la commune de Porto-Vecchio et Balistra, sur la commune de Bonifacio. Seules deux d’entre elles ont été revues entre 2021 et 2023 : Palombaggia et Asciaghju. La première ne compte qu’un seul individu et la seconde compte une vingtaine de pieds reproducteurs. Les quatre sous-populations qui n’ont pas été revues ne comptaient, elles, qu’un seul individu.
Fautea (carte 2)
Situé sur le littoral sud-est de la Corse (commune de Zonza), Fautea est une petite crique caractérisée par la présence d’une dune perchée de sable fin pouvant atteindre 6 m de haut et s’appuyant sur le socle. Depuis la mer jusqu’à la dune fixée, on trouve schématiquement la plupart des espèces de l’Eryngio maritimi-Elymetum farcti (à l’exception d’Ammophila arenaria subsp. arundinacea), un groupement à Lomelosia rutifolia et Crucianella maritima (abondant), un groupement à Cistus halimifolius, des groupements thérophytiques et une pinède à pin maritime (Pinus pinaster).
Stachys maritima a été signalé pour la première fois à Fautea par Thiébaud en 1984 (herbier, CJB ville de Genève, n° SIB 9777/1). Il ne sera revu qu’à l’extrémité sud-ouest de la plage par Paradis, en 1990, sur sable, avec les espèces des Euphorbio-Ammophiletea : Sporobolus pungens [1], Convolvulus soldanella [1], Elytrigia juncea subsp. juncea [+], Achillea maritima [+], Matthiola sinuata [+], Glaucium flavum [+], Sonchus bulbosus [+], Polygonum maritimum [+], Stachys maritima [+] (Paradis, 1992). Ce site est relativement préservé. Il se trouve sur une propriété du Cdl et est intégré dans le périmètre du site Natura 2000 FR9400584 « Lavu Santu ». Il est donc possible que l’espèce soit toujours présente et réapparaisse.
L’Ovu Santu (carte 2)
Le site de L’Ovu Santu (appelé aussi « plage des Américains », car elle fut autrefois le théâtre de manœuvres militaires de l’OTAN, ou « plage de Lavu Santu ») est constitué d’une grande plage de sable grossier de près de 900 mètres de long et 200 m de large, entre une pointe rocheuse au nord-est (qui sépare ce site de celui de Fautea) et l’embouchure du fleuve Cavu au sud-est. À l’arrière de cette grande plage se trouve la zone humide de L’Ovu Santu, un étang d’un hectare recouvert d’un boisement de tamaris, de saules et de roselières denses à phragmites, avec quelques petits plans d’eau libre en son centre.
Stachys maritima n’a été vu qu’une fois sur ce cordon littoral, en 1989, par l’un de nous (G. Paradis) et par Delage (CBNC), lors d’une sortie botanique organisée dans le cadre d’une formation de maîtrise de Sciences et Techniques (MST) de l’Université de Corse. À cette occasion, un pied unique a été observé à « l’extrémité nord-est du cordon littoral, sur des sédiments hétérométriques assez grossiers, en lisière de pinède ». Recherché depuis, il n’a pas été retrouvé. Ce site est, comme le précédent, relativement préservé. Il se trouve sur une propriété du Cdl et est intégré dans le périmètre du site Natura 2000 FR9400584 « Lavu Santu » et de la ZNIEFF de type I 940004093 « Zone humide de Lovo Santo ». Là encore, il est donc possible que l’espèce soit toujours présente et réapparaisse.
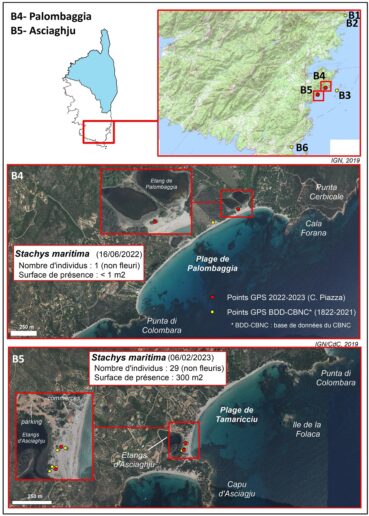
Palombaggia (planches 13 à 14)
Au sud de la commune de Porto-Vecchio, la côte allant de Palombaggia à Asciaghju est l’une des plus réputées de Corse pour ses grandes plages de sable blanc et fin et ses paysages de carte postale. Elle fait face aux îles Cerbicale, qui se trouvent dans la réserve naturelle des Bouches de Bonifacio. Bien que coincées entre l’urbanisation touristique et la mer, les dunes et les zones humides conservent un fort intérêt écologique et paysager.
La première mention du taxon sur la plage de Palombaggia (Porto-Vecchio) est récente. Néry le signale en 2014 (in BDD-CBNC). Piazza le reverra, le 29 avril 2021, à 300 m au nord-est de l’individu unique observé par Nery, sur l’arrière-dune, au droit de l’étang de Palombaggia, près d’un gros pin parasol (in BDD-CBNC). Là encore, un seul individu a été vu (rosette de 18 cm de diamètre, non fleuri). Il ne sera pas retrouvé en 2023. Les deux observations ont été faites dans des zones clôturées. L’espèce n’est donc pas soumise à la surfréquentation estivale. Par contre, les terrains où on la trouve ne sont pas exempts de pressions anthropiques : démaquisage, coupe de pins plus ou moins secs, zone de repos pour les bovins… La végétation est très clairsemée (moins de 20 % de recouvrement). Le cortège floristique est pauvre et uniquement composé de quelques espèces de l’Echinophoro spinosae-Elymetum farcti (Elytrigia juncea subsp. juncea [1], Lotus creticus [+]) et de thérophytes appartenant au Sileno sericeae-Vulpietum fasciculatae dont Silene canescens (= S. sericea) [+], Vulpia fasciculata [1] et Pseudorlaya pumila [+], taxon protégé.
. Protections – Le site ne bénéficie d’aucune protection foncière. Mais il se trouve dans le site Natura 2000 FR9410022 « Îles Cerbicale » et dans la ZNIEFF de type I 940004102 « Étang et pinède de Palombaggia, Capu d’Acciaju, pointe de la Folaca ».
. Conclusions – L’espèce sera à rechercher sur ce site.
Asciaghju (planches 13 à 15)
Le site d’Asciaghju se trouve à l’extrémité sud-ouest de la plage de Tamaricciu, à 2,5 km du site précédent. Il s’agit d’un petit lido de sable fin, d’une centaine de mètres de long, coincé entre une dune mobile côté mer et les étangs d’Asciaghju côté terre.
Bocquet, en 1973, a été le premier à signaler le taxon sur la plage d’Asciaghju (herbier de Zurich, n° 15472). Par la suite, il sera revu par Delage (en 2010), Néry (en 2014), Garraud & Van Es (en 2017) et Piazza (en 2021 et 2023) (in BDD-CBNC).
Le 29 avril 2021, la sous-population de Stachys maritima était constituée de 52 individus (6 rosettes de 5 à 10 cm, 46 rosettes de 2 à 4 cm) et d’une centaine de très jeunes plants de 0,5 à 1 cm de diamètre et le 6 février 2023 de 1 pied de 15 cm de diamètre, 5 pieds de 5 à 10 cm et 23 pieds de diamètre compris entre 2 et 4 cm, soit au total 29 pieds. La population fluctue d’une année sur l’autre, mais compte moins d’une vingtaine d’individus reproducteurs, sur une surface d’environ 150 m2.
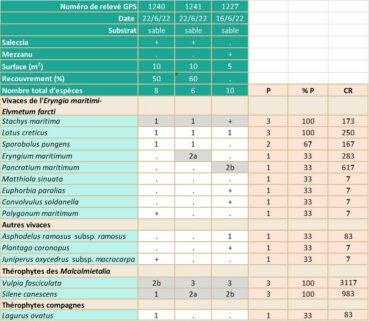
Un relevé floristique réalisé en avril 2021, sur une surface de 3 m2, montre la présence 1/ d’espèces vivaces : Lomelosia rutifolia [2a], Stachys maritima [1], Lotus creticus [1], Sporobolus pungens [1], Echinophora spinosa [+], Sonchus bulbosus [r] ; 2/ de thérophytes : Vulpia fasciculata [1], Silene nicaeensis [1]. Le recouvrement est faible (moins de 20 %). La sous-population de Stachys maritima se trouve dans les zones très dénudées et relativement déstructurées. La végétation est constituée d’un groupement clair à Lomelosia rutifolia dominant, en mosaïque avec des éléments de l’Echinophoro spinosae-Elymetum farcti et du Sileno nicaeensis-Vulpietum fasciculatae. Crucianella maritima est absent, car ce taxon est très sensible aux impacts et ne se trouve plus, aujourd’hui, qu’à l’arrière immédiat de la dune active.
. Menaces – Resté très sauvage jusqu’à la fin des années 1980, le site a fait, par la suite, l’objet de nombreux aménagements qui l’ont en partie dénaturé : constructions, installations de commerces sur la plage, création de très grands parkings à l’arrière, plantations d’espèces exotiques sur le cordon littoral. Malgré la surfréquentation, sa richesse floristique est relativement importante. On y trouve quelques espèces protégées (Juniperus oxycedrus subsp. macrocarpa, Pseudorlaya pumila) ou d’autres espèces qui ont tendance à se raréfier en Corse (Crucianella maritima, Stachys maritima). La dynamique sédimentaire est toujours active à l’avant de la dune, qui est colonisée par l’Echinophoro spinosae-Elymetum farcti. Par contre, l’arrière-dune est constituée de dépressions et de zones légèrement plus élevées, présentant quelques pieds isolés de Juniperus oxycedrus subsp. macrocarpa, des lambeaux d’un groupement à Lomelosia rutifolia et une petite station de Stachys maritima. Le sable est relativement tassé par endroits et de nombreux végétaux sont déchaussés. Lors des crues, les étangs d’Asciaghju débordent et inondent l’arrière-dune. Stachys maritima se trouve généralement sur les zones les plus élevées, mais peut également être impacté lorsque l’inondation se prolonge.
. Protections – Le site ne bénéficie d’aucune protection foncière. Mais il se trouve dans le site Natura 2000 FR9410022 « Îles Cerbicale » et dans la ZNIEFF de type I 940004102 « Étang et pinède de Palombaggia, Capu d’Acciaju, pointe de la Folaca ».
. Conclusions – Malgré les nombreux impacts liés aux activités touristiques, cette sous-population se maintient sur le site depuis au moins cinquante ans et semble relativement dynamique. Un suivi régulier devra être mis en place pour suivre son évolution.
Île Piana (Cerbicale) (carte 2)
Situé au sud-est de Porto-Vecchio, face au site de Palombaggia, l’archipel des îles Cerbicale est constitué de plusieurs îlots (du nord au sud : Forana, Maestro-Maria, Piana, Pietricaggiosa, plus les îlots de la Vacca et du Toro) formés de roches siliceuses et d’assez faibles altitudes (point culminant : 36 m pour l’île Piana).
Gamisans a réalisé, au printemps 1991, un inventaire de la flore et de la végétation de ces îlots. C’est le seul auteur à avoir signalé la présence de Stachys maritima sur l’île Piana (Gamisans, 1992). La liste floristique qui a été réalisée à cette époque renvoie à une cartographie localisant les relevés floristiques qui situe le taxon au niveau d’une petite zone sableuse au nord-ouest de l’île. Aucune autre mention de présence n’existe sur ce site.
. Protections – L’île Piana se situe dans le périmètre de la réserve naturelle des Bouches de Bonifacio, dans le périmètre Natura 2000 FR9410022 « Îles Cerbicale » et dans la ZNIEFF de type I 940004105 « Îles Cerbicale ».
. Menaces – Situé dans une réserve naturelle, le site bénéficie d’une protection forte et n’est concerné par aucune menace d’ordre anthropique.
. Conclusions – L’espèce sera à rechercher sur ce site.
Balistra (carte 2)
La côte du sud-est de la Corse, bien que rocheuse sur sa plus grande longueur, présente quelques sites sableux. L’un d’entre eux, le cordon littoral de Balistra, d’altitude assez basse et d’environ 700 m de long, isole l’étang du même nom de la mer.
L’espèce a été signalée pour la première fois sur ce site par Thiébaud en 1981 (herbier, CJB ville de Genève). Cette mention pourrait correspondre à l’observation sur « Bonifacio » de Serafini (06/1847) et de Kralik (08/1849) (Briquet & de Litardière, 1955). Le taxon (un pied unique) a également été observé par Piazza & Paradis (1994, carte p. 73) sur le haut du cordon littoral, à l’extrémité sud de l’étang de Balistra. Il se trouve au sein d’une mosaïque à Lomelosia rutifollia, Lotus creticus, des thérophytes du Sileno sericeae-Vulpietum fasciculatae faciès à Rumex bucephalophorus et, par endroits, Pancratium maritimum. Bien que recherché, il n’a pas été revu en 2022 et 2023.
. Protections – Le site se trouve dans le périmètre Natura 2000 FR9410021 « Îles Lavezzi, Bouches de Bonifacio » et dans la ZNIEFF de type I 940004110 « Étang de Balistra ».
. Menaces – Le cordon littoral ne subit pas d’érosion marine, mais sa végétation est modifiée par les impacts anthropiques (surfréquentation estivale, pistes, passages de véhicules 4×4, stationnements).
. Conclusions – L’espèce sera également à rechercher sur ce site.
Golfe d’Ajaccio s.l.
Une seule sous-population est connue dans le golfe d’Ajaccio sensu lato.
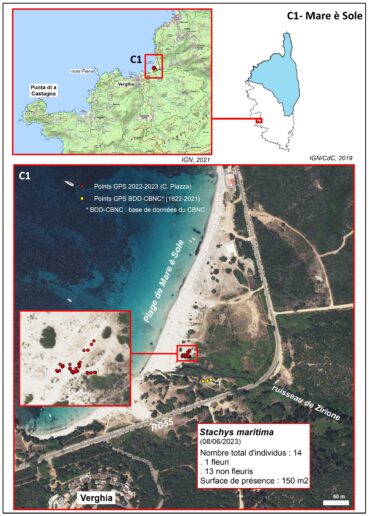
Le site de Mare è Sole (planches 16 et 17 ; figure 1), sur les communes de Pietrosella et de Coti-Chiavari, se trouve à une trentaine de kilomètres d’Ajaccio ; on y accède par la RD 55. La plage est constituée de sédiments fins. Elle forme un cordon sableux de 550 m de long et est limitée à son extrémité S/SW par le ruisseau de Zirione. La rive droite du ruisseau est occupée par de petites dunes, inexistantes ailleurs, en raison des nombreuses perturbations d’origine anthropique qui se sont exercées sur le site depuis des décennies. C’est là, sur et au bord des chemins, que se trouve la station de Stachys maritima. Une autre petite station, observée par l’un de nous (G. Paradis) en rive gauche du ruisseau de Zirione, était présente jusqu’en 2011, mais elle n’a pas été revue depuis.
Stachys maritima est connu depuis très longtemps sur le site de Mare è Sole. La première observation a été faite par de Chauvenet, en 1872 (Briquet & de Litardière, 1955). Le taxon a été revu par Bonfils en 1948 (Briquet & de Litardière, 1955) et Thiébaud, en 1981 (herbier, CJB ville de Genève). Retrouvée par Paradis en 2021, la station a été régulièrement suivie par Piazza entre septembre 2021 et mars 2024. La mention de Sieber « Ajaccio » (in Briquet & de Litardière, 1955) correspond probablement à cette sous-population.
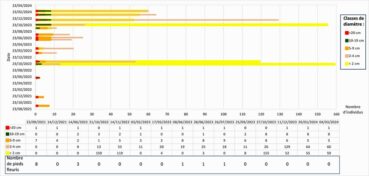
La figure 1 montre que la population n’est constituée que de très peu de pieds reproducteurs (8 en 2021, 3 en 2022 et 1 en 2023). Les germinations ont lieu en octobre-novembre et sont assez nombreuses : ainsi, près de deux cents plantules ont été observées en octobre 2022. En février 2023, il n’en restait qu’une vingtaine, en raison de perturbations importantes survenues sur la station (passages de véhicules liés à l’entretien des ganivelles). Les pieds adultes ont été ensablés ou au contraire déchaussés. Mais, bien qu’abîmés, ils se sont maintenus pour la plupart. En octobre 2023, environ deux cents plantules ont également été observées et elles étaient toujours présentes jusqu’au mois de mars 2024. Cette sous-population était constituée le 3 mars, lors de notre dernier comptage, de 59 plantules de diamètre inférieur à 2 cm, 64 plants de 2 à 4 cm de diamètre, 8 plants de 5 à 9 cm de diamètre, 5 plants de 10 à 19 cm et 1 plant de plus de 20 cm de diamètre. Quatorze pieds possiblement reproducteurs sont donc actuellement présents sur le site. Au niveau de cette sous-population, la végétation est très clairsemée. Elle est constituée, au printemps-été, d’espèces de l’Echinophoro spinosae-Elymetum farcti et de thérophytes du Sileno sericeae-Vulpietum fasciculatae, dont le recouvrement n’excède pas 40 %. Un relevé de végétation effectué, en juin 2023, sur une surface de 5 m2, donne les taxons suivants :
– pour les vivaces : Pancratium maritimum [2a], Echinophora spinosa [1], Medicago marina [1], Sporobolus pungens [1], Stachys maritima [+], Elytrigia juncea subsp. juncea [+],
– pour les thérophytes : Vulpia fasciculata [2a], Silene canescens [1], Malcolmia ramosissima [1], Pseudorlaya pumila [1], Medicago littoralis [+], Erodium cicutarium subsp. bipinnatum [+], Euphorbia peplis [r].
La relative abondance de Pancratium maritimum est caractéristique de milieux perturbés (Kuhnholtz-Lordat, 1924). En automne, après la disparition des thérophytes et des parties aériennes des hémicryptophytes et des géophytes, le recouvrement par la végétation est quasi nul. La surface où vit le taxon est d’environ 150 m2.
. Protections – Cette sous-population se trouve dans la ZNIEFF de type I « Dune de Pascialella et pinède de Verghia ». Elle est bordée du côté mer par le site Natura 2000 « FR9410096 – Îes Sanguinaires, Golfe d’Ajaccio » et du côté terre par la ZNIEFF de type I « Forêt de Chiavari ».
. Menaces – Le site a été soumis à de nombreux impacts dans le passé : constructions, aménagements divers (stationnements, nombreuses pistes, terrassements dont un très grand en 2007 à l’entrée du site, plantations d’essences exotiques…), présence de bétail (bovins), circulation anarchique de véhicules et de motos (y compris sur les dunes). Ces forts impacts ont conduit à la destruction des dunes et du fourré littoral sur une grande partie du site. Les sédiments fins ont été exportés par le vent vers l’intérieur des terres, la zonation de la végétation littorale a été fortement perturbée et la flore herbacée des dunes s’est appauvrie.
À l’heure actuelle, la situation s’est un peu améliorée. Une barrière a été installée au niveau de la RD 55 pour limiter la circulation sur le cordon aux socioprofessionnels et aux véhicules de service et, en 2022, l’avant-dune a été mise en défens par des ganivelles pour protéger le milieu et assurer la sécurité du public vis-à-vis du bétail (vaches plus ou moins agressives). Les résultats de ces travaux sont déjà visibles : 1/ les communautés végétales littorales commencent à se reconstituer et 2/ certaines espèces, peu visibles ces dernières années, gagnent du terrain. C’est le cas notamment de deux espèces protégées au niveau national, annexe I (Arrêté du 31/08/1995 portant modification de l’arrêté du 20/01/1982, J.O. du 17/10/1995) : la fausse girouille des sables (Pseudorlaya pumila) et l’euphorbe des plages (Euphorbia peplis).
D’autres espèces, non protégées mais rares ou peu fréquentes en Corse et qui font l’originalité du site, devraient également bénéficier de ces aménagements : Polygonum maritimum, Silene succulenta subsp. corsica), endémique corso-sarde, et Scrophularia canina subsp. ramosissima.
La sous-population de Stachys maritima de Mare è Sole se trouve, elle, sur une zone de passages, dans le tiers SW de la dune. Les perturbations modérées engendrées par le piétinement du public et des bovins limitent ici la concurrence végétale et favorisent l’installation du taxon, qui occupe les milieux ouverts, sur et à proximité des sentiers créés sur les dunes plus ou moins fixées. Par contre, nous avons constaté, le 3 février 2023, que des perturbations importantes sont survenues sur ce secteur. Le sol a été piétiné (bovins, piétons) et de nombreuses traces de véhicules 4×4 étaient également visibles sur la dune et sur le cordon, à proximité de l’embouchure du ruisseau de Zirione. Ces impacts importants, au moment où les plantules étaient encore peu développées, ont eu un effet très négatif sur le renouvellement de la population. La commune a été informée de la présence du taxon et des dégradations survenues sur la station et il est à espérer que cela ne se renouvellera plus. En mars 2024, le recrutement était encore assez important, ce qui pourrait permettre à cette sous-population de se reconstituer.
. Conclusion – La station de Stachys maritima de Mare è Sole est de très petite taille et compte peu d’individus. Malgré les nombreux impacts, elle est parvenue à se maintenir sur le site depuis plus de cent-cinquante ans. Les aménagements effectués par la mairie devraient être favorables au taxon, si toutefois le site n’est plus perturbé de façon importante lors des travaux d’entretien de ces aménagements ou lors de la préparation de la saison estivale (circulation motorisée, terrassement pour l’installation de câbles et tuyaux…). Il conviendra de continuer le suivi de cette sous-population pour suivre son évolution et faire de nouveaux porter à connaissance en cas de nouvelles dégradations.
Cargèse
Deux sous-populations d’épiaire maritime ont été observées sur la commune de Cargèse, mais aucune n’a été revue en 2022 et 2023. Il s’agissait de sous-populations comprenant plusieurs individus.
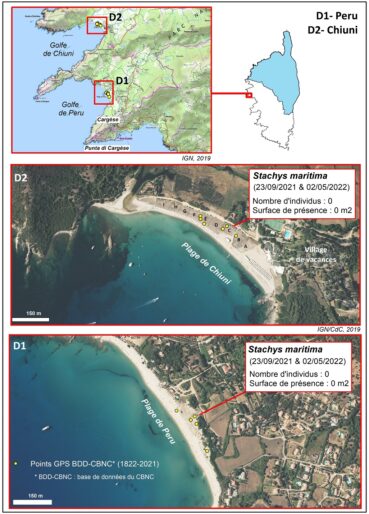
Peru (planches 18 et 19 ; tableau 3)
La plage de Peru, d’une longueur de 820 m, occupe le fond du golfe du même nom, compris entre les pointes rocheuses de la Punta di Cargèse au sud et de la Punta d’Omigna au nord. Dans la partie centrale du site se trouvent une plage aérienne d’une vingtaine de mètres de large, une dune de pente variable (5 à 20°) d’une cinquantaine de mètres et, enfin, une dune haute (5-6 m) stabilisée par un fourré à lentisques, dominant les champs de la plaine de Peru. Stachys maritima, a été trouvé en plusieurs endroits, en avant du fourré littoral.
Lauranceau (1949) signale le taxon pour la première fois en 1949 (Briquet & de Litardière, 1955). Il sera revu par Deschâtres (1985, in Jeanmonod & Burdet, 1987) et Paradis et Piazza en 1993 et 1995 (Paradis & Piazza, 1999). Recherché en 2021 et 2023, il n’a pas été retrouvé. Des relevés réalisés en 1995 montrent que le taxon était présent dans une mosaïque entre l’Eryngio maritimi-Elymetum farcti et le Sileno sericeae-Vulpietum fasciculatae.
. Protection – Le cordon littoral et la dune de Peru ne bénéficient d’aucune protection, qu’elle soit réglementaire ou foncière
. Menaces – Le site est très fréquenté et a été fortement impacté par les activités humaines dans le passé (prélèvements de sable, urbanisation aux extrémités NW et SE du site, création de pistes et d’aires de stationnement à l’arrière de la dune, constructions de plusieurs paillotes, plantation d’espèces exotiques envahissantes…). Les établissements touristiques sont toujours présents aujourd’hui, mais depuis une quinzaine d’années le massif dunaire a été mis en défens par des ganivelles, ce qui limite un peu les impacts.
. Conclusions – Le site est toujours soumis à de fortes pressions, mais il n’est pas impossible de retrouver le taxon. Une veille est à prévoir.
Chiuni (planches 18 et 19 ; tableau 3)
Situé au fond d’un golfe entre la Punta d’Omigna au sud et la Punta d’Orchinu au nord, le site de Chiuni est constitué, dans sa majorité, de sable grossier. Il comprend : (a) une plage aérienne, peu large et à forte pente, d’une longueur de 750 m, (b) un sommet plat dépassant 5 m d’altitude et (c) un revers en pente moyenne, dominant de 1 à 2 m la plaine alluviale du ruisseau de Chiesaccia. L’embouchure de ce ruisseau se situe à l’extrémité nord du cordon. Une telle géomorphologie paraît correspondre à une basse terrasse fluvio-marine (Paradis & Piazza, 1999). Stachys maritima a été observé à l’arrière de la terrasse par Deschâtres en 1985 (in Jeanmonod & Burdet, 1987), Paradis et Piazza en 1993 et 1995 (Paradis & Piazza, 1999), Delage et Paradis, en 2012 (in BDD-CBNC) et Féral en 2014 (BDD OGREVA-DREAL in BDD-CBNC). Le taxon n’a pas été revu depuis, bien qu’activement recherché en 2021 et 2023. Comme sur le site précédent, le taxon était présent dans une mosaïque entre l’Eryngio maritimi-Elymetum farcti et le Sileno sericeae-Vulpietum fasciculatae.
. Protections – Le cordon littoral de Chiuni est intégré au périmètre de la ZNIEFF de type I 940030288 « Punta Omigna, Punta di Cargese, plages de Peru et de Chiuni ».
. Menaces – À partir des années soixante, les parties nord et sud/sud-est du site ont été urbanisées (villas au nord, centre de vacances au S/SE). Une large piste a été tracée à l’arrière du cordon comprenant de nombreuses places de stationnement, ce qui a permis d’accroître fortement la fréquentation. Pour préserver le milieu, la commune a entrepris en 2012 des travaux d’aménagements de la plage et de ses accès. Des ganivelles ont été installées sur tout le cordon et huit passages perpendiculaires à la mer ont été créés pour canaliser le public, formant ainsi neuf « casiers », numérotés de A à I depuis le S/SE du cordon jusqu’à l’W. Des panneaux de sensibilisation ont été posés. Le taxon comptait le 12 mars 2012 104 pieds : 15 pieds dans le casier A, 39 dans le casier B, 49 dans le casier C et 1 dans le casier D (observation de G. Paradis). Le taxon était présent dans les zones dénudées où le sable avait été remobilisé par des impacts modérés et par la dynamique éolienne. En 2014 de rares pieds ont été observés par Feral. Depuis lors, plus aucun pied n’a été observé. L’absence totale de perturbations et de saupoudrage de sable provenant de la plage a eu pour conséquence un tassement du sable et une modification des cortèges floristiques. Le milieu se referme et l’arrière est colonisé par des formations denses à Plantago coronopus dominant. Cette absence de milieux ouverts et de remobilisation du sable semble avoir été très défavorable au maintien du taxon sur le site.
. Conclusions – Le taxon paraît avoir disparu du site de Chiuni et les aménagements réalisés pour protéger celui-ci pourraient en être responsables. Il conviendrait de revoir le dispositif et peut-être de ne laisser qu’une ganivelle à l’arrière de la terrasse pour éviter la circulation motorisée, mais permettre un libre accès pour les piétons à l’ensemble du cordon.
Agriate
La région de l’Agriate, en Haute-Corse, s’étend sur environ 15 000 hectares. Ce vaste territoire est limité au nord par 37 km de rivages naturels sans urbanisation, à l’est par la ville de Saint-Florent et la plaine du Nebbiu et à l’ouest par la vallée de l’Ostriconi. Stachys maritima a été signalé dans deux localités de l’Agriate : Saleccia, sur la commune de Santo-Pietro-di-Tenda (une vingtaine de pieds reproducteurs), et Mezzanu (sous-population à pied unique), sur la commune de Saint-Florent. Toutes deux ont été retrouvées.
Saleccia (planches 20 et 21 ; tableau 4)
La plage de Saleccia est un long bandeau de sable blanc et fin qui s’étend sur près de 1 200 m. Elle est limitée au NE par la Punta di Curza et au SW par l’embouchure du marais de Padulella qui est alimenté par un petit fleuve côtier, le Liscu. À l’arrière de la plage se trouvent des dunes à Juniperus oxycedrus subsp. macrocarpa et une vaste forêt de Pinus halepensis, plantée à la fin du xixe siècle.
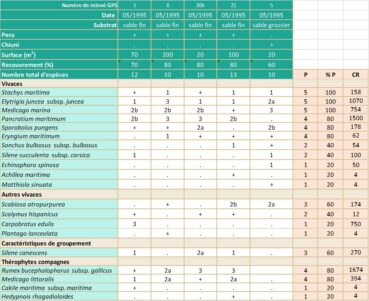
La sous-population de Stachys maritima de Saleccia a été observée pour la première fois par Deschâtres, en 1983 (Jeanmonod & Burdet, 1987), puis par Jeanmonod, Roguet et Natali en 1986 (Jeanmonod & Burdet, 1987). Nous l’avons revue en 2022 et 2023, en rive gauche du marais de Padulella, sur sable, dans deux ouvertures créées à l’intérieur du fourré littoral à genévriers. La station se trouve sur sable fin, entre une ceinture plus ou moins continue à Juncus acutus, côté embouchure du Liscu, et la pinède à pin d’Alep, côté terre (Piazza, in BDD-CBNC). Les relevés de végétation montrent que le taxon est présent au sein d’un groupement à thérophytes, le Sileno sericeae-Vulpietum fasciculatae, qui présente également quelques rares taxons de l’Eryngio maritimi-Elymetum farcti.
En juin 2022, la station comptait 17 individus : 11 fleuris, dont un de 25 cm de diamètre, 4 pieds non fleuris de 10 à 15 cm de diamètre et 2 pieds secs. En mai 2023, 24 pieds ont été recensés, tous non fleuris : 9 pieds adultes de 10 à 20 cm de diamètre, 5 jeunes pieds de 2 à 3 cm de diamètre et 17 très jeunes pieds de 0,5 à 1,5 cm de diamètre. La surface où vit le taxon est d’environ 100 m2.
. Protections – La sous-population de Stachys maritima de Saleccia se trouve sur un terrain appartenant au Cdl. Elle est aussi dans le périmètre Natura 2000 FR9400570 « Agriates » et dans celui de la ZNIEFF de type I 940004073 « Zone humide de Saleccia-Loto ». Elle dispose donc de protections réglementaire et foncière importantes.
. Menaces – Ce site fait partie d’une vaste zone naturelle, dont près de 5 700 hectares appartiennent au Cdl et il est éloigné des zones urbanisées. Resté relativement sauvage, il est très réputé pour la beauté de ses paysages et draine un flux important de touristes en été, aussi bien par la piste qui conduit à la plage que par la mer. Bien qu’il ait déjà fait l’objet de nombreux aménagements concertés avec l’ensemble des acteurs du territoire, la surfréquentation devient problématique et des mesures sont envisagées pour en limiter les impacts. La station d’épiaire maritime se trouve, elle, à l’entrée du site, mais dans un endroit relativement isolé et peu fréquenté, à l’exception du bétail (bovins) qui favorise des perturbations modérées.
. Conclusions – Bien que peu étendue et de petite taille, cette sous-population ne semble pas actuellement menacée et se maintient depuis les années 1980. Elle bénéficie de nombreuses protections et semble assez épargnée par les activités anthropiques. Il serait important que la Collectivité de Corse, gestionnaire du site, veille à sa préservation.
Mezzanu (planches 20 et 21 ; tableau 4)
À près de quatre kilomètres à vol d’oiseau à l’est de la plage de Saleccia, le site de Mezzanu se trouve entre la plage du Loto à l’ouest et la Punta di Cavallata à l’est. Il s’agit d’un petit cordon de sable fin, d’orientation NW/SE, d’environ 50 m de long, encaissé entre deux massifs granitiques, et qui remonte le long de l’embouchure du ruisseau de Mezzanu sur plus de cent mètres. Le ruisseau s’écoule à l’est du cordon, contre le relief rocheux. À environ un mètre au-dessus de la plage, en rive gauche du ruisseau, se trouve une petite dune, dont l’extrémité sud est limitée à l’ouest par une petite zone humide et à l’est par le ruisseau de Mezzanu. La végétation est constituée : 1/ le long de la rive gauche du ruisseau, par une ceinture plus ou moins continue à Juncus acutus subsp. acutus et Limbarda crithmoides subsp. longifolia dominants, 2/ à la limite entre la plage et la dune, par un groupement à Eryngium maritimum et Elytrigia juncea subsp. juncea et 3/ sur la dune, par quelques bosquets de Juniperus oxycedrus subsp. macrocarpa et/ou J. phoenicea subsp. turbinata et des formations thérophytiques à Vulpia fasciculata nettement dominant.
Un pied isolé de Stachys maritima a été trouvé à l’extrémité sud de la dune, en 2010, par Spinosi, Panaïotis & Anquez, (in BDD-CBNC). Recherché en juin 2022, le taxon a été revu. Mais, là encore un seul individu était présent. Il s’agissait d’un pied en fruits de 30 cm de diamètre, de 38 cm de hauteur et avec cinq hampes florales.
. Protections – Cette micropopulation se trouve aussi sur un terrain appartenant au Cdl et dans le périmètre Natura 2000 FR9400570 « Agriates ». Elle dispose donc de protections réglementaire et foncière importantes.
. Menaces – Ce site est beaucoup moins fréquenté que les plages de Saleccia et du Loto. Le sentier littoral le traversant draine du monde sur la plage, mais sans excès. La dune est donc assez préservée de la surfréquentation. Le bétail a, par contre, un impact relativement important sur le site et a modifié la végétation. Les espèces consommées ont fortement diminué, notamment Elytrigia juncea subsp. juncea. Les espèces non consommées se sont, elles, fortement développées (Eryngium maritimum, Euphorbia paralias, Pancratium maritimum). Mais cela a peu de conséquence pour le maintien de l’épiaire maritime sur ce site.
. Conclusions – Cette micropopulation ne semble pas menacée. Elle bénéficie de nombreuses protections et semble assez épargnée par les activités anthropiques. Mais une action de veille est à envisager.
4.4. Synthèse des données (tableau 5)
Trente-deux sous-populations ont été signalées en Corse. Toutes ont été recherchées entre fin 2021 et 2023 (à l’exception de celle de l’île Piana). Le taxon n’a pas été revu sur la plupart des très petites stations ne comportant qu’un seul ou quelques individus. Cela concerne 18 des 21 sous-populations de la Plaine orientale et celles des cordons littoraux de Fautea, de l’Ovu Santu et de Balistra. Deux populations plus importantes situées sur la commune de Cargèse (Peru et Chiuni) n’ont pas, non plus, été revues.
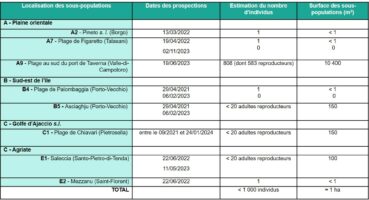
Au cours de cette étude, seules huit sous-populations ont été retrouvées : Pineto s. l., Figaretto, plage au sud du port de Taverna, Palombaggia, Asciaghju, Mare è Sole, Saleccia et Mezzanu. La plus importante est celle présente au sud du port de Taverna qui compte entre 800 et 1 000 individus (dont plus de 70 % de pieds reproducteurs). Viennent ensuite trois sous-populations de moins de vingt pieds reproducteurs (Asciaghju, Mare è Sole et Saleccia). Enfin, quatre sous-populations à un seul individu ont également été retrouvées : Pineto, Figaretto, Palombaggia et Mezzanu.
Le fait de n’avoir pas revu la plupart des sous-populations à pied unique n’est pas trop inquiétant, car il s’agit de populations à éclipses, qui réapparaissent épisodiquement. Par contre, la disparition (qui reste à confirmer par des passages réguliers sur les sites) des sous-populations de plus grande taille de Cargèse est plus problématique. La population totale de l’île est estimée en 2024 à moins de mille individus, vivant sur une surface d’environ un hectare.
Concernant les huit sous-populations où le taxon a été revu :
. trois appartiennent au Cdl : Pineto s. l. (pour partie), Saleccia et Mezzanu,
. cinq font partie du réseau Natura 2000 : Pineto (pour partie), Palombaggia, Asciaghju, Saleccia et Mezzanu,
. cinq sont classées en zone naturelle d’intérêt écologique faunistique et floristique (ZNIEFF) de type I : Pineto s. l., Palombaggia, Asciaghju, Mare è Sole et Saleccia,
. deux ne bénéficient d’aucun statut : Figaretto et surtout la plus importante sous-population de l’île, celle de la plage au sud du port de Taverna.
5. Conclusions et perspectives (planche 22)
Stachys maritima, n’est pas protégé sur l’île et n’est pas non plus un taxon endémique. Mais, comme le montre cette étude, il est extrêmement rare en Corse. Sa situation est également préoccupante sur l’ensemble de son aire de présence.
Sur les six sous-populations connues comprenant plus d’un individu, deux n’ont pas été revues depuis plusieurs années (Peru et Chiuni). Étant une plante littorale, certains de ses habitats ont été fortement dégradés en raison du développement touristique (plusieurs sites de la plaine orientale, Asciaghju, Peru). Le site de Chiuni a été aménagé pour protéger les habitats littoraux, mais l’absence totale de perturbations semble avoir été fatal au taxon. Dans ce cas, les aménagements devraient être repensés. Enfin, sur les quatre plus importantes sous-populations de l’île, seule celle de Saleccia bénéficie de protections réglementaire et foncière suffisantes. Les trois autres (Asciaghju, Mare è Sole et sud du port de Taverna pour partie) sont toujours soumises à des dégradations plus ou moins importantes.
Dans la BDD du CBNC, le taxon est signalé dans 25 mailles de 5 km × 5 km, entre les années 1825 et 2021. Entre 2000 et 2021, période retenue par le CBNC dans le cadre du travail sur la stratégie de conservation « flore » pour la Corse, on ne dénombre que douze mailles de présence, ce qui a contribué au classement du taxon dans la catégorie d’enjeu de conservation « fort ». Enfin, sept mailles de présence sont notées en 2024 (dont trois concernant des sous-populations ne comportant qu’un individu et à éclipses). Quelle que soit la période de référence (1822-2021, 2000-2021 ou 2022-2024) et selon la méthodologie retenue, le taxon reste évalué en enjeu de conservation « fort » sur l’île. Il n’entre pas dans la catégorie d’enjeu « très fort », car il ne s’agit pas d’un taxon endémique de la Corse, mais ses sous-populations sont peu nombreuses et ses habitats sont considérés comme vulnérables sur l’île.
L’évaluation de Stachys maritima en « EN » (en danger) dans la Liste rouge des espèces menacées en France (UICN France et al., 2018) est totalement justifiée. De plus, l’inscription du taxon sur la liste des espèces protégées au niveau national est fortement souhaitable.
Au vu de sa régression sur l’ensemble de son aire de présence, la conservation du taxon est aujourd’hui envisagée à plus grande échelle (au moins à l’échelle de la Méditerranée). Des contacts ont déjà été pris. Ils permettront de mutualiser les connaissances et les bonnes pratiques. Il conviendra aussi de renforcer les acquisitions foncières et la réglementation sur certains des sites à Stachys maritima, de mettre en place une action de veille sur l’ensemble des sous-populations et de rechercher celles qui n’ont plus été revues.
Note 1. « Bilan stationnel (site inventory) : méthode d’inventaire spécifique de terrain pour toutes les stations avérées et historiques ou pour un nombre représentatif de stations (si N > 20), avec relevé des informations précises sur l’état des cibles. Cet état des lieux sert également à évaluer l’état de conservation des cibles » (in RESEDA-FLORE (coord.), 2024).
Note 2. Les coefficients de recouvrement (CR) ont été légèrement modifiés pour les coefficients 2a et 2b, c’est-à-dire en donnant les valeurs suivantes (quantités moyennes) aux coefficients d’abondance-dominance : 5 = 87,5 ; 4 = 62,5 ; 3 = 37,5 ; 2b = 18,5 ; 2a = 8,5 ; 1 = 2,5 ; + = 0,2 ; r = 0,1. Ainsi, dans chaque relevé, la quantité moyenne des coefficients d’abondance-dominance a été additionnée, pour chacun des taxons, et la somme obtenue a été divisée par le nombre total des relevés du tableau, puis multipliée par 100 pour obtenir le CR.
Annexe : Suivi photographique d’un individu de Stachys maritima à Figaretto, entre mai 2022 et novembre 2023.
Bibliographie
Anonyme, 1999. Natura 2000, Manuel d’interprétation des habitats de l’Union européenne – EUR 15/2. Commission européenne, DG Environnement, Protection de la nature, zones côtières et tourisme, 127 p.
Anonymous, 2007. Interpretation Manual of European Union Habitats – EUR 27. European Commission DG Environment, Nature and Biodiversity, 142 p.
Aydin A., 1978. Reports. In A. Löve (ed.), IOPB Chromosome Numbers Reports LXI, Taxon 27 (4) : 375-392 (Stachys maritima p. 375).
Bardat J., Bioret F., Botineau M., Boullet V., Delpech R., Géhu J.-M., Haury J., Lacoste A., Rameau J.-C., Royer J.-M., Roux G. & Touffet J., 2004. Prodrome des végétations de France. Patrimoines naturels 61 (Publications scientifiques du Muséum national d’Histoire naturelle, Paris) : 1-171 p.
Barriocanal C. & Banché C., 2002. Estat de conservació i propostes de gestió per a Stachys maritima Gouan a la península Ibèrica. Orsis 17 : 7-20.
Blanché C., Barriocanal C., Martinell M. C., Massó S. & López-Pujol J., 2010. Deu anys de seguiment demogràfic i genètic d’Stachys maritima a Catalunya (2001-2010). Implicacions per a un pla de recuperació. Collectanea Botanica 29 : 59-78, 10.3989/collectbot.2010.v29.006.
Bolòs (de) O. & Vigo J., 1995. Flora dels Països Catalans. Editorial Barcino, Barcelona, III, 1230 p. (Stachys maritima p. 281).
Briquet J. & de Litardière R., 1955. Prodrome de la Flore Corse, 3 (2). Paul Lechevalier, Paris, 264 p. (Stachys maritima p. 187-188).
CBNC (Conservatoire botanique national de Corse), 2016. EUNIS, Liste pour la Corse. Système d’information européen sur la nature. Classification des habitats. Office de l’environnement de la Corse-CBNC, Corte, 32 p
Coste H., 1906. Flore descriptive et illustrée de la France, de la Corse et des contrées limitrophes. Albert Blanchard, Paris, 3, 807 p. (Stachys maritima p. 116).
Delage A. & Hugot L., 2015. Liste rouge régionale de la flore vasculaire de Corse. Conservatoire botanique national de Corse, Office de l’environnement de la Corse, Corte, 72 p.
Devillers P., Devillers-Terschuren J., Ledant J.-P. et al., 1991. CORINE biotopes manual. Habitats of the European Community. Data specifications, part 2. EUR 12587/3 EN. European Commission, Luxembourg, 300 p.
ENGREF, 1997. Nomenclature CORINE Biotopes. Types d’habitats français (travail réalisé par M. Bissardon et L. Guibal, sous la direction de J.-C. Rameau). Muséum national d’histoire naturelle, Paris, 217 p.
Gamisans J., 1981. Contribution à l’étude de la flore Corse, VIII. Candollea 36 : 1-17 (Stachys maritima p. 14).
Gamisans J., 1992. Flore et végétation des îles Cerbicale (Corse-du-Sud). Travaux scientifiques du PNR et RN de Corse, 37 : 69-99 (Stachys maritima p. 85).
Gargominy O., Tercerie S., Regnier C., Ramage T., Dupont P. & Daszkiewicz P. & Poncet L., 2022. TAXREF, référentiel taxonomique pour la France : méthodologie, mise en œuvre et diffusion. Rapport PatriNat (OFB-CNRS-MNHN), Muséum national d’histoire naturelle, Paris, 47 p.
Géhu J.-M., 2006. Dictionnaire de sociologie et synécologie végétales. J. Cramer, Berlin-Stuttgart, 899 p.
Géhu J.-M. & Rivas-Martínez S., 1981. Notions fondamentales de phytosociologie. Berichte der Internat. Symposium d. Internat. Vereinigung f. Vegetationskunde : 5-33.
Gonard A., 2015. Lamiacées de France, flore illustrée en couleurs. Bulletin de la Société botanique du Centre-Ouest, n. s., n° spécial 42 : 1-526 (Stachys maritima p. 400-401).
IGN, 2019. Cartes à 1 : 25 000, TOP 25 (4151 OT-Vico-Cargèse ; 4153 OT-Ajaccio ; 4253 ET-Aiguilles de Bavella-Solenzara ; 4254 ET-Porto-Vecchio ; 4255 OT-Bonifacio ; 4348 OT-Bastia ; 4349 OT-Vescovato ; 4351 OT-Cervione ; 4352 OT-Aleria.Ghisonaccia). Institut national de l‘information géographique et forestière.
IGN/CdC, 2019. Photographies aériennes, mission Corse. Institut national de l’information géographique et forestière.
INGECORSE (bureau d’études Environnement), 2022. Projet de réaménagement et d’entretien d’un ouvrage d’échange hydraulique durable entre l’étang d’Urbinu et la mer. Dossier d’étude d’impact réalisé pour le compte du Conservatoire du littoral, 385 p. (Stachys maritima p. 115 et 145).
Jeanmonod D. & Burdet H.-M., 1987. Notes et contributions à la flore de Corse, II. Candollea 42 : 25-95 (Stachys maritima p. 72).
Jeanmonod D. & Gamisans J., 2013. Flora Corsica, 2e éd. Bulletin de la Société botanique du Centre-Ouest, n. s., n° sp. 39, 1074 p. (Stachys maritima p. 655).
Koeva-Todorovska J.T., 1988. Kariologicno I polenomorfologicno izsledvane na vidovete ot rod Stachys L. in Balgarija. Centenary of Academy N.J. Stojanov : 138-151.
Kuhnholtz-Lordat G., 1924. Essai de géographie botanique sur les dunes du golfe du Lion. Thèse Sciences, Paris, 307 p.
Lauranceau J., 1949. Herborisations dans les environs de Piana (Corse). Le Monde des Plantes 262 : 51-55.
López-Pujol J., Orellana M.R., Bosch M., Simon J. & Blanché C., 2003. Effects of habitat fragmentation on allozyme diversity and conservation status of the coastal sand dune plant Stachys maritima (Lamiaceae) in the Iberian Peninsula. Plant Biologie 5 : 504-512.
Massó S., Blanché C., Barriocanal C., Martinell M.C. & López-Pujol J., 2016. How habitat fragmentation affects genetic diversity? The case of a sand dune plant (Stachys maritima) in the Iberian Peninsula. Advances in Genetics Research 16 : 65-78.
Morales R. & Pardo de Santayana M., 2010. Stachys. In S. Castroviejo, R. Morales, A. Quintanar A., F. Cabezas, A. Pujadas & S. Cirujano (eds.), Flora iberica – Plantas vasculares de la Península Ibérica e Islas Baleares, Reál Jardín Botánico, CSIC, XII, 250 p. (Stachys maritima p. 226-227).
Olivier L., Galland J.-P., Maurin H. & Roux J.-P., 1995. Livre Rouge de la flore menacée de France, 1 – espèces prioritaires. Muséum national d’histoire naturelle, service du Patrimoine naturel, Conservatoire botanique national de Porquerolles, ministère de l’Environnement, Paris.
Paradis G., 1992. Description de la végétation de quatre sites littoraux de la Corse orientale : Mucchiatana, Fautea, Pont de Fautea, Favone. Bulletin de la Société des sciences et d’histoire naturelle de la Corse 661 : 363-418 (Stachys maritima p. 374, 394 et 395).
Paradis G. & Piazza C., 1999. Étude phytosociologique et cartographique de la végétation de plages des environs de Cargèse (Corse occidentale) : Arone, Chiuni, Peru, Capizzolu, Stagnoli. Documents phytosociologiques XIX : 164-217 (Stachys maritima p. 180, 183, 188, 190).
Paradis G. & Piazza C., 2020. Flore et végétation d’une portion de côte en accrétion : sud du port de Taverna (côte orientale de la Corse). Bulletin de la Société botanique du Centre-Ouest, n. s., 51 : 248-307.
Piazza C. & Paradis G., 1994. Étude phytosociologique et cartographique d’un site littoral sableux en voie de dégradation anthropique : le cordon de Balistra (sud de la Corse). Bulletin de la Société botanique du Centre-Ouest, n. s., 25 : 59-98 (Stachys maritima p. 73).
Piazza C. & Paradis G., 2000. Description phytosociologique et cartographique de la végétation du cordon littoral de Palo (côte orientale de la Corse). Bulletin de la Société botanique du Centre-Ouest, n. s.., 31 : 115-170 (Stachys maritima p. 168).
Piazza C., Spinosi P., Quiquerez I., Delage A. & Hugot L., 2021. Stratégie de conservation de la flore vasculaire de Corse, 1re partie – Hiérarchisation des taxons et détermination des enjeux de conservation. Conservatoire botanique national de Corse/Office de l’environnement de la Corse, 102 p.
Piazza C., Spinosi P., Delage A. & Hugot L., 2022. Stratégie de conservation de la flore vasculaire de Corse. 2e partie – Typification des actions, priorisation et choix des projets. Conservatoire botanique national de Corse/Office de l’environnement de la Corse, 104 p.
Pignatti, S., 2017. Flora d’Italia, 2nd éd. Edagricole, Bologna, 3, 1287 p. (Stachys maritima p. 247).
RESEDA-FLORE (coord.), 2024. Glossaire pour la conservation de la flore et des milieux naturels méditerranéens, v. 2. CBNMED, CBNA, CBNC, CBNMC, CEFE-CNRS, AMAP, IMBE, ISEM, LESSEM, Tour du Valat, 15 p.
Reymann J., Panaïotis Ch. & Bioret F. (coord.), 2016. Prodrome des végétations de Corse. Documents Phytosociologiques, série 3, 4 : 1-175.
Tison J.-M. & de Foucault B. (coords), 2014. Flora Gallica. Flore de France. Biotope, Mèze, xx + 1 196 p. (Stachys maritima p. 812).
UICN France, FCBN, AFB & MNHN, 2018. La Liste rouge des espèces menacées en France, chapitre Flore vasculaire de France métropolitaine. Paris, 31 p.
Ugo J., 2019. Note d’information sur l’épiaire maritime (Stachys maritima) en France continentale méditerranéenne. Conservatoire botanique national méditerranéen de Porquerolles, 20 p.
Ugo J., Burkhart J.-A., Dixon L. & Diadema K., 2023. Plan régional d’action en faveur de l’épiaire maritime (Stachys maritima) 2024-2034. Conservatoire botanique national méditerranéen de Porquerolles, 79 p. + annexes.
Vanden Berghen C., 1982. Initiation à l’étude de la végétation. Jardin botanique national de Belgique, Meise, 263 p.
Remerciements
Nous remercions vivement Alain Gauthier (docteur en géologie et auteur de très nombreux livres sur le milieu naturel de la Corse) qui nous a aimablement donné des photographies aériennes obliques prises en hélicoptère du port de Taverna en octobre 2009 et décembre 2013.