Panicum hillmanii Chase, un taxon discret nouvellement découvert dans le Languedoc
Title
Panicum hillmanii Chase, an inconspicuous taxon newly discovered in Languedoc
Résumé
La graminée Panicum hillmanii Chase originaire du nord de l’Amérique et naturalisée en France a été observée pour la première fois dans le Sud-Est, en Provence, en 1992, puis dans l’ouest du pays plus récemment, au cours des années 2000 et 2010. Elle vient d’être découverte en Languedoc, plus précisément dans le Gard et l’Hérault, dans quatre localités occupées par de la vigne. Ces observations complètent la distribution de l’espèce dans le sud de la France et confirment son écologie liée à des milieux agricoles. Les critères permettant de la discriminer des deux autres taxons du groupe P. capillare dont elle est proche sont par ailleurs rappelés.
Abstract
The grass Panicum hillmanii Chase native to North America and naturalized in France was first observed in the South-East, in Provence, in 1992, then more recently in the west of the country during the years 2000 and 2010. It has just been discovered in Languedoc, more precisely in Gard and Hérault, in four localities occupied by vineyards. These observations update the distribution of the species in the south of France and confirm its ecology linked to agricultural environments. The criteria that discriminate it from the two other taxa of the P. capillare group to which it is close are also recalled.
1. Les observations de la plante
On ne s’attend pas nécessairement à trouver des choses bien originales quand on sillonne une vigne du Gard. On fouine un peu, encore et toujours les mêmes rudérales, quelques lignes du carnet de terrain sont noircies par principe. On récolte par acquis de conscience quelques plantes appartenant à des groupes complexes afin de confirmer qu’il s’agit toujours des mêmes espèces. Sauf que pour une fois, surprise, la plante sous la binoculaire est une nouveauté pour le territoire. Ce nième échantillon d’un supposé Panicum capillare L. s’est avéré être un P. hillmanii Chase, un taxon nouveau pour le Languedoc et plus largement l’Occitanie. Il a été collecté le 17 octobre 2020 par Frédéric Andrieu au lieu-dit Cancade sur la commune de La Rouvière. Et comme une nouveauté en appelle parfois d’autres, trois autres localités de la même espèce sont découvertes l’année suivante. La deuxième est mise à jour dans le même secteur, le 26 septembre 2021 sur la commune voisine de Montignargues, au lieu-dit les Murles, par le même observateur. Alerté par cette découverte publiée dans le Bloc-Note de botanique n° 16 de la Société d’horticulture et histoire naturelle de l’Hérault (https://s2hnh.org/wp-content/uploads/2020/12/BNB_16.pdf), Guillaume Fried prête une attention particulière aux individus du groupe P. capillare lors de l’échantillonnage d’un réseau de quarante parcelles de vignes du Montpellierais. Bien lui en prit, puisque les deux récoltes de Panicum s’avèrent à chaque fois être P. hillmanii. Deux autres localités ont ainsi été découvertes dans l’Hérault, d’une part sur la commune de Campagne au lieu-dit Roubayrolle le 09 nomvembre 2021 et d’autre part à Saint-Bauzille-de-Montmel au lieu-dit Favas le 15 novembre 2021.
2. Le groupe Panicum capillare en France
Le genre Panicum se compose d’une centaine d’espèces à distribution majoritairement pantropicale (Kellogg, 2015). En Amérique du Nord, certains de ses représentants remontent même plus au nord, jusqu’à la hauteur du Canada (http://beta.floranorthamerica.org/Main_Page). La caractérique que les espèces du genre Panicum partagent v avec toutes les espèces relevant de la sous-famille des Panicoideae Link est de présenter deux fleurs appariées, la supérieure généralement hermaphrodite, l’inférieure réduite à une étamine ou stérile.
Sur les sept espèces du genre Panicum recensées en France (Tison & de Foucault, 2014), P. repens L. est la seule considérée comme indigène. Elle possède une distribution subtropicale et est connue du littoral de Provence et de Corse. Les six autres espèces sont naturalisées. Parmi celles-ci, P. miliaceum L., originaire d’Asie, est devenu cosmopolite et est fréquent dans une grande partie de la France avec trois sous-espèces pour le représenter ; P. schinzii Hack., originaire d’Afrique du Sud, est présent dans l’ouest de la France où il reste rare ; P. dichotomiflorum Michx., originaire d’Amérique du Nord, est dispersé un peu partout en France. Les trois dernières espèces sont originaires d’Amérique du Nord et appartiennent au complexe de P. capillare avec P. capillare L. (au sens strict), P. barbipulvinatum Nash (= P. capillare subsp. barbipulvinatum (Nash) Tzvelev, P. capillare var. occidentale Rydb., P. riparium H. Scholz) et P. hillmanii Chase (= P. capillare subsp. hillmanii (Chase) Freckmann & Lelong). Ce sont des taxons morphologiquement proches et étroitement apparentés, qui demandent un examen attentif pour les distinguer. Leur considération au rang d’espèce adoptée en France et dans l’est de l’Europe n’est pas partagée par les botanistes anglo-saxons dont l’approche plus synthétique les place au rang de sous-espèce, voire de variété (Freckmann & Lelong, 2003, 2007).
Au sens strict, P. capillare est de loin le plus fréquent des trois taxons du groupe en France. Signalé dès le début du xixe siècle, il est présent dans la quasi-totalité des départements. Il occupe les friches et les pelouses ouvertes dans les milieux rudéraux et les systèmes rivulaires, et investit même les cultures. Mais les révisions récentes remettent en cause nombre de ses mentions passées, au moins en contexte rivulaire, au profit de P. barbipulvinatum. Ce dernier, ignoré des botanistes européens, a été mis en évidence en Europe tout récemment (Amarell, 2013) et plusieurs citations historiques attribuées par erreur à P. capillare (Dirkse & Holverda, 2016) lui sont désormais attribuées. Il en est de même de P. riparium H. Scholz, décrit récemment et considéré comme un néotaxon européen (Scholz, 2002) et mis depuis en synonymie de P. barbipulvinatum par les travaux d’Amarell. P. barbipulvinatum est principalement connu des systèmes rivulaires en Europe et est indiqué en France dans les bassins du Rhône, de la Durance et de la Loire, ainsi que dans la plaine du Roussillon et en Aquitaine. Cette distribution est sans doute mal connue et encore sous-estimée. Aux Pays-Bas, la révision des collections d’herbiers montre que ce serait en fait le taxon le plus commun des trois espèces du groupe dans ce pays (Dirkse & Holverda, 2016). Quant à P. hillmanii, c’est le taxon le moins fréquent du trio. Ses premières citations en France remontent aux années 1990.
3. Distribution de P. hillmanii
Panicum hillmanii est une espèce originaire d’Amérique du Nord. Dans sa patrie d’origine, il est distribué dans le sud-ouest des États-Unis, entre la Californie à l’ouest et l’Iowa et le Texas à l’est. Ailleurs dans le monde, il est naturalisé dans l’ouest de l’Australie (Jessop, 2006) ainsi qu’en Europe (Clayton et al., 1980), avec une présence confirmée dans plusieurs pays : Autriche (Fischer et al., 2008), Belgique (Verloove, 2018), Pays-Bas (Dirkse & Holverda, 2016), Allemagne (Hügin, 2010), Grèce (Greuter & Raus, 2000), Slovénie (Jogan, 2007), Russie, Biélorussie et Ukraine (Alekseev, 2005).
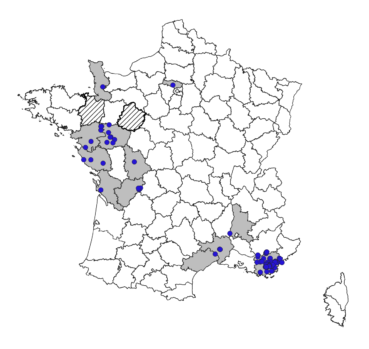
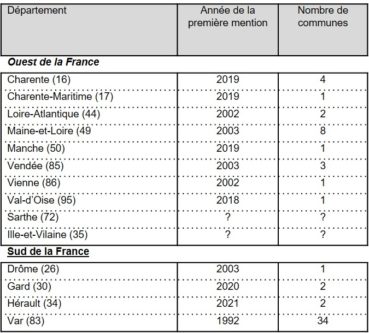
En France (figure 1), ses premières citations datent de 1992 et ont été réalisées en Provence, dans le Var, par André Lavagne au Cannet-des-Maures, puis par Yvette Orsini au Muy (base de données du Conservatoire botanique national méditerranéen). Les années qui suivent ont confirmé l’installation de P. hillmanii dans ce département qui est à ce jour celui où il est le plus fréquent avec une présence attestée dans 34 communes (tableau 1). En 2002 et 2003, les premières mentions de l’espèce sont signalées dans l’ouest de la France, dans la Vienne, la Loire-Atlantique, le Maine-et-Loire et la Vendée, ainsi qu’en vallée du Rhône dans la Drôme. En 2018 et 2019, quatre nouveaux départements sont ajoutés dans la moitié ouest de la France avec la Charente, la Charente-Maritime, la Manche et le Val-d’Oise. Dans les départements de la Sarthe et de l’Ille-et-Vilaine, la présence de P. hillmanii a été signalée, mais nous n’avons pas eu confirmation de ces informations.
Les quatre dernières localités découvertes en Languedoc dans l’Hérault et le Gard élargissent un peu plus à l’ouest l’aire méditerranéenne française de l’espèce. Cette distribution en France est sans nul doute sous-estimée au vu des diverses observations réalisées ces dernières années.
4. Écologie et description des stations du Languedoc
En Amérique, P. hillmanii est indiqué dans les milieux cultivés, les milieux rudéraux, les friches. Dans l’ouest de la France, il fréquente les mêmes types de milieu et s’observe dans les terrains cultivés (maïs…) ou les jachères (Dupont, 2001 ; Hunault & Moret, 2009 ; Philippon et al., 2006). En région parisienne, il a été noté dans une culture maraîchère par Fabrice Perriat (Jordane Cordier, comm. pers.). En Provence, il est régulièrement observé dans les vignes et les friches, mais également dans des pelouses mésophiles, fraîches ou temporairement humides, dans des groupements pionniers sur limons exondés et dans des friches inondables près de cours d’eau. D’autres situations plus marginales sont encore enregistrées comme les talus de route ou les olivettes.
Pour les stations découvertes en Languedoc, la situation est similaire à celle déjà connue. Ce sont des vignes au sein de plaines agricoles. Les sols sont dans les quatre cas profonds et développés à la faveur de placages de colluvions et de limons alluvionnaires récents, et de formations détritiques de l’Oligocène (limons argileux jaunes, avec grès calcareux ou marnes). Le cortège floristique accompagnant P. hillmanii dans ces stations est ordinaire et très classique des milieux de vigne et des friches de la région. Il se compose des espèces suivantes dans les deux stations gardoises :
Amaranthus hybridus L. subsp. hybridus
Amaranthus retroflexus L.
Bothriochloa barbinodis (Lag.) Herter
Bromus hordeaceus subsp. thominei (Hardouin) Braun-Blanq.
Calendula arvensis L.
Chenopodium album L. subsp. album
Cynoglossum creticum Mill.
Diplotaxis erucoides (L.) DC.
Erigeron bonariensis L.
Erigeron canadensis L.
Erigeron sumatrensis Retz.
Euphorbia prostrata Aiton
Heliotropium europaeum L.
Helminthotheca echioides (L.) Holub
Malva sylvestris L.
Polygonum aviculare subsp. depressum (Meisn.) Arcang.
Reseda phyteuma L.
Setaria verticillata (L.) P. Beauv.
Solanum villosum Mill.
Sorghum halepense (L.) Pers.
Tragus racemosus (L.) All.
Tribulus terrestris L.
Dans l’Hérault, les deux stations sont localisées sur des inter-rangs gérés par fauche et par pâturage ovin à la fin de l’hiver. Ce mode de gestion plus extensif permet l’expression d’un cortège plus diversifié, avec quelques éléments prairiaux s’ajoutant aux rudérales classiques :
Agrostis stolonifera L.
Allium vineale L.
Anisantha madritensis (L.) Nevski
Avena sterilis L.
Bothriochloa barbinodis (Lag.) Herter
Carex otrubae Podp.
Chenopodium album L. subsp. album
Cirsium arvense (L.) Scop.
Cirsium vulgare (Savi) Ten.
Convolvulus arvensis L.
Cornus sanguinea L.
Crepis foetida subsp. rhoeadifolia (M. Bieb.) Čelak.
Crepis sancta (L.) Bornm.
Cynodon dactylon (L.) Pers.
Daucus carota L. subsp. carota
Diplotaxis erucoides (L.) DC.
Dipsacus fullonum L.
Epilobium tetragonum L. subsp. tetragonum
Equisetum ramosissimum Desf.
Erigeron canadensis L.
Erigeron sumatrensis Retz.
Erodium cicutarium (L.) L’Hér. subsp. cicutarium
Euphorbia helioscopia L.
Galium mollugo L.
Geranium dissectum L.
Geranium rotundifolium L.
Hedera helix L.
Helminthotheca echioides (L.) Holub
Holcus lanatus L.
Lactuca serriola L.
Lactuca virosa L.
Lolium rigidum Gaudin subsp. rigidum
Malva sylvestris L.
Medicago orbicularis (L.) Bartal.
Mentha suaveolens Ehrh. subsp. suaveolens
Ornithogalum divergens Boreau
Picris hieracioides L. subsp. hieracioides
Plantago lanceolata L.
Plantago major L.
Poa annua L.
Polygonum aviculare L. subsp. aviculare
Poterium sanguisorba L.
Rubus caesius L.
Rumex crispus L.
Rumex pulcher L.
Setaria italica subsp. viridis (L.) Thell.
Solanum nigrum L.
Solanum villosum Mill.
Sonchus asper (L.) Hill
Sonchus oleraceus L.
Tordylium maximum L.
Torilis arvensis (Huds.) Link
Tragopogon dubius Scop.
Trifolium fragiferum L.
Trifolium lappaceum L.
Verbena officinalis L.
Veronica persica Poir.
Vicia hybrida L.
Vicia segetalis Thuill.
Xanthium orientale subsp. italicum (Moretti) Greuter
5. Identification de P. hillmanii
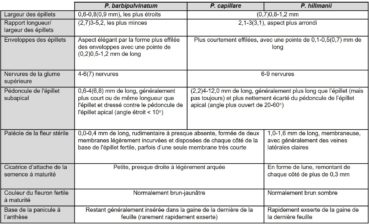
Le tableau 2 résume les caractères permettant de distinguer P. hillmanii des deux autres taxons du groupe P. capillare présents en France (Verloove, 2001 ; Amarell et al., 2014 ; Kiraly & Alegro, 2015 ; Dirkse & Holverda, 2016). Les principaux éléments à retenir pour identifier P. hillmanii sont les suivants :
- la forme de l’épillet: comme capillare, l’épillet présente un aspect ventru (figure 2a) avec ses enveloppes (glume supérieure et lemme de la fleur stérile) terminées en pointe courte inférieure à 0,5 mm (chez P. barbipulvinatum, épillet à aspect plus effilé et plus mince, se terminant en pointe de 0,5 à 1,2 mm de long ; figure 2c) ;
- le pédoncule de l’épillet subapical (figure 2b): comme capillare, il est aussi long ou plus long que l’épillet qu’il porte et est plus ou moins écarté du pédoncule de l’épillet apical, formant généralement un angle de 20 à 60° (chez P. barbipulvinatum, pédoncule plus court ou égal à l’épillet et pour ainsi dire appliqué au pédoncule de l’épillet apical) ;
- les nervures de la glume supérieure: comme capillare, la glume supérieure possède six à neuf nervures (chez P. barbipulvinatum, quatre à six nervures) ;
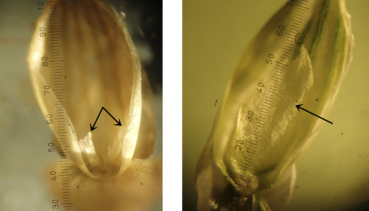
- la cicatrice d’attache du fleuron fertile à maturité (figure 3) : cette « cicatrice » correspond au renflement souvent plus sombre situé des deux côtés de la couche d’abscission qui embrasse latéralement la base de la lemme. Elle est très voyante chez hillmanii, nettement arquée en forme de faucille ou de croissant de lune, et longue, dépassant généralement 0,3 mm de chaque côté (cicatrice peu visible, à peine arquée, presque droite et bien plus courte chez les deux autres espèces) ;
- la paléole du fleuron stérile (figure 4) : chez hillmanii, elle est longue de 1 à 1,6 mm, atteignant la moitié de la lemme, et généralement échancrée (absente ou bien très courte et le plus souvent formée de deux petites lames de moins de 0,4 mm de long, inférieure au quart de la lemme chez les deux autres espèces). À noter que, lors de la révision des herbiers du Centre de biodiversité Naturalis à Leyde et du Musée d’histoire naturelle de Nimègue, Dirkse et Holverda (2016) n’ont trouvé aucune taille intermédiaire de paléole. À la maturité de l’épillet fertile, la paléole stérile reste généralement attachée à la lemme stérile, mais parfois il arrive qu’elle adhère à la fleur fertile.
Conclusion
Ces découvertes successives de P. hillmanii dans le Gard puis dans l’Hérault doivent inciter les botanistes à se pencher systématiquement sur les Panicum du groupe capillare. Cela permettra de préciser la répartition et l’écologie des trois taxons de ce groupe. Le milieu de vignes dans lequel P. hillmanii a été observé occupe de très grande surfaces dans la région et il est très probable que P. hillmanii soit déjà plus largement présent en Languedoc.
Bibliographie
Alekseev Y.E., 2005. Panicum hillmanii Chase, the new adventive species for Russia. Bjulleten’ Moskovskogo Obscestva Ispytatelej Prirody / Otdel geologiceskij 3 : 79-81 (en russe).
Amarell U., 2013. Panicum riparium H. Scholz, eine neoindigene Art Europas? Kochia 7 : 1-24.
Amarell U., Hoffer-Massard F. & Röthlisberger J., 2014. Panicum barbipulvinatum Nash (= Panicum riparium H. Scholz), eine übersehene Art in der Schweiz. Bauhinia 25 : 59-68.
Clayton W.D., 1980. Panicum L. In T.G. Tutin, V.H. Heywood, N.A. Burges, D.M. Moore, D.H. Valentine, S.M. Walters, D.A. Webb, A.O. Chater & I.B.K. Richardson (eds.), Flora Europaea, Cambridge University Press, Cambridge, 5 : 261.
Dirkse G.M. & Holverda W.J., 2016. Panicum capillare L. (Draadgierst) en Panicum barbipulvinatum Nash in Nederland: eerherstel voor een miskende soort. Gorteria 38 : 34-42.
Dupont P., 2001. Atlas floristique de la Loire-Atlantique et de la Vendée. État et avenir d’un patrimoine. Éditions Siloë, Nantes, 2 vol., 175 p. + 599 p.
Fischer M., Oswald K. & Adler W., 2008. Exkursionsflora für Österreich, Liechtenstein und Südtirol. Land Oberösterreich, Biologiezentrum der Oberösterreichischen Landesmuseen, Linz, 1391 p.
Freckmann R.W. & Lelong M.G., 2003. Panicum L. In Flora of North America, 25 – Magnoliophyta: Commelinidae (in part): Poaceae, part 2 : 450-488.
Freckmann R.W. & Lelong M.G., 2007. Panicum L. In M.E. Barkworth, L.A. Anderton, K.M. Capels, S. Long & M.B. Piep (eds.), Manual of Grasses for North America, Intermountain Herbarium & Utah State University Press, Logan, Utah : 289-296.
Greuter W. & Raus Th., 2000. Med-Checklist, notulae 19. Willdenowia 30 (2) : 229-243.
Hügin G., 2010. Panicum dichotomiflorum, P. hillmanii, (P. laevifolium), P. miliaceum subsp. agricola, P. miliaceum subsp. ruderale und Setaria faberi in Südwestdeutschland und angrenzenden Gebieten. Berichte der Botanischen Arbeitsgemeinschaft Südwestdeutschland 6 : 31-68.
Hunault G. & Moret J., 2009. Atlas de la flore sauvage du département de la Sarthe. Muséum national d’histoire naturelle, Paris & Biotope, Mèze, 640 p.
Jessop J., Dashorst G.R.M. & James F.M., 2006. Grasses of South Australia. Wakefield Press, Kent Town.
Jogan N., 2007. Poaceae. In A. Martinčič, T. Wraber, V. Ravnik, N. Jogan, A. Podobnik, B. Turk & B. Vreš (eds.), Small flora of Slovenia, Tehniška založba Slovenije, Ljubljana : 826-932 (en slovène).
Kellogg E.A., 2015. The families and genera of vascular plants (edited by K. Kubitzki), 13 – Poaceae.Springer, 416 p.
Kiraly G. & Alegro A., 2015. Re-evaluation of the Panicum capillare complex (Poaceae) in Croatia. Acta Botanica Croatia 74 (1) : 173-179.
Philippon D., Prelli R. & Poux L., 2006. Atlas de la flore des Côtes-d’Armor, flore vasculaire. Éditions Siloë, Nantes, 566 p.
Tison J.-M. & de Foucault B. (coords), 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1 196 p.
Verloove F., 2001. A revision of the genus Panicum (Poaceae, Paniceae) in Belgium. Systematics and Geography of Plants 71 (1) : 53-72.
Webographie
https://obv-na.fr/ : Observatoire de la flore de la région Nouvelle-Aquitaine
http://www.cbnbrest.fr/ecalluna/ : base de données flore du CBN de Brest
https://cbnbp.mnhn.fr/cbnbp/ : base de données flore du CBN du Bassin parisien
http://floranorthamerica.org/Main_Page : Flora of North America
http://www.plantsoftheworldonline.org/ : Plants of the World Online, Royal Botanic Gardens, Kew
https://www.emplantbase.org/home.html : Euro+Med, Euro-Mediterranean plant diversity
https://florabase.dpaw.wa.gov.au/ : base de données de la flore d’Australie
https://s2hnh.org/recherche-botanique : page botanique de la Société d’horticulture et d’histoire naturelle de l’Hérault
Remerciements
Les plus vifs remerciements sont adressés à Grégory Caze (CBN Sud-Atlantique), Jordane Cordier (CBN du Bassin parisien), Patrick Gatignol, Julien Geslin (CBN de Brest) pour la transmission d’informations sur les localités de P. hillmanii dans l’ouest de la France. Merci également à Marie-Charlotte Bopp puisque les observations dans l’Hérault se sont faites dans le cadre de sa thèse sur la flore des vignes.