Juncus imbricatus Laharpe (Juncaceae), une nouvelle espèce exogène pour la Nouvelle-Aquitaine et la France
Title
Juncus imbricatus Laharpe (Juncaceae), a new alien species for Nouvelle-Aquitaine and France
Résumé
La découverte d’une population de Juncus imbricatus Laharpe à Pessac (Gironde) constitue une première mention pour la France. Il s’agit d’une espèce originaire d’Amérique du Sud et naturalisée en plusieurs autres points du globe. Elle appartient à la section Steirochloa Griseb. et se caractérise notamment par de grandes capsules et des rhizomes épais recouverts des restes fibreux de cataphylles. J. imbricatus colonise des pelouses urbaines plus ou moins rudéralisées et semble en cours de naturalisation. Une première évaluation de son potentiel invasif montre que l’espèce présente un risque élevé, ce qui pourrait motiver une surveillance de la population.
Abstract
A population of Juncus imbricatus Laharpe, discovered in Pessac (Gironde), represents the first mention for France. This species is native to South America and naturalized in several other parts of the world. It belongs to the section Steirochloa Griseb. and is characterized by large capsules and thick rhizomes covered with fibrous remains of cataphylls. J. imbricatus grows in more or less disturbed urban grasslands and seems to be in the process of establishment. A first assessment shows a high invasion risk, which could justify a monitoring of the population.
1. Contexte de la découverte
La Nouvelle-Aquitaine accueille de nombreuses espèces allochtones : la base de données de la flore vasculaire exogène s’enrichit tous les ans et liste actuellement 1 292 taxons, dont 820 considérés comme spontanés pour la période contemporaine (Caillon et al., en prép.). Parmi ceux-ci, trois joncs exogènes étaient connus jusqu’à présent sur le territoire régional : Juncus tenuis Willd., Juncus fontanesii J. Gay et Juncus marginatus Rostk.
Au cours de suivis de stations d’orchidées, quelques membres de la Société linnéenne de Bordeaux (SLB) ont remarqué la présence d’un jonc inconnu à proximité du campus de Talence-Pessac en métropole bordelaise (Gironde, France). L’espèce a été observée pour la première fois en 2017 et tous les ans depuis, sans que son identité puisse alors être établie. Michèle Dupain (SLB) a fait une première description de la plante avec photographies et planche d’herbier. Les tentatives de détermination à partir des flores françaises sont toutefois demeurées vaines ou ont abouti à des espèces dont la présence locale était improbable.
L’auteur ayant été informé de l’existence de ce jonc mystérieux au printemps 2022, une première visite de la station le 20 mai, en compagnie de Bruno Cahuzac (SLB) et de Sandy Barberis, a permis de récolter quelques échantillons. De retour au laboratoire, l’analyse des flores classiques a montré qu’aucune espèce française ne correspondait aux spécimens prélevés. Des recherches bibliographiques plus poussées (e.g. Fernandez-Carvajal et al., 1989 ; Kirschner, 2002a, 2002b ; Romero Zarco, 2010 ; Jung et al., 2012) ont permis de découvrir l’identité de la plante : Juncus imbricatus Laharpe. Quelques échantillons ont ensuite été soumis à Filip Verloove (Jardin botanique de Meise, Belgique) et Jean-Marc Tison, qui ont confirmé cette détermination.
Une seconde visite du site a été effectuée le 6 juillet 2022, en compagnie de B. Cahuzac et d’Aurélien Caillon (Conservatoire botanique national Sud-Atlantique – CBNSA) afin d’appréhender plus précisément le contexte stationnel et la population locale.
2. Juncus imbricatus Laharpe, Mém. Soc. Hist. Nat. Paris iii : 149 (1827)
- Juncus capillaceus var. chilensis Buchenau, Abh. Naturwiss. Vereins Bremen 6 : 377 (1879).
- Juncus chamissonis Kunth, Enum. Pl. [Kunth] 3 : 348 (1841) ; Juncus imbricatus var. chamissonis Buchenau, Pflanzenr. (Engler) 4, Fam. 36 : 122 (1906).
- Juncus collinus Steud., Syn. Pl. Glumac. 2 (10) : 306 (1855).
- Juncus lechleri Steud., Syn. Pl. Glumac. 2 (10) : 306 (1855) ; Juncus imbricatus var. lechleri Buchenau, Pflanzenr. (Engler) 4, Fam. 36 : 122 (1906).
- Juncus pringlei Fernald, Proc. Amer. Acad. Arts 45 : 416 (1910).
- Juncus spanianthus Steud., Syn. Pl. Glumac. 2 (10) : 306 (1855).
- Juncus urvillei Steud., Syn. Pl. Glumac. 2 (10) : 306 (1855).
2.1. Description (e.g. Snogerup, 1980 ; Kirschner, 2002b ; Romero Zarco, 2010 ; Jung et al., 2012)
Espèce vivace, atteignant 45(80) cm de hauteur (photos 1 et 2). Rhizome ± horizontal, épais (2-3 mm), densément recouvert des restes fibreux des cataphylles ; entrenœuds courts. Tiges en lignes ± denses, dressées, subcylindriques, ≈ 1 mm de diamètre, rigides et sillonnées. 3-4 cataphylles par tige. 1-2(4) feuilles subbasales à limbe 10-35 cm, ≈ 1 mm de diamètre, canaliculées. Oreillettes entières, obtuses, de 0,3-0,5 mm. Inflorescence terminale, de (1-)5-30 fleurs, assez dense, composée de (1-)2-4 cymes unilatérales (photos 3 et 4). Bractée inférieure foliacée, généralement > inflorescence. Fleurs solitaires à 2 bractéoles. Tépales de 3-5 mm, les externes ≥ internes, aigus (à subobtus), châtains à nervure verte et marges scarieuses. 6 étamines, 1,7-2,1 mm. Capsule de 3,5-6 mm ≥ tépales (photo 5), trigone-ovoïde, obtuse (à tronquée), brune. Graines de 0,4-0,6 mm, à appendices absents.
2.2. Chorologie
Juncus imbricatus est indigène en Amérique du Sud, depuis la Colombie jusqu’en Argentine (Kirschner, 2002b). L’espèce a été décrite d’Argentine et du Chili (Laharpe, 1827) : elle est considérée comme indigène au Chili par Kirschner (2002b) et la plupart des sources consultées (e.g. POWO, 2022), mais elle est listée comme potentiellement exogène chez Ugarte et al. (2011)1.
Elle est naturalisée au Mexique, en Afrique du Sud, Océanie (Australie et Nouvelle-Zélande) et Europe (Kirschner, 2022b). Elle a également été signalée récemment à Taiwan (Jung et al., 2012).
En Europe, J. imbricatus a été occasionnel dans les îles Britanniques (Clement & Foster, 1994) et en Belgique (1911 : Verloove, 2006). Il est naturalisé en plusieurs localités de la côte nord-ouest de la péninsule Ibérique (Espagne et Portugal : Romero Zarco, 2010 ; GBIF, 2021 ; Anthos, 2022) et a été récemment découvert aux Pays-Bas, sur les rives de la Meuse (Sipke Gonggrijp & Filip Verloove, comm. pers.).
2.3. Écologie
Juncus imbricatus est une espèce de prairies et friches mésophiles, se comportant souvent comme une adventice d’habitats plus ou moins perturbés (Kirschner, 2002b ; Balslev & Zuluaga, 2009) : pelouses rudéralisées, bermes de routes, friches post-culturales, zones remaniées, etc. Il se trouve depuis le niveau de la mer jusqu’à 3 800 m d’altitude dans les Andes (Kirschner, 2002b ; Balslev & Zuluaga, 2009) et peut supporter des sols compacts (Balslev & Zuluaga, 2009 ; Romero Zarco, 2010). J. imbricatus a également été cité d’autres types d’habitats, dans et hors de son aire naturelle, ce qui traduit sans doute un certain potentiel adaptatif : rizières (Snogerup, 1980), pâtures, zones humides neutrocalcicoles naturelles (Keighery & Keighery, 2006), zones humides acides, contaminées de métaux lourds (Miguel et al., 2013).
2.4. Identification (e.g. Snogerup, 1980 ; Fernandez-Carvajal et al., 1989 ; Kirschner, 2002b ; Romero Zarco, 2010 ; Jung et al., 2012)
Juncus imbricatus appartient au sous-genre Agathryon Raf.2, caractérisé par une inflorescence en cyme et des fleurs entourées chacune d’une paire de bractéoles, et à la section Steirochloa Griseb.2, composée d’espèces vivaces à inflorescence terminale et à feuilles planes ou canaliculées.
La grande taille des capsules (photo 5) et les rhizomes horizontaux épais, densément recouverts des restes de cataphylles (photo 6) sont typiques de l’espèce. Parmi les espèces françaises de la section, J. imbricatus diffère de Juncus gerardi Loisel. et Juncus compressus Jacq. par les capsules plus grandes et les tépales plus aigus, de Juncus squarrosus L. et du groupe de Juncus tenuis Willd. par ses longs rhizomes, etc. Les feuilles subcylindriques légèrement canaliculées sont également caractéristiques de l’espèce (photo 7).
Clef d’identification des espèces de Juncus section Steirochloa2 en France métropolitaine
1 – Feuilles basales nombreuses, en rosette, à gaines dilatées ; rhizome court : port cespiteux ; tépales obtus, bruns ………………………………………………………………………………………………………………………………………………………………………. J. squarrosus
1’ – Feuilles basales absentes ou rares (moins de 10) …………………………………………………………………………………………………………. 2
2 – Tépales aigus à acuminés (verdâtres chez J. tenuis s. s.) ; capsule ≤ périanthe ; rhizome court : port cespiteux ……………………………………………………………………………………………………………………………………………………………………….. J. tenuis s.l.
2’ – Tépales aigus à obtus (habituellement colorés de châtain à brun rougeâtre) ; capsule ≥ périanthe ; rhizome ± long : souche produisant une colonie (mais port pouvant être pseudocespiteux chez J. imbricatus) ……………………………………………………………………………………………………………………………………………………………………………………………………… 3
3 – Tépales aigus à subobtus ; capsule grande (3,5-5 mm) ; rhizome avec nombreux restes filamenteux de cataphylles et feuilles ; entrenœuds courts : tiges en lignes assez denses ………………………………………………………………………………………………………………………………………………………………………………………………………. J. imbricatus
3’ – Tépales obtus ; capsule petite (2,1-3,8 mm) ; rhizomes nus ou avec restes de bases foliaires peu nombreux ; tiges souvent plus espacées …………………………………………………………………………………………………………………………………….. 4
4 – Anthères 1-2 ´ filet ; capsule > périanthe ……………………………………………………………………………………………….. J. compressus
4’ – Anthères 2-6 ´ filet ; capsule ≈ périanthe ………………………………………………………………………………………………………… J. gerardi
3. Station de Pessac
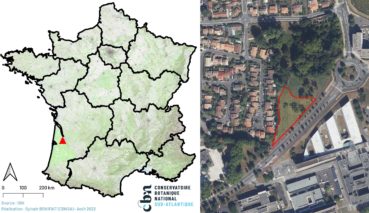
La station se trouve à Pessac (Gironde), en bordure du campus sur une parcelle appartenant à l’université de Bordeaux, à proximité du rond-point entre l’avenue Roul, l’avenue du Docteur-Schweitzer et l’avenue de la Mission Haut-Brion (carte 1).
- Habitat
Le site se trouve en contexte urbain. Il s’agit de pelouses et prairies urbaines situées entre une avenue, un quartier résidentiel et un petit parc boisé. Le secteur a été remanié il y a plusieurs années ; il est désormais occupé par une végétation herbacée plus ou moins enfrichée et rudéralisée, piquetée de quelques arbres et arbustes. Le contexte est mésophile.
Sur ce site, Juncus imbricatus est surtout présent sur des pelouses bordant une ligne de désir (photo 8) et l’avenue ; ces pelouses sont plus ou moins piétinées selon la proximité de la ligne et/ou rudéralisées. L’espèce pénètre également en plusieurs points dans la prairie mésophile de fauche adjacente (photo 9), qui semble correspondre à une communauté basale et rudéralisée du Brachypodio rupestris-Centaureion nemoralis Braun-Blanq. 1967 (Arrhenatheretea elatioris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952).
- Abondance
Juncus imbricatus est bien présent sur les pelouses, principalement le long de la ligne de désir où il semble pouvoir supporter un certain piétinement du fait de son fort développement rhizomateux. Dans la prairie, il est nettement plus ponctuel, possiblement du fait de l’importante concurrence d’autres espèces prairiales. La station occupe près de 3 400 m² ; le 6 juillet 2022, la population a été estimée à plus d’un millier de tiges, pour un recouvrement de quelques dizaines de mètres carrés sur la station.
- Cortège floristique
Les espèces compagnes suivantes ont été observées le 6 juillet 2022 sur la station de J. imbricatus. Compte-tenu de la date d’inventaire et des conditions météorologiques de 2022, le cortège floristique est partiel, en particulier pour les espèces vernales et/ou annuelles.
- Achillea millefolium L.
- Anisantha diandra (Roth) Tutin ex Tzvelev
- Avena barbata Pott ex Link
- Bellis perennis L.
- Bromus hordeaceus L. subsp. hordeaceus
- Carex divulsa Stokes s. s.
- Centaurea decipiens Thuill. [sensu Tison & de Foucault, 2014]
- Cichorium intybus L.
- Convolvulus arvensis L.
- Cynodon dactylon (L.) Pers.
- Dactylis glomerata L. subsp. glomerata
- Daucus carota L.
- Eleusine indica (L.) Gaertn.
- Hordeum murinum L.
- Hypericum perforatum L.
- Hypochaeris radicata L.
- Iris gr. germanica L.
- Jacobaea vulgaris Gaertn.
- Linum usitatissimum L.
- Lolium perenne L.
- Lotus corniculatus L.
- Oenanthe pimpinelloides L.
- Paspalum dilatatum Poir.
- Plantago coronopus L.
- Plantago lanceolata L.
- Potentilla reptans L.
- Poterium sanguisorba L.
- Ranunculus bulbosus L.
- Rumex crispus L.
- Scabiosa columbaria L.
- Schedonorus arundinaceus (Schreb.) Dumort.
- Silene latifolia Poir.
- Sporobolus indicus (L.) R. Br.
- Trifolium pratense L.
- Trifolium repens L.
- Trisetum flavescens (L.) P. Beauv.
La présence de plusieurs autres espèces exotiques (Eleusine indica, Iris gr. germanica, Paspalum dilatatum, Sporobolus indicus) est à noter, les deux dernières étant fortement envahissantes dans la région sur ce type de milieu.
4. Quel statut ?
4.1. Mode d’introduction
Juncus imbricatus a pu être introduit de manière intentionnelle (échappé de culture3) ou non intentionnelle, via le transport de matériaux4 (DAISIE in Saul et al., 2017). Il est notamment considéré comme une adventice lainière et les localités d’Europe du Nord (îles Britanniques, Belgique, Pays-Bas) semblent directement liées au commerce de laine de mouton (Clement & Foster, 1994 ; Filip Verloove, 2006, comm. pers. ; Sipke Gonggrijp & Filip Verloove, comm. pers.).
Du fait des remaniements récents de la localité de Pessac, Juncus imbricatus peut être considéré comme une néophyte, nouvellement arrivée. Le mode d’introduction ou l’origine de la population n’ont pas pu être identifiés, les différentes hypothèses envisagées (remblais lors des travaux sur le secteur, dispersion depuis les zones résidentielles ou transport de graines par les usagers du site) se révélant trop fragiles (ou insuffisamment documentées) pour être retenues.
4.2. Potentiel invasif
Compte-tenu de la présence continue depuis au moins 2017 et du développement actuel autonome de la station, Juncus imbricatus peut être considéré comme acclimaté et en cours de naturalisation. Le suivi de la population devra permettre de dire si cette implantation est pérenne ou pas.
Le contexte stationnel de Pessac, l’écologie de l’espèce et l’existence d’autres populations naturalisées ailleurs autour du globe, permettent d’envisager une possible extension de l’espèce sur le territoire néo-aquitain et au-delà. Si sa capacité de colonisation des milieux naturels et semi-naturels (par ex. prairies, zones humides, etc.) reste à évaluer, J. imbricatus pourrait facilement trouver des conditions propices à son développement sur des milieux plus ou moins perturbés (pelouses rudéralisées, bermes de route, etc.) comme ceux colonisés actuellement.
L’étude des populations introduites montre des dynamiques contrastées, avec des implantations temporaires (e.g. Belgique, Verloove, 2006 ; îles Britanniques, Clement & Foster, 1994), des populations naturalisées demeurant « relativement » localisées (e.g. péninsule Ibérique, GBIF, 2021) et des populations envahissantes en expansion (Océanie, Keighery & Keighery, 2006).
Dans ces conditions, il apparaît utile d’évaluer dès à présent son potentiel invasif. Une pré-évaluation (Annexes, 1) de l’espèce, suivant la méthode d’évaluation du risque de prolifération proposée par Weber & Gut (2004) montre l’intérêt d’appréhender plus précisément le risque d’invasion de J. imbricatus. L’analyse subséquente (Annexes, 2) reprend le questionnaire de Weber & Gut (2004), adapté au niveau régional pour la rubrique n° 9 « Mode de dispersion » (Caillon et al., en prép.). Juncus imbricatus atteint un score de 32, indiquant un risque élevé de devenir une espèce exotique envahissante, susceptible de menacer la biodiversité locale.
Même si les impacts apparaissent limités5 en l’état actuel des connaissances (mais l’arrivée est récente), une surveillance de l’espèce pour appréhender ses capacités d’expansion et ses impacts éventuels sur la biodiversité serait utile afin de déclencher si nécessaire une gestion préventive.
Quelques précisions complémentaires
1 Ugarte et al. (2011) indiquent 1854 comme date de premier signalement. Or, dans sa description originelle, Laharpe (1827) écrit « Cette espèce a été rapportée de Buenos-Ayres par Commerson, et de la Conception, au Chili, par M. Lesson ». La première citation chilienne de Juncus imbricatus semble donc être plutôt 1825 (date de la lecture de Laharpe à la Société d’histoire naturelle de Paris, avant publication en 1827). Par ailleurs, des planches d’herbier de C.L.G. Bertero datant de 1818 et 1830 existent dans la collection du Muséum national d’histoire naturelle (ReColNat, 2022) ; ces spécimens ont été déterminés sous divers noms, dont certains synonymes de J. imbricatus, et sont actuellement rapportés à celui-ci. Une exploration plus poussée des collections ou de la bibliographie permettrait peut-être de trouver d’autres signalements antérieurs à 1854.
2 Brožová et al. (2022) proposent d’élever Agathryon au niveau du genre dans leur étude phylogénétique des Juncaceae (= Agathryon (Raf.) Záv. Drábk. & Proćków, gen. et stat. nov.) ; dans ce traitement, la section Steirochloa n’est pas retenue du fait de son absence de monophylie. Dans l’attente d’une éventuelle intégration de ces propositions, le traitement pré-existant (Kirschner, 2002a, b ; Tison & de Foucault, 2014) est conservé pour le présent article, à l’exception toutefois d’Oreojuncus trifidus (L.) Záv. Drábk. & Kirschner, exclus de la section Steirochloa et du genre Juncus L. (Záveská Drábková & Kirschner, 2013).
3 « Escape from confinement » sensu CBD, 2014 ; Saul et al., 2017.
4 « Transport – Contaminant & Stowaway » sensu CBD, 2014 ; Saul et al., 2017. Le bétail (et ses produits) semble notamment un vecteur classique pour cette espèce (e.g. Randall, 2017).
5 À noter cependant la présence d’une espèce protégée au niveau national et fortement patrimoniale au sein de la station.
ANNEXES
Réponses et scores correspondants en gras
- Pré-évaluation du risque invasif (Weber & Gut, 2004)
Identité : Juncus imbricatus Laharpe
→ Est-ce que l’espèce est présente dans le territoire ? Oui
→ Est-ce que l’espèce est largement présente dans le territoire ? Non
→ Est-ce que l’espèce fait l’objet de régulations (contrôles, quarantaines) ? Non
→ Est-ce que l’espèce est arrivée récemment ? Oui
→ Est-ce que l’espèce est uniquement une adventice de terrains cultivés ? Non
- Espèce à évaluer
- Évaluation du risque invasif (Weber & Gut, 2004, adapté par Caillon et al., en prép.)
- Correspondance climatique : l’aire géographique connue de l’espèce comprend-elle des zones éco-climatiques similaires avec celles de la zone à risque ?
→ Oui – 2 (Kottek et al., 2006 ; GBIF, 2021).
- Statut du taxon en Europe : le taxon est-il indigène en Europe ?
→ Non – 2 (Kirschner, 2002b).
- Distribution géographique en Europe : dans combien de pays le taxon est-il présent ?
→ 2 à 5 – 2 (Espagne et Portugal ; Romero Zarco, 2010 ; GBIF, 2021 ; Anthos, 2022).
Seuls les pays où l’espèce est naturalisée de longue date ont été considérés (exclusion des pays où sa présence est occasionnelle ou récente).
- Distribution mondiale : quelle est l’ampleur de l’aire de répartition mondiale (indigène et exogène) du taxon ?
→ Répartition mondiale grande (plus de 15° de longitude ou latitude) ou couvrant plus d’un continent – 3 (Kirschner, 2002b ; GBIF, 2021).
- Connaissance du taxon comme exotique envahissant : le taxon a-t-il été signalé comme exotique envahissant ailleurs ?
→ Oui – 3 (Keighery & Keighery, 2006).
- Taxonomie : le taxon a-t-il des congénères envahissants ?
→ Oui – 2 (Randall, 2017 ; Caillon et al., en prép.).
- Reproduction et viabilité des graines : de manière approximative, combien de semences produit un individu de la plante ?
→ Beaucoup de semences – 3 (obs. pers. ; Jean-Marc Tison, comm. pers.).
- Croissance végétative : quel type de multiplication végétative la plante pratique-t-elle ?
→ Développement de rhizomes et/ou des stolons pour s’étendre latéralement – 4 (Kirschner, 2002b ; obs. pers.).
- Mode de dispersion : quel est mode de dispersion du taxon ?
→ Zoochorie – 4 (Randall, 2017).
- Type biologique : quel est le type biologique du taxon ?
→ Plante herbacée vivace de petite taille (< 80 cm) – 2 (Kirschner, 2002b ; obs. pers.).
- Habitat : quel habitat colonise le taxon ?
→ Prairie sèche – 3 (Kirschner, 2002b ; obs. pers.).
- Densité de population : quelle est l’abondance locale du taxon ?
→ Individus formant occasionnellement des noyaux de forte densité – 2 (obs. pers.).
- Score final : 32 = risque élevé.
Bibliographie
Anthos, 2022. Information System of the plants of Spain [11/08/2022]. Real Jardín Botánico, CSIC – Fundación Biodiversidad. http://www.anthos.es/.
Balslev H. & Zuluaga A., 2009. Flora de Colombia, 26 – Juncaceae. Instituto de Ciencias naturales, Universidad nacional de Colombia, Bogotá, 79 p.
Brožová V., Proćków J. & Záveská Drábková L., 2022. Toward finally unraveling the phylogenetic relationships of Juncaceae with respect to another cyperid family, Cyperaceae. Molecular Phylogenetics and Evolution 177 : 107588.
Caillon A. (coord.), Bonifait S., Chabrol L., Dao J., Leblond N. & Ragache Q., en prép. Liste hiérarchisée des plantes exotiques envahissantes de Nouvelle-Aquitaine, version 1.0. Conservatoire botanique national Sud-Atlantique, Conservatoire botanique national du Massif central & Conservatoire botanique national des Pyrénées et de Midi-Pyrénées, 110 p. + annexes.
Clement E.J. & Foster M.C, 1994. Alien plants of the British Isles. Botanical Society of the British Isles, London, xviii + 590 p.
Convention on Biological Diversity, 2014. Pathways of introduction of invasive species, their prioritization and management. 18th Meeting of the Subsidiary Body on Scientific, Technical and Technological Advice, Montreal, 23-28 June 2014, 18 p.
Fernández-Carvajal M.D.C., Garcia R. & Díaz González T.E., 1989. Clave para la identificación de las especies ibéricas del género Juncus L. basada en caracteres anatómicos. Acta Botanica Malacitana 14 : 89-104.
Global Biodiversity Information Facility Secretariat, 2021. Juncus imbricatus Laharpe [09/08/2022]. GBIF Backbone Taxonomy. https://www.gbif.org/fr/species/2701618.
Keighery G.J. & Keighery B.J., 2006. Native and naturalised Juncus in Western Australia. In V. Longman (ed.), Managing Sharp Rush (* Juncus acutus), Proceedings of the workshop, Wollaston College Conference Centre, Mt Claremont, Perth, 4/08/2006 : 9-18.
Kirschner J., 2002a. Juncaceae, 2 – Juncus subg. Juncus. In Species Plantarum: Flora of the World, part 7, Australian Biological Resources Study, Canberra, 336 p.
Kirschner J., 2002b. Juncaceae, 3 – Juncus subg. Agarythron. In Species Plantarum: Flora of the World, part 8, Australian Biological Resources Study, Canberra, 192 p.
Kottek M., Grieser J., Beck C., Rudolf B. & Rubel F., 2006. World Map of Köppen-Geiger climate classification updated. Meteorologische Zeitschrift 15 (3) : 259-263.
Laharpe J. (de), 1827. Essai d’une monographie des vraies joncées. Mémoires de la Société d’histoire naturelle de Paris III : 89-181.
Jung M.-J., Chu M.-K., Hsu T.-C., Kao R.-C. & Dai S.-S., 2012. Four newly naturalized grasses and rushes in Taiwan. Taiwania 57 (4) : 426-433.
Miguel B., Edell A., Edson Y. & Edwin P., 2013. A phytoremediation approach using Calamagrostis ligulata and Juncus imbricatus in Andean wetlands of Peru. Environmental Monitoring and Assessment 185 : 323-334.
Plant of the World Online, 2022. Plants of the World Online [11/08/2022]. Royal Botanic Gardens, Kew. http://www.plantsoftheworldonline.org/.
Randall R.P., 2017. A Global Compendium of Weeds, 3rd ed. Perth, 3 653 p.
ReColNat, 2022. e-ReColNat [07/10/2022]. ANR-11-INBS-0004. https://explore.recolnat.org/.
Romero Zarco C., 2010. Juncus L. In S. Castroviejo (coord.), Flora iberica, Real Jardín Botánico, CSIC, Madrid, 17 : 123-187. [26/05/2022]. http://www.floraiberica.org/.
Saul W.C., Roy H.E., Booy O., Carnevali L., Chen H.J., Genovesi P., Harrower C.A., Hulme P.E., Pagad S., Pergl J. & Jeschke J.M., 2017. Assessing patterns in introduction pathways of alien species by linking major invasion data bases. Journal of Applied Ecology 54 (2) : 657-669.
Snogerup S., 1980. Juncus. In T.G. Tutin, V.H. Heywood, N.A. Burges, D.M. Moore, D.H. Valentine, S.M. Walters & D.A. Webb (eds.), Flora Europaea 5, Cambridge University Press, Cambridge : 102-111.
Tison J.-M. & de Foucault B. (coords), 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1 196 p.
Ugarte E., Lira F., Fuentes N. & Klotz S., 2011. Vascular alien flora, Chile. Check List 7 (3) : 365-382.
Verloove F., 2006. Catalogue of neophytes in Belgium (1800-1925). Scripta Botanica Belgica 39 : 3-89.
Weber E. & Gut D., 2004. Assessing the risk of potentially invasive plant species in central Europe. Journal for Nature Conservation 12 : 171-179.
Záveská Drábková L. & Kirschner J., 2013. Oreojuncus, a new genus in the Juncaceae. Preslia 85 : 483-503.
Remerciements
L’auteur tient à remercier Filip Verloove (Jardin botanique de Meise, Belgique) et Jean-Marc Tison pour la confirmation de l’identité de Juncus imbricatus, les échanges sur le sujet et la relecture du manuscrit ; Bruno Cahuzac (SLB) pour les informations relatives à la découverte et au contexte local et Michèle Dupain (SLB) pour les premières observations et la photo 7a ; Tomás E. Díaz pour la photo 7c ; Aurélien Caillon (CBNSA) pour son expertise sur l’évaluation du potentiel invasif. Merci également aux collègues du CBNSA consultés sur le sujet (Nicolas Leblond, Pierre Lafon, Cécile Pontagnier), ainsi qu’aux botanistes linnéens pour la découverte de l’espèce et la remontée des informations.