Découverte des deux premières stations de Rumex stenophyllus Ledeb. en France
Title
First discovery of Rumex stenophyllus Ledeb. in France on two sites
Résumé
Rumex stenophyllus Ledeb. a été découvert en France dans deux stations : le barrage-réservoir de Chazilly en Côte-d’Or (21) en 2019 et l’étang de Capestang dans l’Hérault (34) en 2021. L’espèce se développe sur les grèves exondées sur les deux sites. Les densités présentes sur le site de Chazilly (plus de cinq mille individus) plaident pour un statut « naturalisé ». R. stenophyllus présente des caractères intermédiaires entre R. crispus (feuilles à marges ondulées-crispées et bases atténuées) et R. obtusifolius (valves fructifères dentées). Certaines déterminations de l’hybride Rumex ×pratensis pourrait ainsi être à attribuer à R. stenophyllus.
Abstract
Rumex stenophyllus Ledeb. was discovered in France on two sites: the Chazilly storage dam in the department Côte-d’Or in 2019 and the Capestang pond in the department Hérault in 2021. The plant was found on exposed banks on both sites. The abundance of the species on the Chazilly site (more than five thousand individuals) pleads for a « naturalized » status. R. stenophyllus presents features intermediate between R. crispus (crisped leaf margins and narrowed at the base) and R. obtusifolius (dented fruit valves). Some observations of the hybrid Rumex ×pratensis could be attributed to R. stenophyllus.
1. Cadre des découvertes
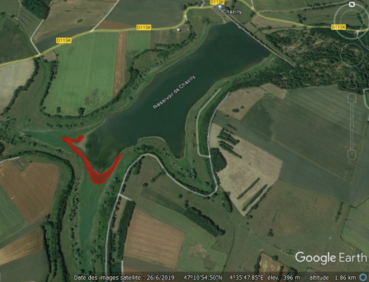
Rumex stenophyllus Ledeb. a été découvert pour la première fois en France le 4 août 2019 au barrage-réservoir de Chazilly, en Côte-d’Or, lors d’une sortie botanique amicale entre Guillaume Adeux, Cécile Frelin et Johann Lallemand. L’espèce n’a pu être nommée lors de cette première sortie, les auteurs n’étant convaincus par les déterminations proposées par Tison & de Foucault (2014) ou Bugnon (1995). Des photos ont été prises et des échantillons collectés pour poursuivre l’investigation. Le partage des photos sur la page facebook Botanique et Flore de France a permis de soulever la piste de R. stenophyllus, détermination qui fut ensuite confirmée par la consultation Boufford (2021), Verloove (2022) et Jean-Marc Tison (comm. pers.). Une deuxième sortie le 30 août 2019 a permis d’estimer la taille de la population, d’identifier les autres espèces végétales à proximité et de réaliser une série de photographies.
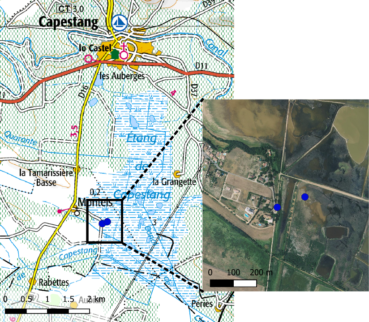
La deuxième station a été découverte deux ans plus tard, le 29 août 2021, à l’étang de Capestang dans l’Hérault par Frédéric Andrieu à l’occasion d’une sortie dominicale avec le groupe des botanistes de la Société d’horticulture et d’histoire naturelle de l’Hérault. Les flores nationales ne permettant pas d’aboutir à des solution satisfaisantes, l’hypothèse d’un R. stenophyllus a été envisagée suite à la consultation de Tutin (1993). Elle fut confirmée après échange sur la page facebook Botanique et Flore de France et sollicitation de Filip Verloove (comm. pers.).
2. Description des sites
Le barrage-réservoir de Chazilly fait partie des six barrages-réservoirs d’alimentation du canal de Bourgogne que sont Panthier (130 ha), Grosbois (120 ha), Pont-et-Massène (82 ha), Cercey (75 ha), Chazilly (72 ha à l’origine, plus que 36 en 2019) et Tillot (30 ha). Ce barrage a été mis en service en 1835 et alimente le canal de Bourgogne au moyen d’une rigole qui passe par la digue du Tillot et se jette dans le bassin d’Escommes. Le barrage-réservoir de Chazilly est un site réputé pour la pratique de la pêche (carnassiers, poissons blancs, carpes), depuis le bord comme depuis une embarcation, le site étant doté d’une rampe de mise à l’eau « naturelle » sur la rive gauche en amont de la digue. La hauteur de la retenue est de 22.5 m et la contenance initialement prévue était de 5 200 000 m3. Le site abrite de nombreuses espèces d’oiseaux telles que la mouette rieuse, la bécassine des marais, le foulque macroule, le grèbe huppé, le héron cendré, la grande aigrette… Ainsi, l’arrivée de R. stenophyllus via la présence d’akènes dans le plumage d’oiseaux semble l’hypothèse la plus probable.
L’étang de Capestang est une vaste zone humide de près de 1 300 ha située au niveau de la basse vallée de l’Aude dans le département de l’Hérault, en contexte méditerranéen. Aujourd’hui distant d’environ 15 km de la côte, il se trouvait sur le rivage de la mer Méditerranée il y a quelques milliers d’années et formait alors une vaste baie. Les atterrissements des alluvions charriées par le fleuve Aude et les variations du niveau de la mer ont eu raison de cette situation et ont peu à peu comblé la baie. Il reste de cette époque quelques cuvettes, dont l’étang de Capestang. Un abondant réseau de canaux a été aménagé par l’homme pour drainer les basses terres humides et inondables. Cette zone humide de faible profondeur est l’une des plus reculées du complexe des étangs littoraux et abrite l’une des plus grandes roselières du Languedoc. Elle présente ainsi un intérêt écologique pour sa diversité avifaunistique (hérons, fauvettes paludicoles, talève sultane…) et est intégrée au réseau Natura 2000. Sa gestion est partagée entre des enjeux hydrauliques (stockage d’eau en cas de crue de l’Aude), des enjeux naturalistes, les activités de chasse et de pêche.
3. Contexte floristiques des découvertes
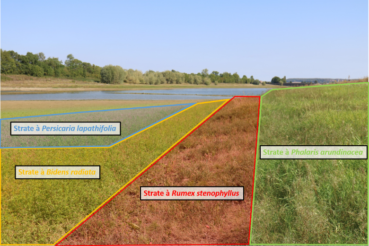
Sur les deux sites, R. stenophyllus a été observé sur des grèves récemment exondés (moins de trois ans). À Chazilly, la majorité de la population était concentrée au niveau de la queue de la retenue (sud-ouest de la digue ; photo 1), dans une strate étroite (2 à 10 m de largeur, sur environ 300 m de berges ; photo 2), intermédiaire entre une végétation dominée par les annuelles estivales (une strate externe à Bidens radiata Thuill. et B. tripartita L., puis une à Persicaria lapathifolia (L.) Delarbre sur la zone plus récemment exondée, à rattacher au Lythro tribracteati-Crypsietum aculeatae B. Foucault et une végétation dominée par des pérennes supportant une submersion temporaire (e.g. Phalaris arundinacea L., à rattacher au Rumici crispi-Phyletum minoris B. Foucault 2022 (de Foucault, 2021, 2022). Ainsi, les principales espèces identifiées à proximité de R. stenophyllus étaient (par ordre d’importance) Alopecurus aequalis Sobol., Phalaris arundinacea L., Veronica catenata Pennell, Lythrum salicaria L., Rorippa palustris (L.) Besser, Oenanthe aquatica (L.) Poir., Agrostis stolonifera L., Bidens radiata, B. tripartita, Epilobium parviflorum Schreb., Gnaphalium uliginosum L., Trifolium hybridum L., Mentha aquatica L. et Persicaria lapathifolia. Certaines espèces telles que Plantago major subsp. pleiosperma Pilg., Alisma plantago-aquatica L., Cirsium arvense (L.) Scop., Lipandra polysperma (L.) S. Fuentes, Uotila & Borsch, Stellaria aquatica (L.) Scop. et Ranunculus sceleratus L. ont été fréquemment observées à proximité, mais avec un recouvrement moindre. Les auteurs estiment la densité à un minimum de cinq mille individus, avec environ sept cents pieds identifiés comme étant en fleurs ou fruits (photo 3). Ce niveau d’abondance et de diversité de stades phénologiques, couplé à la distribution spatiale de l’espèce sur le site (équivalent linéaire de berges d’environ 300 m), laisse à penser que l’espèce est présente depuis au moins quelques années, qu’elle se maintient (a minima) et que le statut de « naturalisé » pourrait être à considérer. Aucune autre espèce de Rumex n’a été observée à proximité, bien que le milieu fut propice pour Rumex maritimus L. La population de R. stenophyllus de Chazilly présente un avenir incertain. Des travaux de renforcement de la digue ont débuté en 2020 et ont comme objectif de restaurer la capacité de stockage de la retenue. Ainsi, la queue de la retenue où l’espèce abonde actuellement pourrait être repoussée de plus d’une centaine de mètres.
Des prospections sur les berges est et ouest n’ont pas permis d’identifier d’autres zones où R. stenophyllus était présent, potentiellement à cause d’un substrat plus filtrant et moins riche en matière organique (remblais graveleux, caillouteux) et de pentes plus abruptes adaptées pour la pêche. Des prospections sur les barrages-réservoirs proches de celui de Chazilly (Cercey et Tillot) n’ont pas permis d’affirmer l’existence d’autres stations.
Au niveau du site de l’étang de Capestang, les observations sont loin d’être complètes. Le site est vaste, les assecs peu fréquents et l’accessibilité réduite (propriétés privées). Les herborisations effectuées en 2021 à l’ouest, au pied du village de Montels, ont mis en évidence R. stenoplyllus en deux points (carte et photo 4). Le premier est situé en périphérie de l’étang sur des terrains topographiquement élevés et peu inondés. Il s’agit d’une prairie mésohygrophile pâturée occasionnellement et envahie de jeunes ligneux et de fourrés. Aucun relevé n’a été effectué dans cette zone. La seconde se trouve sur des vasières exondées et a été prospectée plus en profondeur. Comme pour le site de Bourgogne, la végétation est dominée par des espèces annuelles à développement estival. Le cortège floristique y est cependant très différent (tableau 1). Il comprend des espèces caractérisant l’Helochloion schoenoidis Braun-Blanq. ex Rivas Goday, Borja, Monasterio, Galiano & Rivas Mart. 1956, groupement qui s’observe dans une forme appauvrie réduite à Crypsis aculeata (L.) Aiton et C. schoenoides (L.) Lam. dans les zones les plus longuement inondées, et des espèces caractérisant le Frankenion pulverulentae Rivas Mart. ex Castrov. & Porta 1976, groupement mieux développé sur les zones topographiquement plus élevées, moins inondées et plus halophiles, avec Frankenia pulverulenta L., Suaeda splendens (Pourr.) Gren. & Godr., S. spicata (Willd.) Moq., et Limonium narbonense Mill.
Entre ces situations extrêmes, les vastes étendues de vasières offrent des conditions intermédiaires qui se traduisent par un mélange des cortèges précédents. C’est là que prospère R. stenophyllus. De nouvelles espèces sont relevées, des halophiles comme une salicorne annuelle indéterminée (Salicornia gr. europaea) et Tripolium pannonicum subsp. pannonicum (Jacq.) Dobrocz., ainsi que des annuelles des friches, principalement des espèces allochtones comme Xanthium orientale subsp. italicum (Moretti) Greuter, Erigeron canadensis L., E. sumatrensis Retz. et Symphyotrichum squamatum (Spreng.) G.L. Nesom. La population de R. stenophyllus est estimée à une centaine d’individus dans le secteur parcouru.
4. Description de l’espèce
4.1. Caractéristiques
R. stenophyllus (syn. : Rumex odontocarpus Sándor ex Borb.) est une plante herbacée pérenne, glabre (papilleuse uniquement au niveau des nervures des feuilles, à la face inférieure), de 40 à 80 cm de haut (photo 5). Des individus plus grands (> 1 m) peuvent néanmoins être observés dans des conditions favorables. Les individus peuvent se maintenir plusieurs années grâce à une racine pivotante charnue. Les bourgeons de rénovation se situant au niveau de collet, l’espèce peut être considérée comme hémicryptophyte selon la classification des types biologiques de Raunkiær (1934). Le pivot est surmonté d’une (jeunes individus) ou plusieurs (individus âgés) tiges charnues, érigées, de couleur rouge et ramifiées à partir de la moitié supérieure. Les feuilles forment une rosette basale mais sont également disposées de manière alterne le long de la ou des tiges. Le pétiole des feuilles basales est plus court que la longueur du limbe et celui des feuilles caulinaires s’amenuisent jusqu’à devenir absent sur les feuilles de l’inflorescence, qui sont étroitement lancéolées. L’ochréa est membraneuse et fugace.
Le limbe est de forme lancéolée (environ 15-25 cm de long et 2-7 cm de large), avec une base atténuée et un apex pointu. Les marges sont généralement entières et ondulées-crispées mais peuvent être irrégulièrement dentées (photo 6). Le limbe est acuminé à obtus. Les inflorescences sont terminales (moitié supérieure de l’appareil aérien), ramifiées, et constituées de grappes de faux-verticilles de 20-25 fleurs denses mais pouvant paraître d’aspect interrompu à la base (photo 5). Les pédicelles sont filiformes (3-8 mm de long) et présentent une articulation nettement renflée dans le tiers proximal (photo 7). Les fleurs sont hermaphrodites (photo 8), vertes (à la floraison) et présentent six tépales. À maturité, les trois tépales internes (dénommés aussi valves fructifères) sont plus larges (3.5-5 mm de long, 3-5 mm de large) que les externes, de forme ronde à ovale-triangulaire, à marges bordées de 4-10 dents (0.2-1.5 mm de long) aiguës de chaque côté (photo 9), à base tronquée ou plus ou moins cordée, et munis chacun d’un granule lisse de taille semblable atteignant environ un tiers à la moitié de la longueur de la valve. Le fruit est marron à marron-rougeâtre à maturité et de forme ellipsoïde (2-2.5 mm de long et 1-1.5mm de large), avec une section transversale nettement triangulaire et un apex aigu.
La floraison a lieu à partir de mois de juin et la fructification intervient en cours d’été et début d’automne.
4.2 Distribution
R. stenophyllus a été décrit en Asie centrale par von Ledebour (1930). C’est un taxon indigène d’Eurasie (Europe centrale, Europe orientale, Asie tempérée). Sa distribution forme une ceinture quasi continue dans les zones tempérées entre l’Allemagne et la Corée du Nord (latitude entre 45° et 60° Nord). Présente en Europe centrale (Autriche, Slovaquie, Tchéquie, Slovénie, Hongrie…), elle atteint sa limite occidentale d’indigénat en Allemagne où elle est en population isolée dans le centre du pays (Hegi, 1957). À l’ouest de l’Europe, l’espèce n’est pas considérée comme indigène. Elle apparaît ainsi comme naturalisée en Scandinavie (Suède et Norvège, Finlande selon les auteurs), dans les Pays-Bas (Hegi, 1957) et en Angleterre (Lousley, 1939 ; Stace, 2010). En Belgique, sa présence n’a été reconnue que récemment. Elle y a été pourtant collectée depuis le début du xxe siècle, mais sous le nom de R. ×pratensis par confusion avec ce taxon (Verloove, 2008). En Italie, l’espèce est également considérée comme une néophyte occasionnelle (Galasso et al., 2018) dans le nord du pays, en Haut Adige (Pignatti et al., 2017 ; Acta Plantarum, 2007). R. stenophyllus est aussi naturalisé en Amérique du Nord dans plusieurs États du centre et de l’ouest du Canada et des États-Unis (Love & Bernard, 1958).
La dispersion de R. stenophyllus hors de son aire est favorisée par le transport des céréales. En Belgique, les premières observations ont été réalisées à proximité des silos à grains de Gent Grain Terminal à Gand et par la suite dans des lieux identiques (Verloove, 2008). En Amérique du Nord, Love et Bernard (1958) établissaient déjà ce lien entre la présence de l’espèce et les graines apportées par les migrants venus d’Europe, en particulier des agriculteurs ukrainiens.
4.3 Habitat
À travers son aire d’indigénat, l’espèce semble être associée aux habitats côtiers et alluviaux (ripariens) légèrement salés. La flore de Chine précise comme habitats les bordures de point d’eau, les bords de champs, les vallées humides, et les sols salins (Li et al., 2003). En dehors de son aire de répartition naturelle, l’espèce se retrouve dans une diversité d’habitats propices aux rudérales : champs cultivés, terrains remaniés, décharges, bords de route, prairies (Lousley, 1939 ; Love & Bernard, 1958), ainsi que dans des milieux humides et salins (marais, marécages, côtes maritimes).
5. Distinction entre Rumex stenophyllus et l’hybride ×pratensis
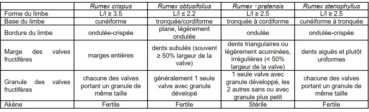
Les difficultés de distinction entre R. stenophyllus et R. ×pratensis (hybride entre R. crispus et R. obtusifolius) sont soulignées par Verloove (2013). Par rapport aux parents de R. ×pratensis, R. stenophyllus se distingue aisément par ses valves fructifères à dents courtes et trapues (valves non dentées chez R. crispus et à dents longues et fines chez R. obtusifolius). Le tableau 2 détaille les principaux critères permettant de discriminer les deux taxons.
Bibliographie
Acta Plantarum, 2007. Progetto open source finalizzato allo studio della Flora spontanea d’Italia [27/03/2022], https://www.actaplantarum.org/.
Boufford D. E., 2021. Flora of North America North of Mexico [27/03/2022], http://floranorthamerica.org/.
Bugnon F., 1995. Nouvelle flore de Bourgogne : clés de détermination. Société bourguignonne d’histoire naturelle et de préhistoire, 811 p.
Foucault B. (de), 2021. Contribution à la connaissance de la végétation des étangs asséchés et des canaux du Narbonnais. Carnets botaniques 38 : 1-15 + 3 tableaux ; https://doi.org/10.34971/387K-6576
Foucault B. (de), 2022. Validation de syntaxons invalidement publiés en 2021. Carnets botaniques 79 : 1-12, https://doi.org/10.34971/dxjk-t193
Galasso G., Conti F., Peruzzi L., Ardenghi N.M.G., Banfi E., Celesti-Grapow L., Albano A., Alessandrini A., Bacchetta G., Ballelli S., Bandini Mazzanti M., Barberis G., Bernardo L., Blasi C., Bouvet D., Bovio M., Cecchi L., Del Guacchio E., Domina G., Fascetti S., Gallo L., Gubellini L., Guiggi A., Iamonico D., Iberite M., Jiménez-Mejías P., Lattanzi E., Marchetti D., Martinetto E., Masin R.R., Medagli P., Passalacqua N. G., Peccenini S., Pennesi R., Pierini B., Podda L., Poldini L., Prosser F., Raimondo F.M., Roma-Marzio F., Rosati L., Santangelo A., Scoppola A., Scortegagna S., Selvaggi A., Selvi F., Soldano A., Stinca A., Wagensommer R.P., Wilhalm T. & Bartolucci F., 2018. An updated checklist of the vascular flora alien to Italy. Plant Biosystems 152 (3) : 556-592.
Hegi G., 1957. Illustrierte Flora von Mittel-Europa, III / 1. Munich, Carl Hanser Verlag, 452 p.
Ledebour C.F. (von), 1830. Flora altaica, 2. Berlin, G. Reimeri, XVI + 464 p.
Li A.J., Bao B.J., Grabovskaya-Borodina A., Hong S.P., McNeill J., Mosyakin S.L., Ohba H. & Park C.W., 2003. Polygonaceae. In W. Zhengyi, P.H. Raven & H. Deyuan (eds.), Flora of China, 5 (Ulmaceae through Basellaceae), Science Press, Beijing & Missouri Botanical Garden Press, St Louis : 277-350.
Lousley J.E., 1939. Notes on British Rumices. Report botanical Society Exchange and Club of the British Island 12 : 118-157.
Love D. & Bernard J.-P., 1958. Rumex stenophyllus in North America. Rhodora 60 : 54-57.
Pignatti S., Guarino R., & La Rosa M., 2017. Flora d’Italia, 2, 2e ed. Edagricola di New Business Media, Bologna, XVIII + 1178 p.
Stace C., 2010. New Flora of the British Isles. Cambridge University Press, Cambridge, UK, 1232 p.
Tison J. M., & de Foucault B., 2014.Flora Gallica, Flore de France. Biotope, Mèze, 1196 p.
Tutin T.G., 1993. Flora Europaea. Cambridge University Press, Cambridge, UK, 2392 p.
Verloove F., 2008. Twee miskende Rumex-taxa in België. Dumortiera 95 : 4-8.
Verloove F., 2013. Verder onderzoek binnen het genus Rumex (Polygonaceae) in België. Dumortiera 102 : 3-9.
Verloove, F., 2022. Manual of the Alien Plants of Belgium [27/03/2022], https://alienplantsbelgium.myspecies.info/species-list/rumex-stenophyllus.
Remerciements
Les auteurs tiennent à remercier Fabienne Niebler pour sa proposition de piste sur la page Facebook Botanique et Flore de France, ainsi que Jean-Marc Tison et Filip Verloove pour la confirmation de la diagnose pour les localités respectivement de Chazilly et de Capestang.