Contribution à la connaissance des Limonium du groupe duriusculum en France
Title
Contribution to the knowledge of the Limonium of the duriusculum group in France
Résumé
Les Limonium du groupe duriusculum présents en France (L. duriusculum et L. companyonis) sont étudiés à travers une synthèse bibliographique détaillée, l’étude des échantillons types, une analyse du cycle de vie et des mesures morphométriques. Nos résultats préliminaires ne supportent pas la distinction de ces deux taxons sur la base des caractères étudiés.
Abstract
The Limonium of the duriusculum group known in France (L. duriusculum and L. companyonis) are studied through a detailed bibliographic overview, the study of type specimens, a life cycle analysis and morphometric measurements. Our first results do not support the distinction of these two taxa on the basis of the criteria studied.
Notre objectif est d’affiner la connaissance du cycle de vie et de la morphologie des Limonium du groupe duriusculum en France.
1. Introduction
Le groupe de Limonium duriusculum au sens d’Erben (1991) comprend une dizaine d’espèces à répartition ouest-méditerranéenne (Espagne, France, Sardaigne, îles Baléares). Les espèces appartenant à ce groupe sont caractérisées par des épis pauciflores et le calice apparent après la floraison (Sáez & Rosselló, 1999). En France, le groupe est représenté par deux taxons :
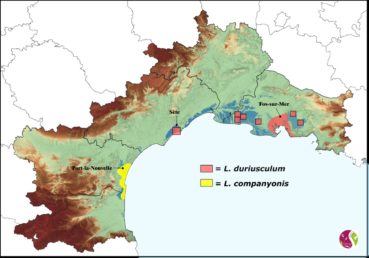
- Limonium companyonis (Gren. & Billot) Kuntze (photo 1), décrit par Grenier et Billot (in Billot, 1855 : 339) d’un secteur entre l’île Sainte-Lucie et les plages près de Narbonne (Aude) ;
- Limonium duriusculum (Girard) Fourr. (photo 2), dont la description originelle a été fournie par de Girard (1844), avec deux indications géographiques : les rochers de Sète dans l’Hérault et le lieu-dit « les Sablettes près de Toulon » (Var).
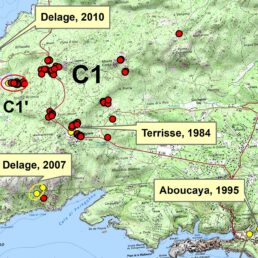
La répartition actuelle des deux taxons est illustrée sur la carte 1.
Dès sa description originelle, la proximité de Limonium companyonis avec L. duriusculum a été mise en évidence. Bien plus tard, Erben (1978, 1981) décrit plusieurs critères morphologiques pour la distinction des deux taxons et souligne leurs aires de répartition clairement séparées. Il confirme toutefois leur proximité morphologique et suggère des études complémentaires pour étudier leur variabilité et statuer sur leur rang taxonomique. Encore récemment, Andrieu et al. (2016) confirment ce besoin d’une étude comparée de ces deux taxons : « Des études complémentaires seraient nécessaires pour vérifier si L. companyonis et L. duriusculum sont des entités distinctes ou non, car, sur le plan morphologique et écologique, les similitudes sont nombreuses. ».
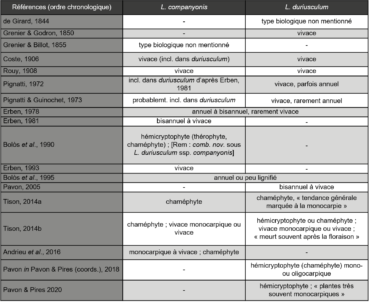
Notre travail vise à fournir les premiers éléments d’une telle étude comparée, à travers l’analyse de critères morphologiques. Par ailleurs, les indications sur le type biologique et le cycle de vie des deux taxons, non précisées dans leurs descriptions originelles, sont largement contradictoires (tableau 1).
Ainsi, les indications des auteurs au sujet du type biologique varient entre annuel, hémicryptophyte bisannuel et chaméphyte vivace. Le cycle de vie était initialement considéré comme vivace sans particularité, mais les auteurs français (Tison, 2014a, b ; Andrieu et al., 2016 ; Pavon, 2018 ; Pavon & Pires, 2020) signalent plus récemment une tendance à la monocarpie. Par ailleurs, des observations réalisées par l’un d’entre nous (MK) sur des populations de L. companyonis en culture ne montrent aucune mortalité notable après floraison et ce sur plusieurs années.
Ces éléments contradictoires nous ont incités à réaliser une étude détaillée du cycle de vie à l’échelle de l’ensemble de l’aire de répartition des deux taxons en région méditerranéenne française.
2. Méthodes
2.1. Étude des échantillons types
Afin d’asseoir notre étude des deux taxons sur des bases univoques, nous avons tenté d’accéder aux échantillons types des deux taxons.
2.2. Cycle de vie / type biologique
Le cycle de vie des deux taxons est étudié à travers des comptages exhaustifs réalisés en période post-floraison (fin 2020) dans plusieurs sites parmi lesquels les loci classici à Sainte-Lucie (Aude) pour L. companyonis et à Sète (Hérault) pour L. duriusculum. Au total, les comptages ont porté sur 616 pieds dans quatre populations pour L. companyonis et 853 pieds dans neuf populations pour L. duriusculum. Lors des comptages, nous avons distingué trois catégories :
- stériles,
- fleuris vivants,
- fleuris morts.
2.3. Étude morphologique
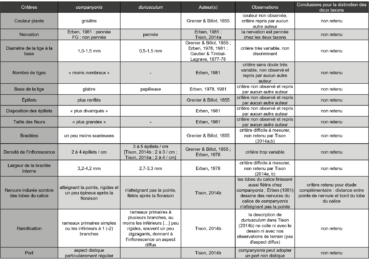
Le travail sur les critères morphologiques a été mené en trois étapes. La première a consisté à rassembler sous forme de tableau synthétique l’ensemble des critères différentiels retenus par les différents auteurs, y compris les descriptions originelles (duriusculum : de Girard, 1844 ; companyonis : Grenier & Billot in Billot, 1855). Dans une seconde étape, nous avons évalué la pertinence de chaque critère en tenant compte soit des échantillons types, soit d’observations de terrain réalisées sur les loci classici, soit de données déjà publiées permettant de mesurer la variabilité d’un critère (tableau 2).
La troisième étape a visé le seul critère retenu comme pertinent et facilement mesurable : la distance entre la fin de la nervure du calice et la pointe du lobe (photo 3).
Mesures
Nous avons réalisé 550 mesures, 354 pour Limonium duriusculum et 196 pour L. companyonis. Ces mesures ont été effectuées grâce aux logiciels ImageJ (Schneider et al., 2012) et Inkscape (Inkscape Project, 2020), sur des photographies prises à l’échelle 1:1 à l’aide de focales fixes montées sur reflex numérique. Ainsi, le champ du capteur étant connu, le calibrage précis de l’échelle de mesure du logiciel est possible. Les échantillons photographiés proviennent de différents sites (entre parenthèses : nombre de photos analysées) :
- L. companyonis : Sainte-Lucie (90), Talavigne (63), Grimaud (43) ;
- L. duriusculum : Sausset (74), golfe de Fos (102), Martigues (87).
Analyses statistiques
Compte tenu de la distribution non normale des mesures, l’analyse a été réalisée grâce à des tests non paramétriques (test de Kruskal-Wallis, puis comparaison par paires selon le test de Dunn, en appliquant la correction de Bonferroni). Les seuils de significativité des tests ont été fixés à 0,05. L’ensemble des analyses statistiques a été réalisé sous R (R Core Team, 2021).
Résultats
3.1. Étude des échantillons types
Limonium companyonis
Le type de Limonium companyonis correspond à l’échantillon n° 1541 de l’herbier de Billot comme indiqué par son descripteur (Billot, 1855). Il s’agit vraisemblablement d’une centurie récoltée et distribuée par Companyo. De ce fait, il existe une certain nombre d’isotypes de cette récolte. L’herbier de l’Institut de botanique de Montpellier (MPU) par exemple en possède : MPU021444, MPU021445 (photo 4). D’autres isotypes existent, avec la même étiquette imprimée de la série Flora Galliae et Germaniae exsiccata de C. Billot et désignés comme typus sur la feuille. L’un d’entre eux est conservé à l’herbier de Genève (G00440177 ; photo 5), un autre aux Pays-Bas au Naturalis Biodiversity Center (https://www.gbif.org/fr/occurrence/2515810601).
Erben (1978, 1981) cite ce type avec indication géographique « Leucate ». Cette indication est erronée dans la mesure où Billot ne mentionne aucune localité dans son article de 1855. En revanche, le lieu de récolte est cité sur l’étiquette d’herbier du type, il s’agit des « plages des environs de l’île Sainte-Lucie et de Narbonne (Aude) » (photo 6).
À signaler qu’en l’absence de désignation explicite d’un des deux spécimens de la planche comme type la typification effectuée ne semble pas valide.
Limonium duriusculum
La situation est bien plus compliquée pour ce taxon. De Girard (1844) mentionne deux localités, Sète, sans mention d’échantillon d’herbier, et Les Sablettes dans le Var, en mentionnant un échantillon de « Robert in herb. Delile » (photo 8). Sur le site internet du MNHN, l’herbier Delile est signalé comme faisant partie de « l’herbier de la Faculté de Médecine de Montpellier ».
Des recherches ciblées « herbier Delile » ont été effectuées dans les herbiers du Muséum national d’histoire naturelle de Paris (MNHN) et de Montpellier, en vain. Toutefois, l’herbier du MNHN possède un échantillon très intéressant « Statice gracilis, recueilli à Cette par M. Delile », ensuite complété par la mention « Statice duriuscula Girard », malheureusement sans date ni nom d’herbier, spécimen P05386060. Il pourrait ici s’agir d’un échantillon très ancien (Delile : 1778-1850), possiblement étudié par de Girard.
Entretemps, Erben (1978) a désigné un lectotype dans l’herbier de Montpellier, échantillon datant de 1841 et récolté par de Girard à Sète (« Rochers du Lazaret pr. Cette » ; photo 9). Par la même occasion, Erben a désigné deux isolectotypes, en provenance des récoltes par de Girard en 1841. Ces planches sont conservées à Munich (M-0173913 ; photo 10) et Genève (G00440168 ; photo 11).
Avec C. Loup, responsable des collections à MPU, nous avons mené des recherches approfondies du lectotype désigné par Erben, ces investigations sont malheureusement restées infructueuses. De ce fait, l’étude des échantillons type de L. duriusculum s’est limitée à celle des scans des isolectotypes.
La comparaison de tous les échantillons observés ne permet pas de mettre en évidence une différence morphologique manifeste (port, ramification, forme des feuilles, disposition des épillets, etc.).
Bref historique sur le statut des deux taxons
Si le taxon duriusculum n’a jamais été contesté, ce n’est pas le cas pour companyonis. Au-delà du fait que Grenier et Billot (1855) l’aient décrit sans indication de localité, leur approche a été partiellement critiquée comme décrit par Gautier & Timbal-Lagrave (1877-78). Janka (1882) retient la validité des deux taxons, alors que Rouy (1904, 1908) considère companyonis comme hybride avec L. echioides comme parent évident au vu des caractères des lobes du calice.
Bien plus tard, dans sa contribution à l’ouvrage européen de référence Flora Europaea, Pignatti (1972) retient L. duriusculum mais passe L. companyonis sous silence. Peu après, dans la Flore de France du CNRS, Pignatti et Guinochet font ce même choix. En 1978, Erben publie la première partie des résultats de sa thèse sur les Limonium sud-ouest-méditerranéens. Il y adopte une démarche très descriptive, sans études statistiques ni comptages chromosomiques. À signaler par ailleurs qu’il a rédigé ses descriptions de L. companyonis sans avoir vu l’échantillon type ou d’individu vivant sur le terrain. Pour Flora Iberica, Erben (1993) maintient sa position d’espèce à part entière pour companyonis, alors que quelques années plus tôt de Bolòs et al. (1990) l’avaient considéré comme sous-espèce de duriusculum. Ces deux taxons sont rapprochés du complexe rigualii-thiniense (espèces non présentes en France) par Koutroumpa et al. (2018), complexe auquel semble également appartenir L. echioides d’après les résultats préliminaires de phylogénie établis par ces auteurs.
Ce bref historique se termine en France par les contributions de Tison (2014a, b) qui conserve les deux taxons au rang d’espèce.
Force est de constater que le statut de L. companyonis est loin de faire l’unanimité à ce jour.
3.2. Cycle de vie
Mono- ou polycarpie ?
Pour une vision plus synthétique, nous avons regroupé les résultats des comptages en trois ensembles :
- L. duriusculum : stations des Bouches-du-Rhône ;
- L. duriusculum : population de Sète ;
- L. companyonis : populations de l’Aude.
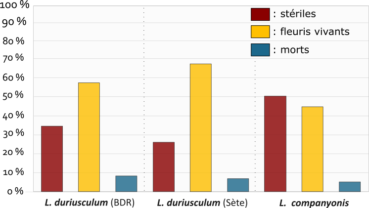
Toutes les populations observées montrent une nette tendance à la survie après floraison avec un taux de survie après floraison de près de 90 %, quelle que soit l’espèce considérée (figure 1). Les populations sont dominées par des individus toujours bien vivants après avoir fleuri. Les pourcentages moyens de pieds morts restent pour les trois ensembles inférieurs à 10 %.
Les différences entre populations ne sont pas statistiquement significatives. Le comportement des taxons peut être considéré comme homogène à l’échelle des sites échantillonnés.
Le taux de mortalité constaté paraît équivalent à celui observé sur d’autres Limonium vivaces de France méditerranéenne. Ces résultats corroborent des observations de plants de L. companyonis en culture (MK) qui persistent depuis plusieurs années sans mortalité notable. Le caractère monocarpique de ces espèces, parfois évoqué, ne semble donc représenter qu’une possibilité, qui n’est pas la plus fréquemment observée dans la nature, tant pour L. duriusculum que pour L. companyonis.
Il nous paraît évident de considérer les Limonium français du groupe duriusculum comme des plantes vivaces polycarpiques.
Type biologique
En France méditerranéenne, à l’exception des espèces rupicoles du groupe cordatum – pseudominutum, tous les Limonium montrent un caractère pionnier très marqué et sont capables de fleurir dès la première saison en conditions favorables (obs. pers. MK). Parmi ces taxons, Limonium echioides reste actuellement le seul taxon indiscutablement annuel. Toutes les espèces vivaces forment une rosette de feuilles la première année et pourraient à ce stade être considérées comme des hémicryptophytes. Dès la seconde année, la plupart des taxons ont tendance à renforcer leur structure végétative en produisant des rosettes supplémentaires à partir de la tige très courte qui commence à être lignifiée. À partir de ce stade, ces plantes possèdent les caractéristiques de chaméphytes, même si la partie lignifiée est peu évidente.
D’après nos observations, les Limonium français du groupe duriusculum se développent de façon équivalente. Les rosettes de première année sont uniques et appliquées au sol (photo 2), au cours des années suivantes, la production de rosettes voisines mène à une structure plus aérienne (photo 12).
Les Limonium du groupe duriusculum en France sont à considérer comme des chaméphytes à tige courte.
3.3. Étude morphologique
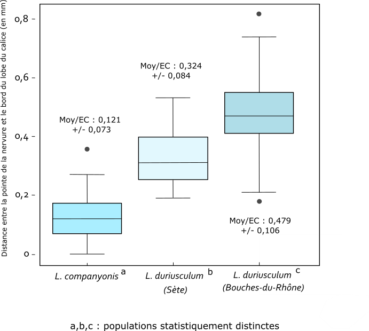
L’analyse de la distance entre l’apex de la nervure et l’apex du calice illustre un critère diagnostic dans la différenciation des taxons. Les résultats montrent une différence statistique significative (p < 0,001) entre trois groupes de populations (figure 2) :
- Limonium duriusculum: Bouches-du-Rhône (Fos-sur-Mer, Martigues, Sausset-les-Pins) ; distance très réduite (moyenne à 0,48 mm) ;
- Limonium duriusculum: population de Sète, qui diffère à la fois des populations de Limonium companyonis et des populations des Bouches-du-Rhône ; moyenne à 0,32 mm ;
- Limonium companyonis: Aude (Talavigne, Grimaud et Sainte-Lucie – typodème de l’espèce) ; distance très réduite (moyenne à 0,12 mm).
On observe sur ce critère des calices un gradient ouest-est et dont les valeurs moyennes se situent entre 0,12 et 0,48 mm. Ces valeurs inférieures à un demi-millimètre sont de toute évidence difficiles à mesurer aussi bien sur le terrain qu’au laboratoire sans matériel sophistiqué. À souligner également que, malgré leurs différences significatives, les valeurs concrètes se recouvrent de façon notable pour les trois taxons.
Une distinction des taxons ne pourra être réalisée sur la base purement morphologique de la structure des calices.
4. Discussion
Les Limonium français du groupe duriusculum forment un ensemble singulier et facile à reconnaître sur le terrain. Leurs critères de détermination généralement avancés, à savoir les calices étalés après floraison et la forme des feuilles, ainsi que leur cycle de vie paraissent homogènes à l’échelle de la région méditerranéenne française.
La présente enquête comparative, réalisée sur un nombre représentatif de populations à l’échelle de l’arc méditerranéen français, permet une première vue d’ensemble sur les deux taxons du groupe. Ceux-ci s’avèrent morphologiquement très proches, à tel point qu’un seul critère (forme du calice) nous a paru potentiellement distinctif et a donc été évalué ici.
L’étude morphométrique de ce critère, réalisée sur un nombre de mesures et d’échantillons représentatifs, met en évidence trois ensembles statistiquement distincts. Toutefois, les fourchettes des valeurs mesurées pour ces trois ensembles se recouvrent largement. De surcroît, les valeurs à mesurer pour la distinction des ensembles se situent entre 0,12 et 0,48 mm. De notre point de vue, ces deux arguments compromettent clairement la détermination des taxons. L’écueil, comme pour d’autres Limonium apomictiques, est que les déterminateurs vont in fine et de façon insatisfaisante attribuer un nom en fonction du lieu de récolte.
Se pose alors la question du traitement des taxons apomictiques morphologiquement très proches et décrits d’aires géographiquement parfois très restreintes et limitrophes, mais clairement allopatriques. En France, cette question a fait l’objet de publications récentes et argumentées auxquelles nous pouvons recourir (Jauzein, 1998 ; Tison, 2015). Si les deux auteurs proposent par ailleurs une approche a priori opposée, la comparaison des deux démarches s’en trouve d’autant plus intéressante. Nous en proposons quelques extraits succincts avant de formuler une réponse correspondant à leur démarche respective.
Jauzein (1998)
« La taxinomie de ces groupes [apomictiques] n’est en général accessible qu’à des spécialistes car il est facile de multiplier les taxons ; on assiste actuellement à une pulvérisation des genres Limonium ou Nigritella préjudiciable à mon avis à la clarté requise pour toute classification systématique ».
« [Les] taxons autogames ou apomictiques, qui ne sont pas des espèces au sens classique du terme, […] ne peuvent que très difficilement être inclus dans une nomenclature linnéenne. ».
« Dans beaucoup de cas, le binome linnéen devrait être utilisé pour ces groupes, et non pour les » petites espèces » constituantes (surtout en cas d’autogamie ou d’apomixie), sans pour autant revenir à des espèces trop extensives […]. En pratique, l’approche supérieure ne doit pas dépasser la limite d’identification facile. »
« La finalité même de la botanique systématique, science d’amont, et le rôle médiatique du nom scientifique se rejoignent pour impliquer une accessibilité aux non-spécialistes et donc :
- une reconnaissance des espèces sans ambiguïté […],
- une nomenclature définitivement stabilisée. ».
Adaptation aux Limonium du groupe duriusculum : afin de permettre l’identification facile, sans ambiguïté, accessible aux non-spécialistes ainsi qu’une nomenclature stabilisée, le taxon L. companyonis devrait être inclus dans l’espèce linnéenne L. duriusculum (cf. Coste, 1906 ; Pignatti, 1972 ; Pignatti & Guinochet, 1973 ; de Bolòs et al., 1990, 1995). Cette conclusion est encore plus valable pour la variante de L. duriusculum à Sète.
Tison (2015)
Au sujet des espèces apomictiques : « Chaque individu génétiquement distinct donnant naissance à un clone, et certains de ces clones ayant une distribution aussi vaste que l’Europe, toute la question réside dans la manière de les traiter taxonomiquement. »
« Ainsi, l’un des auteurs les plus méticuleux dans ce domaine, Tyler (2006), admet que deux clones ne sont séparables que s’ils ont au moins deux caractères morphologiques discriminants, correspondant à au moins deux mutations, faute de quoi l’un d’eux risque d’être accidentel et sans lendemain. »
« Même si elle ne répond pas directement à cette question, la proposition de Tyler (2006), consistant à ne séparer que des entités ayant au moins deux caractères morphologiques discriminants, donne souvent satisfaction. »
« En fait, si deux taxons diffèrent par deux caractères ou plus, une étude attentive permet généralement de leur suspecter des parentés distinctes, sans certitude aucune bien sûr, mais avec assez d’assurance pour admettre leur séparation. Ainsi, ce principe permet d’obtenir des taxons aussi monophylétiques que possible, tout en contournant les difficultés de l’étude moléculaire. »
Adaptation aux Limonium du groupe duriusculum : dans la mesure où le taxon (postérieur) L. companyonis ne diffère de L. duriusculum que sur un seul critère, et ce de façon peu convainquante (« forme » intermédiaire à Sète), il devrait être inclus dans l’espèce linnéenne L. duriusculum.
L’application des démarches proposées par Jauzein (1998) et Tison (2015) semble mener au même résultat après analyse morphologique des populations citées. Les premiers résultats semblent montrer une absence de caractère net permettant de discriminer entre les deux espèces, conduisant au regroupement de Limonium companyonis avec L. duriusculum. Des analyses supplémentaires, intégrant les autres critères morphologiques usuellement utilisés chez les Limonium, doublées si possible de nouveaux éléments de phylogénie moléculaire, seront cependant nécessaires avant de pouvoir déterminer avec certitude le rang taxonomique respectif de ces deux taxons.
5. Perspectives
Le groupe de Limonium duriusculum a une répartition géographique limitée au nord-ouest du bassin méditérranéen, entre l’extrémité nord du Maghreb et la Camargue, et reste rare au niveau mondial. Il comprend plusieurs taxons considérés actuellement comme endémiques à aire restreinte (Andrieu et al., 2016). Il serait évidemment intéressant de mener une étude à l’échelle du groupe sur l’ensemble de son aire, en faisant intervenir notamment des données moléculaires.
Bibliographie
Andrieu F., Barreau D., Plassart C. & Thys E., 2016. Limonium companyonis (Grenier & Billot) Kuntze. In C. Plassart, D. Barreau & F. Andrieu, Atlas de la flore patrimoniale de l’Aude, Biotope, Mèze. http://atlas.cbnmed.fr/atlas11/commun/fiche_taxon.php?id=149
Billot C., 1855. Florae Galliae et Germaniae Exsiccata, herbier publié par C. Billot. Quinzième et seizième centuries. In F.W. Schultz, Archives de la Flore de France et d’Allemagne 1 : 328-339.
Bolòs O. (de), Vigo J., Masalles R.M. & Ninot J.M., 1990. Flora manual dels països Catalans. Ed. Portic, 1 247 p.
Bolòs O. (de), Vigo J., Masalles R.M. & Ninot J.M., 1995. Limonium. In O. de Bolòs & J. Vigo, Flora dels països Catalans, III, Barcino édit. : 69-93.
Coste H., 1906. Flore descriptive et illustrée de la France, de la Corse et des contrées limitrophes, 3. P. Klincksieck, Paris, 807 p.
Erben M., 1978. Die Gattung Limonium im südwestmediterranen Raum. Mitteilungen der botanischen Staatssammlung München 14 : 361-631.
Erben M., 1981. Bemerkungen zur Gattung Limonium, II. Mitteilungen der botanischen Staatssammlung München 17 : 485-510.
Erben M., 1993. Limonium Mill. In S. Castroviejo, C. Aedo, S. Cirujano, M. Laínz, P. Montserrat, R. Morales, F. Muñoz Garmendia, C. Navarro, J. Paiva & C. Soriano (eds.), Flora Iberica 3 : 2-143.
Gautier G. & Timbal-Lagrave E., 1877-78. Note sur un nouveau Statice, Statice legrandi. Bulletin de la Société des sciences physiques et naturelles de Toulouse 4 : 40-42.
Girard F. (de), 1844. Armeriae et Statices generum species nonnullas novas proponit. Annales des sciences naturelles 3e série, botanique, 2 : 323-332.
Grenier M. & Godron M., 1850. Flore de France ou description des plantes qui croissent naturellement en France et en Corse, tome deuxième. Éd. Sainte-Agathe Aîné, Besançon, 760 p.
Inkscape Project, 2020. Inkscape, Available at: https://inkscape.org.
Janka V. (de=, 1882. Plumbagineae Europaeae. Természetrajzi Füz. 6 : 164-175. Available from https://www.biodiversitylibrary.org/item/96887#page/592/mode/1up
Jauzein Ph., 1998. Opinion sur l’espèce végétale, sa taxinomie et sa nomenclature. Sauve qui peut 10, 22 p.
Koutroumpa K., Theodoridis S., Warren B.H., Jiménez A., Celep F., Doğan M., Romeiras M.M., Santos‐Guerra A., Fernández‐Palacios J.-M., Caujapé‐Castells J., Moura M., Menezes de Sequeira M. & Conti E., 2018. An expanded molecular phylogeny of Plumbaginaceae, with emphasis on Limonium (sea lavenders): taxonomic implications and biogeographic considerations. Ecological Evolution 8, 12397-12424, https://doi.org/10.1002/ece3.4553
Pavon D., 2005. Note sur le genre Limonium Mill. dans le département des Bouches-du-Rhône. Bulletin de la Société linnéenne de Provence 56 : 135-139.
Pavon D. & Pires M. (coords.), 2018. La flore patrimoniale des Bouches-du-Rhône. Éd. Biotope, Mèze, 464 p.
Pavon D. & Pires M., 2020. Flore des Bouches-du-Rhône. Éd. Naturalia, Turriers, 351 p.
Pignatti S., 1972. Limonium Miller. In : T.G. Tutin, V.H. Heywood, N.A. Burges, D.M. Moore, D.H. Valentine, S.M. Walters & D.A. Webb, Flora Europaea 3 – Diapensiaceae to Myoporaceae, Cambridge University Press : 38-50, https://doi.org/10.5281/zenodo.305475
Pignatti S. & Guinochet M., 1973. Limonium Mill. In M. Guinochet & R. de Vilmorin, Flore de France, 1. CNRS, Paris : 340-346.
R Core Team, 2021. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria, https://www.R-project.org/.
Rouy G., 1904. Sur quelques espèces, formes ou variétés du genre Statice (suite et fin). Revue de botanique systématique et de géographie botanique 1 (12) : 179-186.
Rouy G., 1908. Flore de France ou description des plantes qui croissent spontanément en France, en Corse et en Alsace-Lorraine, X, Société des sciences naturelles de la Charente-inférieure, 404 p.
Sáez L. & Rosselló S.A., 1999. Is Limonium cavanillesii Erben (Plumbaginaceae) really an extant species? Anales del Jardín Botánico de Madrid 57 (1) : 47-55. http://rjb.revistas.csic.es/index.php/rjb/article/download/188/186
Schneider C.A., Rasband W.S. & Eliceiri K.W., 2012. NIH Image to ImageJ: 25 years of image analysis. Nature Methods 9 (7) : 671-675.
Tison J.-M., 2014a. Limonium Mill. In J.-M. Tison & B. de Foucault (coords.), Flora Gallica, Flore de France, Biotope éditions, Mèze : 906-910.
Tison J.-M., 2014b. Limonium Mill. In J.-M. Tison Ph. Jauzein & H. Michaud, 2014. Flore de la France méditerranéenne continentale, Naturalia Publications, Turriers : 1080-1085.
Tyler, T. 2006. Patterns of morphometric variation and a new supraspecific classification of apomictic taxa of Hieracium (Asteraceae) from Denmark and southern sweden. Plant Systematics and Evolution 261 : 39-88.
Remerciements
Les auteurs tiennent à remercier les personnes suivantes pour leur aide précieuse : Caroline Loup (herbier MPU) et Grégoire Flament (MNHN, recherche de spécimens), Mathias Erben (envoi de documents pour la recherche des isolectotypes), Laurence Soze (CJB herbier de Genève, envoi de scan), Frédéric Andrieu (CBNMed, mise à disposition de données), Kattalin Fortuné, Guilhem Mollera, Jérôme Paoli (PNR de la Narbonnaise en Méditerranée, prospections en sites protégés et gérés par le PNRNM), Daniel Marc (CEN Occitanie, soutien matériel et logistique), Elodie Klesczewski et rédacteur de la revue (relecture finale). Merci aussi à E-Recolnat (ANR-11-INBS-0004 ; https://www.recolnat.org/fr/) qui nous a permis la recherche efficace de spécimens en ligne.