Observations sur les deux jonquilles du Massif central (Narcissus hispanicus Gouan), comparaison avec celles de Provence et des Pyrénées centrales
Title
Observations on the two daffodils from the Massif central (Narcissus hispanicus Gouan), comparison with those of Provence and central Pyrénées
Résumé
Deux Jonquilles spontanées vivent dans le Massif central :
– N. hispanicus diploïde (localité type : Espérou, Aigoual) : Cévennes, Causses, massifs de l’Hérault et de l’Aude (Séranne, Espinouse, Montagne Noire) ;
– N. hispanicus subsp. dutartrei Fridl. subsp. nov. hexaploïde : Auvergne, Aubrac, Limousin, Livradois-Forez et nord des Cévennes (mont Lozère).
Diploïde ancestral méditerranéen, N. hispanicus a colonisé l’axe rhodanien (Marsanne, Pilat, Vercors) jusqu’aux Jura suisse ; dans le nord du Massif central, cette jonquille a donné naissance à un apo-endémique hexaploïde. Les diploïdes correspondent à plusieurs schizoendémiques parmi lesquels N. hispanicus subsp. provincialis (Provence) et N. hispanicus subsp. tubulosus (Pyrénées centrales). Depuis des siècles, des Jonquilles sauvages et horticoles de toutes provenances sont cultivées un peu partout en France. Les populations de plaine sont vraisemblablement toutes subspontanées ; les N. pseudonarcissus tétraploïdes qui semblent parfois spontanés en montagne ont des origines incertaines.
Abstract
Two wild daffodils grow in French Massif central:
– N. hispanicus is a diploid found in the grasslands and rocky areas of Causses, southern Cévennes (type locality at Espérou, Aigoual), and some massifs in Hérault and Aude (Séranne, Espinouse, Montagne Noire);
– N. hispanicus subsp. dutartrei Fridl. subsp. nov. is an hexaploid endemic taxon which colonises grasslands, meadows, forest edges and peat bogs in Auvergne, Aubrac, Limousin, Livradois-Forez and the northern Cévennes (mont Lozère).
N. hispanicus is also found along the Rhône corridor (Marsanne, Pilat, Vercors) as far as the Swiss Jura and northern part of the Iberian Peninsula. It has differentiated into several schizoendemic taxa such as N. hispanicus subsp. provincialis (Provence) and N. hispanicus subsp. tubulosus (central Pyrénées). For centuries, wild and horticultural daffodils have been cultivated throughout France; some have become naturalised. Tetraploid N. pseudonarcissus appears to be subspontaneous, with multiple and uncertain origins.
1. Introduction
Le plus souvent nommées N. pseudonarcissus L., les jonquilles se singularisent par leur grande paracorolle (= couronne = godet) de couleur jaune à peu près aussi longue que les tépales (la couronne est une structure mixte encore mal comprise ; Waters et al., 2013). Elles ont été classées dans un genre ou des sections à part : Narcissus sect. Pseudonarcissus DC., Ajax Salisb. ex Haw., sect. Ajax (Salisb. ex Haw.) Dumort). Autochtones dans la péninsule Ibérique, en France, en Suisse et dans le nord-ouest de l’Italie, leur introduction et leur popularité dans toute l’Europe sont largement attestées à partir du Moyen Âge (Rivera Nuñez et al., 2003 ; Rivera et al., 2006). En France, la plupart des stations de plaine résultent d’introductions parfois très anciennes.
Dans la chaîne pyrénéenne française, Marcel Saule (1991) reconnaît cinq jonquilles. En Provence, les petites jonquilles qui poussent dans les sols pierreux (garrigues à Thym de Grasse c. 700 m et jusqu’à 2 000 m au Tournairet) sont rapprochées des N. minor L. du nord-ouest de l’Espagne ou considérées comme une endémique liguro-provençale N. pseudonarcissus subsp. pronvincialis (Rouy, 1902 ; Pugsley, 1933 ; Guinochet, 1978 ; Pignatti, 2017 ; Tison et al., 2014 ; Tison & de Foucault, 2014 ; Le Driant et al., 2022).
En Auvergne, les plantes du Sancy sont connues pour être de grande dimension (Delarbre, 1795 ; Lecoq & Lamotte, 1847 ; Chassagne, 1956), mais n’ont jamais fait l’objet d’études particulières si bien que
N. pseudonarcissus est la seule espèce signalée dans le Massif central : le N. hispanicus décrit dans les Cévennes par Gouan (1773) est tombé dans l’oubli.
Le nombre de taxons et les noms des jonquilles retenus dans les différentes flores sont dissonants : six taxons dans les Pyrénées catalanes (de Bolòs & Vigo, 2001) ; sept dans le Pays basque (Aizpuru et al., 2000), huit pour la France et quatorze pour la péninsule Ibérique selon Webb (1980), mais neuf selon Aedo (2013). Plusieurs jonquilles récemment décrites en Espagne n’auraient aucune réalité génétique (Jimenez et al., 2009). Nous avons tenté de comprendre ce qui pourrait expliquer toutes ces contradictions concernant celles du Massif central en comparant des dizaines de populations dans le sud-est de la France (mesures des feuilles, bulbes, fleurs, étude cytogénétique, suivi des floraisons, mise en culture…).
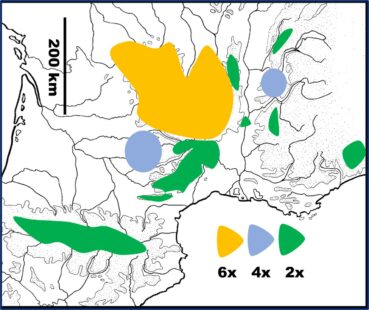
2. Analyse cytogénétique (niveaux de ploïdie) des jonquilles du sud-est de la France
D’après les données bibliographiques, la plupart des jonquilles (N. pseudonarcissus s. l.) récoltées dans la nature seraient diploïdes à 2n = 2x = 14 et tétraploïdes à 2n = 4x = 28 chromosomes. Si on inclut les jonquilles subspontanées ou cultivées on observe une série polyploïde (2n = 14, 15, 21, 22, 28, 30, 42, 48, 49…) avec des aneuploïdes, des chromosomes surnuméraires – B, etc. (Fernandes, 1934, 1946, 1968 ; Sañudo et al., 1983 ; Fedorov, 1969 ; Fernandez Casas, 1987).
Pour cette étude, nous avons analysé plus de 250 bulbes de jonquilles récoltées dans une quarantaine de populations sauvages et cultivées à Marseille ; elles se répartissent en trois ensembles (trois niveaux de ploïdie) dont la distribution est reportée sur la carte 1.
Les diploïdes (2n = 2x) – Deux à cinq individus issus de plusieurs localités du sud du Massif central (Montagne Noire, Espinouse, collines calcaires de l’Hérault et du Gard – Séranne, Saint-Hippolyte -, massif de l’Aigoual, causses du Larzac et de Méjean) se sont tous révélés diploïdes. Il en est de même des jonquilles des Pyrénées centrales, de Provence (600-2 100 m) et des massifs qui bordent l’axe rhodanien (Pilat, Marsanne, Vercors, Bugey, Jura).
Les hexaploïdes (2n = 6x) – Les jonquilles du nord des Cévennes (mont Lozère), d’Auvergne (Cézallier-Sancy, monts du Cantal, Margeride, Livradois Forez…) et Limousin sont toutes hexaploïdes. Elles correspondent aux plus vastes peuplements des prairies et pelouses du Massif central (abondantes à partir de 900-1 000 m) : ces jonquilles poussent en touffes denses et possèdent des grandes fleurs dont les paracorolles sont largement récurvées à leur extrémité.
Les tétraploïdes (2n = 4x) – Comme beaucoup de Liliaceae, Iridaceae ou autres Amaryllidaceae à bulbes et rhizomes, les Narcissus possèdent un « génome obèse » : l’ADN 2C des diploïdes (x = 5, 7) varie de 15 à plus de 30 pg !
Plusieurs jonquilles tétraploïdes (4x et/ou ~ 4x) sont atypiques et possèdent un génome tantôt plus grand, tantôt plus petit que les tétraploïdes. Chez les plantes horticoles on observe des diploïdes (2n = 2x) dont le génome est celui d’un triploïde (2n ~ 3x). Par ailleurs, de nombreux composés cellulaires (cf. mucus) rendent les estimations de tailles de génome moins précises (fixation irrégulière des colorants sur l’ADN). On doit donc être prudent dans les interprétations génétiques. Quoi qu’il en soit, remaniements, pertes ou gains de plusieurs milliers de paires de bases apparaissent sans conséquence sur la survie des individus et ne se manifestent pas nécessairement d’un point de vue morphologique ou écologique (cf. aneuploïdie chez les polyploïdes). Dans la suite de cet article, la catégorie « tétraploïde » correspond donc à un ensemble hétérogène qui n’a pas d’intérêt à être détaillé ici.
Les périanthes des populations « tétraploïdes » sont notablement variables (mélange de fleurs petites ou géantes, bicolores ou concolores). Les populations tétraploïdes identifiées sont rares en montagne et se rencontrent toutes dans les secteurs les plus anthropisés où leur spontanéité peut être mise en doute : à proximité de fermes parfois abandonnées, de sites touristiques avec nombreux aménagements plus ou moins anciens. Elles sont concentrées dans deux secteurs :
- dans les massifs qui bordent la vallée du Rhône (Royan- Chartreuse),
- dans le sud-ouest du Massif central, des Causses de Gramat aux contreforts du Lévezou (Ségala).
Nous n’avons pas trouvé de populations présentant des di- et hexaploïdes en mélange. En revanche, di- et tétraploïdes peuvent parfois cohabiter (Pilat, cf. § 6). Les diploïdes présentent plutôt des paracorolles cylindriques généralement moins évasées que celles des hexaploïdes. Selon les endroits, les fleurs des tétraploïdes ressemblent aux diploïdes ou aux hexaploïdes.
3. Remarques sur les dimensions, formes et couleurs des jonquilles
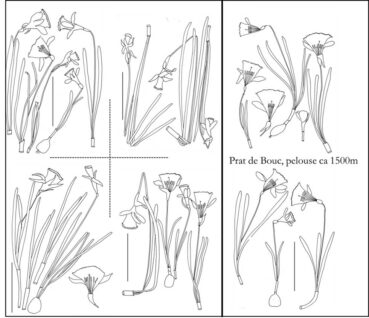
Les bulbes de jonquilles émettent au printemps 2-3(4) limbes et une hampe aérienne terminée par une seule fleur jaune à vie brève (2-4[5] jours). Grâce à leurs racines tractrices, ils s’enfoncent jusqu’à atteindre la profondeur qui leur convient : ils grossissent progressivement en même temps qu’ils deviennent de plus en plus sphériques (plus allongés dans leurs jeunes années). La formation de bulbes fils est plus fréquente et intense chez les jonquilles polyploïdes que chez les diploïdes (planche 1). Selon les conditions environnementales, le feuillage se desséchera après un à trois mois, bien avant ou au moment de la maturation du fruit. Quels que soient les cytotypes et la population étudiée, partout on observe côte à côte des plantes dont la dimension des limbes, hampes et aussi des fleurs varie de un à trois et souvent plus (planches 2 à 6).
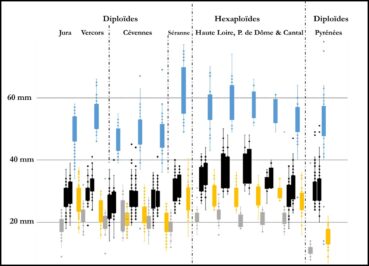
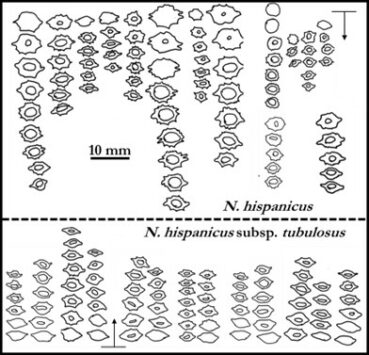
L’analyse statistique globale (cf. ACP) de milliers de mesures qui correspondent à quinze-trente individus dans plus de quarante populations (longueur et largeur des limbes et tépales, longueur de la couronne, diamètres des bulbes, hampes, couronnes…) montre un nuage de points qu’il nous a semblé bien difficile à déchiffrer. Pour illustrer assez simplement les difficultés d’interprétation, on peut se référer à la figure 1 qui compare les mesures de quelques pièces florales des principaux groupes de populations : dans toutes les populations de jonquilles, les tépales et couronnes sont globalement de même longueur ; les plantes des Pyrénées se distinguent assez nettement des autres par un tube court et une couronne cylindrique de faible diamètre non évasée ni récurvé à son extrémité ; les diploïdes des Cévennes sont globalement un peu plus petits que ceux des Préalpes du Vercors et du Jura ; les jonquilles hexaploïdes possèdent des fleurs généralement plus grandes mais des exceptions notables se rencontrent dans certaines populations.
Les logiques de ces variations n’apparaissent pas évidentes : les jonquilles des crêtes de la Séranne ont des fleurs parfois géantes, celles des pelouses de Prat de Bouc nettement plus petites que celles de Margeride (qui à altitude égale sont plus grandes que dans le Cézallier)… Les dimensions résultent de facteurs disparates : polyploïdie, variabilité génétique individuelle, environnement (altitude, microvariations édapho-climatiques, contexte écologique, variabilités climatiques…), histoires de vie des différents bulbes et des populations (grandissement avec l’âge, broutés ou non certaines saisons, ensoleillement, compétitions racinaires et aériennes). En culture à Marseille, toutes les jonquilles deviennent nettement plus petites que dans la nature (faible humidité atmosphérique, fortes chaleurs ?) et les différences de dimensions entre la plupart des populations s’effacent dès la deuxième année.
3.1. Longueur et forme des hampes
Les feuilles continuent leur croissance après la floraison, tandis que les hampes s’allongent presque jusqu’à la pleine maturation des graines : le diamètre et la longueur des hampes en fruit dépassent souvent largement le double de ce qu’ils étaient à la floraison !
En coupe transversale, les hampes sont pleines ou fistuleuses sur une partie ou toute leur longueur, cylindriques, compressées, légèrement ailées ou non sur les marges. Ces caractères varient non seulement d’un individu à l’autre, mais également de la base au sommet de la hampe. Les jonquilles du Jura ont des hampes assez homogènes et comprimées assez semblables à celles des Pyrénées, alors qu’elles sont nettement plus variables dans les populations cévenoles aux hampes tantôt cylindriques, tantôt nettement ancipités (planches 1, 4, 6, 7).
3.2. Dimension des fleurs et altitude : une source de confusions
Si on compare des populations mesurées en même temps ou à un ou deux jours d’écart dans un massif et donc ayant vécu les mêmes variations météorologiques au cours de leur anthèse et subi les mêmes variations climatiques au cours des dernières années (sécheresse, chaleur), on observe que chez les diploïdes du Jura (N. hispanicus), des Pyrénées (N. hispanicus subsp. tubulosus) ou de Provence (N. hispanicus subsp. provincialis) les fleurs sont plus grandes quand l’altitude augmente (figure 2).
Ces différences apparaissent moins nettement chez les hexaploïdes qui sont par exemple sensiblement identiques dans le Sancy à 1100, 1200 et 1400 m, mais légèrement plus grands à 1600 m. Dans des pelouses rocailleuses de Prat de Bouc entre 1300 et 1500 m, les fleurs sont plus petites que dans le Sancy.
Les jonquilles géantes observées certaines années à la Séranne ou dans le Cézallier ne l’ont pas été d’autres années !
3.3. Formes et couleurs des jonquilles
Dans le bouton, les pièces florales sont vertes, couleur liée à la dominance de la chlorophylle. Au cours de l’anthèse, les autres couleurs apparaissent du fait de l’augmentation de la concentration en xanthophylles et caroténoïdes et à une destruction partielle de la chlorophylle. Les physiologistes ont montré que la synthèse des pigments et le passage d’une couleur verte à jaune, orange ou blanche dans les pièces florales (et les téguments de plusieurs fruits) est régulée par un ensemble de facteurs environnementaux (pH intracellulaire, température, lumière, concentration en éthylène). Dans une même inflorescence, le vert initial des pièces florales disparaît plus ou moins vite et pas toujours complètement au cours de l’anthèse (Fridlender, 2018).
La base des tépales externes et/ou du tube du périanthe est parfois lavée de vert. Des fleurs épanouies côte à côte présentent souvent des couleurs et formes distinctes et les transitions entre fleurs jaunes concolores et fleurs plus ou moins bicolores sont fréquentes au sein d’une même population. Dans les sous-bois et le long des ruisseaux des Cévennes, les N. hispanicus possèdent des tépales nettement plus clairs (parfois blanchâtres) que ceux des jonquilles des pelouses et escarpements de pleine lumière ; sous la pluie les fleurs apparaissent souvent pâles, comme délavées.
Dans certaines populations pyrénéennes, le tube reste vert à sa base, tandis que les tépales (ou même les couronnes) d’individus proches sont jaunes, jaune pâle ou blanchâtres. Certaines populations renferment des fleurs chez lesquelles certains tépales ou seulement une partie du tépale est pâle ou même d’un blanc pur (planche 8).
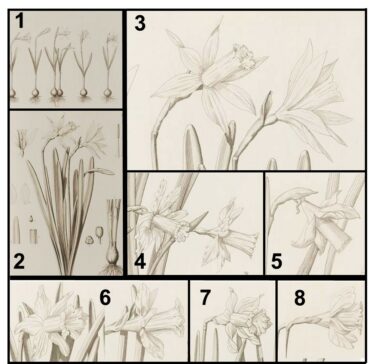
À partir de ces variations individuelles présentes dans presque toutes les populations naturelles, les collectionneurs ont aisément sélectionné et produit d’innombrables clones aux dimensions et colorations variées, obtentions qui sont largement attestées dès le xvie siècle (planche 9). La manipulation de lignées cellulaires du méristème apical est d’ailleurs largement employée pour l’obtention de fleurs (chimères) où se combinent les coloris souhaités (Datta, 2025) ; des fleurs bicolores adviennent naturellement sans hybridations. Un même individu (un génotype) peut donner naissance à une multitude de variations florales (phénotypes) à partir desquelles on obtient rapidement des centaines d’individus originaux (clonage) que l’on peut considérer comme des cultivars mais aucunement comme des taxons distincts !
Les rapports entre morphologie, coloration, dimensions et ploïdie ne sont pas constants ; les observations issues de nos mesures et cultures indiquent que :
- les fleurs sont d’autant plus grandes que le bulbe est âgé et donc plus gros, que le sol est profond, que les pluies et l’humidité atmosphériques sont importantes (ce qui est souvent le cas en altitude et en allant vers le nord) ;
- la paracorolle est plus évasée et récurvée à son extrémité chez les hexaploïdes que chez les diploïdes dont la couronne apparaît plus ou moins tubulaire (avec des exceptions très nettes dans certaines populations !) ;
- les fleurs des polyploïdes sont globalement plus grandes que celles des diploïdes. Mais les jonquilles diploïdes qui poussent dans un sol profond et temporairement humide possèdent des fleurs et un feuillage parfois aussi grands que ceux des hexaploïdes (cf. lapiaz de la Séranne certains printemps à c. 900 m).
Les observations en culture (Hanks, 2002) permettent de mieux appréhender le rôle de l’environnement dans la variabilité. Le feuillage se dessèche parfois peu après la floraison, ce qui n’empêche nullement la plante de vivre, on peut d’ailleurs retirer du sol les bulbes sans dommage chaque année quand les fleurs sont fanées. En revanche, si des jonquilles conservent leur feuillage deux ou trois mois après la floraison dans des conditions fraîches et humides, l’année suivante presque tous les bulbes fleuriront, y compris les bulbes fils plus petits, et la floraison sera en outre plus synchrone. La floraison des bulbes les plus profonds (souvent plus âgés) est plus tardive que les autres, elle est mauvaise si les bulbes subissent une trop forte chaleur estivale. Dans des conditions écologiques différentes, un bulbe se comporte différemment ; les années chaudes et sèches sont plutôt défavorables à d’abondantes floraisons ultérieures : les prairies des montagnes d’Auvergne se couvrent d’un tapis de fleurs au printemps, alors que les jonquilles sont plus dispersées avec une floraison plus étalée dans les garrigues (dessèchement rapide du feuillage puis du sol, fortes chaleurs, substrats et microclimats plus hétérogènes).
La valeur taxonomique de mesures effectuées in situ s’avère d’autant plus limitée que celles-ci varient rapidement et fortement au cours de l’anthèse : l’ovaire grossit très rapidement au cours de la floraison (5-10 mm de plus au cours des premiers jours de la vie de la fleur chez les hexaploïdes) ; la couronne n’acquiert pas immédiatement son plein développement, celle-ci étant toujours cylindrique au début ; chez certaines fleurs sa marge se recourbe de façon importante mais tardivement, seulement le deuxième ou troisième jour. Il est donc souvent difficile de distinguer les jonquilles diploïdes et polyploïdes d’après les formes, couleurs et dimensions de la fleur. Pourtant, au sein du complexe de N. hispanicus il existe plusieurs entités génétiques dont la distribution évoque une longue histoire évolutive.
4. Remarques concernant la nomenclature des jonquilles
Gerarde (1633) emploie le terme de bastard daffodil pour distinguer les jonquilles des autres Narcisses (daffodil), ce qui montre que les botanistes n’avaient guère de doute sur la nature horticole des jonquilles à leur disposition dans le nord de l’Europe (plantes cultivées largement issues de sélections et hybridations).
Linné disposait des jonquilles des collections vivantes d’Uppsala, de parts d’herbiers en provenance de nombreux botanistes et bien entendu des ouvrages des xvie et xviie siècles (planche 9) qui décrivaient concomitamment et sans distinctions les espèces sauvages et les cultivars. Dans la première édition de Species Plantarum (1753), il ne décrit qu’une jonquille (N. pseudonarcissus), peut-être parce qu’il ne sait pas où faire des limites parmi toutes les fleurs de jonquilles et toutes les illustrations à sa disposition, mais peut-être aussi parce qu’il considère que ce sont des plantes cultivées (A varietatibus hortulanorum monstrosis) qui par conséquence ne devraient pas être prises en compte par les botanistes puisque seules importent les espèces sauvages, celles de l’Omnipotentis Creatoris (Linné, 1737). Malheureusement dans la seconde édition de Sp. Pl. (1762), il rajoute de nouvelles espèces, N. minor, N. bicolor, N. moschatus glanées dans les illustrations des anciens et chez les collectionneurs de bulbeuses (cf. Rudbeck ; planche 9).
Son N. pseudonarcissus correspond à « une espèce collective » comme en attestent les ratures présentes dans son herbier, dans lequel il demeure délicat de savoir quels pourraient être les types (et l’origine) des N. pseudonarcissus et N. minor (Diaz & Fernandez, 1979 ; Barra & Lopez, 1984 ; Fernandez Casas, 1986).
Haworth (1819, 1831), qui se fournit en bulbeuses dans les marchés londoniens et chez les pépiniéristes anglais et étrangers, décriera 24 nouvelles espèces de jonquilles ! Descriptions d’ailleurs largement contestées par ses contemporains qui soulignaient que toutes ses espèces n’étaient que des variations en provenance des jardins hollandais (and originating in the flowery gardens of the Dutch). N. nobilis est décrit par Haworth (sub Ajax nobilis) comme « plus grand que Ajax spurium lui-même originaire comme Ajax serratus de Mill Hill en Angleterre », autrement dit des cultivars naturalisés dans les environs de Londres ! En revanche, Ajax leonensis Pugsley correspond à une plante récoltée dans la nature et d’origine connue. La combinaison N. nobilis var. leonensis (Pugsley) Fernandes est, parmi tant d’autres (cf. N. minor subsp. asturiensis, N. pseudonarcissus subsp. nevadensis…), un exemple où s’entremêlent des épithètes créées pour désigner des plantes cultivées et des plantes sauvages. Bien évidemment, aucune de ces jonquilles de collectionneurs, décrites et illustrées à partir de ces collections, n’est autochtone en France, même si quelques-uns de ces clones sont localement subspontanés (planche 9).
Les botanistes semblent indifférents (ou inconscients ?) au fait qu’ils utilisent des noms qui se réfèrent à ces plantes achetées et échangées entre collectionneurs (obtentions horticoles volontaires ou survenues spontanément au cours des décennies de cultures). S’appliquant à des plantes cultivées depuis des siècles dans les collections du nord de l’Europe, on devrait réserver ces anciennes épithètes (pseudonarcissus, nobilis, bicolor, calathinus, minor, abscissus…) et toutes les combinaisons associées aux jonquilles cultivées et subspontanées…, ce qu’elles sont depuis leurs origines. En effet, les interprétations à la lettre du code de nomenclature conduisent à nommer des plantes sauvages comme étant des variantes de cultivars, ce qui est biologiquement absurde. Paradoxalement, quasiment tous les botanistes ignorent le plus ancien nom (N. hispanicus Gouan) qui s’applique aux jonquilles sauvages du sud de la France !
5. Les groupes cyto-morphologiques de jonquilles
5.1 N. hispanicus, un diploïde méditerranéen qui remonte le couloir rhodanien jusqu’au Jura
N. hispanicus Gouan, Illust. Obser. Bot.: 23 (1773) ; « in pyrenaeis & monte Calcaris frequens mihi occurrit»
= Ajax montinus Jord. p.p. = N. pseudonarcissus L. subsp. bicolor (L.) Baker p.p. in Guinochet, 1978 = N. pseudonarcissus L. subsp. minor (L.) Baker p.p. in Guinochet, 1978 = N. pseudonarcissus subsp. pallidiflorus p.p. in Tison et al., 2014 = N. pseudonarcissus L. in Baudière, 1970, Flore du Gard de l’Hérault et des Cévennes = N. pseudonarcissus p.p. in Coste, 1901, Fournier, 1947, Guinochet, 1978, Lauber & Wagner, 1998 in Fl. Helvetica, Aeschimann et al. 2004, in Fl. Alpina, Garraud, 2003 in Fl. Drôme, Tison & de Foucault, 2014, Driant et al., 2022.
Icon. : planches 2, 3, 10.
Quelques échantillons (Col. A. Fridlender) représentatifs de N. hispanicus ayant fait l’objet d’études cytogénétiques (diploïdes) – Massif de l’Aigoual et ses contreforts : prairie de l’Espérou 1 150 m (loc. type), MPU 886982 ; escarpement rocheux à Cytisus oromediterraneus au Cap des Côtes, c. 1 200 m, 3-4-2023, MPU 886983 ; en lisière de la hêtraie, à quelques kilomètres du village de l’Espérou, c. 1 135 m, MPU 886984 ; sous-bois de chênes pubescents versant nord-ouest de l’Aigoual ; ruisselet du versant nord de l’Aigoual, c. 1 230 m, 3-4-2023, MPU 886985 ; gorges de la Jonte à Meyrueis, 3-4-2023, c. 650 m, MPU 887002 ; plateau du Larzac, chênaie claire sur calcaire, entre 800 et 900 m, vers Carbon, 16-5-2022, MPU 887001 ; massif de la Montagne Noire, sous-bois vers 900 m, 13-5-2022, MPU 887003 ; massif de la Séranne, lapiaz c. 900 m, mai 2021, MPU 886987 ; Saint-Hippolyte, dans les éboulis et rochers, avril 2018 ; Haut Jura, massif de la Dôle, prairies sommitales 1 600-1 650 m, mai 2024, MPU 886986 ; ibid. prairie vers 1 400 m ; prairies et berges tourbeuses au Rosay (Viry) c. 800 m, mai 2023 ; prairies de la Pesse, c. 1 000 m, mai 2023 ; Vercors, pelouses et lisières forestière vers Ambel, c. 1 100 m, MPU 886982 ; Drôme, massif de la Marsanne sous-bois clair, c. 500 m.
Botaniste de Montpellier et collaborateur de Linné, A. Gouan (1773) adopte l’épithète hispanicus très utilisée aux xviie et xviiie siècles (cf. Clusius in liber secundus, Rar. Plant. Hist. : « Pseudo-narcissus major Hispanicus » ; planche 9) afin de décrire les jonquilles qu’il a observées dans les Pyrénées et les Cévennes « in pyrenaeis & monte Calcaris » (le mont Calcaris désigne l’Espérou [Espéron] sur le versant sud de l’Aigoual). Comme les jonquilles pyrénéennes sont notoirement polymorphes et comportent des populations diploïdes et polyploïdes, trop imprécis, « in pyreneis » n’est guère informatif ; aussi avons-nous recherché les jonquilles dans tout le massif de l’Aigoual afin de préciser la nature et la variabilité de cette espèce.
Les fleurs de jonquilles présentes sur tous les flancs du massif de l’Aigoual de 350 à 1 560 m diffèrent les unes des autres par des variations de dimensions (figures 1 et 2), de forme et de colorations, mais les variations intra-populationnelles sont équivalentes à celles observées entre les populations de tout le massif de l’Aigoual et plus largement du sud des Cévennes.
Les jonquilles de l’Aigoual et en particulier de l’Espérou qui est la localité type du N. hispanicus peuvent donc servir de référence pour mieux caractériser cette espèce (polymorpohisme, écologie, cytogénétique). C’est le binôme valide le plus ancien pour décrire les jonquilles sauvages diploïdes de tout le sud du Massif central : paracorolles plutôt cylindriques, peu évasées, marges légèrement ondulées denticulées et assez peu récurvées, fleurs plutôt concolores à tépales souvent jaune intense.
Dans les Cévennes, cette jonquille pousse indifféremment sur calcaire ou silice. Même s’il existe des stations abyssales dès 200 m (Pont d’Hérault ; Braun-Blanquet, 1933), leurs peuplements sont plus nombreux au-dessus de 700 m et en particulier à l’étage montagnard : en lisière de la hêtraie, dans les prairies plus humides avec Tulipa australis et N. poeticus, dans les fissures de rochers et les escarpements à Cytisus oromediterraneuss en soulane ou encore dans les pelouses et landes sommitales à Vaccinium sp.pl.
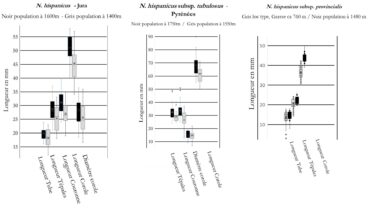
L’analyse de cinquante individus provenant de douze populations du massif de l’Aigoual (sous-bois et prairies des environs de l’Espérou, Cap des Côtes, Barre des Cévennes, stations abyssales le long des cours d’eau…) nous a montré qu’ils étaient tous diploïdes. Ils sont morphologiquement semblables aux autres diploïdes qui fleurissent le long de l’axe rhodanien depuis Montélimar (Marsanne), les contreforts est du Massif central (Pilat) et ouest des Préalpes (sud Vercors), le sud du Bugey (col du Blanchet) et jusqu’au Jura (France, Viry, La Pesse ; Suisse, La Dôle) ; ce sont incontestablement tous des N. hispanicus (figures 1 et 2, planches 2 et 3).
Jusqu’à présent, seuls Rouy (1912) et Fernandes (1968) avaient retenu N. hispanicus en France et uniquement dans le Sud méditerranéen. Nous étendons donc son aire de distribution jusqu’au Jura où ces populations naturelles les plus nordiques appartiennent vraisemblablement à un ancien cortège xérothermique. Sans doute du fait des conditions environnementales (altitude, pluviométrie), les N. hispanicus du sommet de la Dôle ont des fleurs aussi grandes que celles des hexaploïdes du Massif central, ce qui explique que leur identité n’a jamais été questionnée.
5.2 Diploïde de Provence (planches 4, 8 et 11)
N. hispanicus subsp. provincialis (Pugsley) Fridl. comb. nov.
≡ N. provincialis Pugsley (1939), J. Bot. 77 : 334, = N. minor L. var. provincialis (Pugsley) A. Fern., 1951, Bol. Soc. Brot. 25 = N. pseudonarcissus subsp. provincialis (Pugsley) J.-M. Tison, 2010, Biocosme Mésogéen = N. pseudonarcissus L., Pignatti, 2017, Fl. It, vol. I.
Échantillons (Col. A. Fridlender) de N. hispanicus subsp. provincialis ayant fait l’objet d’études cytogénétiques (diploïdes) : boisements clairs et garrigues à thym au-dessus de Grasse à proximité de Gourdon (loc. clas.), mars 2005, MPU 886988 ; montagne de Thiey, pentes caillouteuses et combes à neige entre 1 200 et 1 500 m, fleurit en même temps que de nombreuses bulbeuses peu communes ou endémiques (Arum cylindraceum, Crocus, Fritillaires…), mai 2006 ; massif du Tournairet, c. 1 950 m, 24-5-2010, MPU 886989.
Sous le nom de N. pseudonarcissus L. subsp. minor (L.) Baker, Guinochet (1978) signale une jonquille à tube inférieur à 15 mm, qu’il considère comme naturalisé dans le « Midi de la France », aujourd’hui tout le monde s’accorde sur leur indigénat et leur rareté. Quelques populations sont dispersées dans les garigues caillouteuses de quelques massifs du Var et des Alpes-Maritimes entre 700 et 2 100 m, dans la partie méridionale du Piémont et en Ligurie. Certaines stations italiennes, jusqu’à 800 m, seraient subspontanées, tandis que d’autres semblent sauvages comme celles des collines de Gênes (Pignatti, 2017).
Nous n’avons pas pu vérifier si les individus à tépales partiellement blanc pur (planche 8) conservent le même dessin chaque année, mais quelle que soit la stabilité de cette coloration chimérique elle n’a pas de signification taxonomique (cf. var. bicolorans Pugsley, etc.). Cette originalité se retrouve aussi chez plusieurs individus de N. ramirezii Gomez Murillo de Málaga en Andalousie (Gomez Murillo et al., 2021), hasard des irrégularités des développements méristématiques ou reflet d’une ancienne parenté ?
Les petites jonquilles de Grasse (avec certains tépales blancs) diffèrent notablement des N. hispanicus géants de la Séranne ou même des zones fraîches des Cévennes. Cependant elles sont plus grandes en altitude (même si on y observe aussi des individus florifères minuscules ; planche 4). Si on compare les diploïdes de Provence, des Cévennes et de l’ouest de la chaîne pyrénéo-cantabrique (N. minor auct.), bien des individus se ressemblent et la séparation apparaît souvent hasardeuse en herbier. Comme plusieurs de nos prédécesseurs, nous maintenons cependant leur distinction taxonomique dans la mesure où globalement leurs colorations et dimensions diffèrent de celles des jonquilles cévenoles. En revanche elles ne peuvent être considérées comme une variante des tétraploïdes cultivés (cf. N. pseudonarcissus) et se rattachent au N. hispanicus cévenol (schizo-endémiques).
5.3 Hexaploïdes à grandes fleurs d’Auvergne et du nord du Massif central
N. hispanicus subsp. dutartrei Fridl. subsp. nov.
= N. sylvestris Lam. p.p. in Fl. Fr. 3 : 390, 1778, = N. calatinus auct. in Delarbre, 1795, Fl. Auvergne 137-138, = N. pseudonarcissus L. in Chassagne, 1957, Brugel et al., 2001, Plantes & Végétation en Limousin, Tort et al., 2010, = N. pseudonarcissus auct. p.p. in Coste, 1901, Fournier, 1947, Guinochet, 1978, Webb, 1980, Tison & de Foucault, 2014, Tison et al., 2014, Le Driant et al., 2022.
Diagnosis – Differs from N. hispanicus by its large flowers: corolla length (without ovary) 50-65 (75) mm long (tube [15]19-25 mm, tepals [19] 29-38( 43) mm, corona length [25] 30-40 (48) mm, corona diameter [18] 25-32 (34) mm at the top, corona more widely flared than in N. hispanicus (corolla 41-54 mm long, corona diameter 19-26 mm in Mont Aigoual type locality), margin more strongly lobed and denticulated and with a clearly scurved margin, larger anthers (10-12 mm), tepals often paler than the corona. Hexaploïd daffodil with high vegetative propagation.
Typus – France, Auvergne, versant sud-est du massif du Sancy, c. 1 600 m, prairies en bordure d’une combe à neige. Peuplement plus ou moins continu le long des ruisseaux, dans les pâturages et landes à Cytisus oromediterraneus, Vaccinium sp. pl., les combes à neige à Salix lapponum, entre 1 500 et 1 650 m, 8 juin 2010 A. Fridlender, MPU 886990
Icon. : planches 1, 5 et 6.
Distribution (carte 1): Northern Massif central (France), mainly on granite base and volcanic substrate.
Named in memory of our friend Gilles Dutartre from Cosne-sur-Loire and Lyon, a passionate florist, gardener and great lover of bulbs.
Quelques échantillons (Col. A. Fridlender) de N. hispanicus subsp. dutartrei ayant fait l’objet d’études cytogénétiques (hexaploïdes) – Prairie humide et tourbière autour du lac de Barrandon (mont Lozère), 1 380 m, 3-5-2023, MPU 886991 ; Haute-Loire, prairies tourbeuses de la Margeride, 1 450 m, mai 2021, MPU 886992 ; prairies entre Lajo et Sainte-Eulalie, c. 1 200 m, 3-5-2023, MPU 886993 ; pelouses au-dessus de Prat de Bouc, 2-5-2018, MPU 886997 ; pâturages entre Besse et le lac Pavin, très communs, vers Péalat, 16-4-2011, 1 180 m, MPU 886998 ; ibid., 1 200m, 29-4-2013 ; prairies détrempées et tourbières de Picherande et Chastreix, c. 1 100 m, 2-6-2020, MPU 886999 ; ibid. 1 250 m ; tourbière et pâturages de la Barthe, 27-4-2012, c. 1 200 m, MPU 887000 ; Cévennes, flancs nord et est du mont Lozère, abondant entre 1 300 et 1 600 m, MPU 886994.
Cette jonquille auvergnate forme très souvent des touffes qui sont plus fournies que celles de N. hispanicus du fait de l’importante multiplication végétative (planche 1). Ses fleurs sont plus grandes avec une couronne évasée et récurvée d’un jaune intense et des tépales blanc jaunâtre, rarement jaunes concolores. Même si les fleurs de certaines populations font exception, N. hispanicus subsp. dutatrei est la plus grande jonquille du Massif central (figure 1). Les formes et longueurs des capsules sont aussi variables que chez les diploïdes et dépendent fortement de la production des graines dans chaque carpelle, or les conditions climatiques changeantes et aléatoires lors de la floraison (chutes de neige, gel…) sont peu favorables à une fécondation régulière.
Dans les bois, Lamarck (1778 [1779]) distingue deux variétés de jonquilles (sub N. sylvestris) : l’une à tépales libres jaune pâle, l’autre à tépales presque blancs. Delarbre (1795) remarque que, parmi les N. pseudonarcissus, les Narcissus sylvestris du mont d’Or sont plus grands qu’en plaine et pourraient être une espèce distincte qui cohabiterait avec deux autres espèces de jonquilles, N. bicolor et N. calatinus. Sa description de N. bicolor semble correspondre aux grandes jonquilles horticoles ; quant à son N. calatinus, il reprend les caractères de Linné (spatha multiflora… Simillimus N. tazettae), cet hybride horticole actuellement inconnu dans le Sancy était peut-être cultivé en Auvergne.
En effet, dans les herbiers, on retrouve de nombreux narcisses horticoles récoltés un peu partout dans la région au cours du xixe siècle (planche 12). En montagne, autour des fermes, on observe encore des petits parterres où se mélangent jonquilles, narcisses des poètes et hybrides variés qui sont parfois subspontanées à proximité de certains hameaux. Ce sont probablement ces plantes, décidément largement diffusées en Europe avant le xviie siècle, qui ont été récoltées par les anciens botanistes qui les ont malencontreusement signalées de la même façon que les espèces sauvages dans leurs inventaires. De ces imprécisions sont nés des confusions et beaucoup de surinterprétations ! Il nous apparaît absurde de faire dire à Delarbre qu’il aurait découvert et/ou décrit trois espèces sauvages dans les monts d’Or : N. sylvestris pallidus, N. bicolor, N. calatinus Delarbre, Fl. Auvergne 137-138, 1795 [= ? N. calathinus L. Sp. Pl., 1762]. D’ailleurs, dès 1847, Lecoq et Lamotte précisent bien que les jonquilles du Plateau central appartiennent toutes à la même espèce (N. pseudo-narcissus Lin.), que le N. major Curtis n’est qu’une simple variété à fleurs plus grandes et que « l’on trouve sur nos montagnes tous les intermédiaires possibles… variant non seulement dans la forme et la grandeur des feuilles et de la fleur, mais encore dans la couleur, qui est tantôt jaune très pâle, tantôt jaune souffre ou jaune orangé ».
Chassagne (1956) confirmera que, dans le Puy-de-Dôme et le Cantal, les jonquilles de montagne sont souvent plus grandes et que « les narcisses de plaine sont souvent d’origine cultivée et naturalisés ». Il considère que les N. pseudonarcissus sont polymorphes et que les grandes fleurs observées dans les monts d’Or sont des variations individuelles qu’il ne faudrait pas confondre avec les grandes jonquilles cultivées et parfois naturalisées autours des fermes [et chapelles isolées !] qu’il signale sous le nom de N. major L. Nous souscrivons entièrement aux écrits de Lamotte (1847) et Chassagne (1956) concernant les jonquilles d’Auvergne mais, ayant maintenant connaissance des diploïdes cévenols, nous nommons les hexaploïdes auvergnats N. hispanicus subsp. dutartrei.
Cette jonquille est une apo-endémique du nord du Massif central puisqu’elle présente un cytotype dérivé plus jeune (6x) que le taxon apparenté diploïde (Contandriopoulos, 1988). La polyploïdisation a sans doute permis la colonisation de nouveaux territoires aux climats montagnards et humides éloignés du climat méditerranéen originel. N. hispanicus subsp. dutartrei s’est facilement répandu dans les prairies montagnardes denses grâce à sa forte multiplication végétative ; ses grosses touffes peuvent se maintenir dans les prairies humides à hautes herbes, un habitat dans lequel des plantules n’auraient aucune chance de s’établir (compétition racinaire). De fait, les diploïdes colonisent préférentiellement les pelouses et rocailles, habitats où la compétition végétale est moindre et où les semis peuvent prospérer.
On trouve également des jonquilles hexaploïdes dans les montagnes de León (N. leonensis Pugsley) et des Pyrénées centrales, assez loin des influences méditerranéennes. Nous ignorons les liens éventuels entre ces jonquilles à grandes fleurs (polytopisme ?).
5.4 Diversité des jonquilles diploïdes des Pyrénées
Dans un pot, les premières fleurs de jonquilles s’ouvrent plus lentement sur trois-cinq (huit) jours que les suivantes qui peuvent fleurir un à deux jours après leur sortie de terre. Elles sont alors plus petites et parfois presque redressées, tandis que les fleurs dont l’anthèse a été plus lente sont plus grandes et plus ou moins penchées : les changements de position sont continus au cours de l’anthèse (le bouton émerge verticalement, puis se replie, puis se redresse à nouveau à la floraison). L’environnement (température, pluie, compétition avec la végétation, composés volatiles émis par les autres fleurs…) exerce une influence sur la vitesse de l’anthèse et par la même sur la position et la coloration des fleurs. Dans les Alpes et le Massif central, nous n’avons pas constaté de variations notables entres les localités, tandis que dans certaines populations des Pyrénées ces variations (de régulation de l’ontogenèse) apparaissent plus fréquentes (ou plus stables ?), produisant des colorations et positions particulières chez la plupart des fleurs.
À l’ouest de la chaîne pyrénéo-cantabrique, N. hispanicus devient parfois presque nain (cf. N. hispanicus susbsp. asturiensis). N. hispanicus est donc plus petit aux limites ouest et est de sa distribution (Ajax asturiensis Jord. et N. provincialis Puglsey) tandis qu’au centre de son aire (Pyrénées centrales) il est nettement plus grand avec des limbes larges et des couronnes allongées souvent cylindriques et plus ou moins « tronquées » (cf. Ajax tubulosus). Plusieurs peuplements de ces jonquilles possèdent des fleurs très pâles-blanchâtres et/ou repliées le long de la hampe (signalées sous les noms de N. mochatus auct., A. pallidiflorus Pugsley). N. moleroi Fernandez Casas est décrit de Catalogne (de Bolòs & Vigo, 2001).
Le polymorphisme pyrénéen de N. hispanicus apparaît difficile à traduire taxonomiquement (multiplier ou non les taxons). Comme Pugsley (1933) l’avait souligné, il serait d’ailleurs possible d’identifier dans une même population plusieurs des taxons déjà décrits dans la chaîne pyrénéo-cantabrique (espèces versus variations individuelles). À ce stade, nous retenons l’originalité de l’Ajax tubulosus de Jordan :
N. hispanicus subsp tubulosus (Jord.) Fridl. comb. nov.
≡ Ajax tubulosus Jord. 1903, Icon. ad Floram Europae, 4 (CCCLXV) = N. tubulosus (Jord.) Fridl. comb. nov. = N. hispanicus subsp. parviflorus (Jord.) Fridl. (≡ Ajax parviflorus Jord., Ic. Fl. Eur. 3 :1903) = N. hispanicus subsp. serotinus (Jord.) Fridl. (≡ Ajax serotinus Jord., Ic. Fl. Eur. 2 :1903) = N. moleroi Fernandez Casas p.p. (= N. hispanicus subsp. moleroi (Fernandez Casas) Fridl. comb. & stat. nov. ≡ N. moleroi Fernandez Casas, Fontqueria 14 : 21) = N. pseudonarcissus L. subsp. bicolor (L.) Baker p.p. in Guinochet, 1978, = N. bicolor L. p.p., in Tison & de Foucault, 2014, = N. abscissus auct. Fl. Fr. Med., Tison et al., 2014, = N. muticus auct. p.p. épithète ambiguë (cf. Gay, Baker) recombinée dans plusieurs flores relatives aux Pyrénées.
Icon. planches 7, 13 et 14.
Échantillons (col. A. Fridlender) de N. hispanicus subsp. tubulosus ayant fait l’objet d’études cytogénétiques (diploïdes) – Bagnères-de-Luchon (Superbagnères), prairie en pente forte de la vallée du Lys, c. 1 700 m, 18-5-2018, MPU 886995 ; Val d’Aran, prairies des berges du ruisseau de Baqueira, 19-5-2018, c. 1 550 m, MPU 886996.
Cette jonquille des Pyrénées centrales se distingue des N. hispanicus par ses limbes larges de 20-25 mm à la floraison (versus 10-12 chez les autres jonquilles), des hampes plus nettement ancipitées (planche 7). Les couronnes sont longues, étroites et tubuleuses (diamètre 11-17 mm versus 18-27 chez les diploïdes cévenols et 25-32 mm chez les hexaploïdes auvergnats), l’intensité du jaune, le contraste entre tépales et couronne et la position (fleurs parfois penchées ou même presque repliées sur la hampe) sont assez variables. Les Ajax parviflorus Jord. et A. serotinus Jord. correspondent à des individus (clones) à périanthes nettement plus évasés ou plus petites (planche 14) que l’on observe au sein de diverses populations de N. hispanicus subsp. tubulosus. L’analyse de dix bulbes des prairies des environs de Baqueira et Superbagnères nous a montré qu’ils sont tous diploïdes.
Remarques sur quelques jonquilles fréquemment citées dans les flores récentes concernant l’axe pyrénéo cantabrique
N. hispanicus subsp. asturiensis (Jord.) Fridl. comb. nov.
≡ Ajax astureinsis Jord., Icon. n° 467 : 4 (1903) ; ce diploïde n’est pas présent sur le territoire français. Dans l’ouest de l’Espagne, ces plantes sont souvent signalées sous le nom de N. minor L. (une horticole à petite fleurs jaunes vendue par des marchands du xviiie siècle) ou de N. exiguus Salisb. [in Prodr. Stirp. In hort Chpt. Alberton. p. 220, 1796] qui désigne la même plante cultivée.
N. pallidiflorus Pugsley, Mon. Ajax : 69 (1933) (= N. moschatus auct. p.p.)
Ces jonquilles à fleurs pâles décrites depuis les Pyrénées orientales jusqu’aux Asturies se réfèrent au N. pallidus praecox de Parkinson et à l’illustration de Nicholson (Dic. Gard., 2, fig. 644 p. 415) qui représente un N. pseudonarcissus de type horticole (corolle largement évasée recourbée ; planche 9). Dans ce dictionnaire de jardinage, il est rangé parmi les pseudonarcissus major horticoles sous le nom complet de N. pseudo-narcisusus major pallidus praecox. N. pallidiflorus pourrait être appliqué aux grandes jonquilles souvent nommées N. bicolor dans les Pyrénées (binôme qui désigne une plante cultivée absente de France ; planche 9). Certaines de ces jonquilles à grosses fleurs pourraient être hexaploïdes.
N. moschatus L.
Il se pourrait que les Narcissus albus praelongo calice alter flore pendente (planche 14) cultivées à Uppsala au xvie siècle (Rudbeck, 1601) correspondent aux jonquilles à fleurs blanchâtres et penchées des Pyrénées. Cent soixante ans plus tard, Linné aurait décrit son N. moschatus en se basant sur les illustrations du Campi Elysii (XVI – 73) et/ou à partir de ces plantes encore présentes chez des collectionneurs suédois. N. mochatus L. s’applique donc à une plante cultivée pendant plus de trois siècles. De Candolle (1815) précise « qu’il paraît indigène d’Espagne » et qu’on en cultive trois formes dans les jardins : entièrement blanche, entièrement jaune ou bicolore ! Les premières illustrations (planche 9) en couleur de ces fleurs cultivées à Londres, possiblement en provenance des collections suédoises, ne correspondent pas aux jonquilles sauvages présentes dans la nature en France. Ces cultivars sont diffusés sous le nom de N. alpestris aux États-Unis.
N. abscissus auct.
Lorsque Haworth (1819) crée cette espèce qui se trouve dans le jardin de la Société royale d’horticulture (diagnose : « Habitat…., Floret…. Vidi, at non florentem, in horto Hort. Soc. Lond. Foliis angustioribus glaucius. »), il n’en connaît pas l’origine et ne sait pas à quoi ressemblent les fleurs : « [cette jonquille] fleurira certainement dans quelques années dans ce jardin » (Supplementum Plantarum Succulentarum :117) !
Pour Webb (1980), le N. bicolor L. a été « described from a cultivated plant; the wild populations have been separated as N. abscissus (Haw.) Schultes & Schutles fil., but the differences are slight ». De même, pour Cullen (2011), N. abscissus correspondrait à une variation sauvage du N. bicolor qui est une plante cultivée (planche 9). Il est impossible de savoir à quoi pouvait bien ressembler la fleur d’un N. abscissus en 1819 dans les jardins de la Société royale d’horticulture !
Il est possible que les « Pseudonarcissus angustifolium flore flavescentes tubo quasi abscisso » du Paradisius Terrestris de Parkinson (1629) soient des jonquilles sauvages en provenance des Pyrénées (cf. N. hispanicus subsp. tubulosus ?) qui, après quelques décennies de sélection, donneront divers cultivars décrits comme nouvelles espèces au xixe siècle, la couronne non évasée mais comme coupée (abscido) à son extrémité étant à l’origine de l’épithète abscissus.
Les jonquilles de l’axe pyrénéo-cantabrique doivent être entièrement réétudiées et caractérisées (cytologie, variabilité morphologique au sein des populations) ; seules les deux sous-espèces diploïdes tubulosus et asturiensis nous semblent actuellement bien délimitées, mais leur positionnement par rapport aux autres jonquilles pyrénéennes demeure incertain.
6. Quelle place occupent les populations subspontanées au sein de nos massifs ?
Des Alpes maritimes jusqu’au Jura suisse, toutes les populations montagnardes que nous avons étudiées sont diploïdes. Dans le Massif central, les diploïdes sont présents depuis la Montagne Noire jusqu’aux Cévennes méridionales, toutes les autres jonquilles du Massif central sont hexaploïdes. Ces deux cytotypes ne se mélangent pas : les diploïdes représentent la forme ancestrale méditerranéenne qui colonise les Préalpes en suivant les marges de la vallée du Rhône jusque dans le Jura, tandis que les hexaploïdes sont typiques des montagnes fraîches et humides d’Auvergne (Puy-de-Dôme, Cantal, Lozère…) et du Limousin (Millevaches).
En revanche, dans le massif du Pilat, il y a certes quelques hexaploïdes dans les prés tourbeux et le long de cours d’eau, mais les prairies et pelouses rocheuses des sommets (crêts) sont colonisées par les diploïdes. À moyenne altitude, nous avons observé une prairie où poussaient des jonquilles diploïdes en mélange avec des tétraploïdes qui leur ressemblaient fortement. À proximité, deux anciennes fermes retapées étaient agrémentées de rocailles qui abritent des cultivars récents, dont quelques bulbes commencent à s’échapper dans la prairie limitrophe.
Il s’agit donc d’une population subspontanée de jonquilles ayant plusieurs origines : tétraploïdes d’origines inconnues, mais anciennement introduits dans les jardinières de la ferme, avec d’autres jonquilles sauvages (2x) provenant vraisemblablement des crêts et clones tétraploïdes des catalogues horticoles actuels plantés par les nouveaux résidents. Ce processus suivant lequel en un lieu donné sont introduites des jonquilles de plusieurs origines est manifestement très ancien et il se perpétue !
Dans le Royan, assez anthropisé, quelques prairies montagnardes sont colonisées par des jonquilles tétraploïdes alors que dans les pelouses du sud Vercors fleurissent les diploïdes. Les jonquilles tétraploïdes de Chartreuse (cf. Habert de Pravouta) apparemment sauvages sont peu éloignées d’anciennes bâtisses pastorales et pourraient bien correspondre à d’anciennes introductions dans un massif largement investi par les moines depuis le Moyen Âge ! Généralement ces tétraploïdes ressemblent aux hexaploïdes, mais parfois plus aux diploïdes ; ils en sont peut-être des hybrides.
L’identité des jonquilles autours de Lyon (Pilat, Collonges-sur-Saône…) a fait l’objet de nombreuses discussions qui ont agité les botanistes lyonnais du xixe siècle avec d’un côté les « hybridomaniaques » et de l’autre ceux qui prenaient plus en compte la variabilité au sein d’une espèce (Saint-Lager et al., 1890). Jordan (1903) reprendra cette question et créera plusieurs taxons (Ajax festinus Jord., A. porrigens Jord., A. montinus Jord. ; planche 14).
Dans cette vaste région, les diploïdes suivent le couloir rhodanien, se rencontrent çà et là sur les contreforts des Préalpes et du Massif central (sud Vercors, zones rocheuses du Pilat) ; les hexaploïdes colonisent toutes les prairies plus à l’ouest, tandis que les tétraploïdes sont bien implantés dans les secteurs les plus anthropisées (subspontanés dans les prairies du nord-ouest du Vercors, de la Chartreuse et de quelques endroits du massif du Pilat). Ils correspondraient aux plantes horticoles cultivées et décrites par Linné (N. pseudonarcissus) en provenance de collections constituées dès le xvie siècle. Gerarde (1633) signale qu’il se fournissait en jonquilles à Paris et Orléans. Les moines établis en Chartreuse s’intéressaient beaucoup aux plantes et auraient bien pu se procurer ces jonquilles à la mode chez ces mêmes fournisseurs ! Coquillat (1965) indique que nombre de jonquilles horticoles sont subspontanées dans le Lyonnais, surtout à basse altitude. Des jonquilles sauvages (N. hispanicus, N. hispanicus subsp. dutartrei) récoltées dans différents massifs alentours, ainsi que des N. pseudonarcissus et autres cultivars de diverses origines ont manifestement été introduits çà et là, créant des populations parfois mixtes de jonquilles subspontanées qui finissent toutes par se croiser et se ressembler. Notons que les jonquilles du Blanchet sont diploïdes et potentiellement subspontanées, pourtant le secteur est largement anthropisé.
Les débats lyonnais du xixe siècle n’étaient donc pas sans fondements et reflétaient une complexité caryologique qui mériterait une étude approfondie afin de mieux comprendre l’origine et la nature des tétraploïdes. À quoi attribuer les Ajax du Pilat ou de Coligny décrits par Jordan (1903) ? Certaines de ses descriptions ressemblent à l’hexaploïde auvergnat, d’autres aux 4x mais il est bien difficile de s’en assurer aussi il semble plus sage d’écarter ces noms.
Un autre foyer de jonquilles tétraploïdes se rencontre sur les contreforts sud-ouest du Massif central (Aveyron, Lot) : hêtraies, prairies et tourbières du Lévézou, çà et là dans le Ségala et jusqu’au Causse de Gramat (carte 1). Les tétraploïdes des environs de Rodez sont minuscules, tandis que ceux des prairies d’Aujols sont parfois géants avec des fleurs qui évoquent les cultivars des catalogues horticoles ; à Carniac-du-Causse, les jonquilles tétraploïdes des sous-bois ressemblent à celles d’Auvergne ! Les conditions édapho-climatiques, bien que fort dissemblables, ne suffisent sans doute pas à expliquer ces différences qui reflètent peut-être l’origine distincte de ces tétraploïdes. En effet des individus ont des génomes plus grands que ceux des tétraploïdes (aneuploïdes ou croisements plus ou moins instables entre divers cultivars). Ces populations, souvent localisées dans quelques bois et prairies assez proches des villages, sont indubitablement subspontanées ; en revanche dans les sites pierreux plus isolés il est difficile de se prononcer. En Grande-Bretagne, les hybrides de jonquilles naturalisés (N. ´incomparabilis, Mill.,
N. ´bernardii DC., N. ´odorus L., N. ´boutignyanus Philippe, N. ´taitii Henriq., N. ´monochromus P.D. Sell, N. ´dichromus P.D. Sell) sont morphologiquement et cytologiquement (2n = 14, 21, 26, 27, 28, 29, 36) tout aussi variés (Stace et al., 2016). En Amérique du Nord, où le genre Narcissus n’existe pas à l’état naturel, les cultivars et hybrides ont rapidement colonisé d’immenses territoires où certains les considèrent comme faisant partie de la flore locale (Spaulding & Wayne Borger, 2014).
Dans les cours de ferme auvergnates, on observe souvent des jonquilles d’aspect sauvage vraisemblablement récoltées dans les prairies voisines en mélange avec des hybrides anciens ou des cultivars plus récents. Il est donc certains que depuis des siècles on transporte des jonquilles sauvages et cultivées qui sont ensuite plantées au pied des chapelles, oratoires ou simplement des croix qui se trouvent éloignées de tout (sommets, cols de montagne) d’où elles s’échappent localement dans les prairies alentours. L’examen des herbiers, des inventaires et catalogues floristiques montre que de nombreux narcisses indubitablement horticoles (fleurs géantes, bicolores, hybrides…) ont souvent été traités dans les écrits anciens de la même façon que les espèces sauvages dès lors qu’ils « apparaissaient plus ou moins subspontanés » comme dans les cols de montagne…
Presque toutes ces jonquilles, attestées par des récoltes (planche 12), ont disparu de nos montagnes ou laissé place à des formes d’aspect sauvage dont on ne peut plus reconnaître l’origine. En effet, les jardiniers savent bien que certains cultivars se maintiennent presque indéfiniment tandis que d’autres (cf. fleurs doubles) reprennent une morphologie proche de la souche sauvage après plusieurs années de culture.
7. Discussion
Une grande part des variations de dimensions, colorations ou formes des hampes et des fleurs se rencontre au sein de chaque population de jonquilles si bien que les taxons retenus ici ne sont pas faciles à identifier. Si tel était le cas, il n’y aurait pas eu autant d’hésitations ni de controverses pendant plus de deux siècles !
Les études relatives à la biologie des jonquilles sont rares (Copete, 2011), pourtant elles permettraient de comprendre les innovations induites par la polyploïdie et ses conséquences écologiques qui vont sans doute bien au-delà du fait que les diploïdes se propagent largement par graines, tandis que les polyploïdes semblent privilégier la multiplication végétative.
Les interrogations relatives à la plasticité phénotypiques ne sont pas nouvelles et après les découvertes (éco)physiologiques du xxe siècle, l’accumulation des données relatives à la régulation de l’expression des génomes (méthylation et épigénétique) suscitent un intérêt croissant (Paun et al., 2010) que les naturalistes ne peuvent ignorer. Longtemps caricaturées par l’expression d’hérédité des caractères acquis, les interrogations sur « l’influence des circonstances sur les actions et habitudes… qui modifient leur organisation » de Lamarck (1809) prennent tout leur sens chez les jonquilles ! Tandis que certains considèrent que des fleurs de colorations légèrement différentes représentent deux espèces, d’autres ont la conviction inverse ; les approches cytogénétiques ou moléculaires aboutissent quant à elles à des interprétations parfois déroutantes lorsque des entités génétiques distinctes sont morphologiquement identiques (ou l’inverse !). Les véritables liens entre nos quatre sous-espèces de N. hispanicus nous échappent.
Bien qu’inédite, cette approche des jonquilles de France est cohérente avec la biogéographie de nombreuses autres plantes : diploïdes en régions méditerranéennes et polyploïdes plus au nord. Citons les Ornithogalum umbellatum s. l. avec les petits taxons diploïdes dans les collines méditerranéennes et les polyploïdes à forte multiplication végétative capables de résister à la compétition végétale qui s’exerce dans les zones rudérales ou les prairies hautes du reste du territoire. La distribution des Arum cylindraceum (2x) et A. maculatum (4x) (Fridlender, 1999, 2000) se calque très largement sur celle du couple N. hispanicus subsp. hispanicus / N. hispanicus subsp.dutartrei dans le Massif central et les Alpes. Dans les Causses (Larzac, La Cavalerie, les Rives…), les calcaires des Alpes (Grasse, Caussols, Saint-Geniez, etc.), tous les A. cylindraceum que nous avons analysés sont diploïdes et aucune jonquille polyploïde n’y est connue ! Dans la montagne de Thiey (Alpes), les deux diploïdes A. cylindraceum et N. hispanicus subsp. provincialis poussent ensemble. En Auvergne, parmi ces taxons « cryptiques », seules vivent les polyploïdes A. maculatum, N. hispanicus subsp. dutartrei, O. umbellatum à gros bulbes se multipliant par bulbilles.
Les jonquilles diploïdes sont indubitablement méditerranéennes et éparpillées en populations parfois très réduites et relictuelles : Pyrénées orientales, Montagne Noire, Espinouse, Séranne, contreforts cévenols, dispersés le long du corridor rhodanien jusque dans le Jura et en Provence. Dans le parc national des Cévennes, toutes les jonquilles du Sud (vastes peuplements sur les flancs du massif de l’Aigoual) appartiennent au N. hispanicus tandis qu’au Nord (vastes peuplements du mont Lozère) vivent les N. hispanicus subsp. dutartrei. Les vallées des trois rivières constituent la limite entre les deux cytotypes avec çà et là des populations abyssales de l’un ou l’autre ; jusqu’à présent nous n’y avons pas observé d’hybrides ni de tétraploïdes.
La distribution des deux cytotypes (di- et hexaploïdes) est un marqueur biogéographique fort. En effet, cette séparation cévenole nette entre les deux taxons cryptiques est d’autant plus surprenante et remarquable que la plupart des espèces du genre Narcissus peuvent se croiser entre elles quels que soient la morphologie des fleurs et leurs nombres chromosomiques (sections différentes) ! Même si la phylogénie de ce genre réticulé demeure incertaine, on y a largement démontré que les proximités génétiques et morphologiques (formes et couleurs des fleurs ; les processus de régulations morphogénétiques nous échappent encore complètement) ne concordent pas nécessairement (Marques et al., 2017 ; Konyves et al., 2019).
Les génomes des N. hispanicus subsp. hispanicus que nous avons étudiés (Massif central et Préalpes) sont identiques à ceux des N. poeticus ; il en serait de même des populations du centre de l’Espagne. En revanche, dans l’ouest de la péninsule Ibérique, plusieurs populations de jonquilles diploïdes présenteraient des génomes un peu plus petits, tandis qu’ils sont beaucoup plus grands (+ 6 à + 10 pg de 2C DNA) dans le sud, en particulier en Andalousie avec des jonquilles diploïdes à 2n ~ c. 3x et hampe parfois pluriflore (groupe du N. nevadensis Pugsley). Dans le nord de leur aire, les N. hispanicus ont un génome relativement stable avec formation d’hexaploïdes (chaînes pyrénéo-cantabrique et Massif central), tandis que dans le sud ils demeurent diploïdes, mais avec des augmentations très significatives de la taille de leurs génomes. Nous sommes en présence de deux processus évolutifs distincts. Les données moléculaires de Marques et al. (2017) montrent qu’il existe deux lignées de jonquilles, l’une nordique et l’autre inféodée au sud de la péninsule Ibérique, et que les N. poeticus sont très proches des jonquilles. L’identité que nous avons mesurée entre les ADN 2C des N. poeticus et de nos trois sous-espèces diploïdes de N. hispanicus pourrait suggérer que ces jonquilles sont plus proches de la souche ancestrale que celles du sud et de l’ouest de la péninsule Ibérique où les processus de spéciation du genre Narcissus sont dynamiques et rapides avec une certaine « dérive » de la taille des génomes.
Les jonquilles diploïdes pourraient être originaires des chaînes pyrénéo-cantabriques, elles auraient atteint les Alpes via le Massif central et le Jura méridional à l’image d’autres complexes polyploïdes comme les Bupleurum ranunculoides L. (Küpfer, 1974). Cependant, les diploïdes provençaux ressemblent plus à ceux d’Andalousie (voire de la chaîne cantabrique) qu’à ceux des Cévennes ; peut-être correspondent-ils à une ancienne lignée refoulée sur les marges de distribution du N. hispanicus actuel. Les hexaploïdes de la province de León (N. leonensis) mériteraient d’être soigneusement comparés à ceux du Massif central et aux populations à grandes fleurs des Pyrénées au sein desquelles se trouvent d’autres hexaploïdes.
Les N. hispanicus, N. hispanicus subsp. provincialis, N. hispanicus subsp. dutartrei et N. hispanicus subsp. tubulosus correspondent aux jonquilles sauvages du sud-est de la France (à ce stade il nous semble difficile de se prononcer sur les autres populations de jonquilles pyrénéennes). Ailleurs en France, les jonquilles sont sans doute rarement autochtones et d’origines variables : plantes sauvages très anciennement ou récemment rapportées des montagnes, plantes horticoles (dont le N. pseudonarcissus L. qui correspondrait aux tétraploïdes). Ainsi, dans les sous-bois des plaines et collines peuvent cohabiter des populations subspontanées de jonquilles tantôt sauvages, tantôt cultivées et parfois les deux en mélange selon les hasards des introductions et de leur succès. On ne peut malheureusement pas toujours les reconnaître sur les seules bases morphologiques.
Finalement, dans les bois isolés vers Carniac-du-Causse, nous venons de mettre en évidence que les lierres y sont tétraploïdes (Hedera hibernica (G. Kirchner) Bean.) et sont donc introduits puisque dans cette région les lierres autochtones sont diploïdes (Hedera helix L.). Or, dans ces bois de basse altitude fleurissent des jonquilles (potentiellement relictuelles) qui sont tétraploïdes et donc certainement d’origine horticole (§ 6). Une meilleure connaissance des espèces cryptiques confirme qu’à basse altitude les plantes introduites composent une bonne partie de la flore. Lierres et jonquilles appartiennent indubitablement à un horticultural-invasive-hybrid package (Fridlender, 2019), « packages » fréquents dans toute l’Europe et au sein desquels certains s’appliquent à décrire de nouvelles espèces !
Une nouvelle réflexion relative à la protection des peuplements s’impose. En effet, encore assez abondantes en Auvergne, les jonquilles hexaploïdes, comme les N. poeticus, colchiques, orchidées et de nombreuses plantes des prairies de montagne régressent à la suite des changements des pratiques pastorales et de l’usage des terres agricoles. Quelle est la distribution exacte de N. hispanicus subsp. dutartrei : s’agit-il réellement d’un endémique du Massif central ?
Les jonquilles diploïdes sont protégées en Provence (sub N. provincialis). Or les localités méridionales du Massif central (N. hispanicus s. s.) ne le sont pas et ne font l’objet d’aucune attention puisque la plante y a été confondue avec un N. pseudonarcissus auct. considéré comme abondant en France. Cette jonquille relictuelle y semble pourtant peu abondante, voire rare et menacée dans bien des secteurs (Espinouse, Montagne Noire, Séranne, Gard…). Coste (1893) indique que les jonquilles sont assez répandues dans les Causses, ce qui ne nous semble plus du tout être le cas (changement des pratiques pastorales ?). Dans le sud des Cévennes, les populations sont encore relativement nombreuses dans certaines haies et lisières forestières et quelques prés, mais les prairies de l’Espérou (« localité type ») se dégradent (développement des sports d’hiver et de l’urbanisation). La distribution et l’abondance des N. hispanicus dans les Alpes et le couloir rhodanien demeurent mal connues, mais cette espèce y est localisée et manque dans de vastes secteurs.
Bibliographie
Aedo C., 2013. Narcissus L. In Flora Iberica 13 : 340-397.
Aizpuru I., Aseguinolaza C., Yribe-Echebarria P.M., Urribia P. & Zorrakin I., 2000. Flora de país vasco y territorios limítrofes. Gobierno Vasco ed., Vitoria-Gasteiz, 831 p.
Baker J.G. & Burbidge F.W., 1875. The Narcissus; its history and culture. London L., Reeve & Co. ed.
Barra G. & López G., 1983. Tipificación de los táxones del género Narcissus (Amaryllidaceae) descritos por Linneo. Anales del Jardín Botánico de Madrid 40 : 345-360.
Baudière A., 1970. Recherches phytogéographiques sur la bordure méridionale du Massif central français (les monts de l’Espinouze), III – Planches, tableaux et catalogue systématique. Thèse, Faculté des sciences de Montpellier, 189 p.
Blanchard J.W., 1950. Narcissus, a guide to wild daffodils. Alpine Garden Society, Surrey, 203 p.
Bolòs O. (de) & Vigo J., 2001. Flora dels Paisos Catalans, IV. Barcino (ed.), Barcelona, 750 p.
Braun-Blanquet J., 1933. Catalogue de la flore du massif de l’Aigoual et des contrées limitrophes. Société d’étude des sciences naturelles de Nîmes (Communication SIGMA 20), 352 p.
Breyer S., 2014. Interpréter la Constitution américaine, la lettre ou l’esprit. Paris, 368 p.
Candolle M. (de), 1815. Flore de France ou description succincte des plantes, V (6). Desray (ed.), Paris, 662 p.
Candolle A. (de), 1867. Lois de la Nomenclature botanique adoptées par le Congrès International de Botanique tenu à Paris en août 1867. Genève, 64 p.
Candolle A. (de),1883. Nouvelles remarques sur la nomenclature botanique. Genève, 76 p.
Chassagne M., 1956. Inventaire analytique de la flore d’Auvergne et contrées limitrophes des départements voisins, 1, Lechevalier, Paris, 458 p.
Clusius C. (Charles de L’Écluse), 1601. Narcissus, in Rariorum plantarum historia, Antverpiae : Ex officina Plantiniana Apud Ioannem Moretum : 154-167.
Contandriopoulos J., 1988. Apport de la paléogéographie et de la cytotaxonomie à l’étude de l’endémisme. Actes del Simposi Internacional de Botanica Piu Font i Quer II : 21-42.
Copete E., Herranz J.M., Ferrandis P., Baskin C.C. & Baskin J.M., 2011. Physiology, morphology and phenology of seed dormancy break and germination in the endemic Iberian species Narcissus hispanicus (Amaryllidaceae). Annals of botany 107 : 1003-1016.
Coquillat M., 1965. N. pseudonarcissus L. In Catalogue de la flore rhodano-ligérienne , n° 3075.
Coste H., 1893. Florule du Larzac, du Causse Noir et du Causse de Saint-Affrique. Bulletin de la Société botanique de France 40 : 10.
Cullen J., 2011.Narcissus L. In J. Cullen et al. (eds.), The European Garden Flora, I – Alismataceae to Orchidaceae, second edition, Cambridge, 665 p.
Datta S.K., 2025. Plant chimera and its managements for the floriculture industry. Journal of the floriculture and landscaping 11 : 1-10.
Delarbre A., 1795. Narcissus. In Flore d’Auvergne ou recueil des plantes de cette ci-devant province, Beauvert B. & Deschamps L. (eds.), Clermont-Ferrand : 137-138.
Diaz T.E. & Fernandez J.A., 1979. Estudio de la variabilidad en algunas poblaciones silvestres de la sección Pseudonarcissus DC. (género Narcissus L.) de la Cordillera Cantábric. Anales del Jardín Botánico de Madrid 36 : 153-189.
Fedorov A.A., 1969[1974]. Chromosomes numbers of flowering plants. Acad.. Nauk CCCP, Botanical Institute B.L. Komarov, Leningrad, 926 p.
Fernandes A., 1934. Nouvelle étude caryologique sur le genre Narcissus L. Boletim da Sociedade Broteriana 9 (2) : 1-195.
Fernandes A., 1946. Sur la caryosystématique du sous-genre Ajax Spach du genre Narcissus L. Acta Universitatis Conimbrigensis 1 : 1-33.
Fernandes A., 1968. Keys to the identification of native and naturalizeed taxa of the genus Narcissus L., reprint from Daffodil and Tulip year book : 37-216.
Fernández Casas J., 1986. Acerca de unos cuantos narcisos norteños. Fontqueria 11 : 15-23.
Fernández Casas J., 1987. A vuelta con los narcisos. Fontqueria 14:17-22.
Fridlender A., 1999. Identification des Arum de la flore française. Le Journal de Botanique 11 : 29-43.
Fridlender A., 2000. Le genre Arum en Corse. Candollea 55 (1) : 255-267.
Fridlender A., 2018. Une nouvelle espèce de narcisse en Algérie : N. bellirius spec. nov. Bulletin de la Société linnéenne de Lyon 87 (9-10) : 257-272.
Fridlender A., 2019. About a tetraploid ivy in Sicily: from autochthonous Hedera to horticultural-invasive-hybrid package? bioRxiv doi.org/10.1101/751743 : 1-15.
Gerarde J., 1633. The Herbal or general history of plants. London, 1 630 p. + tables.
Gomez-Murillo P., Arellano-Martin I. & Sanchez-Garcia A., 2021. Novedades en Narcissus sect. Pseudonarcissi DC. (Amaryllidaceae) en España: N. ramirezii sp. nov. Flora Montiberica 79 : 116-119.
Gouan A., 1773, Narcissus. In Illustrationes et observationes botanicae… Rariorum plantarum indigenarum, Pyrenaicarum, exoticarum… Tiguri, Orell, Gessner, Fuesslin & Soc. : 22-24.
Guinochet M., 1978. Narcissus L. In M. Guinochet & R. de Vilmorin, Flore de France, CNRS, Paris, 3 : 1 135-1 138.
Hanks R., 2002. The biology of Narcissus. In Narcissus and daffodil. The genus Narcissus, Taylor & Francis, London : 19-29.
Haworth A.H., 1819. Narcissorum revisio sive enumeration specierum linnaei generis narcissi. Supplementum plantarum succulentum… :108-158.
Haworth A.H., 1831. Narcissinearum monographia, ed. 2, 22 p.
Herbert W., 1837. Amaryllidaceae. Ridgway & Sons, London, 428 p.
Jiménez J.F., Sánchez-Gómez P., Guerra J., Molins A. & Roselló J.A., 2009. Regional speciation or taxonomic inflation? The status of several narrowly distributed and endangered species of Narcissus using ISSR and nuclear ribosomal ITS markers. Folia Geobotanica 44 : 145-158.
Jordan A., 1903. Icones ad floram europae, III. Paris, G. Masson, 350 p.
Könives K., David J. & Culhan A., 2019. Jumping through the hoops: the challenges of daffodil (Narcissus) classification. Taxon 190 : 389-404.
Küpfer Ph., 1974. Recherches sur les liens de parenté entre la flore orophile des Alpes et celle des Pyrénées. Boissiera 23 : 1-322.
Lamarck (Chevalier de), 1778. Flore françoise ou description succincte de toutes les plantes… Paris, Imprimerie Royale, III : 966-967.
Lamarck J.B. P.A., 1809. Philosophie zoologique. Dentu & MNHN, 1, 428 p.
Le Driant F., Ferrus L. & Pellicier P., 2022. Plantes de montagne, Alpes, Massif central, Jura et Vosges. Biotope, Mèze, 1 144 p.
Lecoq H. & Lamotte M., 1847. Catalogue raisonné des plantes vasculaires du plateau central de la France. Paris, Masson :137-138.
Linné C. (von), 1736. Fundamenta Botanica quae majorum operum prodromi inflat theoriam Sciantiae Botanices per breves Aphorismos. Amstelodami , 36 p.
Linné C. (von), 1753. Species Plantarum, édition 1, 1 : 289-290.
Linné C. (von), 1762. Species Plantarum, édition 2, 1 : 414-417.
Marques I., Fuerte Aguilar J., Martin Louçao M.A., Mohameck F. & Nieto Feliner G., 2017. A three-genome five-gene comprehensive phylogeny of the bulbous genus Narcissus (Amaryllidaceae) challenges current classifications and reveals multiple hybridization events. Taxon 66 : 832-854.
Mathew B., 2002. Classification of the genus Narcissus. In Narcissus and daffodil. The genus Narcissus, Taylor & Francis, London : 19-29.
Medrano M., López Perea E. & Herrera C.M., 2014. Population genetics and methods applied to a species delimitation problem: endemic trumpet daffodils (Narcissus sect. Pseudonarcissi) from the southern Iberian Peninsula. International Journal of Plant Science 175 (5) : 501-517.
Navas Fernandez H.S., Fernandez Casado M.A. & Martino Iglesias J., 2013. Los narcisos silvestres de Asturias y áreas próximas. Gijón Documentos 9 : 1-77.
Nicholson G., 1885. Dictionary of gardening a practical and scientific encyclopaedia of horticulture. L. Upcott Gill (éd.), London, 2 : 415.
Parkinson J., 1629. Paradisus terrestres. A garden of all sort of pleasant flowers… 638 p.
Paun O., Bateman R.M., Fay M.F., Hedrén M., Civeyrel M. & Chase M.W., 2010. Stable epigenetic effects impact adaptation in allopolyploid orchids (Dactylorhiza, Orchidaceae), Molecular Biology and Evolution 27 (11) : 2 465-2 473.
Pignatti S., 2017. Flora d’Italia, sec. Edizione. Edagricola (ed.), Milano, 1, 1 064 p.
Pugsley H.W., 1933. Ajax. Monograph of Narcissus subgenus Ajax. Journal of the Royal Horticultural Society 58 (1) : 17-93.
Rivera Nuñez D, Obón de Castro C., Ríos Ruiz S. & Alcaraz Ariza F., 2003. The origin of cultivation and wild ancestors of daffodils (Narcissus subgenus Ajax) from an analysis of early illustrations. Scientia Horticulturae 98 : 307-330.
Rivera Nuñez D., Ríos Ruiz S., Obón de Castro C. & Alcaraz Ariza F., 2006. The image of daffodil in art and botanical illustration: clues to the history of domestication and selection of Narcissus subgenus Ajax (Amaryllidaceae) from an analysis of early illustrations. Global Science Books -UK: Floriculture, ornamental and plant biotechnology 4 : 360-369.
Rouy G., 1912. Flore de France ou description des plantes qui croissent spontanément en France en Corse et en Alsace-Lorraine, XIII, 548 p.
Royal Horticultural Society, 2017. Botanical classification of the genus Narcissus.
Rudbeck O., 1601. Campi Elysii. Upsala, liber 2, 239 p.
Sañudo A., Fernandez Peralta A.M. & Gonzalez Aguilar J.J., 1984. Études cytogénétiques et évolutives dans les populations espagnoles du genre Narcissus L. sect. Pseudonarcissi DC. Webbia 38 : 829-837.
Saint-Lager J.B., Vivian-Morel J.-P. & NRoux N., 1890. Séance du 1er avril 1890 de la Société linnéenne de Lyon. Bulletin mensuel de la Société linnéenne de Lyon 8 (1-4) :18-20.
Saule M., 1991. La grande flore illustrée des Pyrénées. Édition Milan & Randonnées Pyrénéennes, 763 p.
Spaulding D.D. & Wayne Barger T., 2014. Key to wild daffodils (Narcissus) of Alabama and adjacent states. Phytoneuron 82 : 1-10.
Stace C.A., Preston C.D. & Pearman D.A., 2016. Hybrid flora of the British Isles. Botanical Society of Britain and Ireland (ed.), 501 p.
Tison J.-M., Jauzein Ph., Girod Ch. & Espeut M., 2010. Combinaisons et statuts nouveaux proposés dans la « Flore de France méditerranéenne continentale ». Biocosme Mésogéen 27 (4) : 100-133.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de la France. Biotope (ed.), Mèze, xx + 1 196 p.
Tison J.-M. Jauzein Ph. & Michaud H., 2014. Flore de la France méditerranéenne continentale. Naturalia (ed.), Turriers, 2 078 p.
Tort M., Belin B. & Portal R., 2010. Guide de la flore de Haute-Loire, 2, 520 p.
Waters M.T., Tiley A.M., Kramer E., Meerow A.W., Langdale J.A. & Scotland R.W., 2013. The corona of the daffodil Narcissus bulbocodium shares stamen-like identity and is distinct from the orthodox floral whorls. The Plant Journal 74 : 615-625.
Webb H.D., 1980. Narcissus L. In T.G. Tutin et al. (ed.), Flora Europaea, V, Cambridge University Press, 452 p.
Zonneveld B., 2010. The involvement of Narcissus hispanicus Gouan in the origin of Narcissus bujei and of cultivated trumpet daffodils (Amaryllidaceae). Anales del Jardín Botánico de Madrid 67 (1) : 29-39.
Remerciements
Je remercie M. Bourge et K. Madiona (Gif), G. Thébault (CLF !), I. Rault, M. Gouiran et Olivier Bablée qui m’ont aidé dans les analyses, les cultures, la consultation des herbiers ou plusieurs fois accompagné à la recherche des jonquilles. Gilles Dutartre m’avait donné libre accès à ses collections de bulbes et à son très riche herbier. Merci à J.-M. Tison, B. de Foucault et V. Vezinet pour leurs encouragements ou observations concernant le manuscrit.