Troisièmes compléments à la Monographie des Leguminosae de France
Title
Third supplements to the Monographie des Leguminosae de France.
Résumé
Les tomes 3 et 4 de la Monographie des Leguminosae de France ont été publiés respectivement en 2013 et 2016 (Société botanique du Centre-Ouest, numéros spéciaux 40 et 46). Ils traitent des tribus des Trifolieae, Cicereae, Genisteae et des Fabeae. Ces troisièmes compléments actualisent les connaissances des espèces traitées dans ces deux premiers volumes, grâce aux nombreuses contributions du réseau de botanistes nous accompagnant sur ce projet. Ils permettent également de citer des références bibliographiques récemment publiées et d’affiner la connaissance de certains taxons. De nombreuses stations nouvelles nous ont été signalées, mais nous n’avons retenu que les observations les plus importantes, notamment celles modifiant les cartes chorologiques à maille départementale.
Abstract
Volumes 3 and 4 of Monographie des Leguminosae de France were published in 2013 and 2016 respectively (Société botanique du Centre-Ouest, special issues 40 and 46). They concern tribes of Trifolieae, Cicereae, Genisteae and Fabeae. These third supplements update the knowledge of the species treated in these first two volumes, thanks to the numerous contributions of the network of botanists accompanying us on this project. They also make it possible to cite recently published bibliographical references and to refine the knowledge of certain taxa. Many new stations have been reported to us, but we have only retained the most important observations, in particular those modifying the departmental chorological maps.
Ces troisièmes compléments viennent à la suite des deux articles précédemment publiés (Coulot & Rabaute, 2016b, 2017). Ils correspondent à des nouveautés chorologiques et à des éléments de bibliographie récents, venant enrichir le traitement des tribus, espèces et genres dans les tomes publiés. Ils sont présentés par ordre de publication des tomes et dans l’ordre de présentation des genres et espèces au sein de chaque tome.
Tribu des Trifolieae Endl. (tome 3, pp. 1-762)
Genre Ononis L. (tome 3, pp. 33-128)
Ononis spinosa L. (tome 3, pp. 72-80)
Une synthèse sur les propriétés pharmacologiques de la bugrane épineuse, au sens large, a été publiée récemment par une équipe irakienne (Al-Snafi, 2020). Elles sont portées essentiellement par des flavonoïdes comme la daidzine, la genistine, l’ononine, la trifolirhizine, etc. La plante, et tout particulièrement sa racine, est utilisée en médecine traditionnelle comme diurétique, antibactérienne, antifongique, anti-inflammatoire, anti-oxydante et hépatoprotectrice. Son activité anticancéreuse a aussi éte testée.
De même, une étude a été récemment publiée sur les propriétés antifongiques de cette espèce (Stojković et al., 2020), mises en évidence par l’action in vitro d’extraits méthanoliques de la plante sur certaines espèces de Penicillium et de Candida, sans apparente cytotoxicité.
Ononis mitissima L. (tome 3, pp. 86-88)
Cette bugrane très rare dans l’Aude, connue uniquement de Thézan-des-Corbières et de Montséret, a été retrouvée en deux nouvelles stations en cette dernière commune, à la Blaquière et Buffanel (Dominique Barreau, comm. pers.).
Ononis ornithopodioides L. (tome 3, pp. 109-111)
Comme évoqué dans les deuxièmes compléments de la monographie, Thomas Croze a publié ses observations de cette espèce discrète faites en 2016 en plusieurs points du cap Roux, sur les communes de Beaulieu-sur-Mer et Èze et de Roquebrune-Cap-Martin (Croze, 2017). Ces informations sont à compléter par ses propres observations de 2013 faites sur la commune de Vence, sur le balcon rocheux du Baou des Blancs, à 650 m d’altitude. L’espèce est donc présente en plusieurs points du pays niçois, dans des zones peu accessibles, ce qui explique leur découverte récente.
Ononis breviflora DC. (tome 3, pp. 117-120)
Cette espèce est connue du Moyen-Orient (Israël, Jordanie, Liban, Syrie), mais n’avait jamais été rencontrée en Égypte. Elle y a été observée récemment dans le sud du Sinaï, dans la région de Wadi Gebal. Cette mention est détaillée dans une remarquable synthèse du genre en Égypte, récemment publiée (Fayed et al., 2019).
Genre Trifolium L. (tome 3, pp. 129-424)
Trois articles récemment publiés concernant le genre Trifolium méritent d’être mis en avant. Le premier est celui coordonné par Anna Scoppola, de l’université de Tuscia (Viterbe) (Scoppola et al., 2018). Cette étude, très documentée, traite de la diversité et de la répartition du genre Trifolium dans la région méditerranéenne, à partir de l’analyse de 104 espèces.
Le deuxième est une publication récente complète la connaissance de la caryologie du genre Trifolium, à travers l’analyse de huit espèces présentes en Grèce (Samaropoulou et al., 2019). Les espèces concernées par cette étude sont, pour la flore de France, T. arvense L. (2n = 14), T. glomeratum L., T. subterraneum L., T. resupinatum L. et T. suffocatum L. (tous à 2n = 16).
La troisième est une tentative très originale de classifier les quinze espèces de trèfles présents en Égypte, dont treize appartiennent à la flore de France, à partir des cotylédons et de la première feuille, au stade embryonnaire de la plante (Shehata et al., 2020). Les auteurs proposent des illustrations originales et surtout une clé totalement inédite d’identification des espèces à ce stade très précoce.
Trifolium aureum Pollich (tome 3, pp. 146-149)
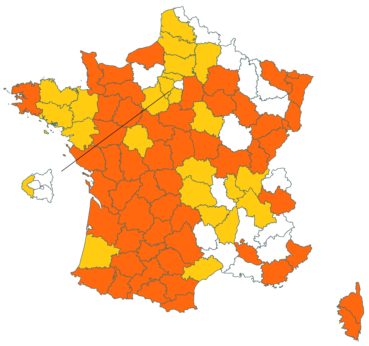
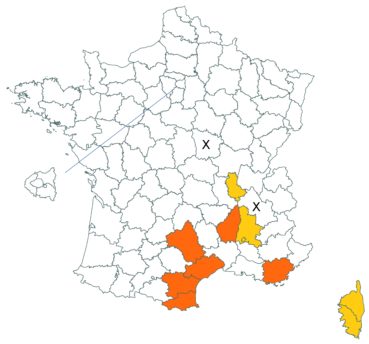
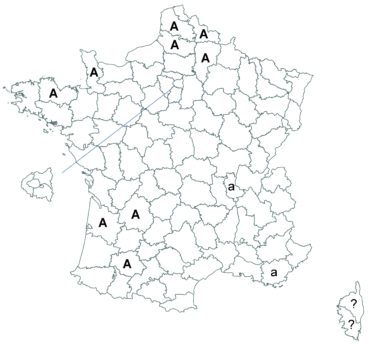
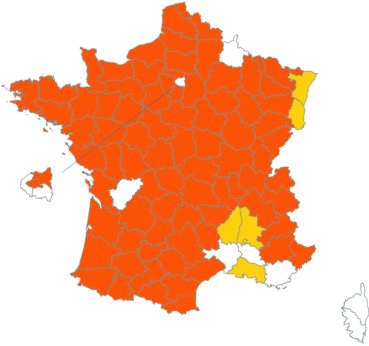
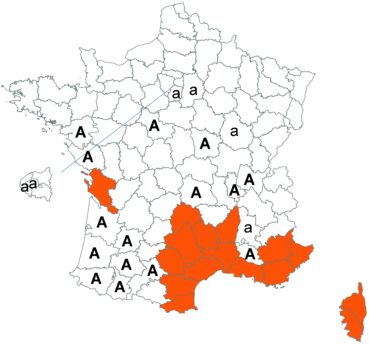
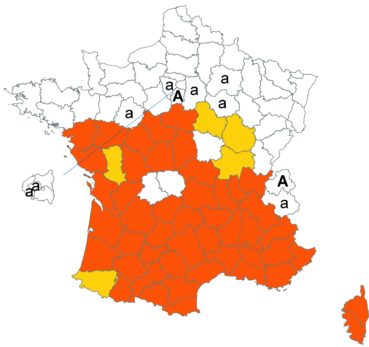
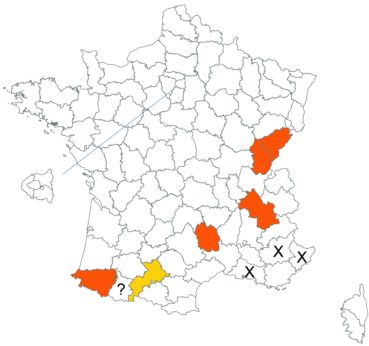
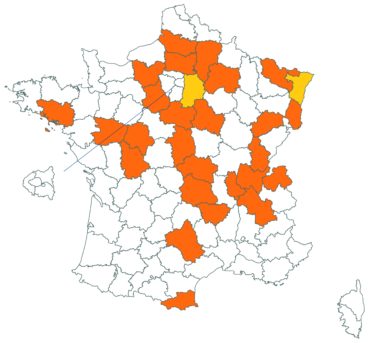
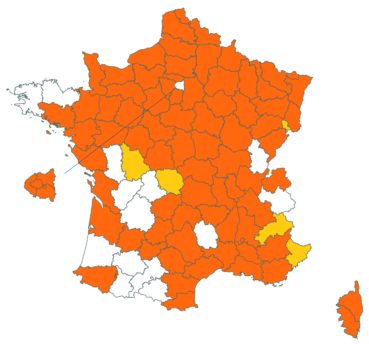
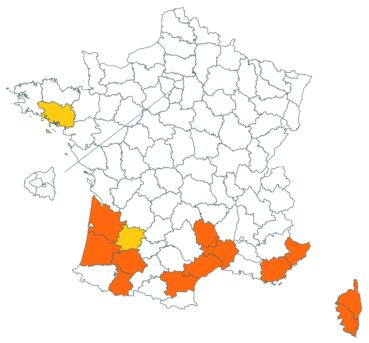
Cette espèce discrète et souvent confondue avec d’autres taxons de la section Chronosemium est d’une grande rareté en Lorraine. Jusqu’alors inconnue du département de la Meuse, elle y a été découverte en 2017 par François Boulay, Patrice Bracquart, Elisabeth de Fay, Michel Klein et Hélène Laugris. Ils ont observé une trentaine de pieds sur le talus d’une large tranchée forestière en forêt de Ligny-en-Barrois (Boulay et al., 2017).
Dans les Ardennes il a été retrouvé dans plusieurs communes, Bouconville (Saint-Val, 2018), Cornet (Misset, 2003), Fumay (Amblard, 2011), La Grandville (Saint-Val, 2015) et Saint-Mendes (Amblard, 2012 puis 2014) (toutes données CBNBP).
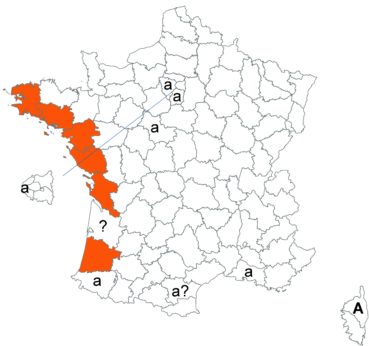
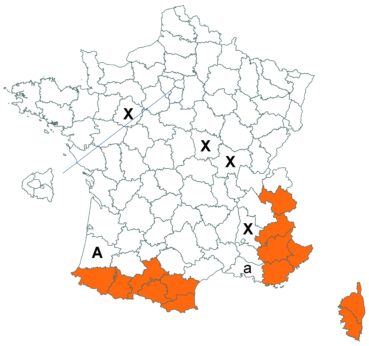
Voir carte réactualisée n° 1.
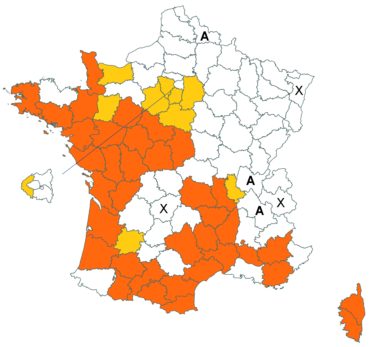
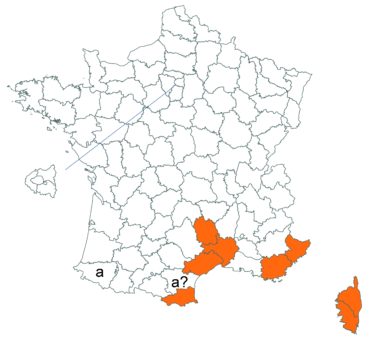
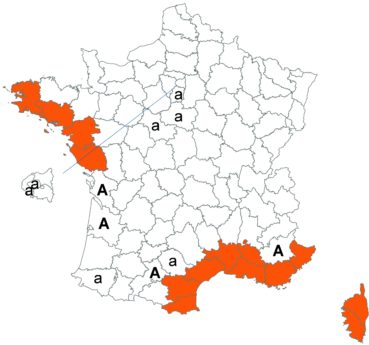
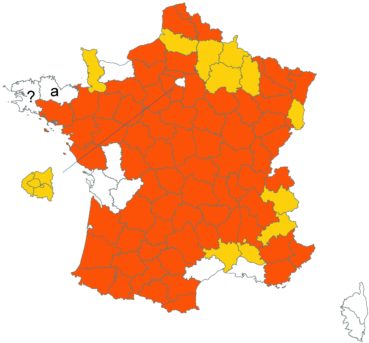
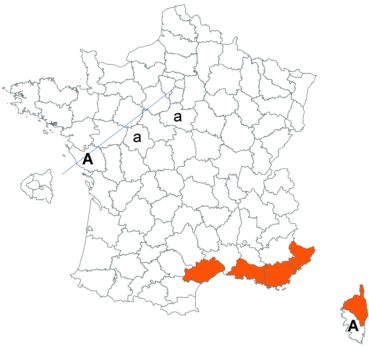
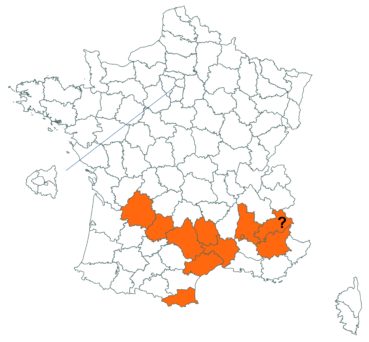
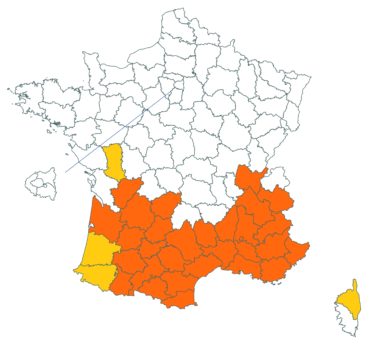
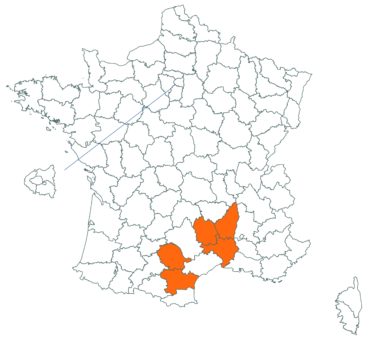
Trifolium patens Schreb. (tome 3, pp. 167-171)
Cette espèce méconnue et discrète a été découverte en Moselle pour la première fois, par Nicolas Pax en août 2015 sur la commune de Juvelize, au lieu-dit « Besborne », dans la vallée de la Seille (Pax, 2015). Cette station est apparemment abondante et est la seule récemment observée en Lorraine.
Par ailleurs, ce trèfle a été observé en plusieurs points du Lot-et-Garonne, en particulier dans une prairie humide de la commune de Montpouillan par Nicolas Leblond (CBNSA) le 28 mai 2015, puis par l’équipe du CBNSA à Castelnau-sur-Gupie, Caubon-Saint-Sauveur, Lavergne, Rayet et Montpezat.
Voir carte réactualisée n° 2.
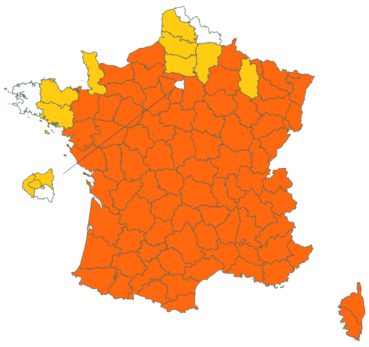
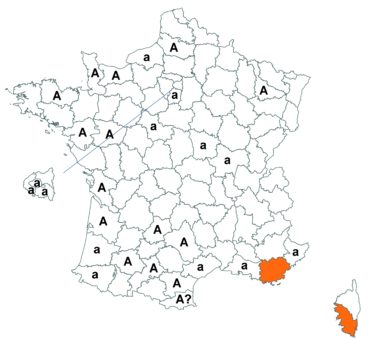
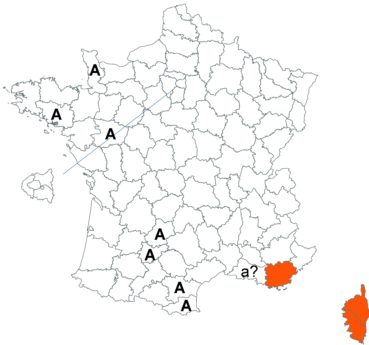
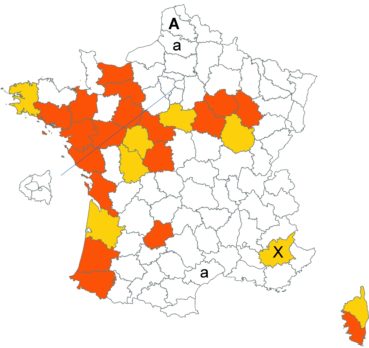
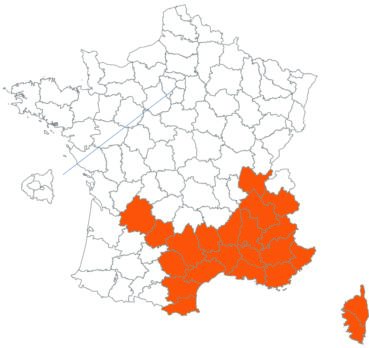
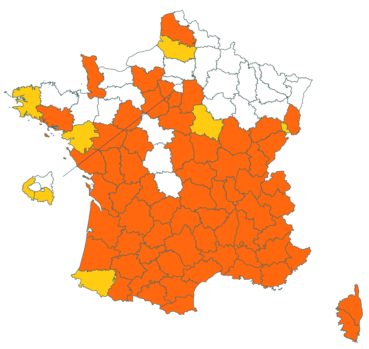
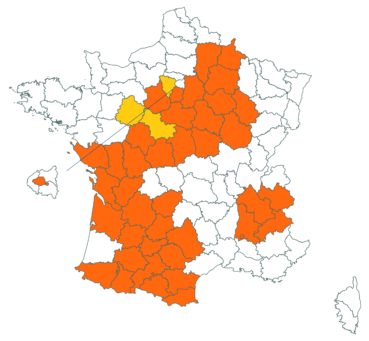
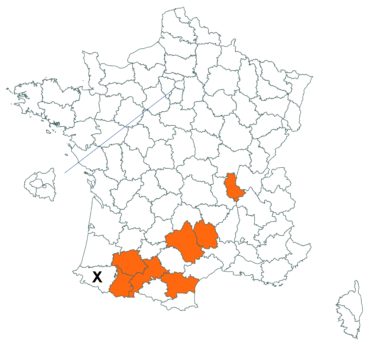
Trifolium strictum L. (tome 3, pp. 181-184)
Ce trèfle, connu de l’Aude en Montagne noire et en quelques stations du littoral, a été trouvé en plusieurs localités des Corbières, à Laroque-de-Fa, Mouthoumet, Salza, Félines-Termenès, Bouisse et Valmigère (Dominique Barreau, comm. pers.).
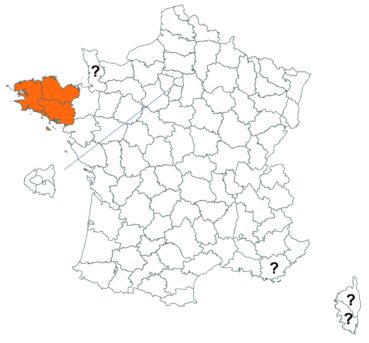
Le trèfle droit n’avait pas été revu en Ille-et-Vilaine depuis les observations de Lloyd et était considéré comme disparu depuis le début du siècle dernier. Il a été retrouvé par Vincent Guillemot en mai 2018 à l’ouest de la Pointe du Meinga en Saint-Coulomb. La population était constituée d’environ 25 pieds. Elle est à rechercher dans le secteur.
Cette espèce n’a toujours pas été observée dans le Lot-et-Garonne, mais une mention ancienne existe bien, à Pompiey, au lac de la Laguë (Chaubard in Debeaux, 1896 : 380 ; Nicolas Leblond, comm. pers.).
Voir carte réactualisée n° 3.
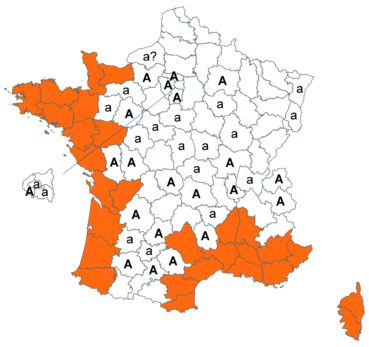
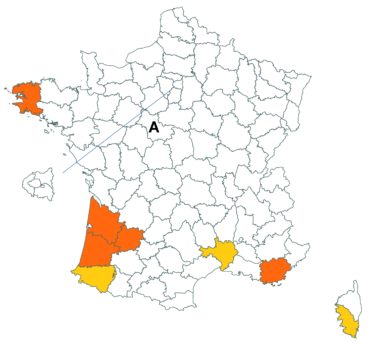
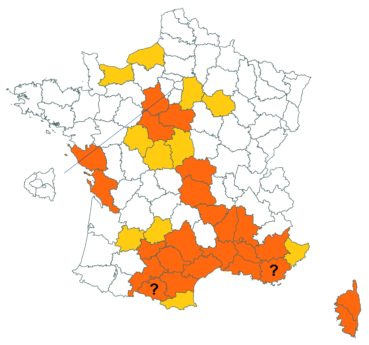
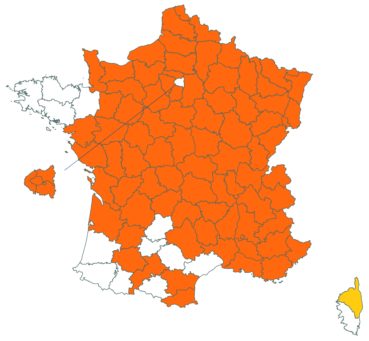
Trifolium medium L. var. medium (tome 3, pp. 202-207)
Ce taxon, très rare en Loire-Atlantique, a été retrouvé dans une troisième commune dans ce département, en juillet 2018, au bord du plan d’eau du Château de la Forêt au Cellier (Fabien Dortel, donnée CBNB).
Il a également été observé dans la Manche en juillet 2018 sur les talus de la N174 à Montmartin-en-Graignes (Juliette Waymel & Lauriane Laville). C’est la troisième observation pour ce département.
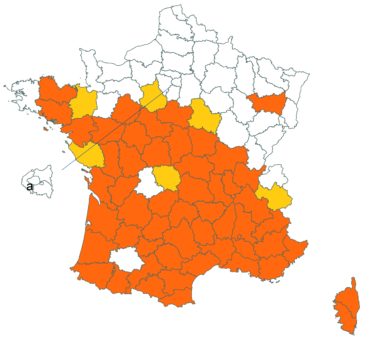
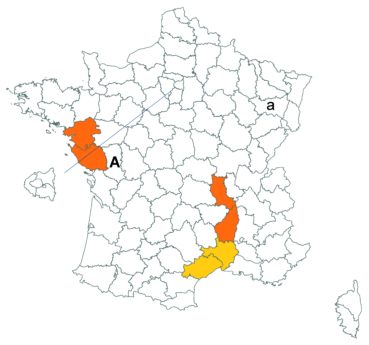
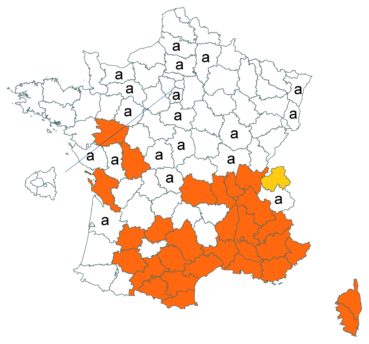
Trifolium ochroleucon Huds. (tome 3, pp. 208-211)
Ce taxon a été revu par Nicolas Leblond dans le département des Landes en trois localités, à Rimbez-et-Baudiets le 12 juillet 2017, à Escalans le 15 mai 2017 et à Parleboscq le 11 mai 2017, toujours en contexte de pelouses calcicoles.
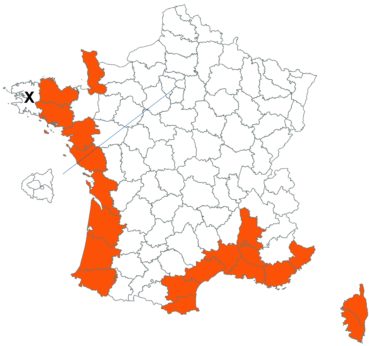
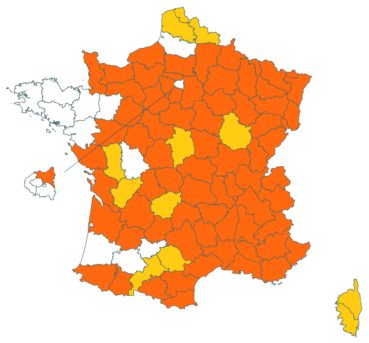
Voir carte réactualisée n° 4.
Trifolium incarnatum L. var. molinerii (Balb. ex Horn.) Ser. in DC. (tome 3, pp. 224-228)
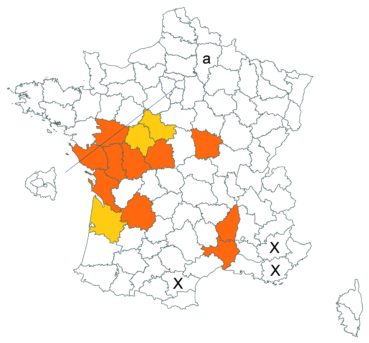
Ce taxon n’avait jamais, à notre connaissance, été observé dans le département des Deux-Sèvres. C’est chose faite, Patrick Gatignol l’y ayant observé le 29 mai 2015 à Moulin neuf, sur la commune de Massais (comm. pers.).
Par ailleurs, ce taxon existe bien en Ariège, où il a été observé sur les coteaux calcaires au-dessus du village de Rouze par Nicolas Leblond (CBNPMP) le 22 juillet 2017 (comm. pers.).
Voir carte réactualisée n° 5.
Trifolium sylvaticum Gérard ex Loisel. (tome 3, pp. 232-235)
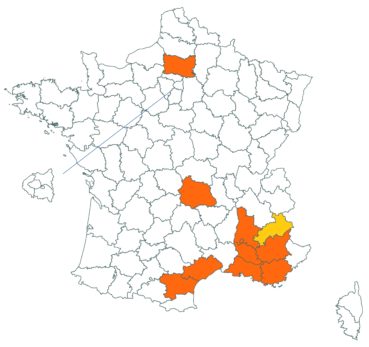
Cette espèce annuelle des milieux acides n’est connue en France que de très peu de zones, et en particulier dans le Var et en Ardèche où sont les stations les plus nombreuses et les plus importantes. Le 6 mai 2020, cette espèce annuelle a été observée en deux stations proches l’une de l’autre sur la commune de Saint-Jean-de-Fos, dans la vallée de l’Hérault (photo 1), par Guillaume Fried (Fried et al., 2020). La plante pousse en ce lieu avec Trifolium bocconei Savi, autre espèce très rare dans l’Hérault.
De même, Dominique Barreau (comm. pers.) nous indique que la plante a été retrouvée dans l’Aude, à Laroque-de-Fa, très probablement dans la station indiquée par Delpont en 1928.
Cette observation porte à six le nombre de départements français où la plante a été observée récemment.
Voir carte réactualisée n° 6.
Trifolium bocconei Savi var. bocconei (tome 3, pp. 241-245)
Cette espèce est très rare en Bretagne, et en particulier dans le Morbihan où elle connue seulement de deux localités sur la rive nord de l’embouchure de la Vilaine à Muzillac et Billiers. Elle vient
d’être trouvée dans une nouvelle station de la commune de Billiers. Cette observation a été faite en juin 2020 par Vincent Colasse (CBNB). Le site est une pelouse littorale près du cairn des Grays ; la plante y abonde (plusieurs centaines de pieds), en compagnie d’autres trèfles rares en Bretagne, comme Trifolium strictum, T. striatum ou T. glomeratum (Paul Mauguin, CBNB, comm. pers.).
Trifolium scabrum L. subsp. scabrum (tome 3, pp. 246-251)
Cette espèce protégée en région Lorraine n’était connue de la Meuse que de deux localités, Pagny-la-Blanche-Côte et Villeroy-sur-Méholle. Une nouvelle population de ce trèfle a été trouvée le 2 juin 2015 dans ce département (200 à 500 individus) par S. Massot sur une frange de pelouse rase en bordure de la route menant à l’ossuaire de Douaumont, à Fleury-devant-Douaumont (Muller, 2016).
Trifolium ligusticum Balbis ex Loisel. (tome 3, pp. 252-255)
Cette espèce, rare dans les Pyrénées-Orientales et inobservée pendant des décennies, a été revue depuis quelques années sur les communes de Banyuls et Argelès-sur-Mer. Elle vient d’être retrouvée également à Port-Vendres par Romain Bouteloup, en 2020 (comm. pers.).
Dans les Alpes-Maritimes, non revu depuis longtemps, ce trèfle a été redécouvert en 2013 à Mandelieu-la-Napoule (Ludovic Thebault, comm.pers.) et à Théoule-sur-Mer dans le Parc départemental de la Pointe de l’Aiguille (Benoît Offerhaus, donnée CBNMed).
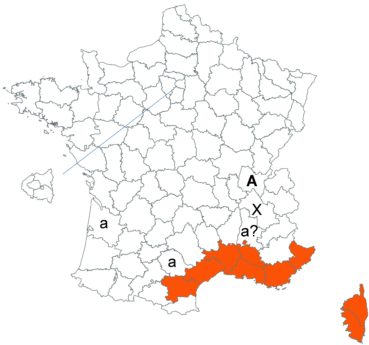
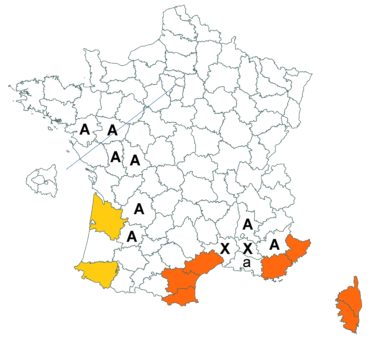
Voir carte réactualisée n° 7.
Trifolium alexandrinum L. (tome 3, pp. 293-295)
Une équipe chinoise vient de publier le génome chloroplastique complet de ce trèfle, ainsi que celui de T. resupinatum L. (Xiong et al., 2020). Indépendamment de la constatation de la grande proximité génétique entre ces deux espèces et avec une quinzaine d’autres espèces étudiées (sur comparaison des gènes rpoC2 et ycfl), la mise à disposition de ces génomes à la communauté scientifique facilitera dorénavant les travaux de phylogénie moléculaire sur le genre Trifolium.
Trifolium leucanthum M. Bieb. (tome 3, pp. 301-304)
Ce trèfle très rare en France reste très majoritairement localisé sur le territoire de l’ex-Languedoc-Roussillon. Il a fait l’objet depuis quelques années de plusieurs observations nouvelles dans le département de l’Aude, à Termes, Laroque-de-Fa, Talairan et Tuchan (Plassart et al., 2016) et dans l’Hérault à Fos (Patrice Delaumone, 2012), Brenas (Patrice Delaumone, 2013), Valmascle (James Molina, 2014), Pardailhan (James Molina et al., 2016), Lunas (Frédéric Andrieu, 2017) et Saint-Maurice-Navacelles (Jean-Marie Coste, 2018) (Andrieu et al., 2019).
Trifolium squarrosum L. (tome 3, pp. 305-308)
Cette espèce, considérée il y a quelques années encore comme d’une extrême rareté en France, s’avère être cultivée de plus en plus souvent à travers la France, parfois en mélange avec d’autres trèfles, comme engrais vert. Les observations de champs de T. squarrosum ou de petites populations résiduelles après ces phases de culture se multiplient (Coulot et al., 2016b, 2017).
Nous citons ici de nouvelles observations dans des départements où il n’avait jamais été relevé. La première est celle faite par Thomas Bousquet (CBNB) dans la Manche en trois communes, le 26 juin 2018 à la Lande-d’Airou, le 10 septembre 2018 à Juvigny-le-Tertre et le 12 juin 2018 au Mesnil-Gilbert. En l’occurrence la plante était en mélange avec T. resupinatum L. var. majus Boiss. et/ou T. incarnatum L. subsp. incarnatum. La deuxième est celle faite le 13 juin 2020 dans la Somme à Ham, dans la commune de Muille-Villette, en bord de chemin rural entre une peupleraie et une zone de culture ; une dizaine de pieds a été observée par Thibaud Daumal. La troisième concerne le département de Maine-et-Loire où il a été observé en juin 2018 par Pierre Chasseloup au sein d’une prairie de fauche humide à Saint-Aubin-de-Luigné où il est utilisé comme fourrage dans l’exploitation à proximité (donnée CBNB).
Il convient également de mentionner une deuxième observation dans le département de Loire-Atlantique, après celle faite en 2014 par Florent Pouzet dans la commune de la Planche. Elle a été faite par Dominique Chagneau à Montoir-de-Bretagne, près de Saint-Nazaire le 3 juin 2018 (données CBNB).
Enfin, l’observation faite le 29 mai 2018 par Henri Michaud (CBNMed), Virgile Noble (CBNMed) et Yves Morvant au plan de la Garde, sur la commune de La Garde, dans le Var, mérite une attention particulière. En effet, la plante y est extrêmement abondante dans les friches à Phalaris coerulescens Desf. et dans les ourlets de la frênaie à Fraxinus angustifolia Vahl, souvent en mélange avec T. squamosum L. Dans ce contexte, proche de celui des stations du sud de la Corse ou du sud de l’Espagne, l’indigénat de cette espèce peut raisonnablement se poser, même s’il est étonnant qu’elle n’y ait jamais été observée.
Par ailleurs, ce trèfle, déjà observé dans l’Aude en 2014 par Barreau et Coirié (Coulot et al., 2016b), a été revu dans d’autres localités de ce département, à Saint-Just-et-le-Bézu et à Missègre, avec T. vesiculosum (Dominique Barreau, comm. pers.).
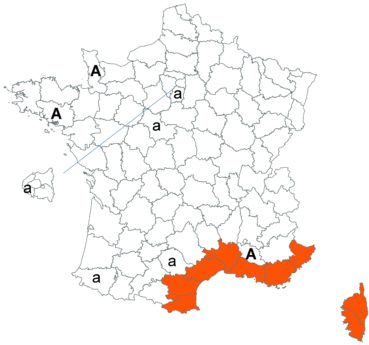
Voir carte réactualisée n° 8.
Trifolium resupinatum L. var. resupinatum (tome 3, pp. 320-327)
Une équipe chinoise vient de publier le génome chloroplastique complet de ce trèfle, ainsi que celui de T. alexandrinum L. (Xiong et al., 2020). Indépendamment de la constatation de la grande proximité génétique entre ces deux espèces et avec une quinzaine d’autres espèces étudiées (sur comparaison des gènes rpoC2 et ycfl), la mise à disposition de ces génomes à la communauté scientifique facilitera dorénavant les travaux de phylogénie moléculaire sur le genre Trifolium.
Cette espèce a par ailleurs été observée par William Lévy (CBNSA) le 17 juillet 2015 dans une prairie de fauche de la commune de Bussière-Badil, en Dordogne.
Voir carte réactualisée n° 9.
Trifolium resupinatum L. var. majus Boiss. (tome 3, pp. 320-327)
Ce taxon, observé çà et là dans les cultures, a été observé par Nicolas Leblond en Dordogne, à Urval (1er juin 2016), et en Gironde, à Pauillac (7 juillet 2016).
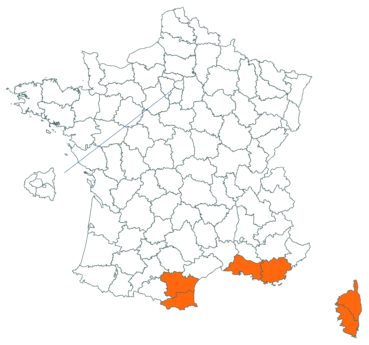
Voir carte réactualisée n° 10.
Trifolium tomentosum L. (tome 3, pp. 328-331)
Ce trèfle méditerranéen a été observé récemment en Vendée et dans le Morbihan par les équipes du CBNB (Coulot et al., 2016b, 2017), mais pas en Loire-Atlantique. C’est chose faite, par Dominique Chagneau et Armelle Dujardin le 18 mai 2018 sur la commune de La-Baule-Escoublac, au camping municipal Tohapy (donnée CBNB). Comme c’est le cas en Vendée, ces observations près de campings ou de pistes cyclables évoquent une naturalisation récente de ce thérophyte à partir d’apports de terre ou de graines.
Il a également été observé pour les premières fois dans le Finistère, toujours sur le littoral, à Plouescat en 2016 et à Santec en 2018 (Données CBNB).
Voir carte réactualisée n° 11.
Trifolium spumosum L. (tome 3, pp. 332-334)
Cette espèce rare, relativement fréquente dans l’Hérault, est très rare dans l’Aude, où elle a été observée une seule fois récemment, en 2008 à Caunes-Minervois. Une station très importante de la plante a été découverte récemment dans le massif de la Clape, sur grès siliceux, dans les communes de Fleury et Salles-d’Aude (Dominique Barreau, comm. pers.).
Trifolium vesiculosum Savi (tome 3, pp. 335-339)
Ce trèfle est de plus en plus fréquemment utilisé comme engrais vert et se naturalise parfois, comme c’est le cas dans l’Aveyron, la Sarthe, les Pyrénées-Orientales (Coulot et al., 2017). Ainsi, il a été observé début octobre 2017 par Francis Kessler (CBNPMP) dans un champ de tournesol sous d’anciennes serres débâchées sur la commune de Bioule, dans le Tarn-et-Garonne, au nord-ouest de Montauban.
De même, la plante a été vue, toujours par Francis Kessler, le 5 octobre 2017 dans le département du Lot, sur la commune de Le Vigan, près de Rocamadour (donnée CBNPMP).
Enfin, ce trèfle a été observé plusieurs fois dans le département du Maine-et-Loire, par Julien Geslin (CBNB) le 20 juillet 2018, à Notre-Dame-d’Allençon, aux abords d’une culture de colza près de Pont d’Aléne à la Chapelle-Saint-Florent (Olivier Gabory, 10 juin 2018) ainsi que dans des friches à La Bardière à Cléré-sur-Layon (Sylvain Courant, 5 juillet 2018). Il a également été cité dans plusieurs nouveaux départements du nord-ouest, les Côtes-d’Armor à Yffiniac en 2017 et la Manche à la Mercerie à Troisgots en septembre 2019 (Thomas Bousquet) (toutes données CBNB).
Par ailleurs, ce trèfle, déjà observé dans l’Aude en 2014 par Barreau et Coirié (Coulot et al., 2016b), a été revu dans d’autres localités de ce département, à Saint-Just-et-le-Bézu et à Missègre, avec T. squarrosum (Dominique Barreau, comm. pers.).
Paul Mauguin (comm. pers.) nous a par ailleurs communiqué l’étiquette d’un mélange de semences SOC France qu’il a trouvé en vente en Bretagne. Intitulé Jango Alex bio, il comprend 20 % de sorgho fourrager, 20 % de millet, 30 % de Trifolium alexandrinum et 30 % de T. vesiculosum. Ce mélange est étiqueté « mélange de semences pour culture intercalaire ». L’utilisation de ce type de mélange va probablement induire des observations de plus en plus fréquentes de l’espèce. Il reste à savoir si elle s’introduira de façon durable en marge des parcelles où elle est semée. Il est d’ailleurs intéressant de noter que l’observation faite le 20 novembre 2014 par Gabriel Coirié et Dominique Barreau dans l’Aude, près de Quillan (Coulot et al., 2016b), avait été faite dans un champ de sorgho.
Voir carte réactualisée n° 12.
Trifolium angulatum Waldst. & Kit. (tome 3, pp. 341-344)
Ce trèfle est un exemple typique de plante très longtemps méconnue des botanistes français, qui est désormais recherchée dans ses milieux préférentiels, des bords de mares sur sols argileux, humides à inondés l’hiver et desséchés craquelés l’été (Isoetion de garrigue en zone méditerranéenne). Non revue en France depuis 1948 dans les costières de Nîmes (Gard), cette plante a été revue en 2013 par Francis Kessler dans le département de la Loire (Kessler, 2014), puis en Vendée et Loire-Atlantique par Dominique Chagneau et Guillaume Thomassin (CBNB) en 2017. Une nouvelle station a d’ailleurs été découverte en juillet 2019 dans le marais breton en Vendée aux Cochets à Saint-Urbain (Perrine Dulac et les Naturalistes vendéens).
Le 18 mai 2020, Nicolas Bianchin (CBNMC, comm. pers.) a trouvé une nouvelle population de la plante, sur le site de la plaine du Regard (plateau basaltique du Coiron), dans le département de l’Ardèche (photo 2). Bien qu’assez localisé, les effectifs du trèfle étaient relativement importants, entre 1 000 et 10 000 individus. Ce site est connu depuis les années 2000 pour ses importantes populations de Ranunculus lateriflorus DC. Le trèfle poussait en bordure de mare temporaire associé à des communautés de prairies humides riches en trèfles (T. micranthum, T. strictum, T. striatum, T. squamosum, T. subterraneum, T. dubium).
Cette nouvelle observation de l’espèce, toujours dans le même type de milieu, est un argument supplémentaire pour l’indigénat de la plante en France, qui nous semble quasiment certain. Sa protection devient donc nécessaire, ce d’autant que ses milieux sont souvent riches en d’autres espèces rares.
Voir carte réactualisée n° 13.
Trifolium hybridum L. var. hybridum (tome 3, pp. 345-350)
Ce trèfle n’avait étonnamment jamais été répertorié dans le département de l’Aude. C’est désormais chose faite, la plante y ayant été observée dans la commune de Roquefort-de-Sault (Dominique Barreau, comm. pers.) et sur le plateau de Sault à Roquefeuil (Andrieu, Barreau & Plassart) (Donnée CBNMed).
Par ailleurs la plante a été abondamment observée en Dordogne lors des prospections systématiques du CBNSA, à Bertric-Burée, Cendrieux, Jumilhac-le-Grand, Lacropte, Marsales, Quinsac, Saint-Crépin-de-Richemont, Saint-Félix-de-Reillac-et-Mortemart, Saint-Geniès, Saint-Pierre-de-Frugie, Sarrazac et Urval, mais aussi dans les Landes à Angoumé, Lit-et-Mixe, Préchacq-les-Bains, Sanguinet et Trensacq, et dans le Lot-et-Garonne à Caudecoste, Clermont-Dessous et Lafitte-sur-Lot (données CBNSA).
Ce trèfle a été noté par Jérémie Van Es dans les Alpes-Maritimes à Isola 2000 en 2014, dans les Alpes-de-Haute-Provence à Thoard (2009), Jausiers et Selonnet (2010) et Allos (2013) (données CBNA).
Voir carte réactualisée n° 14.
Trifolium hybridum L. var. elegans (Savi) Boiss. (tome 3, pp. 345-350)
Ce taxon a été retrouvé dans trois départements où il n’avait pas été relevé de très longue date, le Lot-et-Garonne à Clermont-Dessous par Émilien Henry (CBNSA) le 19 juillet 2018, l’Ariège à Labatut, par Nicolas Leblond le 13 mai 2018 et en Lozère à Allenc sur le causse de Montbel et le valat du Rey (Andrieu et al., 2017).
En Lorraine, peu connu, il a été noté récemment dans tous les départements hormis la Meuse où les données restent historiques. En Mosellle et dans les Vosges, il a été recensé dans environ dix communes dans chaque département ; en Meurthe-et-Moselle, beaucoup plus rare il a été observé en 2016 à Onville, Bayonville-sur-Mad et Vathiménil, en 2017 à Crévic et en 2019 à Deneuvre.
Voir carte réactualisée n° 15.
Trifolium michelianum Savi (tome 3, pp. 351-354)
Ce trèfle a été découvert récemment dans deux communes du département de l’Orne où il était inconnu jusque là.
La première observation est à Buré en 2017 et la seconde par Joachim Cholet dans la vallée de l’Huisne à La Rouge en mai 2019.
Voir carte réactualisée n° 16.
Trifolium ornithopodioides Brot. (tome 3, pp. 355-359)
Dans l’Hérault, cette plante n’était connue que sur le plateau basaltique de Caux. Elle a été redécouverte récemment dans sa localité historique de Roquehaute pendant la session de la Société botanique de France dans le Languedoc en 2018 par Henri Michaud, Frédéric Andrieu et James Molina (CBNMed) (Andrieu et al., 2019).
Cette espèce discrète a également été observée dans le département des Bouches-du-Rhône, par Nicolas Borel, le 5 avril 2020 au lieu-dit les Frignans au sein de la réserve naturelle de Camargue, sur la commune des Saintes-Marie-de-la-Mer (comm. pers.). C’est la seconde observation de ce trèfle dans ce département, où il avait été retrouvé en 2014 par Damien Cohez au lieu-dit La Tour du Valat sur la commune d’Arles (Coulot et al., 2017).
Trifolium cernuum Brot. (tome 3, pp. 361-364)
Dans les deuxièmes compléments à la monographie, nous mentionnions la découverte de ce trèfle très rare dans le sud du Finistère, sur la commune de Plomelin, le 7 juin 2017. À ce stade, nous la traitions comme occasionnelle récente, comme nous l’avions fait pour l’observation toute aussi inédite de la plante en 2010 dans le Loir-et-Cher. Gaëtan Masson (CBNB) nous indique (comm. pers.) que la plante a été réobservée en juin 2018 sur ce site (photo 3), mais pas au sein d’une prairie comme en 2017, plutôt sur le chemin sableux qui débouche sur la parcelle ; une vingtaine d’individus a été comptée. La plante semble bien implantée sur ce site et peut donc être considérée comme appartenant à la flore de ce département.
Par ailleurs, nous signalions (Coulot et al., 2017) l’observation de cette espèce dans le Lot-et-Garonne, par Émilien Henry à Pompiey. Il existait en fait une observation antérieure à celle-ci, par Jelle Hofstra à Feugarolles, le 3 mai 1988 ; Nicolas Leblond (comm. pers.) a pu contrôler l’identité de la plante en herbier.
Il est intéressant de signaler que des recherches ciblées de ce trèfle dans les départements de la Gironde et des Landes ont permis ces dernières années de le localiser dans environ une soixantaine de communes.
Voir carte réactualisée n° 17.
Trifolium nigrescens Viv. (tome 3, pp. 380-383)
Cette espèce essentiellement méditerranéenne remonte toutefois plus au nord, notamment dans le Massif central. Elle a été observée dans le sud-ouest de la France, dans le Lot-et-Garonne, à Damazan, aux environs de la gare de péage de l’A 62. Cette observation a été faite par Nicolas Leblond (CBNSA) en juin 2013, puis revue en juin 2017 (comm. pers.) ; nous considérerons cette plante comme occasionnelle, dans un milieu remanié.
Jamais citée dans le Vaucluse, il existe toutefois une donnée de 2009 à Mondragon au lieu-dit Les Entraigues (Jean-Pierre Roux et al.). Sa présence à proximité de l’autoroute A7 laisse pense qu’il ne pourrait être qu’occasionnel. Il doit être recherché dans ce département.
Voir carte réactualisée n° 18.
Trifolium echinatum M. Bieb. (tome 3, pp. 419-421)
Une population de ce trèfle, occasionnel en France au cours des xixe et xxe siècles, avait été observée en 2016 dans les Bouches-du-Rhône, sur la commune d’Éguilles, au lieu-dit « Surville », au nord-ouest d’Aix-en-Provence (Andrieu, 2016). Le 3 juin 2018, une autre station de la plante a été observée non loin de là par Franck le Driant et Lionel Ferrus (comm. pers.), au sud-est d’Aix, sur la commune de Rousset, près de la montagne Sainte-Victoire. Cette population très importante se situe dans une dépression humide (photo 4).
Ces deux observations proches l’une de l’autre montrent que l’espèce semble naturalisée autour d’Aix-en-Provence et il conviendrait de la rechercher en d’autres points. Il semble également pertinent d’intégrer cette espèce au sein de la flore de France et donc des clés d’identification du genre. Nous aurons l’occasion d’en proposer une clé actualisée.
Enfin, tout récemment en 2019, ce trèfle a également été observé à Marignane en plusieurs points d’une friche de la Z.A.C. des Florides (Henri Michaud et Yves Morvant).
Voir carte réactualisée n° 19.
Genre Medicago L. (tome 3, pp. 425-618)
Medicago sativa L. subsp. falcata (L.) Arcang. (tome 3, pp. 448-465)
Ce taxon n’avait pas été observé à Paris depuis de nombreuses décennies. Il y a été retrouvé dans le 12e arrondissement par Daniel le Quéré, qui nous signale l’observer dans le bois de Vincennes depuis 2007. Une petite population se maintient malgré les coupes régulières.
Voir carte réactualisée n° 20.
Medicago arborea L. (tome 3, pp. 474-477)
Cette espèce a été observée dans les Landes par Gilles Granereau (ONF) à Biscarosse-Plage en 2018. Il s’agissait d’un pied unique, manifestement échappé d’un jardin (Nicolas Leblond, comm. pers.). Il s’agira de surveiller l’éventuelle dispersion de la plante, qui affectionne particulièrement ces terrains sablonneux.
Voir carte réactualisée n° 21.
Medicago polymorpha L. (tome 3, pp. 490-498)
Cette espèce, rarement cultivée comme fourragère (cultivars Anglona et Santiago), vient de faire l’objet d’une étude italienne, publiée par des vétérinaires des universités de Pise et de Milan (Maestrini et al., 2020), qui ont mis en évidence le pouvoir de destruction in vitro de nombreux parasites intestinaux des ovins. Cette propriété, déjà mise en évidence de longue date chez le sainfoin cultivé, est due à la présence dans la plante de nombreuses saponines et prosapogénines (acide médicagénique, hédéragénine, acide zanhique, etc.), qui ont une action très importante contre les nématodes des genres Trichostrongylus Looss, Oesophagostomum Molin, Cooperia Ransom et surtout celui responsable d’une maladie fréquente des moutons et des chèvres, l’haemonchose, Haemonchus contortus Rudolphi. Ces propriétés, si elles sont confirmées par des essais in vivo, seront un argument supplémentaire pour la culture de M. polymorpha comme plante fourragère.
Dans cette même étude, il faut noter que M. sativa L. est également étudiée (cultivar Équipe), avec des résultats satisfaisants mais moindres que chez M. polymorpha.
Medicago coronata (L.) Bartal. (tome 3, pp. 499-502)
Cette espèce, très rare dans l’Hérault, a été trouvée depuis quelques années dans plusieurs localités nouvelles, à Saint-Martin-de-Londres, Mèze et Castries (Andrieu et al., 2019).
Medicago italica (Mill.) E.H.L. Krause (tome 3, pp. 524-530)
Cette espèce des sables atlantiques n’avait jamais été observée dans le département des Landes. C’est désormais le cas, la plante ayant été notée par Sylvain Bonifait (CBNSA) à Callen le 3 mai 2018 et par Josselin Dufay (CBNSA) à Biscarosse en 2019 (données CBNSA).
Voir carte réactualisée n° 22.
Medicago littoralis Rohde ex Loisel. (tome 3, pp. 531-535)
Cette espèce était inconnue de Normandie jusqu’à sa découverte dans la Manche en deux communes voisines, à Coudeville-sur-Mer sur les dunes et à Bricqueville-sur-Mer sur un parking en bord de mer. Ces deux observations inédites pour la région ont été faites le 14 juin 2017 par Thomas Bousquet et Juliette Waymel (CBNB).
L’année suivante, en juin 2018, elle a été observée par Lauriane Laville et Yann Mouchet dans les Prés de l’Olonde à Saint-Lô-d’Ourville.
Voir carte réactualisée n° 23.
Medicago scutellata (L.) Mill. (tome 3, pp. 544-547)
Cette espèce est en nette expansion dans la zone située entre Lunel et Sommières. Déjà connue de Vérargues (Entre-Vignes) et de Lunel, nous l’avons observée (PC) en de nombreuses stations en 2019 à Lunel en plusieurs points, à Boisseron et surtout dans le département du Gard, sur le commune de Sommières sur des talus au bord de la D 22 vers Galargues, à l’extrême limite du département. Elle avait été revue auparavant en 2008 par Mario Klesczewski sur la commune de Vauvert en Camargue gardoise (comm. pers.). Elle n’avait plus été observée dans ce département depuis cent-cinquante ans quand de Pouzolz la signalait à Aigues-Mortes en 1862.
La plante a également été retrouvée dans l’Hérault dans de nombreuses localités où elle était connue anciennement, à Agde, Villeveyrac, Lansargues, et découverte à Marseillan, Montagnac, Saint-Gély-du-Fesc et Jacou (Andrieu et al., 2019).
Voir carte réactualisée n° 24.
Medicago truncatula Gaertn. (tome 3, pp. 551-555)
Cette luzerne a été observée totalement en dehors de son aire, dans la Manche au lieu-dit Le haut de la Côte à Pontaubault par Timothée Prey en août 2018. Elle est suspectée d’avoir été semée sur cette station.
Voir carte réactualisée n° 25.
Medicago ciliaris (L.) All. (tome 3, pp. 562-566)
Cette espèce, de façon générale rare dans le bassin méditerranéen français, a été rarement observée dans le département de l’Aude. Une nouvelle station a été découverte, en milieu non salé, dans une friche au nord de l’étang de Roubia (Dominique Barreau, comm. pers.).
Medicago orbicularis (L.) Bartal. (tome 3, pp. 579-584)
Cette espèce, présente dans les deux tiers méridionaux de notre pays, ne semblait pas avoir été observée dans le département de Loire-Atlantique de longue date. Elle l’a été le 3 juin 2018 par Dominique Chaigneau, sur la commune de Saint-Herblon, sur les talus de la Loire près du château de Juigné dans le secteur où Lloyd l’avait citée autrefois. Elle a été revue, toujours autour d’Ancenis, à Saint-Géréon en 2020 (données CBNB).
Voir carte réactualisée n° 26.
Genre Trigonella L. (tome 3, pp. 619-712)
Deux études phylogénétiques récentes sur le genre Trigonella méritent d’être détaillées. La première a été publiée par une équipe indienne (Dangi et al., 2016). Elle est d’une importance majeure car 22 espèces y sont traitées, représentant onze des douze sections du genre, dans son acceptation traditionnelle (sans y intégrer les espèces du genre Melilotus Mill.). Cette étude repose sur l’analyse des fragments ITS et trnL-F de l’ADN de ces plantes.
Les conclusions sont de plusieurs ordres. Tout d’abord les auteurs n’ont intégré que deux espèces du genre Melilotus et ne veulent donc pas tirer d’enseignements nomenclaturaux de leurs résultats. Pour autant, comme de nombreux auteurs avant eux, ils valident l’extrême proximité entre les genres Trigonella et Melilotus. Cette analyse nous conforte donc sur notre position d’intégrer le deuxième genre au sein du premier dans le tome 3 publié en 2013.
Leurs autres conclusions concernent les divisions infragénériques de Trigonella. La plupart des sections du genre sont considérées comme monophylétiques (Samaroideae, Cylindricae, Uncinatae, Capitatae, Callicerates, Verae) mais certaines n’apparaissent pas l’être dans leur étude. C’est notamment le cas de la section Falcatulae, représentée en France par T. esculenta Willd., qui doit, selon les auteurs, être scindée en deux sections, l’une incluant T. balansae Boiss. & Reut. et T. inguina Delile et l’autre T. maritima Delile ex Poir., T. stellata Forssk. et T. suavissima Lindl. De même, la section Foenum-Graecum est paraphylétique, les deux sous-sections de Boissier, Biebersteinianae (incluant T. coerulescens (M. Bieb.) Halacsy) et Gladiatae (incluant toutes les autres espèces de la section) devant être séparées en deux sections dictinctes. Enfin, la section Erosae (avec T. schlumbergeri Boiss.) doit être intégrée dans la section Pectinatae (T. arabica Delile).
La deuxième étude, publiée par une équipe iranienne (Khandani et al., 2016) ne concerne que les « trigonelles médicaginoïdes », dont ils font une analyse phylogénétique reposant sur l’analyse du fragment ITS. Leurs résultats montrent une monophylie des espèces traitées et la cohérence des sections Bucerates et Lunatae, comme ceux des auteurs précédents (Bena, 2001 ; Dangi et al., 2016 ; etc.) mais ne donne pas de renseignements complémentaires sur le positionnement respectif des genres Trigonella et Medicago et surtout sur leurs périmètres respectifs.
Trigonella italica (L.) Coulot & Rabaute (tome 3, pp. 646-649)
Cette espèce, qui n’est probablement pas indigène en France, est naturalisée en de rares stations du sud de la France. Elle a été récoltée le 19 mai 2020 loin de là, dans le département de la Vendée, par Fabien Dortel (CBNB) et Eric Roirand (Conseil départemental de Vendée). La plante poussait sur la commune de Longeville-sur-Mer, au bord de la forêt de Longeville vers les Conches (F. Dortel, comm. pers.). Le milieu était assez perturbé près d’une zone de stationnement, avec d’autres plantes d’origine méditerranéenne comme Allium roseum L. et Rhagadiolus edulis Gaertn. Il s’agira de voir si la plante s’y maintient.
Voir carte réactualisée n° 27.
Trigonella wojciechowskii Coulot & Rabaute (tome 3, pp. 655-658)
Cette espèce a été découverte dans le département de la Dordogne le 31 mai 2018 par Nicolas Leblond, à Saint-Aubin-de-Nabirat, dans la vallée du Céou. La plante occupe un pied de falaise calcaire (site abritant également Clypeola jonthlaspi, espèce RR en Dordogne) et son indigénat ne semble pas douteux ; il s’agit probablement d’une station relique dans la continuité de celles déjà connues dans le Lot. Cette station est la plus occidentale de la plante en France.
Voir carte réactualisée n° 28.
Trigonella esculenta Willd. (tome 3, pp. 700-703)
Cette espèce continue son expansion dans l’est-Hérault, autour de la ville de Montpellier. Nous l’avons notée en avril et mai 2020 dans le nord de la ville à Jacou et à Clapiers, toujours dans des zones urbaines remaniées récemment, ainsi qu’à Saint-Jean-de-Fos, dans le centre Hérault. Elle s’étend manifestement à partir de graines rapportées avec de la terre, comme c’est le cas autour de Lunel.
Tribu des Fabeae L. (tome 4, pp. 28-33)
La mise en cause des contours et de la validité des genres appartenant à cette tribu est issue, commé évoqué dans le tome 4 de la monographie, d’une étude magistrale réalisée dans le cadre d’une collaboration entre différentes équipes de phylogénéticiens (Schaefer et al., 2012). Une autre étude phylogénétique sur la tribu a été publiée récemment, plus modeste, et concerne uniquement une dizaine d’espèces de Palestine (Omar et al., 2019). Même si leurs conclusions sont très discutables sur le plan nomenclatural, les résultats de leurs analyses sur fragment ITS (ITS-1 spacer, 5.8S rDNA et ITS-2 spacer) valident l’intégration nécessaire du genre Lens au sein du genre Vicia et du genre Pisum au sein du genre Lathyrus.
Genre Lathyrus L. (tome 4, pp. 34-200)
Nous tenons à souligner deux publications très intéressantes concernant le genre Lathyrus.
La première est la thèse soutenue en 2013 à l’université de Cordoba, en Argentine (Chalup, 2013), qui consiste en une analyse morphologique et cytogénétique de la section Notholathyrus, qui correspond aux espèces sud-américaines du genre. Ce travail, désormais accessible en ligne, est particulièrement complet et détaillé, et permet d’appréhender les espèces de gesses sud-américaines.
La deuxième est une étude phylogénétique de la cinquantaine d’espèces de Lathyrus d’Iran, représentant la majorité des espèces du genre dans l’Ancien Monde (Oskoueiyan et al., 2014). Ce travail valide la vision moderne de la section Lathyrus, qui n’est monophylétique que si elle inclut les espèces de la section Cicercula, comme cela a déjà été démontré par Schaëfer et al. (2012). De même, les auteurs iraniens valident la monophylie des sections Lathyrostylis, Pratenses, Orobus, Linearicarpus (excl. L. angulatus) et Aphaca.
Quant aux sections Clymenum et Pisum, elles apparaissent comme très proches l’une de l’autre, ce qui ne permet pas d’intégrer l’une sans l’autre au sein du genre Lathyrus. La position retenue par certains référentiels comme TAXREF, consistant à ne retenir que deux genres (Lathyrus et Pisum) nous semble incohérente, dans la mesure où les trois espèces de la section Clymenum (L. clymenum, L. ochrus et L. gloeospermus) forment un ensemble monophylétique avec les pois. En conclusion, soit il convient de considérer le genre Lathyrus au sens large, ce qui reste notre approche, soit, pour ceux qui souhaitent absolument conserver le genre Pisum, il faut également réhabiliter le genre Clymenum ou intégrer ses trois espèces au sein du genre Pisum.
Nous restons donc, à la lecture des arbres phylogénétiques proposés, sur notre position d’inclure les genres Clymenum et Pisum au sein de Lathyrus, le nom valide de Pisum sativum L. restant selon nous L. oleraceus Lam.
Lathyrus cicera L. (tome 4, pp. 55-57)
Cette espèce méditerranéenne n’avait pas été observée dans le département de la Vienne depuis les mentions de Souché (1901), à Saint-Rémy, Saint-Genest, Chapelle-Moulière et Romagne. Elle a été revue à Saint-Laon en 2012 (Antoine Chastenet) puis en 2014 (Patrick Gatignol) (comm. pers.), et revue ensuite tous les ans.
De même, une deuxième station de cette gesse a été trouvée dans le Lot-et-Garonne, à Penne-d’Agenais sur un talus très sec du plateau de Saint-Michel, par Nicolas Leblond, le 19 mai 2017 (comm. pers.) ; la plante poussait en compagnie de Lathyrus annuus L., également fort rare dans le département.
Voir carte réactualisée n° 29.
Lathyrus sativus L. (tome 4, pp. 64-66)
Une synthèse des propriétés pharmacologiques et toxiques de la gesse cultivée a été publiée récemment par une équipe irakienne (Al-Snafi, 2019). Elles sont portées par de nombreuses molécules chimiques appartenant à différentes familles, comme des alcaloïdes, flavonoïdes, terpènes, phénols, etc.
L’auteur présente une revue bibliographique complète des activités de la plante, mises en évidence in vitro, et dont certaines sont utilisées en médecine traditionnelle : anti-oxydante, analgésique, antipyrétique, hypoglycémiante et cardioprotectrice. Le lathyrisme, intoxication due à l’acide 3-N-oxalyl-L-2,3-diaminopropanoïque, ou β-ODAP, est également présenté, avec une bibliographie actualisée.
Lathyrus tuberosus L. (tome 4, pp. 74-77)
Cette espèce en raréfaction, en particulier dans les départements du pourtour méditerranéen, a été retrouvée récemment en plusieurs stations de l’Aude, à Narbonne (Grand Castelou), Salles-d’Aude, Bize-Minervois (Lécugne), Blomac (étang de Marseillette), Puichéric (rigole), Malepère (versant nord et plaine) avec Montréal, Alzonne, Villeséquelande, Pezens, Lavalette et Cépie (Dominique Barreau, comm. pers.).
Lathyrus alpestris (Waldst. & Kit.) Kit. subsp. vivantii (P. Monts.) Coulot & Rabaute (tome 4, pp. 95-99)
Cet endémique ouest-pyrénéen est connu des vallées d’Ossau, d’Aspe et dans le massif de l’Anie qui les domine. Il a été observé récemment plus à l’ouest, dans le Pays basque, plus exactement dans le pays de Cize, au sud de Saint-Jean-Pied-de-Port. La plante a été découverte le 18 juillet 2018 par Thomas Sanz en différents points, sur les communes de Saint-Michel (entre Erreculus et Etchebestéa) et d’Uhart-Cize (route de Sallaénéa, flanc nord-ouest du Coscohandy). Les plantes ont été revues et leur identification confirmée les jours suivants par Christophe Bergès (CBNPMP), Nils Servientis (Biotope) et Gilles Corriol (CBNPMP).
Lathyrus bauhini Genty (tome 4, pp. 137-141)
L’observation de cette gesse faite par Martine Garcia au col de Menée, sur la commune du Percy, dans l’Isère, est incontestablement une des découvertes les plus importantes concernant la famille des Fabacées en France depuis plusieurs années. Cette plante, très rare et à aire morcelée, compte donc désormais quatre zones de présence en France : la vallée du Drugeon en Franche-Comté, la Lozère, les vallées d’Ossau et d’Aspe dans les Pyrénées occidentales et désormais cette station située dans le Parc naturel régional du Vercors. La population iséroise est très localisée, à environ 1 450 m d’altitude, dans une prairie d’alpage héliophile, orientée nord-nord-est, sur calcaire. Elle est en ce sens conforme aux milieux où la plante est rencontrée en Lozère et dans les Pyrénées. C’est le 11 juillet 2019 que cette population a été découverte pour la première fois. Elle comptait alors environ une dizaine de pieds. Le 21 juin 2020, une nouvelle observation a permis d’en compter une cinquantaine (photo 5), malheureusement broutés par les ovins neuf jours plus tard (Martine Garcia, comm. pers.).
Il nous semble impératif de mettre en œuvre des mesures de protection de cette population et d’inscrire cette espèce dans la prochaine version de la liste des végétaux protégés en région Auvergne-Rhône-Alpes. Nous rappelons d’ailleurs que L. bauhini n’est actuellement protégé en France qu’en région Franche-Comté, où sa présence est connue de longue date, mais elle ne l’est, en raison de sa découverte récente, ni en Nouvelle-Aquitaine, ni en Occitanie ni bien évidemment en Auvergne-Rhône-Alpes. Classée en « NT » (quasi menacée) dans la récente Liste rouge des espèces menacées en France (2018), nous pensons qu’une mesure de protection nationale de l’espèce, désormais présente dans quatre régions administratives, serait judicieuse.
En région Franche-Comté, un plan de protection de l’espèce très détaillé a été proposé par le Conservatoire botanique national de Franche-Comté en mars 2016 (Guyonneau, 2016) ; chaque population connue est analysée et des actions ciblées sont proposées pour chacune d’entre elles. Une analyse de même nature nous semble indispensable pour la population iséroise, en lien avec les autorités locales et le propriétaire de la parcelle. D’ores et déjà, un contact a été pris avec le maire du Percy début août 2020, qui s’avère très sensibilisé à la présence de la plante sur sa commune et à la nécessité de la protéger. Les premières mesures provisoires ont déjà été prises.
Voir carte réactualisée n° 30.
Lathyrus filiformis (Lam.) J. Gay (tome 4, pp. 142-144)
Cette espèce n’était connue du département de l’Hérault que du col de l’Homme-Mort, sur la commune de Joncels (découverte par Patrice Delaumone en 2003). Elle a été découverte dans une deuxième station héraultaise le 7 juin 2019 par Fabienne Niebler (comm. pers.) sur la commune d’Avène, à la limite avec le département de l’Aveyron.
Lathyrus pannonicus (Jacq.) Garcke var. asphodeloides (Gouan) Širj. (tome 4, pp. 145-154)
Dans notre traitement de ce taxon dans le tome 4, nous émettons le souhait de voir confirmer les observations qui lui sont rapportées dans les Alpes-de-Haute-Provence, en particulier à Valbelle, dans la vallée du Jabron. Franck Le Driant (comm. pers.) nous confirme avoir personnellement observé cette plante non loin de là, en plusieurs points de la montagne de Reynier, à Clamensane (entre Gap et Sisteron), au printemps 2018. Les milieux sont des pelouses sèches, sur calcaire, en clairière forestière sur crête, avec Dracocephalum austriacum L. Il s’agit donc bien de cet écovar des milieux secs.
Voir carte réactualisée n° 31.
Lathyrus sphaericus Retz. (tome 4, pp. 155-158)
Cette espèce discrète et souvent mal identifiée a été observée dans le département de l’Essonne en mai 2019 par Jean-Luc Tasset, à Étampes. La dernière mention de cette gesse dans le département datait de 1964 à Étrechy (L. Berrier, Naturalistes parisiens).
De même, elle a été retrouvée dans le département des Landes en trois points par Nicolas Leblond, à Escalans le 15 mai 2017, à Rimbez-et-Baudiets le 12 mai 2016 et à Baudignan le 17 mai 2016, toujours sur les pelouses de bords de route.
Voir carte réactualisée n° 32.
Lathyrus oleraceus Lam. (tome 4, pp. 180-188)
Le botaniste russe Oleg Kosterin, de l’université de Novossibirsk (Sibérie), auteur de plusieurs publications sur le pois, vient de publier une analyse détaillée de deux taxons orientaux, classiquement traités au rang subspécifique, subsp. transcaucasicum Makasheva de Transcaucasie et subsp. asiaticum Govorov d’Asie centrale. Arguments à la clé, notamment géographiques, il en fait des variétés, qu’il recombine (Kosterin, 2017).
Genre Vicia L. (tome 4, pp. 201-399)
Vicia lens (L.) Coss. & Germ. subsp. lamottei (Czefranova) H. Schaefer, Coulot & Rabaute (tome 4, pp. 218-228)
Ce taxon, trouvé dans la commune de Fitou (Aude) pour la première fois en 1998 (Bock et al., 2005), a été trouvé dans cette même commune en de nombreuses autres stations. Elle y est assez commune (Dominique Barreau, comm. pers.).
Vicia johannis Tamamsch. in Karjag. (tome 4, pp. 236-239)
Après vérification du « groupe V. narbonensis » dans l’Aude, cette espèce s’avère la plus fréquente et correspond à de nombreuses mentions de V. narbonensis ou de V. serratifolia, en particulier autour de Carcassonne, à Fraisse-des-Corbières, Ribaute, Laure-Minervois, Villarzel-Cabardès, Conques, Limoux, Alet et dans la Malepère à Caux-et-Sauzens, Lavalette, Montclar, Preixan, Rouffiac-d’Aude, Brugairolles et Cambieure (Dominique Barreau, comm. pers.).
Vicia narbonensis L. (tome 4, pp. 240-243)
La vérification des stations littorales du département de l’Aude et de la région de Carcassonne montre que beaucoup de stations audoises de l’espèce sont à rapporter à V. johannis. Finalement, les seules stations confirmées de V. narbonensis sont à Bize-Minervois, La Redorte, Barbaira et Fourtou (Dominique Barreau, comm. pers.).
Vicia serratifolia Jacq. (tome 4, pp. 244-247)
La confusion entre les trois taxons du « groupe V. narbonensis » nous a amenés à mettre en doute les données de V. serratifolia dans les Alpes-de-Haute-Provence (Gréoux-les-Bains, Manosque et Esparron-de-Verdon). Sans confirmer ces stations précises, nous avons confirmation par Franck Le Driant (comm. pers.) de la présence de cette espèce dans le département, à Mison, sur les rives du lac de Mison, à la limite des Hautes-Alpes. La population, qu’il a découverte en 2006, se maintient mais est très peu abondante.
De même, la vérification des stations du « groupe V. narbonensis » dans l’Aude montre que cette espèce n’a probablement qu’une seule station connue dans ce département, à Saint-Just-et-le-Bézu (Dominique Barreau, comm. pers.).
Voir carte réactualisée n° 33.
Vicia hybrida L. (tome 4, pp. 261-263)
Cette espèce est connue du nord-est et de l’ouest du département de l’Isère, au plateau de Crémieu, à Saint-Lattier et Sardieu. Elle a été récemment trouvée, le 4 mai 2018, par Julien Givord au nord-ouest de l’Isère, à la limite avec le Rhône, sur la commune de Satolas-et-Bonce, au lieu-dit le Rubiau.
Vicia pannonica Crantz subsp. pannonica (tome 4, pp. 273-277)
La vesce de Hongrie n’est pas connue de Bretagne, sous aucune de ces deux sous-espèces. La subsp. pannonica, occasionnelle en France, vient d’être observée dans le Morbihan, à Belle-Île sur la commune de Bangor, par Yves Brien le 5 juin 2020 (photo 6). La plante n’était présente qu’en quelques exemplaires dans une jachère. Son éventuel maintien devra y est surveillé.
De même, la plante a été observée au printemps 2020 par Romain Bouteloup et Jean-Marc Lewin dans le département des Pyrénées-Orientales, dans la commune de Latour-de-France (R. Bouteloup, comm. pers.).
Voir carte réactualisée n° 34.
Vicia cordata Hoppe in Sturm (tome 4, pp. 305-306)
La présence en France de ce taxon du groupe Vicia sativa nous a toujours semblé douteuse, même si de nombreux relevés le mentionnent. Caractérisé par son caryotype à 2n = 10, il correspond à des plantes combinant les deux critères de : 1) des dents du calice égalant voire dépassant le tube et 2) des fruits longs et étroits, de 40-60 × 5-6 mm, glabres et bruns à maturité.
Yvon Guillevic a récolté le 26 mai (en fleurs) puis le 3 juillet 2019 (en fruits) près du parking du port de Guidel, dans le Morbihan, une vesce qui nous semble conforme à Vicia cordata (photos 7 et 8). La plante présente en effet les deux critères ci-avant évoqués. De même elle a des feuilles obcordées, ce qui est une des caractéristiques non exclusives de cette espèce. L’idéal serait évidemment de caryotyper ces plantes, mais il semble qu’il s’agisse bien de V. cordata. En outre, Jean-Marc Tison (comm. pers.) nous informe l’avoir observée sur le littoral breton plus au nord, dans le Finistère à Roscoff et dans les Côtes-d’Armor à Bréhat et Paimpol. La plante est donc à rechercher sur le littoral atlantique.
En outre, la plante a été citée sur une dizaine de communes du littoral dans la Manche entre 2000 et 2017 (données CBNB). Ces observations doivent être confirmées.
Voir carte réactualisée n° 35.
Vicia cassubica L. (tome 4, pp. 326-329)
Cette espèce en régression en France n’avait pas été observée dans le département de la Dordogne de longue date, la dernière mention datant de 1849 (citée à Latour par Desmoulins, sur la commune de Montpon, sur une observation de Revel). Elle a été retrouvée par Raymond Lapeyre en 2012 au lieu-dit « Puy-Chalus », sur la commune de Montpon-Ménestérol (photo 9) ; elle y fleurit tous les ans depuis, la dernière observation datant de juin 2018 (Bernard Bédé, comm. pers.). Il s’agit très probablement de la même station que celle de Revel, retrouvée plus de cent-cinquante ans après son observation.
De même, cette vesce a été observée le 12 juin 2017 dans une deuxième station dans le Maine-et-Loire, sur la commune de Brézé, au pied de la butte de la Bournée, par Jean Croué, Laurent Daburon, Jean-Pierre le Roy, David Mercier, Pierre Zerna et Gaël le Roux (donnée CBNB).
Voir carte réactualisée n° 36.
Vicia dalmatica Kern. (tome 4, pp. 357-359)
Cette espèce, dont la naturalisation a été observée dans plusieurs départements français depuis une dizaine d’années, a été découverte dans la région des Hauts-de-France le 9 juin 2018 sur la commune de Talmontiers, dans l’Oise (Le Pézennec & Ott d’Estevou, 2018), près de la vallée de l’Epte. La plante est présente sur un talus routier sur près de 150 m de long, attestant d’une naturalisation datant manifestement de plusieurs années.
De même, la plante a été observée très récemment dans le département des Bouches-du-Rhône, par Daniel Pavon, le 20 mai 2020. Plus précisément un unique pied de la vesce a été observé sur la commune d’Aurons, près de Salon-de-Provence. Il était caractéristique de l’espèce, en forme de boule sans support. À l’analyse, cette espèce avait déjà été observée dans le département sur la commune voisine de Lambesc par Jean-Pierre Chabert en mai 2018, qui l’a revue en 2020 (comm. pers.). Il est fort probable que la plante observée à Aurons soit issue de celle de Lambesc. Dans les Bouches-du-Rhône, V. dalmatica avait été noté à Cassis en 1992, ainsi qu’à Aix-en-Provence, comme l’atteste une part d’herbier anonyme in MPU. La plante est donc bel et bien présente dans ce département, comme dans de nombreux départements du quart sud-est de la France. Ses observations récentes sont nombreuses et peuvent s’expliquer soit par sa méconnaissance par les botanistes, qui l’ont généralement relevée sous Vicia tenuifolia Roth, soit par sa naturalisation sporadique récente, généralement près des routes, soit par un indigénat de la plante. Nous ne sommes pas convaincus par cette troisième hypothèse et optons plutôt pour l’une des deux autres. Cette plante est en effet très commune en Méditerranée orientale et en zone irano-touranienne, mais très sporadique en Europe, notamment de l’Ouest.
Voir carte réactualisée n° 37.
Vicia incana Gouan (tome 4, pp. 360-362)
Nicolas Leblond (comm. pers.) a observé une touffe isolée de cette espèce dans le département des Landes, dans un champ à Herré le 9 mai 2017. Il s’agit probablement d’un pied accidentel.
Voir carte réactualisée n° 38.
Vicia tenuifolia Roth (tome 4, pp. 363-365)
Cette espèce existe bien en Dordogne, observée par Nicolas Leblond en situation d’ourlets calcicoles à Bouzic et à Florimont-Gaumier le 31 mai 2018. Ces deux communes caussenardes sont limitrophes du Lot.
Il l’a également observé dans le Lot-et-Garonne, à Villeneuve-sur-Lot, en lisière thermophile près de Peyrèles, le 2 juin 2017.
Cette espèce a probablement été sous-observée en région Nouvelle-Aquitaine et des mises à jour dans certains département semblent nécessaires (Landes et Vienne par exemple).
Voir carte réactualisée n° 39.
Vicia benghalensis L. (tome 4, pp. 367-370)
Dans la remarque 1 de la fiche de cette espèce, nous évoquons les variétés moins velues de la plante, voire celles à gousses glabrescentes. Elles sont appelées, selon les auteurs, var. perennis (DC.) Pau, var. heterocalyx (Maire) Hormat ou var. simulans (Maire) Hormat. Parfois citées de France, en Aquitaine, elles sont communes en Afrique du Nord. Dans une étude récente, Hormat et al. (2019) ont mis en évidence que, si V. benghalensis et V. villosa Roth ont bien un caryotype à 2n = 14, il y avait deux types caryologiques des plantes glabrescentes, certaines à 2n = 14 (var. simulans) et d’autres à 2n = 12 (var. heterocalyx). Il y a donc dans ce groupe des phénomènes de dysploïdie descendante, comme on peut l’observer dans le groupe voisin de V. cracca L.
En outre, cette espèce, de plus en plus fréquemment semée dans des mélanges fleuris à vocation ornementale, mais aussi comme engrais vert, a été découverte en Dordogne, en mélange avec Phacelia tanacetifolia Benth., par Bernard Bedé le 23 avril 2017. Le champ se trouvait dans un méandre de la rivière Isle dans la commune d’Antonne-et-Trigonant, au lieu-dit « Les Vergnes » (photo 10). En 2018 la plante n’était plus visible.
De même, ce taxon a été observé dans le département de la Vienne par Patrick Gatignol à La Croix Belle Fille, dans la commune d’Orches, le 1er avril 2018 (comm. pers.).
De façon générale, ces observations sporadiques de la vesce du Benghale méritent un suivi, pour voir si elle s’implante durablement après ces phases de culture.
Voir carte réactualisée n° 40.
Vicia dasycarpa Ten. (tome 4, pp. 371-374)
Cette espèce a été découverte par Patrick Gatignol (comm. pers.) dans le département des Deux-Sèvres, à Sainte-Radegonde, au lieu-dit « Les Pommiers », le 23 juin 2016. Elle n’avait jamais été relevée dans ce département.
Cette vesce est de découverte récente dans le département de la Manche où elle a été observée en 2018 à Agon-Coutainville puis en 2019 par Thomas Bousquet à la Cour de Bas à Bricqueville-la-Blouette et au Frot à Lingreville et par Nicolas Gerard à Lambreville.
Voir carte réactualisée n° 41.
Vicia elegantissima Shuttlew. ex Rouy (tome 4, pp. 375-378)
Dominique Barreau nous confirme (comm. pers.) que cette espèce très rare en France a été observée par son groupe dans la station historique de la carrière de Lians, à Treilles, dans l’Aude.
Voir carte réactualisée n° 42.
Vicia eriocarpa (Hausskn.) Halács. (tome 4, pp. 379-382)
Cette espèce est devenue très fréquente dans les départements du pourtour méditerranéen. Ses observations sont très nombreuses, dans l’Hérault, le Gard, l’Aude, etc. Sans négliger le fait que cette espèce était méconnue des botanistes français jusqu’à il y a une vingtaine d’années (Coulot et al., 2002), on peut raisonnablement penser qu’elle est en nette expansion en France.
Vicia villosa Roth (tome 4, pp. 391-394)
Cette vesce n’avait plus été signalée dans le département de l’Orne depuis des mentions à Camembert et à Fel en 1893. Elle vient d’être revue au lieu-dit Les vallées à Moulins-la-Marche par Joachim Cholet en juin 2019.
Voir carte réactualisée n° 43.
Genre Ervilia L. (tome 4, pp. 400-418)
Ervilia loiseleurii (M. Bieb.) H. Schaef., Coulot & Rabaute (tome 4, pp. 409-412)
Découverte dans l’Aude par Dominique Barreau, Clémentine Plassart et Gabriel Coirié en 2014 sur la commune de Vignevieille, la plante a été revue dans d’autres communes des Corbières centrales et occidentales, à Termes, Montjoi, Lanet, Fourtou, Soulatgé, Arquese et Missègre (Dominique Barreau, comm. pers.), prouvant que cette espèce est finalement peu rare, toujours en lisière de chênaies pubescentes.
Ervilia sativa Link (tome 4, pp. 413-415)
Cette espèce, dont la présence en France est limitée à des observations sporadiques consécutives à des cultures plus ou moins anciennes, a été observée en juin 2019 par Bénédicte Levrel (CEN de Normandie) puis par Bruno de Reviers de Mauny en juin 2020 en deux stations de la même localité, au Plessis-Hébert, dans l’Eure. La plante était dans une friche calcicole, en très faible effectif (Julien Buchet, comm. pers.).
De même, elle a été observée en bordure d’une moisson à Liausson, vers l’Assalis entre le village et le lac du Salagou par Frédéric Andrieu, Patrice Delaumone et Patrick Gatignol en 2017 (Andrieu et al., 2019).
Tribu des Genisteae (Bronn.) Dumort. (tome 4, pp. 437-853)
Genre Lupinus Desf. (tome 4, pp. 448-496)
Lupinus micranthus Guss. (tome 4, pp. 477-480)
Cette espèce rare en France n’était connue dans l’Aude qu’à Cuxac-d’Aude. Elle vient d’être découverte dans une deuxième station audoise, dans le massif de Fontfroide à Fontlaurier (commune de Narbonne) (Dominique Barreau, comm. pers.).
Genre Argyrolobium L. (tome 4, pp. 513-521)
Argyrolobium zanonii (Turra) P.W. Ball subsp. zanonii (tome 4, pp. 517-521)
Nous avons omis de citer la mention ancienne de cette espèce dans le département des Landes, à Hossegor, « sur les bords du chenal » par Camille Heubert en 1931 (Heubert, 1932). Son identification ne semble pas à mettre en doute car il mentionne « jolie papilionacée au feuillage argenté, probablement nouvelle pour les Landes ».
Voir carte réactualisée n° 44.
Genre Cytisus Desf. (tome 4, pp. 527-633)
Cytisus lotoides Pourr. (tome 4, pp. 568-573)
Cette espèce, souvent mal identifiée car confondue avec Cytisus hirsutus L., n’a apparemment jamais été observée dans le département du Tarn. Elle l’a été le 21 juin 2018 à Gaillac, au domaine viticole de Matus, dans des vignes non traitées (Gilles Corriol, CBNPMP).
Voir carte réactualisée n° 45.
Genre Laburnum Fabr. (tome 4, pp. 634-645)
Laburnum anagyroides Medik. subsp. anagyroides (tome 4, pp. 641-645)
Cette espèce est bien présente dans le département du Lot-et-Garonne, où elle est naturalisée çà et là, comme par exemple à Laugnac dans le bois du Roussel (Nicolas Leblond, 1er juin 2018).
Dans le sud-ouest, en général, sa présence dot être réévaluée.
Voir carte réactualisée n° 46.
Genre Genista L. (tome 4, pp. 649-811)
Genista canariensis L. (tome 4, pp. 661)
Cette plante, commercialisée dans les jardineries et pépinières sous différents noms, comme « Genista racemosa », « Cytisus Pollock » ou « Genista Pollock », a été trouvée naturalisée sur les alluvions du Rhône à Miribel, dans l’Ain, le 16 mai 2018 par Philippe Brachet. Cette observation, à proximité immédiate de Lyon, est probablement issue d’une plantation municipale même si, selon l’observateur, la station a une apparence semi-naturelle (Jean-Marc Tison, comm. pers.). C’est à notre connaissance la seule population naturalisée ou en cours de naturalisation de l’espèce en France.
Voir carte réactualisée n° 47.
Genista monspessulana (L.) L.A.S. Johnson (tome 4, pp. 680-684)
Dans les deuxièmes compléments de la monographie (Coulot et al., 2017), nous mentionnions une observation de la plante par Nicolas Leblond à Lafitole, en Haute-Garonne. Cette mention est erronée car la commune de Lafitole est dans les Hautes-Pyrénées. La plante est donc bien présente dans ce département, mais n’a jamais été observée en Haute-Garonne.
Voir carte réactualisée n° 48.
Genista pilosa L. subsp. cebennensis Coulot, Rabaute & J. Molina (tome 4, pp. 699-709)
Ce taxon, que nous avons décrit dans le cadre de notre travail monographique, correspond à des plantes dressées, robustes, dépassant fréquemment 70 cm de hauteur, dont on peut penser qu’elles sont polyploïdes (à confirmer). Initialement décrite des Cévennes siliceuses gardoises et lozériennes, cette sous-espèce s’avère être présente dans le département de l’Ardèche suite aux observations de Brice Chéron (Coulot et al., 2017). Nicolas Leblond a découvert en 2018 et revu en 2019 à Ambialet, à l’est d’Albi, dans la vallée du Tarn schisteuse, une population de plantes, dont nous avons observé les clichés de détails et d’ensemble (photo 11) ; elles semblent assez conformes à celles du Gard, à grandes fleurs et à port dressé, même si elles nous semblent moins densément fleuries. Il s’agit donc probablement de la même plante. Nous l’engloberons donc au sein de la subsp. cebennensis.
De même, Dominique Barreau (comm. pers.) nous indique que de nombreuses populations de la Montagne noire, depuis la vallée de l’Argent-Double jusqu’à celle de la Dure, se rapportent à ce taxon, avec des fleurs nettement plus grandes que le type et un port élevé, dépassant un mètre de hauteur.
De façon générale ce groupe de Genista pilosa dressés et pluriflores, qui englobe également des populations présentes dans la Haute-Marne (échantillons reçus de Jean-Marie Royer) et les plantes des Pyrénées-Orientales isolées au sein de la var. subalpina par Rouy, mériterait une analyse approfondie, avec comptage chromosomique voire traitements plus fins de séquences d’ADN.
Voir carte réactualisée n° 49.
Genista pulchella Vis. (tome 4, pp. 722-728)
Ce genêt n’était pas signalé dans la Montagne noire. Il y a été découvert au roc de l’Aigle, dans la commune de Cabrespine, dans l’Aude (Dominique Barreau, comm. pers.).
Genista aetnensis (Biv.) DC (tome 4, pp. 773-777)
Les populations corses de ce genêt, longtemps considéré comme un endémique sicilo-sarde naturalisé dans l’est de l’île de Beauté, ont la double particularité d’avoir une nombre chromosomique à 2n = 54 (pour 52 pour les populations italiennes ; Verlaque et al., 1992) et d’autre part des fleurs et des fruits plus courts chez les plantes corses (Tison & de Foucault, 2014 ; Coulot et al., 2016a). Alain Fridlender (2018), après une analyse comparée des populations italiennes et françaises, a statué sur le fait qu’il s’agirait d’un taxon paléoendémique autochtone en situation de refuge, pour lequel il a créé la subsp. fraisseorum Fridlender.
En outre, G. aetnensis a été observé en 2020 dans le Tarn-et-Garonne (Leblond et al., 2020), où il a été initialement planté pour ornementation en bord de l’autotoute A 62, mais s’y ressème. Sans parler de naturalisation effective, cette population mérite un suivi pour voir si la plante, qui fructifie, finit par présenter ici une petite population, la première en France.
Voir carte réactualisée n° 50.
Genista horrida (Vahl) DC. in Lam. & DC (tome 4, pp. 807-811)
Ce genêt extrêmement rare en France et en raréfaction vient d’être observé dans le département de l’Aude, en juin 2018, par David Richin. La plante se situe dans la région de la Piège, sur la commune de Ribouisse, au nord du pech de Faure. La plante est abondante et forme un tapis presque continu de 15 m sur 4 (Foucault (de) et al., 2019).
Cette station se situe entre les stations aveyronnaises et haut-garonnaises, et porte à sept le nombre de départements français où la plante est présente.
Voir carte réactualisée n° 51.
Genista tyrrhena Vals. subsp. pontiana Brullo & de Marco (tome 4, pp. 786-793)
Dans le tome 4 de la monographie, nous avons mis en évidence que le genêt des îles Sanguinaires n’était pas, comme jusqu’alors établi, Genista ephedroides DC. La comparaison des échantillons de la plante de Mezzu Mare avec les descriptions des taxons de la section Ephedrospartum Spach, et en particulier ceux récemment décrits (Bacchetta et al., 2011 ; Bacchetta et al., 2012), nous avait amenés à considérer que la plante corse ne correspondait à aucun taxon décrit, approche confirmée par Gianluiggi Bacchetta. Nous avons donc créé le binôme Genista mezzurarensis à cet effet.
Il s’avère que Guilhan Paradis a pu retrouver les personnes à l’origine de l’implantation volontaire de la plante sur l’îlot de Mezzu Mare, à partir d’échantillons de l’île de Ponza (Paradis et al., 2017 ; 2018). Le genêt des Sanguinaires n’est donc pas une espèce nouvelle, mais bel et bien G. tyrrhena subsp. pontiana, sous-espèce décrite en 2011 sur des échantillons des îles Pontines, au large de Naples.
Un des éléments nous ayant amenés à rejeter initialement cette identification est le fait que nos échantillons corses ont des étendards non apiculés (voir tome 4, photos 944 et 945), alors que ce critère est mis en avant par Bacchetta et al. comme caractéristique. Il convient donc de le pondérer.
Il reste toutefois à analyser plus précisement tous les pointages historiques rapportés à G. ephedroides en Corse ou présents dans les herbiers (Saint-Florent, Ghisonnacchia).
Genre Ulex L. (tome 4, pp. 817-853)
Ulex europaeus L. subsp. latebracteatus (Mariz) Rothm. (tome 4, pp. 823-831)
Une belle population de ce taxon existe en Gironde, sur la commune de Laruscade, où elle a été observée par Nicolas Leblond le 18 avril 2018 (comm. pers.). Il y a été introduit en revégétalisation des bords de la N 10 (route d’Angoulême) et se trouve aujourd’hui mélangé aux Ulex europaeus subsp. europaeus.
Plusieurs exemplaires ont été notés en Loire-Atlantique en 2019 par Dominique Chagneau aux abords de la déviation de Chaumes-en-Retz parmi les Ulex europaeus subsp. europaeus ainsi qu’au bord de la route bleue à la Bernerie-en-Retz .
Voir carte réactualisée n° 52.
Ulex breoganii (Castrov. & Valdés Bermejo) Castrov. & Valdés Bermejo (tome 4, pp. 833-835)
Cet ajonc mal connu et en cours de naturalisation en France a peu d’observations recensées en France. Déjà connu en Loire-Atlantique à Herbignac et Blain, il a été observé le 4 février 2018 par Guillaume Thomassin sur la commune de Sautron, au niveau du CEI de Nantes.
Ulex minor Roth (tome 4, pp. 841-845)
Cette espèce, absente des départements jouxtant la Méditerranée, vient d’être découverte dans le nord-ouest du département de l’Aude, à Issel, au lieu-dit « Les Mousques », en bord de route (Dominique Barreau, comm. pers.).
Voir carte réactualisée n° 53.
Abréviations
CBNA (Conservatoire botanique national alpin), CBNB (Conservatoire botanique national de Brest), CBNMC (Conservatoire botanique national du Massif central), CBNMed (Conservatoire botanique national méditerranéen de Porquerolles), CBNPMP (Conservatoire botanique national de Pyrénées et de Midi-Pyrénées), CBNSA (Conservatoire botanique national Sud-Atlantique).
Bibliographie
Al-Snafi A.-E., 2019. Chemical constituents and pharmacological effects of Lathyrus sativus – a review. IOSR Journal of pharmacology 9 (6) : 51-58.
Al-Snafi A.-E., 2020. The traditional uses, constituents and pharmacological effects of Ononis spinosa. IOSR Journal of pharmacology 10 (2) : 53-59.
Andrieu F., 2016. Découverte de Trifolium echinatum M. Bieb. (Fabaceae) dans les Bouches-du-Rhône (France). Le Monde des plantes 513 [2014] : 16-18.
Andrieu F., Coste J.-M. & Delaumone P., 2019. Contributions à la flore de l’Hérault n° 4. Bulletin de la Société d’horticulture et d’histoire naturelle de l’Hérault 158 : 51-68.
Bacchetta G., Brullo S., Cusma Velari T., Feoli Chiapella L. & Kosovel V., 2011. Taxonomic notes on the Genista ephedroides group (Fabaceae) from the Mediterranean area. Novon 21 : 4-19.
Bacchetta G., Brullo S., Cusma Velari T., Feoli Chiapella L. & Kosovel V., 2012. Analysis of the Genista ephedroides group (Fabaceae) based on karyological, molecular and morphological data. Caryologia 65 : 47-61.
Bena G., 2001. Molecular phylogeny supports the morphologically based taxonomic transfer of the “medicagoid” Trigonella species to the genus Medicago L. Plant systematics and evolution 229 : 217-236.
Bock B., Coulot P., Michaud H. & Van Es J., 2005. Lens lamottei Čzefranova, espèce méconnue de la Flore de France. Le Monde des plantes 486 : 17-20.
Boulay F., Bracquart P., de Fay E., Klein M. & Laugris H., 2017. Le coin des découvertes. Willemetia 94 : 3-4.
Bousquet T., 2019. Bilan des découvertes 2018 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 33 : 96-97.
Chagneau D., 2019. Bilan des découvertes 2018 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 33 : 90.
Chagneau D., 2020. Bilan des découvertes 2019 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 34 : 88.
Chagneau D. & Thomassin G., 2017. Observations récentes sur la répartition et l’écologie de Trifolium angulatum Waldst. & Kit. en France ; discussion sur son indigénat en Pays de la Loire. E.R.I.C.A. 31 : 31-38.
Chalup L., 2013. Análisis de la variabilidad del genoma cloroplástico y caracterización cromosómica mediante hibridación in situ fluorescente en especies sudamericanas del género Lathyrus L. (Sección Notolathyrus, Leguminosae). Thèse de doctorat en sciences biologiques, Instituto de Botánica del Nordeste, Université de Corboda (Argentine), 189 p.
Cholet J., 2020. Bilan des découvertes 2019 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 34 : 104.
Coulot P. & Rabaute Ph., 2002. Découverte de deux vesces (Vicia, Leguminosae) nouvelles pour le Languedoc-Roussillon et situation de ces espèces en France. Le Monde des plantes 477 : 7-13.
Coulot P. & Rabaute Ph., 2013. Monographie des Leguminosae de France. Tome 3 : Tribu des Trifolieae. Bulletin de la Société botanique du Centre-Ouest, NS, numéro spécial 40 : 1-760.
Coulot P. & Rabaute Ph., 2016a. Monographie des Leguminosae de France. Tome 4 : Tribus des Fabeae, des Cicereae et des Genisteae. Bulletin de la Société botanique du Centre-Ouest, NS, numéro spécial 46, 903 p.
Coulot P. & Rabaute Ph., 2016b. Premiers compléments à la Monographie des Leguminosae de France. Le Monde des plantes 513 [2014] : 3-15.
Coulot P. & Rabaute Ph., 2017. Deuxièmes compléments à la Monographie des Leguminosae de France. Le Monde des plantes 516 [2015] : 11-35.
Croze T., 2017. La bugrane pied-d’oiseau (Ononis ornithopodioides L., 1753) : une espèce nouvelle pour la flore du sud–est de la France nichée dans les corniches de la Riviera (Alpes-Maritimes). Bulletin de la Société linnéenne de Provence 68 : 101-110.
Dangi R., Tamhankar S., Choudhary R.-K. & Rao S., 2016. Molecular phylogenetics and systematics of Trigonella L. (Fabaceae) based on nuclear ribosomal ITS and chloroplast. Genetic resources and crop evolution 63 : 79-96.
Dortel F., 2019. Bilan des découvertes 2018 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 33 : 90..
Fayed A., El-Hadidy A., Faried A. & Olwey A., 2019. Taxonomic revision of the genus Ononis (Trifolieae, Fabaceae) in Egypt, with the first record of Ononis viscosa subsp. breviflora. Phytotaxa 408 (1) : 1-29.
Foucault (de) B., Richin L., Plassart C., Paris A. & Richin D., 2019. À propos de la découverte de Genista horrida dans l’Aude (France) : contribution à la connaissance de la végétation arbustive de la Piège. Bulletin de la Société botanique du Centre-Ouest 50 : 139-143.
Fridlender A., 2018. Observations sur le genêt de l’Etna en Corse : Genista aetnensis (Biv.) DC. subsp. fraisseorum subsp. nova. Bulletin mensuel de la Société linnéenne de Lyon 87 (3-4) : 73-95.
Fried G., Coulot P. & Rabaute Ph., 2020. Trifolium sylvaticum Gérard ex Loisel., espèce nouvelle pour la flore de l’Hérault. Carnets botaniques 8 : 1-5. https://doi.org/10.34971/y0t0-qn90
Geslin J., 2019 – Bilan des découvertes 2018 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 33 : 93.
Guillemot V., 2019 – Bilan des découvertes 2018 concernant la flore vasculaire du Massif armoricain et de ses marges. E.R.I.C.A. 33 : 87.
Guyonneau J., 2016. Préservation de Lathyrus bauhinii Genty en Franche-Comté. Proposition d’un plan de conservation. Conservatoire botanique national de Franche-Comté, Observatoire régional des invertébrés, direction régionale de l’Environnement, de l’Aménagement et du Logement de Bourgogne-Franche-Comté, Conseil régional de Bourgogne-Franche-Comté. 72 p.
Heubert C., 1932. Quelques observations sur la flore de Landes. Bulletin de la Société de Borda 56 (1) : 100-103.
Hormat K., Tahiri H., Guennoun N. & Gounssa A., 2019. Étude caryologique d’un taxon endémique du Maroc appartenant au genre Vicia (Leguminosae). Flora Mediterranea 29 : 329-333.
Kessler F., 2014. Sur l’observation récente de Trifolium angulatum Waldst. & Kit. dans le département de la Loire (42). Le Journal de botanique 67 : 3-8.
Khandani S., Mehregan I., Assadi M. & Nejadsattari T., 2016. Phylogenetic analysis of medicagoid Trigonella L. species based on ITS sequence data. Ambient Science 3 (2) : 35-39.
Kosterin O., 2017. On three cultivated subspecies of pea (Pisum sativum L.). Vavilov. Journal of genetics and breeding, 21 (6) : 694-700. https://doi.org/10.18699/VJ17.287
Le Pezennec M.-C. & Ott d’Estevou P., 2018. Premier signalement de Vicia dalmatica A. Kerner en région Hauts-de-France. Bulletin de la Société linnéenne Nord-Picardie 36 : 2-5.
Leblond N., Coulot P. & Rabaute Ph., 2020. Genista aetnensis (Biv.) DC., en cours de naturalisation dans le Tarn-et-Garonne ? Carnets botaniques 16 : 1-3. https://doi.org/10.34971/qc9k-1×58
Maestrini M., Tava A., Mancini S., Tedesco D. & Perrucci S., 2020. In vitro anthelmintic activity of saponins from Medicago spp. against sheep gastrointestinal nematodes. Molecules 25 (2), 242 ; https://doi.org/10.3390/molecules25020242
Muller S., 2016. Compléments 2015 à l’Atlas communal des plantes protégées de Lorraine. Willemetia 88 : 4-10.
Omar G., Saqer M. & Adwan G., 2019. Phylogenetic relationship among some species of the genera Lens, Vicia, Lathyrus and Pisum (Leguminosae) in Palestine. Jordan Journal of biological sciences 12 (3) : 289-296.
Oskoueiyan R., Kazempour Osaloo S. & Amirahmadi A., 2014. Molecular phylogeny of the genus Lathyrus (Fabaceae-Fabeae) based on cpDNA matK sequence in Iran. Iran Journal of biotechnology 12 (2) : e10315.
Paradis G. & Chiappe M., 2017. Origine du Genista de l’île Mezzu Mare (Corse) : une énigme résolue. Bulletin de la Société botanique du Centre-Ouest, NS, 48 : 143-146.
Paradis G., Appietto A. & Piazza C., 2018. Répartition en 2018 sur l’île Mezzu Mare (Corse) du genêt introduit Genista tyrrhena subsp. pontiana. Le Monde des plantes 517 [2015] : 3-7.
Pax N., 2015. Redécouverte du trèfle étalé (Trifolium patens Schreber) en Lorraine. Les Nouvelles Archives de la Flore jurassienne et du nord-est de la France 13 : 94-97.
Plassart C., Barreau D. & Andrieu F., 2016. Atlas de la flore patrimoniale de l’Aude. Biotope éditions, Méze, 432 p.
Samaropoulou S., Baliousis E. & Bareka P., 2019. Karyological study of eight Trifolium L. taxa from Greece. Botanika Chronika 22 : 159-170.
Schaefer H., Hechenleitner P., Santos-Guerra A., Menezes de Sequeira M., Pennington R., Kenicer G. & Carine M., 2012. Systematics, biogeography, and character evolution of the legume tribe Fabeae with special focus on the middle-Atlantic island lineages. BMC Evolutionary Biology 12 : 250.
Scoppola A., López Tirado J., Manzano Gutiérrez F. & Magrini S., 2018. The genus Trifolium (Fabaceae) in south Europe: a critical review on species richness and distribution. Nordic Journal of botany 36 (1-2) https://doi.org/10.1111/njb.01723
Shehata F. & Aqlan E., 2020. Embryo and seedling morphology of some Trifolium L. species (Fabaceae). Taeckholmia 40 : 64-84.
Stojković D., Dias M., Drakulić D., Barros L., Stevanović M., Ferreira I. & Soković M., 2020. Methanolic extract of the herb Ononis spinosa L. is an antifungal agent with no cytotoxicity to primary human cells. Pharmaceuticals 13, 78. https://doi.org/10.3390/ph13040078
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1196 p.
Union internationale pour la conservation de la nature, Fédération des conservatoires botaniques nationaux, Agence française pour la biodiversité & Muséum national d’histoire naturelle, 2018. La Liste rouge des espèces menacées en France. Flore vasculaire de France métropolitaine. https://uicn.fr/liste-rouge-flore/
Verlaque R., Contandriopoulos J. & Aboucaya A., 1992. IOPB Chromosme data 4. International Organisation of plant biosystematic, newsletter 18/19 : 9-10.
Xiong Y., Xiong X., He J., Yu Q., Zhao J., Lei X., Dong Z., Yang J., Peng Y., Zhang X. & Ma X., 2020. The complete chloroplast genome of two important annual clover species, Trifolium alexandrinum and T. resupinatum: genome structure, comparative analyses and phylogenetic relationships with relatives in Leguminosae. Plants 9 : 478. https://doi.org/10.3390/plants9040478
Remerciements
Nous remercions pour leurs contributions Frédéric Andrieu, Dominique Barreau, Bernard Bédé, Christophe Bergès, Nicolas Bianchin, Nicolas Borel, François Boulay, Thomas Bousquet, Romain Bouteloup, Philippe Brachet, Patrice Bracquart, Yves Brien, Julien Buchet, Jean-Pierre Chabert, Dominique Chagneau, Vincent Colasse, Gilles Corriol, Jean Croué, Thomas Croze, Laurent Daburon, Thibaud Daumal, Patrice Delaumone, Fabien Dortel, Franck Le Driant, Elisabeth de Fay, Lionel Ferrus, Bruno de Foucault, Guillaume Fried, Martine Garcia, Patrick Gatignol, Julien Geslin, Julien Givord, Gilles Granereau, Vincent Guillemot, Yvon Guillevic, Francis Kessler, Michel Klein, Mario Klesczewski, Oleg Kosterin, Raymond Lapeyre, Gérard Largier, Hélène Laugris, Nicolas Leblond, Bénédicte Levrel, William Lévy, Jean-Marc Lewin, Gaëtan Masson, Paul Mauguin, David Mercier, Henri Michaud, Yves Morvant, Yann Mouchet, Fabienne Niebler, Virgile Noble, Alpet Otogaz, Guilhan Paradis, Daniel Pavon, Nicolas Pax, Marie-Christine Le Pezennec, Daniel Le Quéré, Bruno de Reviers de Mauny, David Richin, Gabriel Rivière, Éric Roiran, Gaël le Roux, Jean-Pierre le Roy, Jean-Marie Royer, Thomas Sanz, Nadine Sauter, Anna Scoppola, Nils Servientis, Jean-Luc Tasset, Ludovic Thébault, Guillaume Thomassin, Jean-Marc Tison, Jérémie Van Es, Jean-Paul Vogin, Juliette Waymel et Pierre Zerna, et tout particulièrement Sophie Lafitte pour la réalisation des 53 cartes de répartition proposées dans cet article.