Redécouverte de Hennediella heimii (Hedw.) R.H. Zander en Pays de la Loire
Title
Rediscovery of Hennediella heimii (Hedw.) R.H. Zander in Pays de la Loire
Résumé
Une station d’Hennediella heimii, bryophyte annuelle, a été observée en Pays de la Loire pour la première fois depuis plus de soixante ans. Le présent article rassemble les éléments sur sa description, sa taxonomie, sa répartition et son écologie en France. Il avance également des menaces potentielles sur la station ligérienne.
Abstract
A station of Hennediella heimii, an annual bryophyte, has been observed in Pays de la Loire for the first time in over sixty years. This article summarizes its description, taxonomy, distribution and ecology in France. It also suggests potential threats to the Pays de la Loire station.
Introduction
Hennediella heimii (Hedw.) R.H. Zanderest est une des rares bryophytes se développant en milieu salé. Lors d’une excursion en 2024 sur la commune de Saint-Hilaire-de-Riez en Vendée (85), elle fut relevée sur la falaise de la Corniche vendéenne. Cette espèce n’avait plus été observée dans la région des Pays de la Loire depuis la première moitié du xxe siècle. Il s’agit actuellement de l’une des stations les plus méridionales du littoral atlantique en limite de son aire de répartition pour cette espèce boréo-tempérée.
1. Description de l’espèce
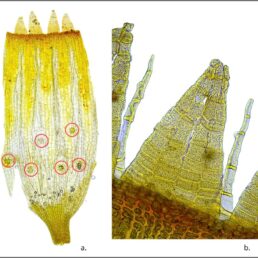
Hennediella heimii est une plante éphémère formant des colonies denses d’individus serrés les uns aux autres, aux teintes variant du vert au marron foncé à maturité (photo 1). Les plantes font une dizaine de millimètres de hauteur en intégrant les sporophytes.
Les feuilles sont oblongues à faiblement lancéolées et possèdent régulièrement des marges dentées à proximité de l’apex, ce qui la différencie d’autres espèces des genres Tortula ou Microbryum (Smith, 2004). La nervure est excurrente et forme un apex acuminé (planche 1). Les cellules du limbe sont finement papilleuses, carrées (excepté à la base où elles sont rectangulaires) et mesurent 13 à 20 µm de largeur. Il n’y a pas chez cette espèce de bandes marginales constituées de plusieurs rangées de cellules allongées, contrairement à Hennediella. stanfordensis et H. macrophylla (présentes toutes les deux au Royaume-Uni). Les capsules sont oblongues à cylindriques et portées par une soie de 5-7 mm de long. Lors de leur déhiscence, l’opercule reste attaché à la capsule via la columelle qui est persistante (photo 2). Il s’agit de l’un des critères diagnostics de l’espèce. La multiplication de l’espèce se fait par reproduction sexuée. Il n’y a pas de reproduction végétative observée.
2. Taxonomie
Hennediella heimii appartient à la famille des Pottiaceae, qui regroupe plus de 80 genres et environ 1 500 espèces décrites à travers le monde. Le genre Hennediella, décrit dans la seconde moitié du xixe comprend vingt espèces (Smith, 2004), dont trois sont présentes en Europe.
Hennediella heimii a d’abord été décrite sous le genre Gymnostomum en 1801 par Johan Hedwig (Hedwig, 1801) d’après un échantillon provenant d’Autriche. Le nom d’espèce fut donné en l’honneur de Heim, conseiller à la cour de Berlin. Elle fut rattachée plus tardivement au genre Desmatodon (Mitten, 1864).
Le nom de genre Hennediella a d’ailleurs subi quelques changements par le passé. En 1893, R. Brown créa un nouveau genre, Hennedia (Brown, 1893), afin de séparer les espèces appartenant initialement au genre Pottia, mais qui possédaient une coiffe élargie au sommet. Cependant, ce nom de genre fut jugé illégitime et remplacé par Hennediella, car le genre Hennedya était déjà attribué à une algue. En 1955, le genre Hennediella fut de nouveau basculé en Pottia, car la forme de la coiffe fut jugée peu différente des Pottia (Blockell, 1990). Enfin, le genre Hennediella fut réhabilité en 1989 par R. Zander, justifiant de la distinction de combinaison de caractères du gamétophyte et du sporophyte (Zander, 1989). Ce n’est qu’en 1993, avec le traitement important de la famille des Pottiaceae par R. Zander à travers l’ouvrage Genera of the Pottiaceae: mosses of harsh environments (Zander, 1993) que l’espèce fut rattachée au genre Hennediella.
3. Chorologie
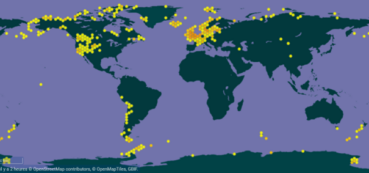
Hennediella heimii est une espèce circumpolaire boréo-tempérée (Ćosić et al., 2022). Son aire de répartition mondiale s’étend principalement en Europe et sur l’ouest du continent américain pour l’hémisphère nord et en Antarctique, en Nouvelle-Zélande et sur la côte ouest du Chili pour l’hémisphère sud. Quelques données éparses sont notées en Asie et sur la côte nord de la Russie (carte 1).
En Europe, elle est présente de la France jusqu’à l’Islande et au nord de la Norvège dans l’archipel du Svalbard, en passant par les Pays-Bas et les îles Britanniques.
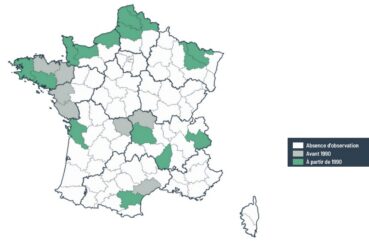
Son aire de répartition en France comprend quinze départements selon les connaissances actuelles (carte 2). Les stations recensées sont principalement localisées sur les secteurs littoraux, hormis quelques stations intérieures situées en Meurthe-et-Moselle, en Moselle, en Puy-de-Dôme, en Ardèche et en Savoie. L’espèce a été recensée dans un seul département méditerranéen depuis 1990.
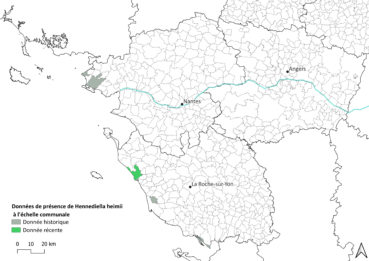
Sur le littoral atlantique, l’espèce est connue de quelques dizaines de stations en région Bretagne et une en Charente-Maritime. Pour les Pays de la Loire, quatre données historiques ont été recensées entre 1876 et 1958 sur le littoral (carte 3), à Guérande et Piriac-sur-Mer en Loire-Atlantique (Gaume, 1955) et sur les communes de l’Aiguillon-sur-Mer et l’Île-d’Olonne pour la Vendée (Charrier, 1958). En Charente-Maritime, quelques stations historiques sont connues à proximité de l’île d’Oléron, dont la dernière observation date de 2010 sur cette île (Émilie Bernard, comm. pers).
4. Écologie
Hennediella heimii est une espèce halophile (Blockeel et al., 2014). Il s’agit de la bryophyte la plus caractéristique des marais salants, où elle pousse dans les pelouses pâturées par des ovins, sur les sentiers et les sols perturbés, abritant une végétation rase et d’espèces pionnières, dans les niveaux supérieurs des marais salants. Elle est décrite comme fréquente dans les îles Anglo-Saxonnes, dans les habitats côtiers, et occupe comme microhabitat les sols sableux et boueux entre les rochers sur les plages, au pied des falaises et des digues (Hodgetts et al., 2019).
Cette espèce est caractéristique de l’association du Pottietum heimii v. Hübschm. 1960, regroupant les communautés bryophytiques des sols rudéralisés et salés (Marstaller, 2006). Elle y côtoie des espèces de phanérogames relevant des alliances du Puccinellion maritimae W.F. Christ. 1927, végétation du schorre inférieur exposée à une immersion fréquente de l’eau de mer, et de l’Armerion maritimae Braun-Blanq. & De Leeuw 1936 des sols du schorre supérieur (Hübschmann, 1960). K. Dierssen (2001) décrit également le Pottietum heimii comme se développant dans les ouvertures des prés halophiles vivaces des Juncetea maritimae Tüxen & Oberd. 1958 ou bien du Saginion maritimae V. Westh., van Leeuwen & Adriani 1962, communautés vernales sur substrat décapé des contacts dunes/prés salés ou sur placages de sable grossier des falaises en zone d’embruns (de Foucault & Bioret, 2010).
En dehors du littoral, l’espèce a également été observée au sein de milieux salés continentaux comme des sources salées dans l’est de la France, à proximité de gisements de sel gemme en Lorraine (Mahévas et al., 2008) ou de sources thermales en Auvergne (Hugonnot & Ully, 2003). En Méditerranée, elle est présente dans des prés salés continentaux (Thouvenot & Hugonnot, 2019). Hennediella heimii se développe sur ces milieux loin du littoral en compagnie d’autres espèces halophiles comme Puccinellia distans ou Juncus gerardii. En Angleterre, elle a également pu être observée à l’intérieur des terres, sur les bords de routes régulièrement salées pour éviter la formation de verglas (Tipper, 2007).
Dans le Massif armoricain, Hennediella heimii est présente uniquement sur le littoral dans différents contextes halophiles. Dans les prés salés de Normandie occidentale, notamment en baie du Mont-Saint-Michel, elle est présente sur les secteurs plus ouverts du schorre et du très haut schorre, par les passages de moutons (T. Prey, comm. pers). Il s’agit principalement de secteurs inondés régulièrement lors des hautes mers de vive eau. Elle est notée dans le catalogue de Gaume comme assez rare et présente dans les prés salés au voisinage de la mer (Gaume, 1956).
Hennediella heimii est également observée en limite supérieure des prés salés, où les marées régulières se font moins sentir. Cette situation particulière a été mentionnée en Basse-Normandie et Bretagne : sur sentier côtier à Carantec dans le Finistère (De Zutterre et al., 2021), sur dunes et sables tassés à Saint-Honorine-des-Pertes dans le Calvados et Genêt dans la Manche (J. Lagrandie, comm. pers.), sur talus soumis aux embruns à Groix dans le Morbihan (Hugonnot, 2019), ainsi qu’à Roscoff, Finistère (Gaume, 1956), sur schiste dans le jardin du fort Sarah-Bernhardt à Belle-Île (Morbihan), proche de la falaise et aussi particulièrement soumis aux embruns (Bates, 1991), en pied de falaise à Landéda sur l’île Tariec dans le Finistère (J. Durfort, comm. pers.), sur les parties terreuses de rochers à Vains dans la Manche (J. Lagrandie, comm. pers.) et en marais salés (Gaume, 1956).
En Pays de la Loire, les données historiques mentionnent que l’espèce a été observée en contexte de marais salants, sur la côte. Peu d’informations précises sur l’écologie de l’espèce sont disponibles à l’échelle régionale.
6. La station découverte en Pays de la Loire
En mai 2024, à l’occasion d’une sortie de terrain, une station d’Hennediella heimii a été découverte sur le littoral de la commune de Saint-Hilaire-de-Riez en Vendée, et plus précisément sur la Corniche vendéenne. Il s’agit d’une falaise rocheuse constituée de micaschistes et de grès, surmontée par endroits d’une couche de sable dunaire (Ters & Viaud, 1987).
La station d’Hennediella heimii se trouve dans les anfractuosités de la falaise, à 1 m au-dessus du niveau de la mer, sur des secteurs où la falaise n’atteint pas plus de 3-4 m. Le substrat est constitué d’une fine couche de sable, apportée probablement par les embruns. Le cortège bryologique est particulièrement peu représenté avec la présence uniquement de deux espèces accompagnantes : Tortella flavovirens et Didymodon tophaceus. Il s’agit d’espèces halophiles adaptées aux conditions physico-chimiques locales, issues des embruns chargés de sel, qui constituent une forte contrainte pour le développement des bryophytes. La flore vasculaire se compose à cet endroit uniquement de Crithmum maritimum et de Limonium sp.
7. Menace et conservation
En Europe, Hennediella heimii a fait l’objet de bio-évaluations dans différents pays. Elle n’est pas considérée comme menacée à l’échelle européenne (Hodgetts et al., 2019), car elle semble commune sur le littoral de la moitié nord de la France à la Norvège. Elle est en revanche considérée comme éteinte en Espagne, en danger critique d’extinction en Slovaquie, en danger en Hongrie et en Serbie et vulnérable en Suisse (Hodgetts & Lockhart, 2020). Selon Ćosić et al. (2022), son habitat de prairie salée a été fortement détruit en Europe centrale, ce qui a entraîné une diminution des populations.
En France, l’espèce ne dispose pas de protection réglementaire au niveau national. Elle est protégée uniquement dans l’ancienne région Basse-Normandie (arrêté du 27 avril 1995 relatif à la liste des espèces végétales protégées en région Basse-Normandie complétant la liste nationale). Elle est considérée comme quasi menacée dans la Liste rouge des bryophytes de Lorraine (Mahévas et al., 2008), liste non validée par l’IUCN, et comme en danger sur la Liste rouge des bryophytes d’Auvergne (Hugonnot et al., 2014).
En contexte continental, son écologie spécifique la rend particulièrement sensible aux atteintes de son milieu. En effet, des modifications de l’alimentation en eau, de la salinité ou encore de l’ensoleillement sont susceptibles de modifier les paramètres abiotiques et de causer sa disparition.
Elle est décrite comme plus fréquente sur les côtes, ce qui la rend donc moins sensible dans ce contexte. Néanmoins, ces secteurs ont été particulièrement soumis à des pressions d’urbanisation et d’artificialisation, qui peuvent également être une menace. À plus long terme, la montée des eaux pourrait également être une cause de disparition de l’espèce.
En Pays de la Loire, la station découverte se trouve sur la Corniche vendéenne, une bande étroite de falaise faisant l’interface entre la mer et l’urbanisation de Saint-Hilaire-de-Riez. Elle se trouve au sein du site Natura 2000 « Marais breton, baie de Bourgneuf, île de Noirmoutier et forêt de Monts » (directive Habitats), du site classée Corniche vendéenne et dans une commune soumise à la Loi littoral. Les aménagements sur ce secteur sont donc particulièrement réduits et très réglementés.
La principale menace sur les populations locales d’Hennediella heimii est le risque d’érosion. En effet, la côte rocheuse de la Corniche vendéenne a reculé de dix mètres en 70 ans. Le recul brusque du trait de côte, notamment par l’effondrement de pans de falaise, pourrait à terme faire disparaître la station.
Une autre menace potentielle sur les populations locales d’Hennediella heimii est le réchauffement climatique. La station de Saint-Hilaire-de-Riez est la seconde station la plus au sud sur le littoral atlantique après celle de l’île d’Oléron (observation datant de 2010). Il est donc probable que l’absence de données plus méridionales soit liée aux conditions climatiques et notamment à la diminution du climat hyperocéanique caractérisé par des faibles écarts de températures annuels. Plusieurs autres espèces de bryophytes, à l’écologie différente, suivent ce patron de distribution, comme Schistidium maritimum ou Bryum sauteri, dont les dernières populations sur la façade atlantique se trouvent en Bretagne ou en Pays de la Loire. Du fait de leurs contraintes climatiques, elles seront dans le futur probablement sensibles au changement climatique qui pourra affecter leur aire de répartition et les faire régresser vers le nord.
8. Conclusion
La redécouverte d’Hennediella heimii en Pays de la Loire est une donnée intéressante, car elle permet de préciser le contexte dans lequel se développe une population frôlant sa limite sud de répartition. En effet, le cœur des populations se trouve sur les côtes des îles Anglo-Saxonnes et en Scandinavie. La station de Vendée est relativement isolée des stations bretonnes plus nombreuses et se trouve en situation précaire à cause de l’érosion. Une prospection plus fine du littoral vendéen et de Loire-Atlantique permettrait de mieux connaître sa répartition et de dresser un état des lieux des populations de l’espèce dans la région. Un suivi dans le temps donnera également des indications sur l’impact du changement climatique sur cette espèce boréo-tempérée et sur sa répartition globale sur le littoral atlantique.
Bibliographie
Bates J.-W., 1991. Bryoflora of Belle Île-en-Mer, Brittany France and comparison with the Channel Islands, UK. Cryptogamie, Bryologie Lichénologie 12 (2) : 111-148.
Blockeel T.L., 1990. The genus Hennediella Par., a note on the affinities of Tortula brevis Whitehouse & Newton and T. stanfordensis Steere. Journal of Bryology 16 : 187-192.
Brown R., 1893. Notes on a proposed new genus of New Zealand mosses; together with a description of three new species. Transactions and proceedings of the New Zealand Institute 25 : 285-287.
Charrier J., 1958. Catalogue des muscinées du département de la Vendée. Annales de la Société des sciences naturelles de la Charente-Maritime 4 (1) : 1-56.
Cosic M., Sabovljevic M., Papp B., Giba Z., Šinžar-Sekulić J., Sabovljevic A. & Vujicic M., 2022. Micropropagation of rare bryo-halophyte Hennediella heimii. Botanica Serbica 46 : 187-195.
De Zuttere P., Quéré P., Durfort J., Pohl H., 2001. Récoltes bryologiques en Bretagne, IV. Nowellia Bryologica 20-21 : 4-64.
Dierssen K., 2001. Distribution, ecological amplitude and phytosociological characterization of European bryophytes. Bryophytorum Bibliotheca, J. Cramer, 289 p.
Foucault B. (de) & Bioret F., 2010. Contribution au prodrome des végétations de France : les Saginetea maritimae Westhoff et al. 1962. Journal de botanique de la Société botanique de France 50 : 59-83.
Gaume R., 1955. Catalogue des Muscinées de Bretagne d’après les documents du Dr F. Camus. Revue bryologique et lichénologique 24 (1-2) : 1-28.
Hedwig J., 1801. Species Muscorum Frondosorum. Joannis Ambrosii Barthii, Lipsiae, vi + 352 p.
Hodgetts N. & Lockhart N., 2020. Checklist and country status of European bryophytes, update 2020. Irish Wildlife Manuals, National Parks and Wildlife Service, Department of Culture, Heritage and the Gaeltacht, Ireland, 123.
Hübschmann A. (von), 1960. Das Pottietum heimii, eine salzliebende Kleinmoosgesellschaft. Mitteilungen der Floristisch-soziologischen Arbeitsgemeinschaft, N. F., 8 : 124-126
Hugonnot V., 2019. Additions à la flore bryologique de l’île de Groix et de Belle-Île (Morbihan). Bulletin de la Société des sciences naturelles de l’ouest de la France 41 : 1.
Hugonnot V. & Celle J., 2014. Première liste rouge des mousses, hépatiques et anthocérotes d’Auvergne. Conservatoire botanique national du Massif central/Direction régionale de l’environnement, de l’aménagement et du logement Auvergne, 48 p.
Mahévas T., Werner J., Schneider C. & Schneider T., 2008. Liste rouge des Bryophytes de Lorraine (Anthocérotes, Hépatiques, Mousses). 62 pp.
Marstaller R., 2006. Syntaxonomischer Konspekt der Moosgesellschaften Europas und angrenzender Gebiete. Haussknechtia 13 : 1-192.
Mitten W., 1864. The « Bryologia » of the Survey of the 49th Parallel of Latitude. Journal of the Linnean Society, Botany, 8 : 12-55.
Smith A.-J.-E., 2004. The Moss Flora of Britain and Ireland, éd. 2. Cambridge University Press, 1012 p.
Ters M. & Viaud J.-M., 1987. Notice explicative de la carte géologique de la France (1/50000), feuille Saint-Gilles-Croix-de-Vie (560). BRGM, Orléans, 123 p.
Tipper C.T.W., 2007. Hennediella heimii growing by salted roads in Hertfordshire. Field Bryology 91 : 15-16.
Thouvenot L. & Hugonnot V., 2019. Hennediella heimii dans les prés salés continentaux de la Sals (Aude), Valeur patrimoniale et conservation. Mycologie et botanique 33 : 5-6.
Zander R.H., 1989. Seven new genera in Pottiaceae (Musci) and a lectotype for Syntrichia. Phytologia 65 : 424-436.
Zander R.H., 1993. Genera of the Pottiaceae: mosses of harsh environments. Bulletin of the Buffalo Society of Natural Sciences 32 : vi + 378 p.
Remerciements
Nous remercions Jean Le Bail et Sylvie Magnanon pour leur relecture, ainsi qu’Émilie Bernard, José Durfort, Julien Lagrandie et Timothée Prey pour leurs contributions.