Les populations de Lierre du massif des Calanques
Title
The ivy populations in the massif des Calanques
Résumé
Plusieurs populations de lierres poussent dans le massif karstique des Calanques, particulièrement aride et ensoleillé. Leurs habitats ne correspondent pas à celui habituellement décrit chez le lierre commun, Hedera helix subsp. helix. Nous avons identifié deux lignées de lierres aux niches écologiques originales. L’une d’elles pousse sur des parois d’ubac parfois salées, présentant une aridité estivale. L’autre lignée pousse dans des biotopes plus arides encore, des éboulis et des sommets de massif très exposés. Nous avons décrit les habitats de ces lierres, leurs originalités botaniques et certaines de leurs réponses adaptatives écophysiologiques. À partir de l’ensemble de ces observations, nous avons rattaché ces deux populations aux lignées méditerranéennes dont la taxonomie est mal établie et avons défini deux sous-espèces. Leur histoire évolutive pourrait leur conférer un statut de reliques, réfugiées dans le massif des Calanques lors des derniers épisodes froids du Quaternaire.
Abstract
Several ivy populations grow in the karst massif des Calanques, which is particularly arid and sunny. Their habitats do not match to that usually described for common ivy, Hedera helix subsp. helix. We have identified two ivy lineages living in particular niches.The first lineage occurs on salty shady cliffs undergoing summer aridity. The other one grows in more arid biotopes, scree and top of hills, under massive irradiation. We have described the habitats of these ivies, their botanical specificity and some of their ecophysiological adaptive responses. Based on all of these observations, we have linked both populations to the Mediterranean lineages whose taxonomy is still poorly established. We propose two new subspecies. Their evolutionary history could give them a relictual status, taking refuge in the massif des Calanques during the last episodes of the quaternary glaciation.
Le massif des Calanques pourrait-il abriter des lignées originales de lierre passées inaperçues, dont la taille de certains sujets peut atteindre celle d’un pachyderme ? Dans ce massif, certaines populations de lierres se sont installées sur des parois ombragées, d’autres sur des pentes ou des sommets fortement ensoleillés (photo 1). Ces derniers biotopes ne correspondent pas aux habitats du lierre commun, Hedera helix, au sens de son protologue linnéen (Linné, 1753), à savoir des arbres, talus ou murs en général ombragés frais et non salés.
Les lierres du massif des Calanques constituent-ils des taxons originaux du genre Hedera, espèces, sous espèces ou écotypes, adaptés à des biotopes originaux, réputés particulièrement arides, ensoleillés, ventés et parfois salés ? Pour répondre à cette question, l’étude porte sur les originalités morphologiques et écophysiologiques des populations de lierres rencontrées dans les habitats du massif, ainsi que sur leurs stratégies d’implantation dans des niches écologiques distinctes.
1. Étude botanique comparative
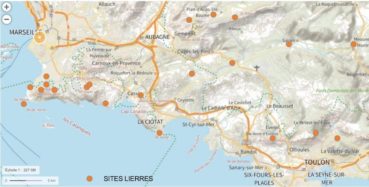
Quelles sont les espèces de lierres rencontrées entre Marseille et Toulon ? L’étude a commencé par l’inventaire des populations de lierres sauvages présents dans le massif des Calanques et dans les plaines ou collines situées entre Marseille et Toulon (carte 1). Dans le même temps, nous avons recensé les taxons de lierres introduits dans les zones urbaines et périurbaines de Marseille.
Quelles lignées de lierre observe-t-on dans le massif des Calanques et sur quel témoin local H. helix subsp. helix peut-on s’appuyer pour comparer les populations ? La hêtraie d’altitude, située sur l’ubac du massif de la Sainte-Baume, a permis d’observer à proximité de Marseille des lierres conformes au type et au concept linnéen du H. helix L. subsp. helix. Ils vivent entre 700 et 900 m d’altitude, dans un biotope montagnard, frais et humide, correspondant à des conditions mésophiles ; ces lierres d’altitude peuvent tenir lieu de témoin (photo 2). Dans le massif des Calanques, une population de lierre pousse sur des parois exposées au nord (ubac) ; leur port plaqué à la roche, une dépigmentation et l’absence de tropisme arboricole diffèrent du port aéré et de la pigmentation soutenue observables chez les lierres arboricoles de la Sainte-Baume (photo 3).
D’autres populations poussent sur des éboulis et sommets du massif des Calanques. Les lignées sur éboulis et sommets sont discrètes, bien que certains sujets puissent occuper plusieurs mètres carrés. Certains lierres peuvent atteindre 6 m de diamètre (photos 4 et 5) sans autre support que la roche et l’appui de leurs troncs. Leur physionomie évoluant en dômes ou coussins dépigmentés les apparente à d’autres espèces buissonnantes des garrigues (Phillyrea, Pistacia lentiscus…). La taille des feuilles n’est pas celle habituellement rencontrée chez les lierres. Pour toutes ces raisons, ils se fondent dans le paysage.
Chez ces deux lignées de lierres, le dôme est construit par le développement des rameaux fertiles à l’âge adulte. En effet, les lierres produisent deux types de rameaux (Metcalfe, 2005) :
- des rameaux végétatifs dits « juvéniles », installant le plant sur le support par leurs croissance et fixation ;
- des rameaux fertiles, dits « adultes », portant fleurs et fruits chez le sujet d’une dizaine d’années ou plus.
Il existe trois lignées de lierres dans le massif des Calanques occupant des biotopes différents. Pour les rattacher à un taxon, nous avons recherché quelles étaient les espèces de lierre présentes dans la région marseillaise.
Un vaste échantillonnage a permis d’identifier plusieurs taxons du genre Hedera. H. helix et H. algeriensis Hibberd sont présents et se distinguent par leurs feuilles (photo 6) ; ces deux espèces sont proposées à la vente en pépinière et introduites dans les parcs et jardins. C’est aussi le cas de H. hibernica (Kirchner) Bean, dont l’aire naturelle englobe les falaises et landes littorales atlantiques, de l’Irlande au Portugal (McAllister & Rutherford, 1990) ; sa bonne tolérance au sel suggère que les lierres littoraux du massif des Calanques pourraient lui être apparentés.
Le polymorphisme des feuilles dans le genre Hedera (photo 7) rend très difficile la distinction entre H. helix et H. hibernica. Il est alors nécessaire d’observer le trichome foliaire, caractère discriminant et héritable, pour distinguer les taxons dans le genre Hedera (Valcàrcel & Vargas, 2010).
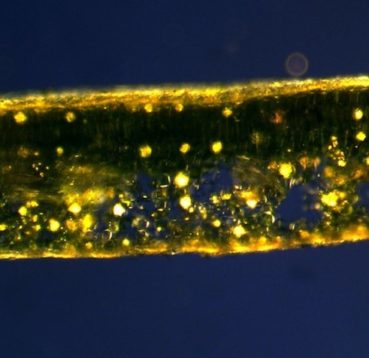
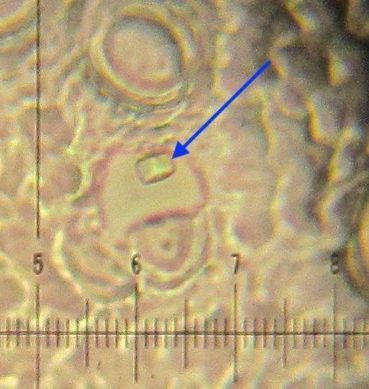
Quelles sont les informations fournies par les trichomes ? L’observation microscopique des poils des faces inférieures, à longue durée de vie, a été retenue pour les déterminations (annexe 1). Les trois espèces de pépinière sont présentes dans les parcs et jardins urbains et péri-urbains à Marseille. Un trichome étoilé multiangulé caractérise H. helix (photos 8 et 9), un trichome étoilé plan caractérise H. hibernica (McAllister & Rutherford, 1990) et un trichome écailleux caractérise H. algeriensis (planche 1). L’hybride interspécifique entre ces deux dernières espèces, H. ×sepulcralis (2015), dont le trichome est intermédiaire (McAllister & Marshall, 2017), pousse spontanément dans des friches, parcs et jardins.
L’observation des trichomes a permis d’écarter l’hypothèse d’une parenté entre les populations des lierres du massif des Calanques avec H. hibernica. Tous les lierres poussant dans ce massif portent un trichome étoilé multiangulé proche de celui de H. helix et ne sont donc pas apparentés à H. hibernica. Toutefois, l’observation de leur trichome a montré qu’il comportait une proportion variable de poils à rayons plats et hélicoïdaux (planche 1). Ce trichome hélicoïdal est un caractère original et sa distribution est étudiée dans la partie 2.
L’étude des trichomes a permis de répondre à deux autres questions :
- les espèces introduites peuvent-elles s’implanter en milieu naturel ? L’étude a été étendue aux populations de lierres situées en plaines et collines, entre Marseille et Toulon (Fontblanche, Grand Caunet, Méounes, Pas d’Ouillier, camp du Castellet, bassin du Beausset…) ; leurs biotopes sont regroupés sous le terme de « plaines », par opposition aux massifs d’altitudes plus élevées (carte 1) ; il est apparu que seules les lignées de helix sensu lato étaient capables de s’implanter en milieu «naturel » de basse Provence, dans les plaines comme dans le massif des Calanques ;
- les espèces introduites peuvent-elles s’hybrider avec les populations locales ? Les trois taxons allochtones rencontrés ( algeriensis, H. hibernica et leur hybride) sont tétraploïdes (4x = 96) et s’hybrident entre eux ; en revanche, H. helix est diploïde (2x = 48) (Ackerfield & Wen, 2002). En 2016, nous avons envoyé un échantillon de lierre poussant en limite de parc national à H. McAllister, spécialiste britannique du genre Hedera. Il a réalisé le caryotype et indiqué la formule 2x = 48 (Hugh McAllister, comm. pers.). Les populations locales de H. helix, « par chance », ne s’hybrident pas avec les espèces introduites. Les trichomes et le caryotype indiquent que les populations du massif des Calanques sont apparentées au groupe helix. Il y aurait donc un isolement génétique des populations locales du lierre commun, par rapport aux taxons introduits.
Le trichome et le caryotype ne sont pas les seuls critères taxonomiques dans le genre Hedera, ainsi le lierre macaronésien H. azorica porte aussi un trichome étoilé multiangulé et un caryotype 2x = 48 (Valcàrcel & Vargas, 2010). Aussi la recherche de caractères morphologiques discriminants, par rapport au témoin H. helix subsp. helix, a été étendue à d’autres caractères, en particulier chez les feuilles.
Les feuilles sont-elles différentes du témoin chez les lignées de lierres rencontrées ? L’observation histologique des feuilles peut-elle apporter des informations ? Les jeunes rameaux végétatifs sont la première cible de la sélection naturelle, lors de l’installation du plant ; nous avons donc privilégié l’étude de ces derniers. La microscopie optique a permis l’étude de deux caractères histologiques (photos 10 et 11).
- la surface stomatique corrélée avec le potentiel de transpiration (Sack et, 2003), mesurée à partir d’empreintes prises au vernis à ongle (annexe 3) ;
- l’épaisseur des limbes, dont l’accroissement peut marquer une réponse au sel (Waysel,1972).
Les moyennes et écarts types mesurés s’inscrivent dans les intervalles suivants : surface stomatique 8 % ± 2 % et épaisseur des limbes 250 μm ± 50 μm. Ces mesures ont toutefois montré que quelques sujets proches du littoral présentent une augmentation de la surface stomatique (11 à 13 %) et un épaississement des feuilles (300 à 400 μm) (Cayet & Coulomb, 2018). Ces mêmes caractères ont été mesurés chez des sujets H. helix poussant dans la forêt de l’université de Harvard (État de Washington, USA ; Sack et al., 2003). Les intervalles mesurés outre-Atlantique sont très proches des nôtres. L’histologie des feuilles montre une forte unité à travers les populations d’H. helix.
Qu’en est-il des mensurations des feuilles ? La croissance des feuilles est saisonnière dans le massif des Calanques, il en résulte une grande disparité de leur taille (photo 12). Les mesures portent sur l’ensemble des feuilles matures, repérables par un verdissement et la mise en place d’une cuticule, quelle que soit leur taille, l’objectif étant de réaliser une mesure qui intègre l’ensemble de la surface photosynthétique chez chaque sujet. Le témoin H. helix subsp helix est toujours la population de l’ubac du massif de la Sainte-Baume.
Quelles mensurations des feuilles retenir ? La mesure des surfaces (aires) des feuilles a été retenue comme signifiante. Les limbes s’inscrivent en général dans un triangle isocèle dont la hauteur (L) et la base (l) sont de cotes voisines. La surface du limbe (exprimée en mm²) est proche de la moitié de celle du carré qui l’inclut (photo 13). Des longueurs du limbe (L) et du pétiole (P) se déduit le rapport des longueurs, P/L exprimé en % (photo 14). Ce caractère ayant été utilisé pour la diagnose de la sous-espèce espagnole Hedera helix L subsp. rhizomatifera (McAllister et al., 1993), ce rapport a été retenu comme signifiant.
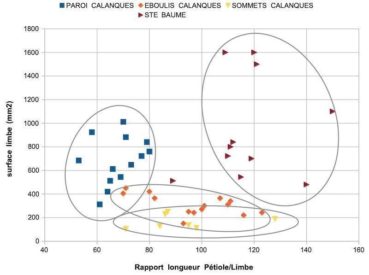
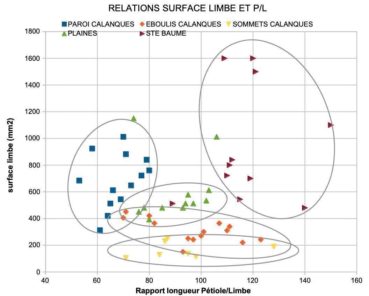
Le croisement des deux caractères permet de regrouper chaque lignée dans un nuage de points. La lecture des résultats donne une idée des caractères différents et partagés (figure 1). Des tests statistiques (Anova, Student) confirment ce que suggèrent les nuages de points : la probabilité que les lierres des différentes populations appartiennent à un même groupe est très faible, il en est de même pour les groupes de lierres pris deux à deux (annexe 2).
Qu’en est il ressorti ? Les trois lignées observées ont des surfaces de limbe très significativement plus petites que celles des lierres témoins de la Sainte-Baume ; le rapport P/L des lierres sur paroi du massif des Calanques est très significativement plus faible que celui des autres lignées ; les surfaces moyennes des limbes sont très significativement plus petites chez les lierres d’éboulis et sommets du massif des Calanques. Les populations sur sommets et éboulis, avec des limbes moyens de 1,5 à 3 cm², diffèrent des populations sur paroi, dont les limbes moyens mesurent de l’ordre de 7 cm². Les populations du massif des Calanques se répartissent en trois lignées à feuilles réduites.
Un échantillon de lierre prélevé à proximité du massif des Calanques et une photo de site confiés à H. MacAllister, en 2016, l’ont amené à publier un commentaire sur cette lignée qu’il a baptisée du nom de cultivar ‘Marseilleveyre’ (McAllister & Marshall, 2017). Ce choix d’intégrer ce lierre dans le champ horticole, et non botanique, tiendrait à la méconnaissance taxonomique actuelle des lignées méditerranéennes à petites feuilles (McAllister & Marshall, 2017). Une seule sous-espèce originaire du sud de l’Espagne, Hedera helix L. subsp. rhizomatifera McAllister, a été décrite (McAllister et al., 1993). Les populations de lierres du massif des Calanques semblent s’inscrire dans ces lignées méditerranéennes à petites feuilles, réputées mal décrites.
Les feuilles sont les organes les plus accessibles et les plus nombreux. Toutefois, existe-t-il des caractères anatomiques discriminants en dehors des feuilles ? Les observations de nombreux troncs, chez des sujets âgés de plusieurs décennies, probablement jusqu’à 80 ans, ont permis d’établir un comparatif qualitatif.
L’écorce du tronc de H. helix subsp. helix est fine et se fissure en motifs rectangulaires chez le sujet âgé (photo 15). Les sujets âgés du massif des Calanques développent une écorce subérifiée, à fissures présentant des rebords épais (photo 16). Le développement différencié du suber permet un diagnostic (photos 15 et 16).
Le développement du suber s’observe assez précocement chez les lierres du massif des Calanques (photo 17). Par ailleurs, les lierres de ce massif développent un appareil de fixation réduit. Le développement des crampons réalise rarement le manchon périphérique fréquemment observé chez les lierres mésophiles de la Sainte-Baume (photo 18). Les troncs comme les feuilles présentent donc des caractères originaux chez les lierres du massif des Calanques.
Au bilan, les lierres du massif des Calanques font partie des lignées méditerranéennes à petites feuilles, dont la taxonomie est mal établie. Si ce caractère foliaire est le plus évident, d’autres différences botaniques plus discrètes existent : la taille relative des pétioles et limbes, la dépigmentation des feuilles, ainsi que la production importante de suber mais faible des crampons par les troncs. Les contextes écologiques rencontrés sont éloignés des habitats habituels de H. helix subsp helix, avec une divergence des biotopes très importante entre la hêtraie fraîche de la Sainte-Baume et les éboulis brûlants du massif des Calanques. Dans le système taxonomique actuel, ces lierres sont supposés appartenir à une même espèce et sous espèce, H. helix subsp. helix. La compréhension des facteurs écologiques et des réponses adaptatives d’ordre écophysiologique peut-elle contribuer à reconsidérer la systématique de l’espèce helix ? Les lierres sur paroi semblent être ceux dont le biotope est le plus proche de celui des lierres mésophiles, ce sont donc les premiers abordés.
2. Écologie des lierres sur paroi nord des chaînes littorales
2.1. Les habitats des lierres sur paroi nord
La distribution des lierres de paroi est vaste en termes d’habitats. On les rencontre du niveau de la mer jusque sous les sommets. Quels sont les points communs et les différences de ces habitats de paroi d’ubac, présentés par altitude croissante ?
Paroi salée, proche du niveau de la mer (1 à 10 m)
Sur paroi calcaire, comme sur paroi de poudingue à La Ciotat (Villeneuve et al., 2018), des lierres poussent à un niveau proche du rivage (photos 19 et 20). Ces sites abrités du mistral permettent d’éviter les submersions répétées. Ces parois salées sont localement nues et l’albédo de l’eau de mer peut s’ajouter à celui des roches.
Parois des pieds de falaises soumises à influence maritime forte (50 à 100 m)
Près de Marseille, les zones salées de l’arrière-littoral, sur sol squelettique, hébergent une phrygane primaire à Thymelaea tartonraira (L.) All. et Plantago subulata L. et des pelouses thermophiles méditerranéennes. Ces formations ouvertes peu recouvrantes ont une dynamique quasi nulle (Bensettiti et al., 2005,1 : 283) du fait de l’action conjuguée du vent, du flux régulier d’embruns et d’un stress hydrique estival intense (Bensettiti et al., 2004a : 186). On retrouve quelques lierres en pied de falaise, à l’arrière du liseré de pelouse aride et halophile (photos 21 et 22). Les pieds de falaise (île Maïre) peuvent aussi héberger localement Suaeda vera G.F. Gmel. Ils forment un habitat de fourrés halophiles (photo 23) à Jacobaea maritima et Daucus carota L. subsp maritimus (Lam.) Batt. Les pieds de falaises salées sont colonisés par des ronces à feuilles plus ou moins caduques (Saména, mont Rose, Maïre). Ces fourrés halophiles (photo 24) n’ont pas non plus de dynamique significative (Bensettiti et al., 2004a : 237).
Sur l’île Maïre, la falaise exposée au nord est largement colonisée par une douzaine de lierres (photo 23). Il est à noter que, chez ce lierre insulaire, vitalité et développement semblent optimaux. Ces lierres occupent des surfaces dont les contours sont strictement définis, mais ménagent entre eux des aires nues. Le recouvrement du bas de falaise par les lierres (photo 25A) laisse la moitié du site nu sur l’île Maïre. Les zones nues correspondent aux 53% de la surface colorée en jaune (photo 25A’). Le pourcentage de recouvrement des lierres est de l’ordre de 50 %. Sur paroi, un évitement de compétition intra comme interspécifique nous a semblé patent. Cependant, quelques rares transgressives rupicoles littorales peuvent végéter çà et là dans les fissures sur les premiers mètres de la falaise (Crithmum maritimum, Limonium pseudominutum…) et quelques pieds Smilax aspera peuvent s’accrocher à la base des lierres (photo 26). Un noyau de plantes non spécifiques des milieux salés accompagne ces lierres : Centranthus ruber, Euphorbia characias, Smilax aspera, Asparagus acutifolius, Ruscus aculeatus, Rubia peregrina (photos 24 et 26). La base de falaise porte de nombreux lichens des zones aérohalines, Rocella phycopis Ach. (photo 27).
Parois de falaises à faibles altitudes (150 à 250 m)
Les pieds de falaises soumises à très faible salinité hébergent des habitats mésosciaphiles à ronce (Rubus ulmifolius Schott) assez pauvres en espèces. La dynamique des végétaux colonisant ces pieds de falaise tend à terme vers la constitution d’une fruticée à Viburnum tinus, Phillyrea media, Quercus ilex et Arbutus unedo. Les substrats propices au dynamisme de cette végétation sont les talus de calcaire argileux. Ces biotopes tendent à se fermer et les surfaces rocheuses nues se réduisent, tendant vers le tiers de la surface (photo 28 B). Le développement de la pineraie et d’une fruticée élevée en pied de falaise réduit progressivement la surface des roches nues au tiers de l’habitat initial du lierre (photo 28 B’).
Sous certains îlots de fruticées élevées, sempervirents et denses, l’humidité reste importante pendant la majeure partie de l’année. L’ambiance peut évoquer celle d’une laurisylve macaronésienne (Canaries, Açores, Madère). Ces pieds de falaise, à dynamique évoluant vers une pineraie à croissance rapide ou vers une yeuseraie de faible développement, ne constituent pas, à terme, un habitat optimal pour les lierres. La compétition exercée réduit la vitalité des lierres sur paroi.
Parois de pied de falaise suintante (étage mésoméditerranéen, 350 m)
À une certaine altitude, sans influence maritime forte, l’eau suintant en pied de falaise (mont Puget : Mestrallet) permet l’installation d’une pelouse fraîche à Sesleria caerulea (L.) Ard., maintenant à l’écart les arbustes comme Sorbus aria (L.) Crantz, Amelanchier ovalis Medik., peu susceptibles de supporter la saturation sur la durée (photos 29 et 30).
Hormis les lierres situés au niveau de la mer, ceux que nous avons présentés sont implantés à la limite d’une paroi de calcaire karstique et d’un talus de calcaire argileux. Le réseau karstique est présent à toutes les échelles de cavité : fissures, grottes… Si 90% des précipitations s’infiltrent (Bodelle & Margat, 1990), le drainage peut néanmoins être rapide, quelques millimètres à quelques centaines de mètres par heure (Tassy, 2012). Toutefois, l’eau percolant à travers le réseau karstique ou ruisselant le long des parois peut être en partie retenue par des calcaires argileux sous-jacents moins perméables. Ce type d’implantation en limite de couches à perméabilités différentes, formant un écran au drainage, voire des exutoires sur certains sites comme celui du Mestrallet, est répandu dans le massif des Calanques. En effet, deux strates importantes de calcaires argileux structurent le massif (Gieu et al, 2008 ; Villeneuve et al., 2018). De même certaines vires associées à de très petites strates de ce type peuvent porter des lierres.
Vires sur paroi (250 à 500 m)
Des lierres poussent sur les vires (saillies étroites le long des falaises) et les falaises elles-mêmes des chaînes littorales. Leur sol squelettique, à faible capacité hydrique, très pauvre, héberge des tonsures à Sedum sp., des chaméphytes nains et quelques thérophytes. Ces habitats n’ont pas de dynamique (Puget, Marseilleveyre). Ils sont à caractère permanent (Bensettiti et al., 2004b : 172) avec un très faible recouvrement (photo 31A) Sur les vires, particulièrement à hautes altitudes, le biotope se dénude considérablement, les zones nues atteignant les deux tiers de la surface (photo 31A’).
Au bilan, ces habitats sur parois claires d’ubac de chaînes littorales, à albédo significatif, peuvent sembler disparates mais une unité se dégage de ces environnements. Ils imposent des conditions stressantes aux compétitrices potentielles des lierres poussant sur ces parois, peu éclairées, arides, soumises à un vent fréquent et parfois salées. Peu d’espèces sont capables de coloniser ce type d’environnement. Les compagnes des lierres sont des chaméphytes à faible capacité de recouvrement. Cette végétation présente une dynamique faible à nulle. En revanche, les lierres peuvent occuper la moitié de la surface de ces parois nues, évitant une compétition interspécifique, tant pour la lumière que pour l’eau localement retenue par des substrats à perméabilité réduite.
Une originalité de l’habitat tient dans sa physionomie stable à long terme. Les sites où la dynamique du pied de falaise permet à la végétation d’évoluer vers une formation arborée imposent une compétition défavorable aux lierres sur paroi. En pied de paroi, du littoral jusque sous les sommets de massif, un même noyau peu spécifique de plantes accompagne les lierres : Jacobaea maritima, Smilax aspera, Rubus sp., Ruscus aculeatus, Euphorbia characias, Centranthus ruber, Asparagus acutifolius et Rubia peregrina. Il comporte des lianes xérophiles. Quelques particularités phytosociologiques et d’habitats de ces milieux extrêmes sont développées en annexe 11.
2.2. Écophysiologie des lierres sur paroi nord des chaînes littorales
Quels sont les principaux facteurs écologiques à l’œuvre, sur les parois d’ubac du massif des Calanques ? Quelles sont les réponses écophysiologiques des lierres qui s’y implantent ? Dans un massif où l’ensoleillement estival est très élevé, qu’en est-il des parois d’ubac ?
Le massif des Calanques étant un des sites les plus ensoleillés de France métropolitaine (Kessler & Chambraud, 1986), nous avons estimé ou mesuré les différents types de rayonnement reçus par les lierres sur paroi lors du solstice d’été (annexe 4). Une situation moyenne est retenue, une paroi exposée plein nord, subverticale, de pente 85° (photo 32). L’insolation directe est limitée aux début et fin de journée. Elle est absente le reste du temps, car une paroi élevée et exposée au nord masque le soleil, le lierre est donc à l’ombre (figure 2). Le rayonnement diffus venu du ciel s’ajoute toute la journée. L’albédo environnemental s’ajoute aux rayonnements venus du ciel. L’albédo est la fraction du rayonnement solaire incident, réfléchie par l’environnement. L’albédo moyen du calcaire a été estimé par les mesures à 33 % et celui de la végétation entre 20 et 25 % du rayonnement reçu (Campbell & Norman, 1998). L’albédo environnemental a donc une valeur de l’ordre de 30 %.
Quel est l’apport relatif des différents types de rayonnement ?
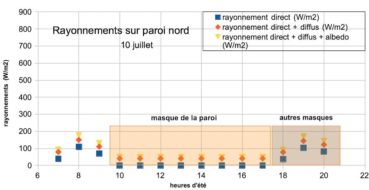
Le rayonnement direct reste modeste. Le maximum, environ 110 W/m², est atteint vers 8 h du matin. Il est masqué par la paroi la majeure partie de la journée. Le rayonnement diffus venu du ciel, de l’ordre de 40 W/m² par ciel clair, s’ajoute. La somme obtenue, 150 W/m², est faible en regard des 850 à 900 W/m² mesurés à la station météo de Marignane le même jour à 14 h (source infoclimat.fr). L’albédo environnemental apporte une à quelques dizaines de W/m² supplémentaires, apport modeste mais continu.
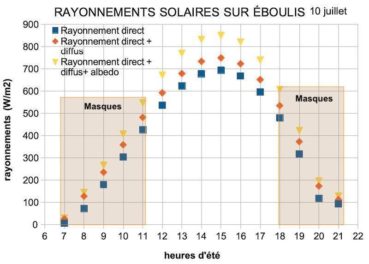
Dans les cirques, vallons ou sur paroi sinueuse, existent des masques supplémentaires, rocheux ou arborés qui cachent le soleil soit le matin, soit le soir (figure 3), soit aux deux périodes. Dans notre estimation finale du flux journalier, nous avons considéré qu’en moyenne ces masques coupaient l’ensoleillement environ 50 % du temps.
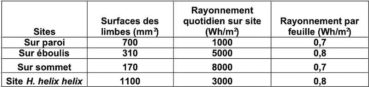
Tous les sites sont différents et cette moyenne cache des disparités (masques et albédo environnemental). Cependant, en moyenne, sur paroi, le rayonnement cumulé durant les heures d’éclairement nous paraît voisin de 1000 Wh/m², soit 1 kWh/m². Ce rayonnement quotidien reçu sur paroi est très faible, près de dix fois inférieur à celui qui est mesuré en station météo.
Quelles en sont les conséquences sur la photosynthèse de ces lierres ?
Certains lierres âgés d’environ soixante ans, de plus de 10 m de hauteur, ont produit des pousses de 15 à 20 cm/an et dépassent aujourd’hui la strate arborée (photo 33). Ils témoignent d’une photosynthèse active sur des décennies. Si le milieu se ferme sans que la croissance en hauteur sur paroi soit possible ou suffisante, des lierres sur paroi dépérissent (photo 34). Un minimum de lumière paraît nécessaire à leur photosynthèse.
Les données relatives à la photosynthèse (Metcalfe, 2005) chez H. helix indiquent (annexe 5) : rayonnement solaire total optimal 174 W/m², rayonnement solaire total minimal 14 W/m². Au printemps, l’optimum n’est atteint qu’une à deux heures dans la journée. En revanche l’éclairement reste au-dessus du minimum requis le reste de la journée, grâce au rayonnement diffus et à l’albédo (figure 3).
Par ailleurs, les limbes d’assez grande taille par rapport aux autres lignées du massif des Calanques (figure 1), pourraient favoriser l’absorption de la lumière. Les lierres sur paroi n’ont pas de tropisme arboricole, même dans un contexte où des arbres se trouvent à proximité. Il est possible que cet évitement soit lié à une trop faible luminosité sous couvert d’une canopée d’espèces à feuillage persistant (chêne vert, pin d’Alep…), de plus à proximité d’une paroi d’ubac. En outre, les rameaux qui atteignent une zone durablement ensoleillée dépigmentent leurs feuilles et stoppent leur croissance végétative. La puissance du rayonnement reçu doit probablement s’inscrire dans une fourchette assez étroite. Les conditions d’éclairement sur paroi nord permettent une photosynthèse prolongée, du printemps à l’automne.
La croissance des feuilles est saisonnière (photo 35). Il en résulte dans le massif des Calanques une forte disparité de leur taille : élevée au printemps et en automne, réduite à la fin de ces périodes, annonçant un arrêt de croissance. L’arrêt de croissance hivernal est lié aux basses températures. L’arrêt de croissance estival est tout autant marqué. Une mise au repos estival se met en place, impliquant un ralentissement puis l’arrêt de la photosynthèse et de la croissance associée.
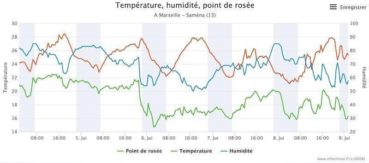
Les conditions thermiques expliquent-elles cet arrêt de croissance ? La majeure partie de la journée, parois et feuilles sont à l’ombre. Toutes les températures s’équilibrent alors au voisinage de celle de l’air. La température de l’air est relevée en station météorologique sous abri, par exemple à la station météorologique amateur de Saména (source infoclimat.fr) en bordure du massif (figure 4). En été, la température dépasse rarement 30 °C sur le littoral et reste assez élevée la nuit (figure 4). L’inertie thermique au cours du cycle nycthéméral est associée à la chaleur absorbée ou émise par la mer, tandis que les roches des parois d’ubac, durablement à l’ombre, absorbent peu de chaleur diurne. Ainsi, les parois peuvent être plus froides que l’air au printemps et en été du fait de leur inertie thermique. Il n’y a donc pas d’échauffement estival notable sur les parois d’ubac de chaîne littorale.
Qu’en est-il des facteurs hydriques ?
Du fait de la proximité de la mer, l’humidité relative reste assez élevée en ubac de chaîne littorale, de jour comme de nuit (figure 4). Le dessèchement de l’air ponctuel est peu susceptible de provoquer la déshydratation des feuilles. L’ouverture des stomates, nécessaire à la photosynthèse, devrait donc être rarement limitée par une forte chute d’hygrométrie, susceptible de déshydrater la feuille (Hopkins, 2003 ; Vialet-Chabrand, 2013). L’hygrométrie de l’air est peu susceptible de limiter la photosynthèse et la croissance des lierres.
L’eau du sol est-elle un facteur limitant chez ces lierres implantés sur paroi ?
L’implantation des lierres est associée au réseau karstique (photo 36). L’approvisionnement en eau de la partie émergée du karst dépend exclusivement des précipitations locales et présente une faible recharge estivale. Le karst du massif des Calanques est fossile et donc en partie colmaté (Blanc, 2012). Cette particularité permet de ralentir voire d’empêcher localement le drainage du massif. Le déficit hydrique en saison estivale est donc localement retardé. Les lierres de l’île Maïre (photo 37) sont implantés à la limite d’une paroi de calcaire karstique et d’un talus de calcaire argileux (Gieu, 2008). Ils bénéficient ainsi de l’écran peu perméable des calcaires argileux. L’enracinement des lierres de paroi se fait sur le mode chasmophytique (photo 38), permettant l’accès à l’eau retenue par les strates peu perméables ou par la fraction fine d’argiles et limons qui colmate les cavités karstiques. Les lierres s’implantent dans des zones où l’humidité du substrat est favorisée.
L’humidité estivale du substrat est-elle durable ?
La transpiration d’un lierre sur paroi littorale a été mesurée (annexe 6) pour apprécier le maintien d’un flux d’eau dans la plante. Ce flux d’eau est lui-même dépendant de l’hygrométrie du substrat (Granier, 2019 ; Koundouras et al. 1999).
La transpiration est modeste au printemps, ce qui correspond à environ la moitié de celle d’une mésophyte. Elle chute fortement au cours de l’été et devient très faible (figure 5). Cette chute est attribuable à la baisse d’hygrométrie du substrat. Une forte économie d’eau est ainsi réalisée, mais implique un fort ralentissement puis l’arrêt de la croissance estivale. La mise au repos estivale semble liée à la chute d’hygrométrie du substrat en pied de paroi. L’économie d’eau est d’autant plus nécessaire qu’une paroi d’ubac expose les lierres au mistral.
Comment les lierres sur paroi répondent-ils aux impacts mécaniques du vent ?
La station de Marignane a relevé 30 % d’heures ventées, dont 73 jours de vent violent par an sur la période de référence (Kessler & Chambraud, 1986). La baisse d’hygrométrie associée et la forte turbulence de l’air augmentent alors le risque de déshydratation.
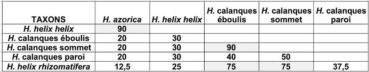
Les ports et les feuilles d’un lierre du massif de la Sainte-Baume et ceux d’un lierre du massif des Calanques diffèrent (photos 39 et 40). Les rameaux végétatifs des lierres du massif des Calanques sont plaqués contre la paroi et les rameaux fertiles, bien que perpendiculaires au support, conservent un port compact. Ce port est lié au raccourcissement des pétioles, déterminant le faible rapport des longueurs pétiole/limbe (figure 1). Par ailleurs, les lierres de paroi différencient en moyenne un à trois lobes, ceux d’éboulis trois à cinq lobes. Les lierres mésophiles de la Sainte-Baume développent en général les cinq lobes du type (tableau 1). Les lobes foliaires sont moins nombreux chez les lierres sur paroi. Par fort vent, une forme entière pourrait diminuer les risques de déchirure au niveau des sinus.
Les lobes foliaires sont clairement moins nombreux chez les lierres sur paroi. La forme triangulaire des limbes à lobulation réduite pourrait-elle participer à l’aérodynamisme (photo 40) ? Elle évoque en effet la forme d’un delta plane ou d’un cerf-volant. La morphologie du limbe favoriserait-elle l’aérodynamisme de la feuille ? Le raccourcissement du pétiole raccourcirait le bras de levier du limbe. Ces caractères morphologiques pourraient permettre d’amortir les fortes turbulences liées au vent et ainsi de diminuer le risque d’arrachement, parfois observé, des feuilles ou rameaux.
Le vent amenant un flux d’embruns aux faibles altitudes, quel est l’impact du sel sur les feuilles des lierres ?
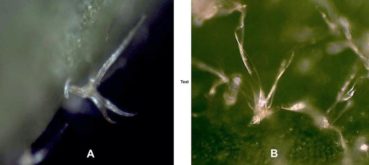
Le flux d’embruns dépose du sel sur l’épiderme des feuilles de lierre sur paroi littorale (photo 41). Or le chlorure de sodium est en général toxique s’il pénètre dans les tissus d’une glycophyte. L’observation du trichome de jeunes feuilles a montré que les poils interceptent les cristaux de sel (photo 42), ces derniers constituent donc un écran protecteur. Au cours de la croissance, la densité des poils diminue, mais la cuticule se différencie et réalise une couche protectrice étanche. La feuille se protège du flux de sel d’abord par son trichome, puis par sa cuticule.
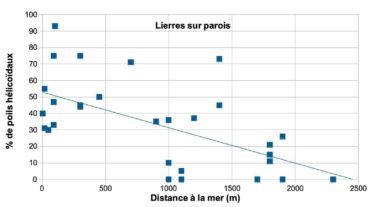
Les poils hélicoïdaux des lierres proches du littoral ont-ils une valeur adaptative ?
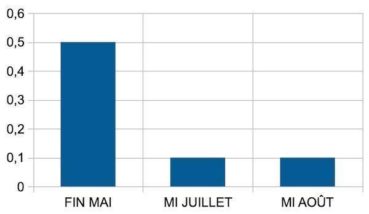
Les poils à rayons hélicoïdaux sont particulièrement fréquents chez les lierres sur paroi. La corrélation des fréquences des poils hélicoïdaux avec plusieurs facteurs a été recherchée. Les facteurs pris en compte sont l’exposition au vent, l’altitude et la distance à la mer (annexe 2 ; tableau 8). Les lierres sur paroi ont montré une corrélation linéaire négative significative (-0,6) avec la distance à la mer.
La fréquence des poils hélicoïdaux augmente avec la proximité de la mer (figure 6). L’expression du caractère « poil hélicoïdal » semble donc liée à l’exposition aux embruns.
La question de l’impact du sel sur le trichome et les feuilles, mais également son rôle dans la condensation sur les parois et les feuilles, amenant des apports hydriques supplémentaires, restent hypothétiques (annexe 7).
2.3. Les caractères des lierres sur paroi sont-ils héritables ?
Afin de vérifier la stabilité des caractères, après autorisation de prélèvement du parc national des Calanques, il a été possible de comparer un sujet de l’île Maïre et un témoin autochtone d’H. helix subsp. helix en conditions identiques de culture à Méounes (Var), sur une durée de trois années. Le tropisme envers les parois exposées au nord, la faible adhérence des crampons sur support vertical, les proportions P/L se maintiennent en culture. Cette première observation permet de penser que ces caractères sont héritables.
En revanche, la différenciation de poils hélicoïdaux n’a pas été observée. L’héritabilité de ce caractère n’est donc pas démontrée. Toutefois, son expression pourrait dépendre d’un environnement aéro halin.
2.4. Bilan
Quelles sont les originalités de la niche écologique des lierres sur paroi ? Les lierres sur paroi du massif des Calanques peuvent s’implanter du littoral jusque sous les sommets, à condition de trouver une niche qui satisfasse à une alimentation hydrique relativement prolongée en fin de printemps ; une insolation faible, mais un rayonnement diffus et un albédo significatifs générant une luminosité continue ; une forme d’homéothermie des températures estivales, dont l’amplitude thermique est lissée par l’inertie thermique de la mer et des parois ; une exposition aux vents violents, parfois au sel.
Quelles sont les réponses écophysiologiques des lierres sur paroi ? Une mise au repos estival face au déficit hydrique progressif du substrat, associée à une faible transpiration ; une surface de limbe réduite, toutefois suffisante pour permettre la photosynthèse sous faible éclairement ; une nette réduction de la longueur des pétioles et une possible adaptation de la géométrie des feuilles pour limiter la prise au vent et résister à l’arrachage par vents forts ; une halo-résistance dans les niches littorales, au sein desquelles la différenciation de poils hélicoïdaux semble induite.
Cette lignée de lierres n’est pas vraiment sciaphile, elle est plutôt photophobe, redoutant l’incidence solaire directe. Ce serait une lignée de cirques rocheux à rayonnements diffus et albédo environnemental dominants. Un néologisme pourrait désigner ce tropisme : cette lignée est albédophile. Les biotopes de paroi d’ubac montrent une certaine constance des conditions estivales et ces lierres vivent dans une ambiance fraîche par rapport à celle des autres biotopes du massif, néanmoins les contraintes écologiques sont fortes.
3. Écologie des lierres sur éboulis et sous sommet
3.1. Les habitats sur éboulis
Les lierres colonisent-ils n’importe quel éboulis ? L’implantation des lierres d’éboulis se fait en situation d’ubac, l’exposition moyenne est nord-ouest, sur des pentes de 15 à 35°, avec une moyenne de l’ordre de 25°. Les altitudes observées sont comprises entre 150 et 500 m, essentiellement celles de l’étage mésoméditerranéen. L’implantation n’est donc pas aléatoire.
La photo 1 montre que des grands lierres de paroi à l’ombre ainsi qu’un lierre d’éboulis exposé au soleil sont visibles dans des biotopes très différents. Ce lierre d’éboulis est agrandi sur la photo 43. Les éboulis d’ubac sont plus ou moins ouverts en fonction de la pente et des masques, mais la surface nue est toujours importante. Ces lierres se développent sur des éboulis non fixés et semblent rechercher ce type de milieu.
Quels avantages un éboulis peut-il procurer ? Il offre peu d’espèces compétitrices pour l’alimentation hydrique, très peu de phanérophytes s’implantent sur éboulis mobile. L’éboulis présente par ailleurs un fort albédo que cette lignée recherche manifestement.
Les cortèges floristiques associés aux lierres sont-ils originaux ? Les cortèges floristiques rencontrés sont ceux des éboulis calcaires de Provence de l’étage mésoméditerranéen (photos 44 à 47 ; Bensettiti et al., 2004b : 23). Toutefois, l’essentiel du noyau des indicatrices est également présent en pied de paroi, on retrouve ici Rubia peregrina, Centranthus ruber, Euphorbia characias, Smilax aspera et Rubus ulmifolius sur éboulis fixé.
Comment répondre à la fixation de l’éboulis et à la fermeture du milieu ? Les éboulis peu mobiles ou de bas de pente ont tendance à se fermer par leurs bordures. Des buissons, voire des pins peuvent s’implanter. L’ombre générée modifie alors le biotope (Bensettiti et al., 2004b).
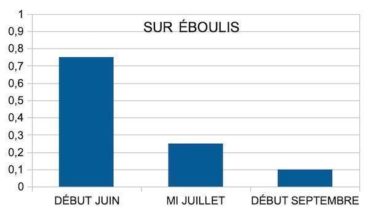
Lors de relevés en bas de vallon (face nord du massif de Marseilleveyre), nous avons observé que des espèces couvrantes avaient fixé les bordures d’éboulis. Les lierres poussant dans ces parties basses d’éboulis subissent manifestement cette concurrence. Quelques sujets assez vigoureux (photo 48) poussent au-dessus de coulées récentes de pierres très blanches, offrant un fort albédo. La recherche d’albédo reste une stratégie de survie, quand des masques s’ajoutent. Cette stratégie semble générale chez les plantes photophiles.
La fixation de l’éboulis n’est donc pas un handicap si l’albédo des pierres vient compenser localement les masques. Toutefois les sujets se développant dans ces niches intermédiaires, plus ombragées et peu mobiles, pourraient être hybridés avec Hedera helix subsp. helix (voir partie 4).
3.2. Les habitats des lierres de sommet
Les lierres de sommet occupent les zones sous-sommitales des chaînes littorales. Ils sont implantés sous des plateaux sommitaux, à des altitudes comprises entre 350 et 550 m. Ces habitats sont caractérisés par des vents violents, une forte insolation et un déficit hydrique estival. La plupart de ces lierres sont situés juste en dessous des sommets, sur une faible pente de l’ordre de 10° à 15°, inclinée vers le nord. Ils sont présents à l’étage mésoméditerranéen (photo 49) mais principalement à l’étage supraméditerranéen (photo 50). Leur habitat optimal est constitué par des lapiaz portant des pierriers peu ou pas mobiles, réalisant une « mosaïque de pierres et de calcaire lapiazé » à fort albédo.
Sur ce type d’habitat, à l’exception des lierres, le recouvrement des végétaux est faible. Peu de plantes sont susceptibles d’entrer en compétition avec les lierres, laissant le plus souvent de vastes zones nues représentant environ 50 % de la surface (photo 51). Molinier (1934) a montré que la dynamique vers la constitution d’une pineraie à pin d’Alep est compromise à cause du vent incessant. Elle n’est possible que vers le matorral de genévrier rouge (Bensettiti et al., 2005, 1 : 180).
Le territoire où le lierre des sommets montre un développement optimal est sans conteste le pierrier sous-sommital. Molinier (1934) avait individualisé cet espace sous le terme de faciès de hauteurs d’éboulis à Santolina (decumbens) et Laser de France, sans citer la présence du lierre. On retrouve les lierres en marge des fruticées à Phillyrea angustifolia. On les retrouve aussi en marge des dalles dures à genévriers rouges où des peuplements vigoureux de Juniperus phoenicea L. subsp. phoenicea forment de beaux matorrals (photo 51).
Les syntaxons auxquels le lierre de sommet participe sur biotopes sommitaux sont ceux à chaméphytes sociables héliophiles des landes épineuses supraméditerranéennes tels Genista lobelii DC., Santolina decumbens Mill. (photos 52 et 53) dans le massif des Calanques ou Hormathophylla spinosa (L.) P. Küpfer dans les massifs nord-toulonnais. Les coussins de ces landes hérisson ne couvrent jamais de grandes surfaces. Dans un environnement encore plus extrême (pierrier sous-sommital sans masque), le lierre est solitaire. Les autres compagnes sont Phillyrea angustifolia L., Festuca cinerea Vill. (RR) et les vivaces présentes sur éboulis comme Euphorbia characias, Centranthus ruber, Jacobaea cinerea et Laserpitium gallicum. Rubia peregrina, toujours discrète, est présente sous le couvert du dôme des lierres (photo 54).
Les lierres des sommets, placés dans une niche où les phanérophytes exercent sur eux une pression compétitive durable, perdent de leur vitalité et paraissent peu aptes à engager une compétition (photo 55). C’est particulièrement vrai à l’étage mésoméditerranéen, qui lui semble moins favorable.
Au bilan, les lierres sur éboulis habitent un biotope ensoleillé, à fort albédo, à renvoi de chaleur important, et mobile qui plus est. Peu d’espèces s’en accommodent. Des herbacées souples (Arrhenatherum elatius (L.) P. Beauv. ex J. Presl & C. Presl, et quelques Petrosedum résistant aux descentes de pierres s’y installent, mais très peu de ligneux en sont capables en dehors des bordures. Les lierres sont des lianes dont la structure confère aux buissons la souplesse nécessaire, face à cette adversité mécanique : « plier mais ne point rompre ».
L’habitat du lierre sous sommet s’intègre dans la mosaïque structurale, passant des pelouses aux fruticées (Bensettiti et al., 2005, 1 : 170). Les lierres sous-sommitaux occupent une niche écologique inhospitalière, caractérisée par de forts vents, une insolation estivale maximale, une aridité et des hivers frais à froids compte tenu de l’altitude.
Indéniablement, le biotope qui convient le mieux aux lierres des sommets est le pierrier sous-sommital peu mobile. Dans ces habitats relativement permanents, aucune formation ne parvient vraiment à recouvrir des aires aussi contraintes. Le développement des lierres peut être très important et peu de phanérophytes y manifestent une telle vitalité. Les lierres sous sommet impriment ainsi leur physionomie au paysage en formant, avec les quelques espèces qui l’accompagnent, une « fruticée » supraméditerranéenne. Entre ce biotope et celui des éboulis pentus et mobiles, existe un continuum de biotopes intermédiaires.
Ces deux lignées de lierres recherchent des types de milieux nus, offrant peu ou pas d’espèces capables de supporter les contraintes locales et de concurrencer leur alimentation hydrique. Ces biotopes sont très différents de celui des lierres mésophiles du massif de la Sainte-Baume ou de celui des lierres sur parois ombragées, poussant souvent à proximité dans le massif des Calanques. Les stress qui s’appliquent dans l’ensemble de ces habitats (déficit hydrique, vent, radiations, mobilité…) sont si intenses que les espèces doivent obligatoirement posséder des caractères adaptatifs dédiés à ces micromilieux. Quelles sont les réponses écophysiologiques chez ces lierres ?
3.3. Réponses écophysiologiques des lierres sur éboulis et sommets
Les éboulis et les plateaux sommitaux sont exposés à un fort rayonnement et à l’aridité estivale. Quelles sont les adaptations de structure chez les lierres d’éboulis et sommets ?
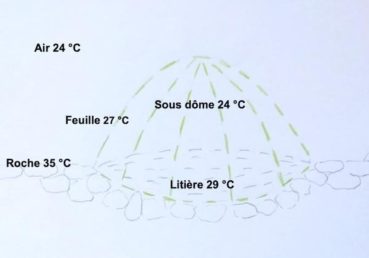
Le feuillage d’un dôme est formé de très nombreuses petites feuilles jointives, portées par une charpente rigide de rameaux courts et ramifiés (photo 56). Cette structure confère une certaine étanchéité au dôme jusqu’au sol, limitant ainsi la pénétration du rayonnement et du vent. Une litière importante peut alors s’accumuler sous le dôme, protégeant les racines des variations thermiques et hydriques (photo 57). Sa décomposition permet aussi d’enrichir le substrat en nutriments.
Quels sont les rayonnements reçus sur ces sites ? Sur éboulis par temps clair, le rayonnement solaire reçu lors du solstice d’été est très important en milieu de journée, mais il est masqué le matin et le soir (figure 7). Vers 14 h, sur une pente de 25°, le rayonnement direct est élevé et atteint 700 W/m2. Le rayonnement diffus est en moyenne de 55 à 60 W/m2. L’albédo de l’environnement dans ces biotopes dénudés induit un rayonnement supplémentaire non négligeable sur les lierres, voisin d’une centaine de W/m2. Leur cumul avoisine 900 W/m2 autour du midi solaire.
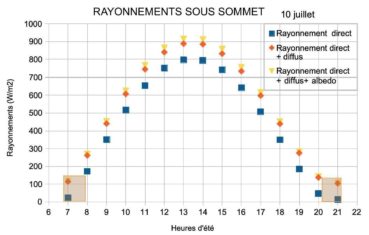
Sous sommet, le rayonnement direct sur site est de 800 W/m2 autour de midi solaire (figure 8). Un rayonnement diffus élevé, voisin de 100 W/m2, s’ajoute, la somme atteint alors 900 W/m2. L’albédo environnemental, bien qu’élevé, ne parvient qu’en fraction très limitée sur les lierres, car ces derniers sont exposés principalement vers le ciel.
La différence majeure entre les deux biotopes provient des masques présents. Les éboulis sont souvent situés dans des couloirs bordés par de la végétation et ou des parois rocheuses. Ces masques cachent le soleil en début et fin de journée, en moyenne la moitié de la journée. Seuls subsistent alors le rayonnement diffus et l’albédo environnemental. Sur sommet, l’absence de masques soumet les lierres à une insolation continue, simplement limitée aux début et fin de journée par les crêtes proches ou les reliefs lointains. Sur éboulis, le rayonnement solaire quotidien cumulé est d’environ 5 kWh/m2, soit cinq fois plus que sur une paroi d’ubac. Sur sommet, le rayonnement solaire quotidien cumulé est d’environ 8 kWh/m2, soit huit fois plus que sur une paroi d’ubac. Ces sites, à la différence des parois d’ubac et des sites arboricoles de la Sainte-Baume, sont exposés au soleil toute ou partie de la journée, ils reçoivent une très grande quantité d’énergie solaire quotidienne autour du solstice d’été.
Face aux forts rayonnements, l’échauffement des dômes est-il important ? Les températures sont contrastées en été, entre une roche chaude et l’intérieur du dôme frais. Les températures de l’air sont mesurées à deux mètres (annexe 8).
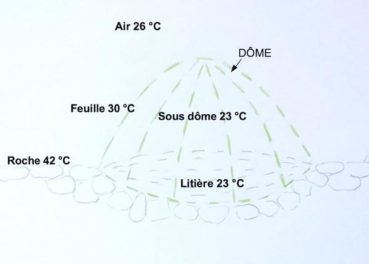
Sur éboulis, les températures ont été mesurées à 12 h 30 au solstice d’été, par ciel clair et vent faible, sur le plateau de l’Homme mort (figure 9). Il existe un fort contraste entre les 42 °C mesurés à la surface de la roche et les autres températures. La température dans le dôme est basse, 23 °C, car les feuilles absorbent l’énergie solaire et s’échauffent tout en ombrageant l’intérieur grâce à la structure compacte du dôme. La température des pierres est élevée mais cette chaleur se propage peu latéralement sous le dôme. L’éboulis sec contenant 20 à 40 % d’air (Bodelle et al., 1980) est un mauvais conducteur de chaleur.
Au sommet, les températures ont été mesurées à 15 h par ciel clair, en fin d’été sur le mont Puget (figure 10), le rayonnement total reçu est moindre qu’au solstice d’été. La température de l’air (24 °C) et celle de la roche sont modérées par l’altitude (500 m) et par un vent d’environ 20 km/h. L’intérieur du dôme est à la même température que l’air. À la surface du sol, les températures sont élevées sur la roche (35 °C), moins élevée sous le dôme (29 °C) préservé de l’insolation. Ces températures au sol montrent que la diffusion de chaleur à travers le calcaire du lapiaz est assez importante. La litière pourrait avoir un rôle isolant en freinant la diffusion de chaleur vers les racines.
Le dôme se comporte comme une cloche isotherme. Les contrastes thermiques jour-nuit étant élevés sur les sols caillouteux (Gras,1994), cette cloche pourrait jouer un rôle isotherme continu. Cette protection, utile en été, l’est sans doute aussi face au froid hivernal, mais nous ne l’avons pas mesurée.
Les lierres du massif des Calanques développent un suber épais. Cette production pourrait correspondre à un caractère évolutif conférant aussi une protection isolante contre les stress thermiques. Les feuilles ne s’échauffent que de 3 à 4 °C par rapport à l’air malgré le fort rayonnement. Le stress thermique estival du feuillage paraît donc limité sur ces sites.
Comment expliquer que les feuilles s’échauffent peu ? Le vent est un régulateur thermique omniprésent sur les sommets. Les feuilles exposées au vent sur sommet enregistrent une température un peu plus basse que les autres. Toutefois cette régulation est moins efficace sur les éboulis, en partie abrités du vent par des masques.
Au midi solaire en début d’été, les pierres calcaires reçoivent 800 à 900 W/m² et leur température peut atteindre 45 à 50 °C par vent faible. L’albédo du calcaire est d’environ le tiers du rayonnement solaire reçu, soit 250 à 300 W/m² dans les situations retenues. Ce fort renvoi limite la température de la roche. Sans ce fort albédo, par vent faible, la température de la roche pourrait atteindre des températures plus élevées et létales pour les rameaux rampants. Les feuilles de lierre ont elles-mêmes un albédo, qui a été comparé à celui d’autres espèces (tableau 2).
Par forte insolation, l’albédo des feuilles de lierre (29 %) est plus élevé que celui des autres espèces testées. Des valeurs usuelles s’inscrivent entre 20 à 25 %, ces valeurs dépendant aussi de l’incidence solaire (Campbell & Norman, 1998). La relative dépigmentation observée chez les dômes des lierres d’éboulis et de sommet permet d’augmenter leur albédo. Ainsi la réflexion d’une forte proportion de rayonnement limite l’échauffement des feuilles. La limitation d’échauffement des feuilles est donc assurée à la fois par l’albédo du calcaire, l’albédo des feuilles et le vent régulier sous les sommets. La protection vis-à-vis de l’échauffement est plus difficile pour les rameaux végétatifs, d’un vert plus foncé et rampant sur un substrat chaud.
Comment ces rameaux rampants peuvent-ils progresser en éboulis brûlant ? Sous l’effet des forts éclairements, on observe un jaunissement des feuilles, distinct de celui qui caractérise la sénescence des feuilles caduques en automne (photo 58). Il est improbable que cette forte dépigmentation estivale soit réversible (McAllister & Marshall, 2017). Elle limite la photosynthèse et la croissance des rameaux végétatifs, mais permettrait la survie des rameaux, en augmentant fortement l’albédo de ces feuilles dépigmentées.
Si la journée est chaude et le vent faible, la température des pierres peut dépasser 50 °C et celle des rameaux rampants 40 °C au soleil. Il s’agit probablement de la limite au-delà de laquelle la feuille risque de se déshydrater (photo 58). Les rameaux végétatifs rampants, assurant la colonisation de l’éboulis, ne peuvent donc pas progresser durablement sans masques, sous la double contrainte thermique et lumineuse. Une stratégie des rameaux végétatifs consiste à progresser entre les pierres et graviers (photo 59), à condition de partir d’un endroit protégé. Ce dernier est en général la bordure d’éboulis, offrant des masques végétaux (photo 60).
Quand les rameaux végétatifs s’éloignent significativement de la bordure d’éboulis, ils donnent alors naissance à des rameaux fertiles, qui en poussant verticalement leur offrent un masque « auto-généré ». Ces rameaux fertiles s’éloignent ainsi des roches chaudes. Ils sont par ailleurs plus résistants aux rayonnements et leur albédo est plus élevé du fait de leur dépigmentation (photo 61).
Sur sommets, la stratégie de colonisation des lapiaz et pierriers est identique. La croissance végétative peut commencer sous les masques d’une fruticée. Les rameaux végétatifs progressent entre les blocs et dans les fissures du lapiaz, qui fournissent des masques (photo 62). Le sujet, atteignant l’âge adulte, développe alors ses rameaux fertiles et construit son dôme en pleine lumière. La colonisation s’effectue donc sous des masques environnementaux et l’établissement du sujet se prolonge sous forme du dôme, comme chez les lierres sur éboulis (photos 62 et 63). Certains sujets isolés semblent ne pas avoir eu de masques au démarrage. Ainsi le lierre (photo 62) a progressé dans le substrat depuis un point d’implantation sans masque, éloigné du dôme.
Ces masques ont pu brûler, car la plupart des zones du massif des Calanques ont subi au moins un incendie depuis les années 1960. Une teneur en eau assez élevée (Metcalfe, 2005), associée à un suber assez épais, conférerait aux lierres une certaine résistance au feu (Duche et al., 2012). L’implantation se réalise donc sous des masques végétaux et rocheux, permettant aux rameaux végétatifs rampants vulnérables d’éviter le fort rayonnement. Nous avons dénommé cette stratégie d’implantation la stratégie de la tortue.
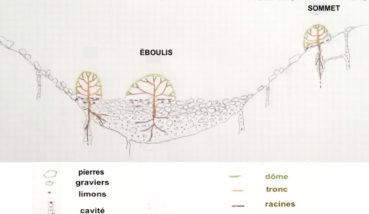
Le substrat des éboulis et lapiaz permet-il une alimentation hydrique durable ? Les zones ravinées offrent des coupes naturelles dans les éboulis (photo 64). Les éboulis sont des couloirs pentus qui drainent des pierres, des graviers et des particules fines (limons et argiles) colmatant les espaces sous les pierres et graviers (Parc national des Calanques, 2017).
Les racines se développent dans la fraction fine, la présence de graviers en mélange ne gênant pas l’enracinement (Gras, 1994). Sous sommet, les lierres s’enracinent dans les cavités colmatées par des graviers, argiles et limons du karst fossile. Les fissures collectent l’eau et le colmatage exerce une rétention d’eau, permettant l’enracinement des nombreux chasmophytes dont les lierres (figure 11).
Les éboulis et lapiaz offrent une fraction fine cachée sous les fractions grossières, susceptible de retenir une ressource en eau. Cette fraction fine permet-elle une alimentation hydrique durable ? L’alimentation hydrique est appréciée par le niveau de la transpiration foliaire (annexe 6). Comment évolue la transpiration chez ces lierres par rapport à celle d’une plante mésophile ?
Au printemps, la transpiration est toujours inférieure à celle d’une plante mésophile, bien que plus élevée sur éboulis. On observe dans tous les sites une forte baisse estivale de la transpiration, qui devient très faible durant l’été, sans s’arrêter totalement toutefois (figures 12 et 13). La chaleur diffusant mal dans les pores d’un éboulis (chute de 10 °C sur 10 cm de profondeur), un microclimat plus frais se maintient. Nous avons mesuré des humidités relatives élevées sur éboulis à 3 cm au-dessus des pierres, toujours supérieures à celles de l’air. L’éboulis malgré sa fraîcheur évapore, ce qui suppose qu’il reste hydraté dans sa partie profonde, même en été.
Sous sommet, la transpiration ne dépasserait pas la moitié de celle d’une mésophyte même au printemps. L’économie d’eau est continue. La survie suppose toutefois le maintien d’une certaine hygrométrie du substrat. La rareté des pluies estivales, la dessiccation liée au vent et au rayonnement épuisent les réserves en eau du lapiaz, conduisant à une aridité précoce du substrat.
Existe-t-il des sources d’eau alternatives ? Si l’humidité relative de l’air est suffisante et la température assez basse, le point de rosée peut être atteint au lever du jour. Alors, la vapeur d’eau se condense en altitude (photo 65). Le nuage orographique formé peut humidifier les plantes et substrats, offrant une alternative à la rareté des précipitations.
Cette condensation s’observe périodiquement, associée à la chute de température en altitude. Les structures des lapiaz et des pierriers, à grandes surfaces de cavités ombragées, en feraient de bons récepteurs de condensation, tout comme la structure en dôme du lierre de sommet et sa litière.
Au bilan, l’écologie des lierres sur éboulis s’inscrit mal dans un modèle couramment admis, à savoir que la dynamique des peuplements végétaux d’éboulis est proportionnelle à leur rapidité de fixation (Bensettiti et al., 2004b). Ce constat est moins vrai en ce qui concerne les lierres sur éboulis, à progression lente depuis les zones masquées de bordure vers l’axe d’éboulis. Alors que les lierres sur éboulis et sous sommet pourraient rester sur leurs sites initiaux et grimper aux arbres ou arbustes, ces lignées, sans tropisme arboricole, s’implantent à l’ombre, puis colonisent la roche sous masques, par la « stratégie de la tortue ». Chez ces lierres, la survie semble liée à ce tropisme en direction des zones réfléchissantes.
La progression est réalisée par des rameaux végétatifs qui « courent » sous les pierres et enracinent le sujet adulte dans un contexte satisfaisant en termes de rayonnement. Un même néologisme pourrait caractériser ces lignées : elles sont albédophiles, mais pour des raisons inverses de celles de la lignée sur paroi. Elles ont développé leur stratégie d’implantation en s’appuyant sur l’albédo du calcaire et de leurs feuilles pour limiter la quantité de rayonnement reçu et ainsi leur échauffement. Ces lignées ont développé une structure adulte en forme de dôme, permettant de réguler la température interne du buisson. Cette régulation fait aussi intervenir le vent chez les lierres sous sommets, exposés en continu au soleil estival. Il existe donc une forme d’homéothermie chez ces lignées, comme chez les lierres sur paroi. La très petite taille des feuilles pourrait être une réponse aux forts rayonnements solaires et aux vents.
Le dôme contribue manifestement aussi à un renouvellement des nutriments et probablement à une stabilité de l’humidité du substrat.
4. Les rangs taxonomiques
4.1. L’hybridation chez les populations du massif des Calanques
Les populations de lierres du massif des Calanques occupent des niches très différentes et présentent des caractères botaniques spécifiques associés à ces niches. Quels rangs taxonomiques attribuer aux trois populations ? En absence de données génétiques, la recherche de zones d’hybridation entre populations a permis de tester la validité d’un rang de niveau sous-spécifique. Les populations du massif des Calanques s’hybrident-elles ?
L’étude comparative des fleurs observées dans tous les sites n’a pas montré de différences tant au niveau des pièces florales (photo 66) que des grains de pollen à trois sillons (photo 67). La structure des fleurs est très conservative dans le genre Hedera, voire chez d’autres Araliacées (McAllister, 2017). Par ailleurs, les floraisons sont synchrones dans tous les sites du massif et dans les plaines et collines alentours. La floraison commence début septembre et se prolonge jusque fin septembre et début octobre. Une relation entre période de floraison et température des sites est admise (Metcalfe, 2005). Nous ne l’avons pas vérifiée sur les parois d’ubac plus fraîches, où aucun retard de floraison n’est observé. Nous avons toutefois observé une floraison tardive, à la fin octobre, sur le massif de la Sainte-Baume.
Si l’autofécondation est possible chez H. helix, l’hybridation semble la modalité dominante (Metcalfe, 2005). La pollinisation est assurée par de nombreux insectes (Déom, 2018) et l’hybridation entre les populations est donc possible de proche en proche, à distance de vol d’insectes. La dissémination des fruits et des graines est assurée par des oiseaux frugivores, des pigeons ramiers ont été observés. La dissémination est donc possible à distance de vol d’oiseaux.
En altitude, existe un continuum de formes entre les lierres d’éboulis et ceux des sommets (photo 68) dans des niches de transition. De même, des lierres de phénotypes intermédiaires poussent en niches intermédiaires, à la fois sur paroi et éboulis (photo 69). La présence de ces sujets intermédiaires semble s’expliquer par une hybridation entre lignées dans le massif des Calanques.
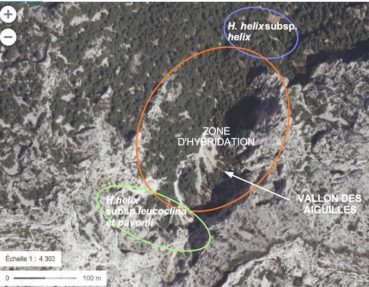
Une autre aire d’hybridation a été observée au pied du massif de Marseilleveyre. On y observe des lierres arboricoles et saxicoles aux phénotypes très proches de H. helix subsp. helix. (photos 70 et 71). Ces sites arborés sont les plus fermés et les plus humides. Un transect le long d’un vallon (vallon des Aiguilles) a montré que cette petite population de H. helix subsp helix habite le bas de vallon. Ce site de basse altitude (100 m) collecte l’eau et la retient dans le calcaire argileux, conservant ainsi une humidité estivale. En haut du vallon (250 m), dans des sites nus, la forme typique d’éboulis haut est présente (figure 14).
Entre ces deux populations existe une vaste zone à formes saxicoles intermédiaires (photo 72). Les caractères intermédiaires sont botaniques – dimensions des feuilles, des pétioles, subérification des troncs – et environnementaux – rayonnements, humidité… Cette zone médiane semble être une zone d’hybridation entre les deux populations extrêmes (figure 14). Nous pensons que l’échantillon de lierre, dont H. McAllister a établi le caryotype de formule 2x = 48, est un hybride de ce type.
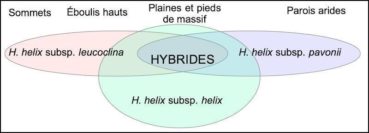
Bilan : les populations de lierres du massif des Calanques s’hybrident manifestement entre elles et s’hybrident aussi avec H. helix subsp. helix (figure 16). Il n’existe pas de hiatus, un continuum de formes intermédiaires s’observe dans des zones de transition séparant les niches aux environnements extrêmes.
C’est donc un rang infraspécifique qu’il convient d’attribuer aux populations typées du massif des Calanques. Quels sont les caractères partagés et divergents entre les différentes lignées ?
La matrice du tableau 3 liste les caractères partagés et divergents, recensés chez les lignées étudiées. Le taxon extra-groupe retenu est le lierre des Açores, H. azorica Carrière, que nous avons cultivé. Cette espèce endémique macaronésienne est phylogénétiquement proche de H. helix (Valcàrcel et al., 2017). Elle habite un biotope subtropical de laurisylves, qui pourrait s’apparenter au biotope de la flore ancestrale provençale de la fin de l’ère tertiaire. Elle se distingue par de grandes feuilles à sept lobes. Compte tenu d’une certaine pérennité de sa niche écologique, l’hypothèse retenue est que ce taxon a conservé certains caractères ancestraux. Nous n’avons pas su apprécier sa thermophilie et avons donc éliminé ce caractère. H. helix subsp. rhizomatifera que nous avons également cultivé a été listé mais, faute de recul suffisant, ses caractères ne sont pas tous connus. Avec l’aide de N. Salamé, nous avons construit la matrice et les arbres phylogénétiques potentiels. Nous ne proposons pas d’arbre, car nous n’avons pas souhaité figer une histoire hypothétique.
Les dix caractères retenus rapprochent H. helix subsp. helix du taxon macaronésien H. azorica (photo 73) et les éloignent des lignées du massif des Calanques et de H. helix subsp. rhizomatifera (tableau 4). Les lignées d’éboulis et de sommets sont apparentées à H. helix subsp. rhizomatifera. La lignée sur paroi partage moins de caractères avec ces trois lignées que ces dernières entre elles. Les lignées du massif des Calanques partagent peu des caractères retenus avec H. helix subsp. helix et avec H. azorica, en particulier sur le plan des tolérances écologiques.
Toutefois, les contrastes observés dans les différents sites, sur le plan des rayonnements et températures, méritent d’être précisés. La température des feuilles d’un dôme est inférieure de 10 °C ou plus à celle des pierres (figures 9 et 10). Cette régulation thermique de la surface du dôme s’explique en partie par la géométrie du dôme : l’éboulis peut être assimilé à un plan, alors qu’un dôme est assimilable à une demi-sphère. Or la surface d’une demi-sphère est double de celle du disque qu’elle circonscrit au sol (figure 15). En étalant l’énergie solaire sur une surface double, la demi-sphère reçoit ainsi deux fois moins d’énergie que le disque au sol correspondant (tableau 5). L’échauffement conséquent se trouve alors fortement diminué.
La comparaison des puissances solaires reçues par différents sites et par feuille de lierre montre que le rayonnement reçu par feuille est proche de 0,8 Wh/m2 (annexe 9). Sur des sites très différents, il existe une unité des rayonnements reçus par feuille.
Derrière la diversité morphologique et écologique du taxon H. helix, il semble exister une unité physiologique. La taille de la feuille a évolué de façon à recevoir une énergie solaire quotidienne « maximale » voisine dans tous les sites, qui permettrait une photosynthèse efficace tout en limitant l’échauffement foliaire. Ceci confirmerait que la lignée sur paroi n’est pas vraiment sciaphile. Cette lignée éviterait plutôt l’incidence solaire directe sur des feuilles d’assez grande taille par rapport aux autres lignées du massif des Calanques.
Qu’en est-il chez une autre espèce du genre Hedera ? Un sujet d’H. algeriensis à grandes feuilles (4000 mm2), poussant à l’état semi-sauvage en limite de parc national, a été retenu. Les mêmes calculs montrent que ce sujet en dôme reçoit un rayonnement quotidien d’environ 5 kWh/m2, soit 10 Wh/feuille, c’est environ douze fois plus que chez H. helix. Il existerait donc une unité foliaire à l’exposition solaire partagée par les seuls membres de l’espèce H. helix.
4.2. Proposition de rangs taxonomiques
Le rang retenu (Pavon et al., 2020) chez trois taxons de genévriers rouges de l’Ouest méditerranéen a été celui de sous-espèce. Les critères conduisant au choix de ce rang peuvent être retenus chez les populations de lierres du massif des Calanques : paramètres écologiques, port des plantes, caractères morphologiques variables dans des populations, caractères morphologiques chevauchants entre populations.
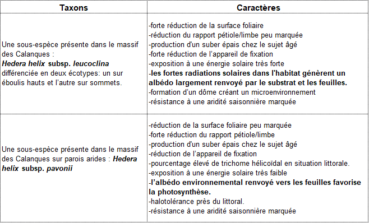
Les lignées du massif des Calanques habitent un même territoire, mais il n’est pas exclu que d’autres sous-espèces homologues telles H. helix subsp. rhizomatifera permettent à terme de les intégrer dans un complexe plus vaste et plus riche, à l’image des genévriers rouges. Nous proposons à partir des caractères retenus (tableau 6) l’établissement de deux taxons au rang de sous-espèce : une sous-espèce sur éboulis hauts et sur sommets, Hedera helix subsp. leucoclina ; une sous-espèce sur les parois les plus arides: salées, ventées et vires, Hedera helix subsp. pavonii.
5. Description des taxons
Nous proposons de décrire deux taxons nouveaux.
Hedera helix L. subsp. pavonii F. Cayet, Ch. Coulomb & M. Grégoire subspecies nova, 2022
Diagnosis: habit prope Massiliam in maritimis. Numquam in arboribus, magis in albis rupes. Liana alta. Subspecies pavonii differt a Hedera helix subspecies helix: suber tegit vetam cauliis, petiolis brevis et foliis minoris.
Daniel Pavon collegae nostro Massiliae eam dedicamus.
Loco dicto : Marseille, Bouches-du-Rhône, France, Parc national des Calanques, massif de Marseilleveyre, pas de la Cabre, altitude 245 m
Holotypus : Hic designatus unicum specimen in herbarium MARS – St-Charles (Massiliam), « Herbier de la région méditerranéenne française », MARS herbarium, université d’Aix-Marseille, code MARS 090388, inscriptionum in folio herbarium « Hedera helix L. subsp. pavonii F. Cayet, Ch. Coulomb & M. Grégoire 2022/ HOLOTYPUS/ Lunio MMXXII collecta/ MARS 090388/ ».
Intention des auteurs : nommer le taxon rupicole albédophile générant du suber sur la partie inférieure de ses troncs âgés, fuyant les expositions directes au soleil, affectionnant les ubacs souvent à l’ombre, les rochers blancs, à fort albédo et arides.
Isotypi : LIV, MA (NYBG Steere herbarium)
Synonyme hétérotypique : néant (Kerguelen,1993)
Équivalence horticole : Hedera cv ‘Marseilleveyre’ MacAllister (MacAllister & Marshall, 2017)
Hedera helix L. subsp. leucoclina F. Cayet, Ch. Coulomb & M. Grégoire, subspecies nova, 2022
Diagnosis : Habit prope Massiliam. Crescit in glaream, lapides et lapiaz ad summum ventosa cacumina. Subspecies leucoclina differt a subspecies helix: tropismus versus saxa, suber tegit vetam cauliis, petiolis brevis et foliis minoris; subspecies leucoclina differt a subspecies pavonii : umbrella informibus, fruticosa habitus, paucis et brevis affectum organum. In peripheria umbella, cauliorum reptans et semi-absconditum sub lapidibus, ad extremitatis cum foliis flavido-viridis.
Loco dicto : Marseille, Bouches-du-Rhône, France, Parc national des Calanques, massif de Marseilleveyre, pas de la Cabre, altitude 222 m.
Holotypus : Hic designatus : unicum specimen in herbario MARS – St Charles (Massiliam), « Herbier de la région méditerranéenne française, MARS herbarium, Université d’Aix-Marseille », code MARS 090389, inscriptionum in folio herbarium : « Hedera helix L. subsp. leucoclina F Cayet, Ch. Coulomb & M. Grégoire 2022/ éboulis sous le pas de la Cabre/ massif de Marseilleveyre, Provence/ HOLOTYPUS/ Lunio MMXXII collecta/ MARS 090389 »
Isotypi : LIV, MA.
Synonyme hétérotypique : néant
Intention des auteurs : nommer le taxon saxicole des endroits chauds, ensoleillés, mettant à profit l’albédo des roches blanches pour éviter la surchauffe de ses tissus. Cette sous-espèce leucoclina montrant une nette inclination pour les zones blanches à fort albédo, nous avons retenu la translittération latine des mots grecs leukos et klino qui signifient respectivement blanc et j’incline, ce qui donne leuco et clina.
6. État des populations
6.1. Quelles sont les relations entre les lignées dans leurs aires de répartition ?
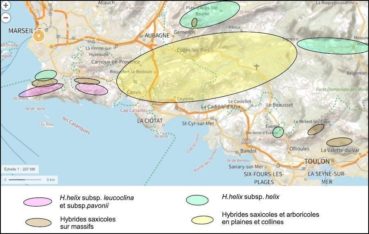
La chorologie est difficile à exploiter compte tenu de la fréquence des lierres dans de nombreux biotopes et de leur forte capacité d’hybridation, c’est donc une image partielle qui est proposée. Les populations des plaines et collines situées entre Marseille et Toulon (figure 16) semblent majoritairement intermédiaires, tant par leurs mensurations foliaires que leurs niches. Ces populations sont probablement hybrides entre les sous-espèces helix, leucoclina et pavonii. Un modèle d’hybridation est proposé (figure 17).
Concernant les massifs, nous n’avons trouvé, ni sur la Sainte-Baume ni sur les massifs nord-toulonnais (mont Faron et Baou des Quatre Ouros), la sous espèce leucoclina type. En revanche, sur ces deux massifs, nous avons rencontré des lierres saxicoles sur pierriers aux caractères intermédiaires (photos 74 et 75). Chez les sous-espèces helix et leucoclina, la surface des feuilles végétatives est voisine de celle des feuilles fertiles. Sur les deux massifs cités, de nombreux sujets présentent une surface des feuilles fertiles double de celle des feuilles végétatives. Ainsi une vaste population à petites feuilles végétatives (300 à 500 mm²), caractère de H. helix subsp. leucoclina, et à grandes feuilles fertiles (600 à 1000 mm²), caractère de H. helix subsp. helix, se rencontre sur pierriers tant dans les parties basses du massif des Calanques qu’en altitude dans les autres massifs explorés. Leur caractère hybride est probable.
Une étude génétique pourrait-elle permettre de préciser l’origine de ces lignées ? La distribution de la sous-espèce pavonii se superpose à celle des lierres de la sous-espèce leucoclina situés sur éboulis. À l’échelle régionale son aire de répartition n’est pas établie, elle englobe sans doute le massif du Gros Cerveau et le mont Caumes, où des sujets peu accessibles ont été observés. Ainsi, les sites à sous-espèce helix semblent limités aux spots à forte humidité, les bas de vallons d’ubac, les ripisylves et les sites d’altitudes élevées (carte 2). Les sites à sous-espèce leucoclina et pavonii semblent limités au massif des Calanques, dans les niches les plus arides et à fort albédo.
6.2. Quel scénario historique pourrait expliquer cette répartition ?
Nous nous appuierons sur les modèles développés pour notre flore régionale. « De par sa situation géographique littorale et la présence d’une topographie très hétérogène déterminant des micro-habitats contrastés, le massif des Calanques a donc pu jouer le rôle de zone refuge pour certains taxons. Ce massif a ainsi facilité la persistance puis la diversification de certaines lignées génétiques originales… » (Pires & Médail, 2018). Les populations typées de lierres du massif des Calanques seraient des reliques de populations ancestrales réfugiées dans nos massifs littoraux lors des périodes froides passées. La topographie complexe de ce massif aurait offert à ces populations des niches thermiquement viables, lors de pulsations froides associées aux périodes glaciaires du Quaternaire, en particulier la dernière qui culmina il y a 20 000 ans. En considérant qu’une population doit coller à l’évolution des niches disponibles (Lewontin,1978), il est probable que ces lignées se soient adaptées morphologiquement et physiologiquement à ces « niches refuges » contraintes et arides (Mc Allister, 2017). Si on accepte l’idée que les niches actuelles ressemblent en partie à celles des périodes froides passées, ces niches refuges auraient pu se trouver proches du littoral, possiblement en situation d’adret, thermiquement plus favorables. Les très petites feuilles d’un dôme autorisent une telle exposition.
Les pulsations climatiques répétées à l’échelle de la ou des dizaines de millénaires auraient remis en contact périodique les populations locales avec des populations migrantes de H. helix. Ces dernières sont fossilisées dans les tufs des environs de Marseille, datés de cinq périodes différentes du Quaternaire (Pires & Médail, 2018 ; Villeneuve et al., 2018). Cette échelle de temps n’aurait pas permis une spéciation aboutie chez les populations de lierres des chaînes littorales calcaires de basse Provence.
Sur d’autres chaînes littorales calcaires, il existe probablement des populations méditerranéennes homologues, H. helix subsp. rhizomatifera en ferait partie. Nous avons vu sur images des lierres proches de la sous-espèce pavonii en Crète dans les gorges de Kotsifou, ainsi qu’à Bonifacio en Corse. L’existence d’un anneau de sous-espèces sur les littoraux méditerranéens à fort albédo nous paraît probable.
6.3. Ces populations présentent-elles des vulnérabilités ?
La vulnérabilité majeure des sous-espèces du massif des Calanques est probablement l’hybridation avec la sous-espèce helix, présente dans les villes, villages et spots humides proches du massif. Ces sous-espèces sont relativement épargnées car elles ont trouvé refuge dans des niches très contraintes, où la compétition et la dynamique vers la constitution d’une pineraie sont très faibles ou nulles.
Sous-espèce pavonii
La sous-espèce pavonii est vulnérable quand elle rentre en concurrence avec des plantes invasives en zones périurbaines (Fallopia aubertii et Pittosporum tobira en bordure du parc). La régénération du lierre de Pavon ne semble pas être menacée car les jeunes plants se trouvent à l’abri ou en marge des cavités karstiques (Marseilleveyre, Puget) souvent peu accessibles. Ce lierre semble être relativement épargné des piétinement et arrachage, car poussant à distance des grandes voies d’escalade, sauf à la grotte de l’Ermite.
Sous-espèce leucoclina
La sous-espèce leucoclina semble s’être hybridée dans les massifs nord-toulonnais dans deux types de biotopes, ceux dont les villes se sont rapprochées et ceux qui se ferment. La fermeture des biotopes semble peu compatible avec le maintien de cette sous-espèce, comme nous l’avons observé dans certains sites au pied du massif de Marseilleveyre ou sur les hauteurs du mont Faron. Hormis ces menaces, sa vulnérabilité semble faible tant que les sites conservent leurs niches très contraintes. L’existence du parc national est sans doute une garantie de cette pérennité.
La forte fréquentation et le piétinement seraient-ils préjudiciables au renouvellement des jeunes plants ? La réponse à cette question est complexe. En effet, les jeunes plants sont à l’abri sous fruticée en bordure d’éboulis, donc peu accessibles au piétinement. Il est manifeste que de vastes buissons coalescents ont pu se former par croissance centrifuge dans les pierriers, selon la stratégie de la tortue. Des buissons distincts mais proches ont pu se former de la même façon. Ce type de multiplication végétative est un clonage générant des sujets génétiquement identiques, donc sensibles aux mêmes adversités. Le piétinement, s’il cisaille des rameaux végétatifs par déplacement de pierres, n’impacte pas forcément la survie de rameaux enracinés en plusieurs points et en partie dissimulés sous les pierres. Enfin, si l’étage supraméditerranéen devait souffrir du réchauffement climatique, les populations de lierres qui s’y trouvent en seraient sans doute affectées.
Nous espérons que ce travail aura été utile pour contribuer à favoriser le maintien et la conservation de ces sous-espèces en milieu « naturel ».
Annexes
Annexe 1 – Observations microscopiques
Les observations microscopiques ont été réalisées sous microscope optique Olympus CHS. Les grossissements sont indiqués pour chaque image et un oculaire micrométrique a été utilisé pour les mesures et échelles. Les observations d’épiderme sont réalisées à partir de prises d’empreintes au vernis à ongle incolore, méthode non destructrice, donnant des images très fidèles des surfaces. Les images sont prises avec un appareil photo numérique Canon dont l’objectif est posé sur l’oculaire micrométrique.
Annexe 2 – Traitements statistiques (Vidal, 2004)
Les mesures traitées pour chaque sujet sont des moyennes établies à partir de larges échantillons de feuilles ou de poils. Ces moyennes obtenues pour chaque sujet ont été analysées à l’aide de trois tests statistiques : l’Anova, le test de Student et la recherche de corrélations linéaires. L’Anova (analyse de variances) permet d’étudier si des échantillons issus de plusieurs groupes ont une probabilité importante d’appartenir à une même population (autrement dit une population pour laquelle le paramètre étudié suit la même loi normale : valeur centrale unique et même variance). Le paramètre étudié est assimilé pour chaque groupe à une variable aléatoire suivant une loi normale. Cette première condition, courante pour des grandeurs biologiques, a été admise. La seconde condition (l’homoscédasticité) consiste à supposer que les populations étudiées ont (sensiblement) la même variance. Dans ces conditions, un test Anova évalue la probabilité que les divers échantillons soient issus d’une même population (hypothèse Ho). Le test est conçu pour rejeter cette hypothèse Ho. Par exemple, si la probabilité que deux échantillons appartiennent à une même population est inférieure à 5 %, on jugera qu’il est peu probable que les deux échantillons soient issus d’une même population. Ainsi on rejettera l’hypothèse Ho et on conclura que les populations sont significativement différentes. Si cette probabilité est inférieure à 1 %, l’hypothèse Ho pourra être rejetée de façon encore plus certaine. On conclut alors que les échantillons sont très significativement différents. Le doute que la différence observée soit liée au hasard est dans ce cas infime. À l’inverse, si cette probabilité est supérieure à 5 %, on considère qu’elle peut s’expliquer par un hasard relativement « probable ». On ne peut pas conclure que les échantillons sont différents, mais on ne peut pas non plus conclure que les populations appartiennent à une même population, le test étant conçu pour rejeter Ho.
Lors de nos tests avec la méthode Anova nous avons constaté parfois de grands écarts entre les variances des échantillons étudiés. La condition numéro 2 d’homoscédasticité n’étant ainsi pas toujours vérifiée, nous avons souhaité nous assurer de la validité de nos conclusions par des tests de Student n’imposant pas cette condition, mais poursuivant les mêmes fins. Sur la base des résultats de ces tests de Student, nous avons construit des tableaux récapitulatifs (tableau 7) proposant une synthèse des différences entre les diverses populations de lierres étudiées. Ces tests ont été en particulier appliqués à la surface des limbes et au rapport pétiole/limbe.
Nous avons également cherché à évaluer l’intensité de corrélation entre diverses grandeurs morphologiques et écologiques, surface des limbes et flux solaire journalier ou encore pourcentage des trichomes hélicoïdaux et distance à la mer. Ces tests avaient pour but de mettre en évidence des corrélations linéaires entre les grandeurs étudiées ou des « puissances » de celles-ci. On sait par exemple que l’intensité sonore n’est pas proportionnelle à la distance à la source mais à son carré. Par analogie, nous avons cherché à déterminer l’intensité de la corrélation entre le pourcentage de poils hélicoïdaux et la distance à la mer, puis avec son carré (tableau 8). Nos conclusions reposent sur une interprétation classique du coefficient R de corrélation de Pearson (plus celui-ci s’éloigne de 0 pour s’approcher de 1 ou -1, plus la corrélation linéaire est forte).
Le pourcentage de poils mixtes et hélicoïdaux diminue avec la distance à la mer ainsi qu’avec l’altitude (plus franchement d’ailleurs avec les carrés de ceux-ci), reflet probable des processus de diffusion de l’air salé dans l’atmosphère. Ce pourcentage augmente également avec l’exposition au vent. En construisant un coefficient prenant en compte à peu près à part égal les effets de ces paramètres (racine cubique de la distance × inverse du carré du coefficient d’exposition au vent × racine de l’altitude), on obtient un R de Pearson de -0,65, confirmant l’effet cumulatif des tendances précédentes. En résumé, le pourcentage de poils hélicoïdaux augmente avec la « proximité écologique » à la mer, elle-même déterminée par au moins trois paramètres aux effets cumulatifs : proximité horizontale et verticale au rivage et exposition au vent, tous trois favorisant le transport du sel de la mer vers les lierres de paroi. Les valeurs de référence pour les différents tests sont consultables sur le site https://www.supagro.fr/cnam-lr/statnet/tables.htm
Pour le test Anova les valeurs de référence sont celles du test de Fisher-Snedecor ; pour le test de Student, les valeurs de référence correspondent au test bilatéral.
Annexe 3 – Traitement des images
Les mesures de surface sur les images (stomates, roches) ont été réalisées avec l’application Mesurim 2. Cette dernière est utilisable en ligne (Mesurim 2). Les surfaces nues rocheuses,sont simplement mesurées avec les outils de l’application.
Sur les images d’empreinte d’épiderme, les stomates ont été préalablement colorés avec un traitement d’images pour mesurer le % de la surface épidermique qu’ils occupent. La distribution des stomates est d’une régularité « cristalline » sur la face inférieure de la feuille de lierre. Ils sont absents de la face supérieure. Connaissant la surface d’empreinte d’épiderme observée, il est possible de calculer la densité stomatique, qui s’inscrit entre 120 et 220/mm² et la surface individuelle des stomates qui s’inscrit entre 300 et 550 µm² carrés chez H. helix. Cette forte variabilité cache l’unité relative des surfaces stomatiques en %, proportionnelles au produit des grandeurs précédentes.
Annexe 4 – Mesures des rayonnements sur site
Bien qu’ayant étudié le bilan radiatif global (rayonnement solaire et infrarouge) des sites où poussent nos lierres, nous nous sommes principalement concentrés sur l’interprétation du bilan radiatif solaire. En effet, les ondes courtes sont à la fois les plus énergétiques (et donc a priori les plus « stressantes » dans le bilan thermique) et évidemment les seules impliquées dans la photosynthèse. Le flux solaire incident a été estimé par un calcul assez élaboré du flux solaire direct qui à son tour nous a permis d’estimer les flux secondaires, diffus et réfléchi (régulièrement évoqué par le terme albédo dans le corps de notre article). L’estimation du flux solaire direct repose sur des calculs astronomiques bien établis dont le chapitre XI de l’ouvrage de Campbell (1998) propose des formules synthétiques ne nécessitant que quelques données clefs et une calculatrice de poche. Les résultats discutés dans le corps de l’article ont été calculés pour un 10 juillet avec un ciel supposé clair. La latitude et la longitude retenues pour tous les sites ont été 43.2° N et 5.4° E. Le flux solaire parvenant à l’entrée de l’atmosphère a été supposé égal à 1 360 W/m². Nous avons successivement appliqué des formules prenant en compte l’atténuation du flux solaire lors de sa traversée de l’atmosphère en fonction de l’angle zénithal à différentes heures d’un 10 juillet, puis nous avons déduit le flux solaire frappant le support supposé plan où s’est développé chaque lierre en prenant en compte l’azimut, la pente et l’orientation du site. Ces derniers angles ont été estimés à 10° près pour l’orientation et 5° près pour la pente. Pour les lierres de paroi nous avons supposé qu’ils se développent sur des parois subverticales (85°).
Dans un premier temps, seuls les facteurs de vue des flux incidents ont été pris en compte afin de modéliser la « fermeture du ciel » impliquée par les roches et la végétation voisine des lierres étudiés. Les flux incidents nous semblaient en effet les plus pertinents pour comparer les conditions écologiques des sites d’installation des lignées de lierre. Autrement dit, lorsque nous discutons des flux solaires parvenant à nos lierres, nous considérons les flux frappant les supports supposés plans où ils se sont développés. La géométrie du dôme, qui nous paraissait une réponse adaptative à cet environnement initial, n’a été prise en compte que dans un second temps sous la forme d’un facteur de 0,5 lors du bilan radiatif foliaire.
Par ailleurs les flux secondaires ont été confortés ou complétés par des mesures effectuées avec un solarimètre de terrain, en réalisant des mesures à l’ombre pour le diffus. Le rayonnement diffus d’une journée d’été ensoleillée est d’environ 100 W/m² (Campbell, 1993). Sa valeur sur un site est proportionnelle au facteur de vue du ciel. Sur paroi ou en fond de canyon, la vue du ciel est de l’ordre de 40 %, sur éboulis de 50 à 60 % et sous sommet de 90 %.
Les mesures d’albédo environnementales et foliaires ont été aussi mesurées au solarimètre directement sur les objets. En acceptant que ces réflexions s’apparentent à un rayonnement diffus tant chez les environnements complexes (Kastendeuch et al., 2006) que chez la végétation (Bouquet, 2007), alors l’albédo reçu par un lierre est proportionnel à la vue environnementale. Cette dernière est le complément de la vue du ciel, pour atteindre 100 %. Ces types de données sont exploitées dans les canyons urbains.
Annexe 5 – Données sur la photosynthèse
Les données sur la photosynthèse et les valeurs d’éclairement fournies (Metcalfe, 2005) sont relatives aux radiations actives sur la photosynthèse (PAR). Elles sont initialement exprimées comme un flux de photons, c’est-à-dire une quantité molaire de photons par unité de surface et de temps (micromoles / m2 × s). Nous les avons converties en
W/m² et étendues au spectre solaire pour les rendre comparables à nos mesures environnementales.
1 µmol photons / m² × s = 0.217 W / m2 en moyenne pour un photon du PAR (Campbell,1998). Le PAR représente environ 45 % du rayonnement solaire total (Nobel, 1983).
Conversion : n en µmol de photon du PAR / (m² × s) = (n x 0,217) / 0,45 (W / m² du rayonnement solaire)
Annexe 6 – Mesures de transpiration
La transpiration a été estimée par un protocole non destructeur consistant à mesurer l’évolution au cours du temps de la température et de l’humidité relative à l’intérieur d’une boîte hermétiquement close contenant un rameau de lierre (photo 76).
Méthode. Une boîte en plastique transparente est percée afin de recevoir un rameau ainsi qu’un thermo-hygromètre destiné à mesurer température et humidité relative à des intervalles de temps réguliers. Le volume de la boîte est connu. À partir de la mesure de la température et d’une table de thermodynamique est obtenue la pression de vapeur saturante à la température mesurée Psat(T). La pression de vapeur d’eau dans l’air Pvap vaut Hr x Psat (Hr : humidité relative). En admettant que l’air de la boîte et la vapeur d’eau qu’il contient suivent la loi des gaz parfaits, on obtient une estimation simple et rapide de la quantité d’eau dans la boîte à tout instant t :
neau (mol) = Hr × Psat(T) × Vb / (R × T)
où T est la température à l’instant t, Vb le volume de la boîte et R la constante des gaz parfaits.
Jeau le flux molaire d’eau transpirée par unité de surface foliaire et par unité de temps s’obtient finalement en divisant la différence des quantités d’eau entre deux instants par la surface foliaire (Sfoliaire) du rameau et la durée écoulée entre les deux mesures que l’on multipliera par mille pour exprimer le résultat en mmol/(m².s).
Jeau = 1000 × (neau(t2) – neau (t1)) / (Sfoliaire × (t2 – t1)).
La surface foliaire est assimilée à la surface moyenne des limbes (voir partie 1) multipliée par le nombre de feuilles du rameau.
Limites de la méthode. Première limite, indépassable, la boîte hermétiquement close coupe les effets du vent et de la turbulence, non négligeables sur la transpiration. La transpiration pourrait alors être abaissée par la mise en place d’une couche limite plus épaisse, résistant à la diffusion de vapeur (Campbell, 1993). D’autre part, les mesures nous semblent devoir être effectuées sur des durées courtes puisque la température et la quantité de vapeur d’eau dans la boîte augmentent rapidement au cours de l’expérience. Ainsi, plus l’expérience se prolonge, plus on s’éloigne des conditions normales de transpiration du végétal en milieu ouvert. Il est par ailleurs délicat d’estimer la nature de ces perturbations puisque l’augmentation de la température dans la boîte tend à augmenter la transpiration, tandis que la réduction du déficit de vapeur d’eau (différence entre Psat et Pvap) joue dans le sens inverse. Enfin, une expérience réalisée sur un temps court limite les possibilités de voir celle-ci perturbée par une modification significative du degré d’ouverture des stomates (Hopkins, 2003 ; Viallet-Chabrand, 2013).
Résultats. La courbe représentant nos mesures de pression de vapeur d’eau dans la boîte au cours du temps (figure 18) est proche d’une fonction affine pendant les premières minutes de l’expérimentation. Ceci reflète une transpiration quasi constante pendant ces premiers instants. Le protocole semble donc peu perturber la transpiration sur une durée aussi courte et nous offrir une estimation raisonnable. Les valeurs de transpiration obtenues entre 0,2 et 3 mmol/m².s sont très en deçà des valeurs moyennes de transpiration des plantes mésophiles estimées autour de 4 à 5 mmol/m².s (Nobel, 1983), ce qui n’a rien de surprenant compte tenu des conditions extrêmes que doivent affronter les lierres étudiés.
Annexe 7 – Les relations entre la feuille et le sel
Le sel influence-t-il la transpiration ?
Si l’influence du sel sur les propriétés de l’eau a été identifiée il y a fort longtemps par les botanistes et les chimistes, constituant une référence dans la modélisation de l’osmolarité (Perrin, 1913), la compréhension profonde des mécanismes sous-jacents paraît encore incertaine (Pollack, 2019). Il est certain que la présence de sel à la surface des feuilles modifie les échanges hydriques. Quantifier cette influence et même dans certaines conditions son sens demeure complexe.
Le sel étant un cristal ionique, les cristaux de sel attirent naturellement les molécules d’eau qui sont polaires et ce quel que soit l’état de l’eau, l’observation microscopique en témoigne (photo 41). La présence de cristaux de sel à la surface des feuilles conduit donc à la formation d’une couche d’air dont l’humidité relative est abaissée à 0,77 (Campbell, 1998), valeur qui traduit tout simplement la facilitation de la condensation de la vapeur d’eau à proximité d’une surface salée. Ce phénomène d’apparence simple complexifie néanmoins considérablement la modélisation de la transpiration foliaire. En effet, celle-ci est le plus souvent considérée comme proportionnelle au gradient de pression de vapeur d’eau entre la feuille et l’air. Par souci de simplicité, la pression de vapeur d’eau de la feuille est supposée la même à l’intérieur des espaces sous-stomatiques et à la surface extérieure des feuilles, en sortie des stomates. On admet également que, les cellules mésophylliennes offrant une très grande surface d’échange, la pression de vapeur d’eau dans l’air qui se trouve dans les espaces sous stomatiques est très proche de la pression saturante (l’humidité relative y est ainsi supposée égale à 1). Il en découle la formule bien connue décrivant une transpiration proportionnelle à la différence Psat(Tlimbe) – Pvap(air). Ces hypothèses sont totalement bouleversées par la présence de sel à la surface des feuilles. Si les épidermes des lierres ne laissent pas traverser les solutions salées, le gradient de pression entre la surface des feuilles et l’air devient alors 0,77.Psat(Tlimbe) – Pvap(air). Ceci implique un abaissement de la transpiration voire une inversion du flux hydrique (quand Pvap(air) est supérieur à 0,77.Psat(Tlimbe) à condition que les stomates restent ouverts. Cette situation, courante le matin et la nuit, pourrait favoriser la formation de rosée sur les feuilles et de façon encore plus évidente sur les parois rocheuses où poussent les lierres. Il serait à ce sujet intéressant de quantifier ce dépôt aqueux, source possiblement non négligeable d’eau, et sa salinité car pellicule d’eau douce et pellicule d’eau salée sont relativement peu miscibles (Pollack, 2019).
Cependant, concernant la feuille, ce gradient de pression de vapeur d’eau ne nous paraît pas à lui seul pouvoir modéliser convenablement les modifications impliquées par la présence de sel sur la transpiration. En effet, un second gradient apparaît entre la pression de vapeur d’eau à l’intérieur de la feuille (voisin de Psat en l’absence de sel) et à la surface salée de la feuille (0,77.Psat). Ceci complexifiant trop le problème (cette surface salée nous semblant devoir être modélisée par l’équivalent hydrique d’un condensateur électrique), nous avons décidé de suspendre nos investigations à ce sujet.
Les poils hélicoïdaux ont-ils une valeur adaptative ?
Chez H. helix, une fraction des poils racinaires portés par les crampons expriment le caractère hélicoïdal. Ces poils, par leur géométrie, renforcent la fixation des crampons dans le support (Björn, 2012). Les étapes de différenciation de ces poils racinaires (croissance, déshydratation, aplatissement et spiralisation des rayons) sont très voisines de celles observées chez les poils foliaires des lierres.
La cuticule est considérée comme très peu perméable à la vapeur d’eau chez le lierre (Sack, 2003). Mais la surface pileuse, qui représente environ le tiers de celle d’une feuille mature, pourrait constituer une zone importante d’échanges de vapeur d’eau. En effet, les poils communiquent avec l’épiderme par un stipe d’ancrage (planche 2A). La déshydratation des poils pourrait être suivie d’une stabilisation de leur géométrie par la spiralisation des rayons (planche 2B). Cette conformation pourrait empêcher qu’un flux de vapeur d’eau ne s’installe entre le limbe, les poils et l’air.
Annexe 8 – Mesures des températures et hygrométries sur site
Les températures des roches, limbes ou autres objets ont été mesurées au thermomètre laser. Les températures et l’hygrométrie de l’air ont été mesurées au thermo-hygromètre. Les températures en pierrier ont été mesurées au thermomètre digital à longue tige captrice.
Annexe 9 – Corrélations surface limbe et flux solaire des lierres
L’étude de la corrélation entre flux solaire journalier et surface des limbes a apporté des résultats inattendus. Contre toute attente, la corrélation entre surface des limbes et flux journalier n’est pas apparue au sein de chaque lignée prise isolément (paroi, éboulis, sommet). À l’inverse elle est très franche (R de Pearson = – 0,82) lorsque sont étudiées dans leur ensemble toutes les lignées de lierres du massif des Calanques. La dimension adaptative, à savoir des feuilles qui se réduisent quand le flux solaire est plus fort, nous paraît évidente et bien traduite par ce dernier résultat. Autant les calculs de surface des dômes et des rayonnements reçus en milieu ouvert sont accessibles, autant ces calculs en hêtraie de la Sainte-Baume sont complexes.
Par chance, nous avons pu observer un sujet proche de H. helix subsp. helix, dont la géométrie est assimilable à un « obus à demi-douille ». Les rayonnements reçus pouvaient être approchés dans cette pineraie assez ouverte (photos 70 et 75).
Hypothèses. La surface globale du lierre étudiée est assimilée à un cylindre d’une hauteur H de 3,5 m surmonté d’un dôme hémisphérique de rayon 1,5 m. Compte tenu des masques du site d’implantation de ce lierre situé en bas de vallon, le rayonnement journalier est assimilé au flux solaire de la période où le soleil est au plus haut, entre 11 et 15 h. L’angle des rayons solaires par rapport à la verticale varie alors entre 20° et 30°. Dans ces conditions et sur cette période de quatre heures, le flux solaire moyen par unité de surface sur un plan horizontal est voisin de 830 W/m². Le flux solaire intercepté est calculé sur une surface constituée I) du projeté orthogonal de la surface du lierre au sol, II) de la surface de l’ombre au sol au-delà de la surface précédente. Par ailleurs, on suppose que les masques des pins voisins et du pin hôte emportent entre 10 et 20 % du flux. On considère que les feuilles du lierre tapissent de façon uniforme la surface foliaire (assimilée à un cylindre surmonté d’un dôme). Une feuille a une surface moyenne estimée à 1 100 mm². Le flux solaire « journalier » par feuille en Wh vaut alors :
flux moyen (Wh) × 4 (heures) × 0.80 (flux non intercepté par les masques) ×
surface sur un plan horizontal du flux intercepté / surface foliaire du lierre × surface d’une feuille.
Les calculs ont été effectués pour R = 1,5 m et H = 3,5 m :
surface du dôme = 2πR2, surface du demi-cylindre = 2πRH ⇒ surface foliaire = 2πR2 + 2πRH ;
- i) surface du projeté orthogonal du lierre = πR2, ii) surface supplémentaire de l’ombre projetée liée à l’incidence des rayons = 2RH tgθ où θ est l’angle moyen des rayons solaires incidents par rapport à la verticale ; surface sur un plan horizontal du flux intercepté = πR2 + 2RH tgθ.
Résultats. Surface foliaire = 47.1 m², surface sur un plan horizontal du flux intercepté = 12.0 m², flux moyen journalier par feuille = 0.74 Wh / jour pour des masques emportant 20 % du flux et 0.84 Wh / jour si les masques en captent 10 %. L’hypothèse d’une unité du flux foliaire journalier par feuille voisin de 0,8 Wh / jour constatée sur les lierres du massif des Calanques semble donc pouvoir s’étendre plus largement au sein de l’espèce H. helix, comme en témoigne ce flux chez un sujet de subsp. helix arboricole.
Annexe 10 – Clef du taxon H. helix
Les limbes sont observés sur les rameaux végétatifs (juvéniles) aux rangs 6 à 8. La longueur du limbe est mesurée entre le pétiole et l’extrémité du lobe central
Tableau 9. Clef de détermination dans le groupe H. helix.
1 – Limbes de 3 à 6 cm de long ……………………………………………………………………………………………………………………………………………………………. 2
1’ – Limbes de 2 à 3,5 cm de long ………………………………………………………………………………………………………………………………………………………. 3
2 – Longueur des pétioles ≥ longueur des limbes ; en général limbes à 5 lobes ………. H. helix subsp. helix
2’ – Longueur des pétioles ≤ longueur des limbes ; en général limbes à 3 lobes .. H. helix subsp. pavonii
3 – Longueur des pétioles = longueur des limbes ; en général limbes à 3 à 5 lobes ……………………………………………………………………………………………………………………………………………………………………………. H. helix subsp. leucoclina
3’ – Longueur des pétioles > longueur des limbes ; en général limbes à 3 lobes ……………………………………………………………………………………………………………………………………………………………………. H. helix subsp. rhizomatifera
Annexe 11 – Prolongements sur l’écologie, les habitats et les communautés floristiques associées aux « lierres des calanques »
Microclimat des habitats extrêmes du massif des Calanques
Dans le massif des Calanques, la masse de roche nue et le peu de rétention d’eau superficielle induisent un réchauffement significatif en journée. En absence d’évaporation, l’énergie solaire réchauffe la roche en surface (figures 9 et 10). Une partie de cette chaleur est transmise à l’atmosphère par échange convectif sous forme de chaleur sensible, une autre stockée dans la roche par conduction, au prorata de la diffusivité thermique du calcaire. L’énergie stockée est ensuite dissipée par rayonnement (Hufty, 2001 ; Don Scott, 2000). Températures clémentes et inertie thermique caractérisent le territoire des calanques.
Lierres des parois karstiques ombragées littorales, Hedera helix L. subsp. pavonii
Falaises maritimes
Maïre : le pied de falaise nord de l’île Maïre, dont le substrat graveleux est enrichi en matière organique par les oiseaux, héberge localement (photo 78) Suaeda vera Forssk. ex G.F. Gmel. et Jacobaea maritima (L.) Pesler & Meijden, indicatrices d’un habitat halonitrophile à physionomie de fruticée maritime, dont l’association est le Cinerario maritimae-Suaedetum verae. Cette fruticée, fragmentaire puisque les caractéristiques de l’alliance de l’Artemision arborescentis (Artemisia arborescens (Vaill.) L. et Melomphis arabica (L.) Raf.) y sont absentes, ne couvre que quelques mètres carrés et n’héberge que certaines de ses caractéristiques, dont Daucus carota L. subsp maritimus (Lam.) Batt. et Oloptum miliaceum (L.) Röser & Hamasha. Matthiola incana (L.) W.T. Aiton est présente sur les rochers de la Corniche et les îles du Frioul. L’association à cinéraire et soude est exposée au nord-est et bénéficie d’un ensoleillement matinal. Mêlés aux espèces citées, quelques rameaux du lierre de Pavon rampent sur le sol. Ces rameaux rampants en contexte ouvert et maritime avaient été remarqués à cet endroit-même (« +H. helix+ sensu A. Knoerr : Maïre, face nord, tapisse les falaises au-dessus des bâtiments et descend quelque peu sur les pentes, poussant à terre, CC » ; Knoerr, 1960). Intrigué par l’originalité floristique du cortège et son habitat, on peut être tenté par la création d’une sous-association hederetosum pavonii du Cinerario maritimae-Suaedetum verae.
Sur l’île Maïre, le glacis aérohalin de la face nord est largement colonisé par une ronce à tiges de couleur grenat au printemps, blanchissant progressivement au cours de l’été (photo 79). Cette ronce joue un rôle structurant sur l’île car elle y est abondante et communique à l’automne une physionomie de « fourré maritime réflecteur » inédit, probablement utile à la survie du lierre (coévolution basée sur le mutualisme ?). Cette ronce possède des cannes rigides, quadrangulaires, munies d’aiguillons acérés à base épaisse. Elle ne se rapporte pas à Rubus obtectus Boulay (ronce maritime du secteur Antibes-île Sainte-Marguerite) d’après la lecture de sa diagnose faisant référence à ses corolles blanches (des photos du type de R. obtectus sont disponibles sur le site du MNHN). La ronce du littoral marseillais possède une corolle rose pâle, elle est présente en quelques points salés sur le continent (Saména, mont Rose) et sous le pas de la Cabre au vallon des Aiguilles. Elle est différente de R. ulmifolius, reconnaissable à ses corolles pourpres, ses cannes violacées, brunâtres en hiver, à aiguillons plus courts et moins forts. Nous avons la conviction que la ronce halophile du littoral marseillais ne se rapporte à aucune entité décrite et attirons l’attention des rubologues sur cette « micro-espèce ».
La physionomie du lierre de paroi sur l’île Maïre évoque une draperie dense sur une falaise parabolique. On retrouve cette physionomie et cet habitat sur le continent (falaises du pas de la Cabre, Trois Gancets, Trois Arches et rocher Saint-Michel). La parabole pourrait avoir un effet « concentrateur » d’albédo.
Pied de falaise en ambiance mésotherme
Le pied de falaise du Mestrallet héberge le lierre de Pavon. Celui-ci est abondant et forme également une draperie dense sur la falaise (photo 1). Le pied est relativement dégagé par la présence d’une pelouse fraîche hébergeant quelques marqueurs subméditerranéens [Sesleria caerula (L.) Ard., Brachypodium pinnatum (L.) P. Beauv.(= « rupestre ») et Laserpitium siler L. (non revu mais cité par Molinier, 1980)]. À cet endroit, le lierre de Pavon bénéficie d’un fort albédo de la falaise en vis-à-vis du canyon (photo 1). Cette ambiance mésotherme pourrait témoigner d’une tolérance thermique chez ce lierre de paroi.
Association fragmentaire : Erysimo nevadensis-Seslerietum caerulae Molin. 1934) ; synchorologie : R sur Puget, plus C sur Carpiagne/mont Saint-Cyr d’où l’association fut décrite (Braun-Blanquet et al., 1952).
Vires d’altitude
Nous avons repéré des lierres de Pavon sur des vires inaccessibles (ubacs de Marseilleveyre et du mont Puget). Sans avoir été en mesure d’effectuer des relevés in situ, nous pensons que le cortège est constitué de thérophytes naines et de chaméphytes tel Thymus vulgaris. Ce type de substrat rocheux sec, sans capacité hydrique, oligotrophe, ne peut héberger que des lithophytes de type Petrosedum spp. (Sedion micrantho-sediformis selon Bardat et al., 2004) mosaïquées avec des pelouses d’éphémérophytes et thérophytes naines telles que citées dans les cahiers d’habitat (annuelles des Thero-Brachypodietea ; Bensettiti et al., 2005 : 222), probablement sous une déclinaison Vulpio unilateralis-Desmazieretum rigidi, ou bien, sur les sols squelettiques que ces dalles peuvent offrir, des pelouses à thérophytes méditerranéennes mésothermes (Trachynion distachyae). Tous ces habitats ont une dynamique nulle à faible. Ils sont à caractère permanent en ce qui concerne les tonsures à orpins ou évoluent très lentement vers un recouvrement en chaméphytes pour ce qui est des pelouses de thérophytes naines (Bensettiti et al., 2005). Ces dernières ont un pouvoir de recouvrement faible et sporadique compte tenu de la brièveté de leur cycle végétatif.
La falaise elle-même est abrupte et presque nue. Il n’y a guère que les doradilles les plus xérorésistantes pour s’accommoder de ce type d’habitat en fissures étroites, où le peu de matière nourricière accumulée risque l’élimination lors de pluies torrentielles. La physionomie de cet habitat de vire frappe par le contraste qu’offrent la vitalité du lierre grimpant sur une falaise nue et le liseré de thérophytes à sa base.
Les communautés végétales de ces falaises ne suivent pas le concept admettant que les orophytes sud-européennes de falaise peuvent migrer vers la mer à la faveur des microclimats frais d’ubac. Cette hypothèse est également infirmée par les catalogues floristiques (Albert & Jahandiez, 1908 ; Molinier, 1980 ; Pavon & Pires, 2020). Il semblerait plutôt qu’il existe une ligne imaginaire Étoile-Carpiagne-Sainte-Baume au-dessous de laquelle ces rupicoles ne transgressent pas ; c’est le cas de Hieracium humile Jacq., Globularia repens Lam., Minuartia rostrata (Pers.) Rchb. ; cette ligne coïncide avec l’influence maritime réchauffant les chaînes littorales. Compte tenu de la lacune dans les connaissances phytosociologiques actuelles, il serait nécessaire de proposer une unité phytosociologique nouvelle pour caractériser les groupements rupicoles littoraux exposées à l’est/nord/ouest organisés autour du lierre de Pavon, désigné en tant qu’espèce de strate compte-tenu de sa présence constante et sa dominance sur plusieurs sites de paroi karstique.
Physionomie du paysage : draperie dense recouvrant les falaises karstiques souvent paraboliques.
Synécologie : milieux ouverts sublittoraux exposés nord ou à fenêtre étroite, supplémentés en albédo provenant de la mer ou des milieux de teinte claire environnants.
Synchorologie : voir ci-dessous.
Arborescence des groupements phytosociologiques
Le lierre de Pavon s’intègre dans les communautés suivantes :
Falaises avec végétations des côtes méditerranéennes avec Limonium spp. endémiques
Végétations aérohalophiles pionnières de fissures de falaises méditerranéennes
Crithmo maritimi-Limonietea Braun-Blanq. in Braun-Blanq. et al. 1952
Crithmo maritimi- Limonietalia Molin. 1934
Crithmo maritimi-Limonion Molin. 1934
Crithmo maritimi-Limonietum pseudominutae Molin. 1934 (Marseille : En Vau, île Maïre : massif de la Nerthe : calanque de l’Establon ? ; La Ciotat : anse du Sec)
Erodion corcisi ?
Crithmo maritimi-Limonietum obtusifolii (à vérifier : Bonifacio, au bas de la falaise du port ?),
Communautés thermoméditerranéennes des falaises maritimes
Rosmarinetea officinalis Rivas Mart. et al. 1991
Helichrysetalia italici Biondi & Géhu in Géhu & Biondi 1994
Euphorbion pithyusae Biondi & Géhu in Géhu & Biondi 1994
Astragalo massiliensis-Plantaginetum subulatae (Samena : route !, Maïre !)
Frankenio laevis-Camphorosmetum monspeliacae (Samena : parking !)
Diantho « frioulensis »-Thymelaeetum tartonrairae (nom incorrect prov. ; mont Rose !, Maïre !)
Communautés sous falaises des substrats graveleux enrichis en matière organique liée aux oiseaux marins
Pegano harmalae-Salsoletea vermiculatae Braun-Blanq. & O. Bolòs 1958
Salsolo vermiculatae-Peganetalia harmalae Braun-Blanq. & O. Bolòs 1958
Artemision arborescentis Géhu & Biondi 1994
Cinerario maritimae-Suaedetum verae (Marseille : île Maïre ; Corse : Bonifacio ?) ; à rechercher à Marseille : falaises rue du Bois Sacré… ; faciès à lierre de Pavon à décrire.
Communautés des falaises calcaires méditerranéennes thermophiles
Groupements rupicoles à lierre de Pavon, Asplenium xérophiles reviviscents (A. petrarchae, A. ruta-muraria, A. trichomanes) et Thymus vulgaris. À décrire car le Sileno saxifragae-Asplenietum fontani représente assez mal le biotope sublittoral de paroi nord ; Marseilleveyre : pas de la Cabre, Trois Gancets, Trois Arches, grotte de l’Ermite, vallon des Aiguilles, pas de la Demi-Lune) ; Puget : ubac ; stations putatives à vérifier dans le Var : mont Caumes, mont Faron au fort Faron, Roquefort-la-Bédoule au rocher de Juhlans, ubac du Gros Cerveau.
Végétations des vires calcaires exposées au nord des chaînes littorales
Sedo albi-Scleranthetea biennis Braun-Blanq. 1955
Alysso alyssoidis-Sedetalia acris Moravec 1967
Sedion micrantho-sediformis Rivas Mart. et al. in Sanchez Gomes & Alcaraz 1993 ?
Vulpio unilateralis-Desmazieretum rigidi (ubacs de Marseilleveyre et du mont Puget)
Végétations des pieds de falaise en ambiance mésotherme
Festuco valesiaceae-Brometea erecti Braun-Blanq. & Tüxen in Klika & Hadač 1944
Ononidetalia striatae Braun-Blanq., Emb. & Molin. ex Braun-Blanq. 1950
Ononidion striatae Blanq. & Susplugas 1937
Erysimo nevadensis-Seslerietum caeruleae (mont Puget : Mestrallet !)
Lierre d’éboulis, Hedera helix L. subsp. leucoclina, écotype mésoméditerranéen
Les lierres d’éboulis s’implantent à la marge des fruticées, en bordure fixée d’éboulis mobiles. La fruticée des éboulis fixés est surtout composée de lianes lapidicoles (Rubus ulmifolius, Lonicera implexa, Smilax aspera) et d’arbustes (Jasminum fruticans, Amelanchier ovalis, Rhus coriaria). Sur les coulées mobiles, on retrouve çà et là le cortège du Gouffeion arenarioidis bien caractérisé par Molinier en 1934. Cette flore glaréicole (Bardat et al., 2004) de thérophytes et de chasmophytes est localisée sur des tertres stabilisés par le mélange de graviers et de terre fine. Du fait des contraintes, les éboulis mobiles sont en majorité évités par la végétation. Les lierres d’éboulis poussent toutefois sur ces deux milieux. La seule espèce que nous avons vue présente très près des lierres dans la zone mobile est Geranium purpureum Vill., éphémérophyte naine, donc peu susceptible de recouvrir la surface. Le géranium pourpre s’intègre à l’ensemble du Gouffeietum arenarioidis des éboulis mobiles, mais son rythme de croissance et sa floraison précoce le prémunissent d’une dessiccation précoce.
Certains lierres poussent à l’état isolé. L’indice de sociabilité de ces lierres est donc variable : il est de 1 dans le cas de lierres d’éboulis isolés (suite à déprise du cortège « fixateur » : remise en mouvement du substrat, passage du feu n’épargnant que les souches de lierre ?) à 5 en ce qui concerne les individus évoluant en marge de l’éboulis mobile, en peuplements denses au sein du cortège « fixateur ». Quand le cortège fixateur exerce une trop forte compétition, le lierre exploite la surface mobile par sa stratégie de tortue. Le lierre d’éboulis n’est pas intégrable au cortège du Linario supinae-Gouffeietum arenarioidis. Sa caractérisation phytosociologique est toutefois duelle car il végète au sein des fruticées lapidicoles et se positionne en marge du Gouffeietum par tropisme envers la surface réfléchissante qu’il trouve à sa proximité. Il sera utile dans un travail ultérieur de créer une association nouvelle caractérisant le cortège lapidicole des éboulis fixés hébergeant, à leur marge, des espèces à fort tropisme envers les milieux clairs.
Synécologie : communautés denses de lapidicoles évoluant au contact des surfaces nues réfléchissantes.
Synchorologie : Puget (Mestrallet, AR), Marseilleveyre (vallons des Aiguilles AR, Malvallon RR). À rechercher Ceyreste, Allauch, par exemple au Ratier…
Physionomie : paysage de « layons » à endémiques, alternant dans le sens de la pente coulées mobiles dénuées de végétation et coulées fixées gagnées par une végétation majoritairement lianescente.
Lierre de sommets, Hedera helix L. subsp. leucoclina, écotype supraméditerranéen
L’environnement optimal du lierre des sommets n’est pas le lapiaz (à dynamique lente vers une garrigue à romarin via le stade Genistion lobelii) ni la dalle à genévrier rouge (sans dynamique apparente), mais le pierrier sous-sommital, lui aussi sans dynamique manifeste, sur lequel romarin et genévrier rouge échouent à coloniser un espace soumis à des contraintes sévères (cf partie 3). Cet habitat, passé relativement inaperçu, est bien distinct des deux premiers. II fut néanmoins singularisé par Molinier en 1934, le décrivant près du « sommet de Marseilleveyre et du Garlaban » en termes de faciès du Linario supinae-Gouffeietum arenarioidis. Les plantes caractéristiques citées dans son étude sont Santolina (decumbens) et Laserpitium gallicum (nulle citation de lierre supraméditerranéen). Dans un travail ultérieur, nous préciserons la consistance du syntaxon accompagnant ce lierre et sa synchorologie. Il sera sans doute nécessaire de créer une unité phytosociologique nouvelle, et probablement une unité supérieure dans laquelle nous indiquerons les caractéristiques que nous avons déjà aperçues : Lactuca viminea (L.) J. Presl & C. Presl subsp. chondrilliflora (Borreau) St.-Lag. et quelques autres « albédophiles » telles que Santolina decumbens, Laserpitium gallicum et Rubia peregrina. Ces espèces ont toutes en commun l’élection de cet habitat hostile figé dans un état permanent (Aboucaya et al., 2021). On retrouve sur ce pierrier sous-sommital de rares transgressives des habitats voisins telles que Festuca cinerea Vill. RR, Teucrium flavum L. R, provenant du matorral de genévriers rouges, et Genista lobelii tout aussi erratique provenant du lapiaz voisin.
Le lapiaz héberge aussi quelques individus de lierre leucocline, néanmoins ces derniers y ont une plus faible vitalité, car subissant à la fois la concurrence d’espèces de la garrigue à romarin (qui le privent d’irradiation directement ou indirectement via des masques) et des espèces sociales en coussins du Genistetum lobelii qui, du fait de leur port tapissant, recouvrent le substratum. On peut s’interroger sur l’état primaire hypothétique de l’habitat de pierrier sous-sommital. Le lierre leucocline a-t-il colonisé cette zone inhospitalière en tant que plante pionnière ou bien y a-t-il survécu à l’état solitaire, après déprise des fourrés sclérophylles (pastoralisme ancien, exploitation ancienne, incendie ; Conseil général des Bouches-du-Rhône, 2007, fiche 17 : 11). Les arguments en faveur de l’état permanent de certains habitats des calanques ont été évoqués in Conseil général des Bouches du Rhône, fiche 17 : 12. La stratégie au feu de cette sous-espèce est disruptive et s’oppose à la stratégie d’espèces sclérophiles pyrophiles sérotiniques : H. h. subsp. leucoclina choisit l’évitement et la dispersion au sein d’un biotope minéral.
Difficultés à intégrer H. helix subsp. leucoclina dans des communautés connues
Nous avons eu le plus grand mal à intégrer les lierres d’éboulis et de sommets aux communautés déjà connues. Le lierre leucocline des sommets des chaînes littorales ne s’intègre pas de façon satisfaisante aux ensembles agropastoraux distingués par Bensettiti et al. (2005, 1), lequel rassemble dans un même ensemble, sous le nom Landes épineuses supraméditerranéennes et crêtes ventées des Préalpes méridionales, les communautés de garides peu épineuses pâturées à Genista provincialis Coulot, Rabaute & Rebuffel (région des Alpes-de-Haute-Provence, dont le syntaxon correspond au Genistetum pulchellae (Lavagne & Rebuffel, 1997), avec les ensembles plus australs, plus épineux et non pâturés du Genistion lobelii Molin. 1934. La carte de répartition du cahier d’habitat exclut d’ailleurs les stations les plus méridionales où le Genistion lobelii n’est que fragmentaire et enrichi en éléments thermophiles (zones exclues sur la carte : Marseilleveyre, Puget, mont Faron). Le Genisto lobelii-Potentilletum velutinae Molin. 1934 repose sur quinze relevés (massifs de l’Étoile, Carpiagne, Sainte-Victoire, Olympe et Sainte-Baume). Cette association a été lectotypifiée par Royer & Ferrez en 2020 par la désignation du relevé 5 de la Sainte-Victoire où Genista lobelii a un indice d’abondance-dominance de 4.3, c‘est-à-dire couvrant entre 25 et 50% de la surface du sol au pic des Mouches, associé à Potentilla velutina Lehm. (AD 2.3). Il apparaît donc inopportun de rassembler ces deux habitats, tranchés par leur écologie distincte avec des espèces indicatrices aussi différentes. Il paraît nécessaire de créer une unité nouvelle, dédiée aux sommets lapiazés des massifs littoraux habités par des lierres. Dans cette dernière, les espèces caractéristiques du Genistetum lobelii citées par Molinier sont absentes, moins abondantes ou ont moins d’emprise. Il sera nécessaire de créer parallèlement une unité caractérisant les pierriers sous-sommitaux dans lesquels le lierre leucocline évolue en entité solitaire. Hedera helix subsp. leucoclina peut dominer ces communautés supraméditerranéennes et structurer le paysage en lui donnant soit une physionomie mixte de fruticée (lande épineuse), soit une formation alticole subdésertique.
Physionomie du paysage : le lierre leucocline n’étant ni une sclérophyte ni une mésophyte au sens physiologique, le paysage des pierriers sous-sommitaux ne cadre pas avec la phrygane et pas davantage avec la garrigue méditerranéenne, bien que ce paysage ait de loin un aspect en « peau de léopard » (Conseil général des Bouches-du-Rhône, 2007, 17 : 11). À ce jour, ce type de paysage est non décrit à notre connaissance. Nous proposons de le nommer « plateau alticole subdésertique à fruticée sempervirente éparse endémique ».
Synécologie : communautés de crêtes ventées, lande-hérisson infiltrées en éléments sempervirents endémiques, pauvres en éléments cryophiles. Fruticée alticole sempervirente éparse.
Synchorologie : Marseilleveyre (Homme mort), mont Puget (sommet). L’habitat relique existe ailleurs sous un état fragmentaire dégradé, où H. helix subsp. leucoclina est introgressé par H. helix au Mont Faron (sur la crête après le zoo), Baou de Quatre Ouros sur corniches ventées et à Roussargue près du col de l’Espigoulier. Vérifier sa présence à Allauch, Garlaban, Bertagne.
Bibliographie
Ackerfield J. & Wen J., 2002. A morphometric analysis of Hedera L. and its taxonomic implications. Adansonia 24 (2) : 197-212.
Albert A. & Jahandiez E.,1908. Catalogue des plantes vasculaires du Var. Muséum d’histoire naturelle Toulon, Klincksieck, 615 p.
Bardat J., Bioret F., Botineau M., Boullet V., Delpech R., Géhu J.-M., Haury J., Lacoste A.,Rameau J.-C., Royer J.-M., Roux G. & Touffet J., 2004. Prodrome des végétations de France. Patrimoines naturels 61 : 1-121.
Bensettiti F., Bioret F., Roland J., Lacoste J.-P., 2004a. Cahiers d’Habitats Natura 2000, 2 – Habitats côtiers. La Documentation française, Paris, 399 p.
Bensettiti F., Hérard-Logereau K., Van Hes J. & Balmain C., 2004b. Cahiers d’habitats Natura 2000, 5 – Habitats rocheux. La Documentation française, Paris, 381 p.
Bensettiti F., Boullet V., Chavaudret-Laborie C. & Deniaud J., 2005. Cahiers d’habitats Natura 2000, 4 – Habitats agropastoraux. La Documentation français, Paris, 1 : 445 p., 2 : 487 p.
Björn M., Steinbrecher T., Seidel R., Kraft O., Schwaiger R. & Speck T., 2012. Structure, attachment properties, and ecological importance of the attachment system of English ivy (Hedera helix). Journal of Experimental Botany 63 (1) :191-201.
Blanc J.-J., 2012. Les grottes du massif des Calanques (Marseilleveyre – Puget – Riou, France) : géologie, géomorphologie, sédimentologie. Physio-Géo. (6) : 161-200.
Bodelle J. & Margat J.,1980. L’eau souterraine en France. Masson, Paris, 208 p.
Bouquet L., 2007. Mesures et modélisations des propriétés optiques spectrales et directionnelles des feuilles. Thèse 3e cycle, Université Paris 7-Denis Diderot.
Braun-Blanquet J., Roussine N. & Nègre R., 1951. Les groupements végétaux de la France méditerranéenne. CNRS, Service de la carte des groupements végétaux, Paris, 297 p.
Campbell G.S. & Norman J.M.,1998. An introduction to environmental biophysics. Springer-Verlag, 286 p.
Cayet F. & Coulomb Ch., 2018. Signalement d’un écotype halorésistant de lierre dans les calanques de Provence. Le Monde des plantes 517 (2015) : 7-13.
Conseil général des Bouches-du-Rhône, 2007. Atlas des paysages des Bouches-du-Rhône, édition 1, fiche 17. Conseil général des Bouches-du-Rhône, 17 p.
Déom P., 2018. Le lierre. La Hulotte 107 : 2-35.
Don Scott H., 2000. Soil Physics, agricultural and environmental applications. Iowa State University Press, 421 p.
Duche Y., Savazzi R. & Teissier du Cros B., 2012. Guide DFCI, sensibilité des haies face aux incendies de forêt sous climat méditerranéen. Office national des forêts, 29 p.
Gieu G., Ricour J., Rouire J., Philip J. & Monteau R., 2008. Découverte géologique de Marseille. BRGM éditions, 243 p.
Gras R.,1994. Sols caillouteux et production végétale. INRA éditions, Paris, 174 p.
Hopkins W., 2003. Physiologie végétale. Éditions De Boeck Université. 514 p.
Hufty A., 2001. Introduction à la climatologie. Presses de l’université de Laval, De Boeck Univ., 541 p.
Inflovar, 2021. Atlas-catalogue de la flore vasculaire du Var. Naturalia publications et Inflovar, 1 184 p.
Kastendeuch P., Najjar G. & Ringenbach N., 2006. Modélisation du bilan radiatif et d’énergie d’un canyon urbain à Strasbourg. Climatologie 677.
Kerguélen M., 1993. Index synonymique de la flore de France. Patrimoines Naturels 8 : 1-196.
Kessler J. & Chambraud A.,1986. La météo de la France. J.-C. Lattès, Paris.
Knoerr A., 1960. Le milieu, la flore, la végétation, la biologie des halophytes dans l’archipel de Riou et sur la côte sud de Marseille, partie I. Bulletin du Muséum d’histoire naturelle de Marseille XX : 1-173.
Koundouras S., Van Leeuwen C., Seguin G. & Glories Y., 1997. Influence de l’alimentation en eau sur la croissance de la vigne, la maturation des raisins et les caractéristiques des vins, en zone méditerranéenne. Journal international des sciences de la vigne et du vin 33 (4) : 149-160.
Lavagne A. & Rebuffel G., 1997. Contribution à l’étude du Genistetum villarsii dans le centre et le nord du département du Var. Documents phytosociologiques, NS, XVIII : 97-117.
Lewontin R.,1978. L’adaptation. Bibliothèque Pour la science: 132-144.
Linné C. (von), 1753. Species Plantarum, I, p. 202, Stockholm
MacAllister H. & Rutherford A., 1990. Hedera helix L. and Hedera hibernica (Kirchner) Bean (Araliaceae) in the British Isles. Watsonia 18 : 7-16.
MacAllister H., Mill R. & Rutherford A., 1993. New ivies from the Mediterranean area and Macronesia.The Plantsman 15 (2) : 118-119.
McAllister H. & Marshall R., 2017. Recents developments in Hedera. Royal Horticultural Society 16 (2) : 100-105.
McAllister H. & Marshall R., 2017. Hedera, the complete guide. Royal Horticultural Society, 427 p.
Metcalfe D.J., 2005. Hedera helix L. Journal of Ecology 93 : 632-648.
Molinier R., 1934. Études phytosociologiques et écologiques en Provence occidentale. Annales du Muséum d’histoire naturelle de Marseille XXVII : 1-274.
Molinier R., 1980. Catalogue de la flore vasculaire des Bouches-du-Rhône. Bulletin du Muséum d’histoire naturelle de Marseille 49 : 1-225.
Nobel P.,1970. Biophysical Plant Physiology and Ecology. W.H. Freeman & Comp., San Francisco, 608 p.
Parc national des Calanques, 2016. Document d’objectifs du site Natura 2000 n° FR9301602 « Calanques et îles marseillaises – Cap Canaille et massif du Grand Caunet » – Annexe 1 – Fiches descriptives des habitats et espèces d’intérêt communautaire.
Pavon D., 2014. Mémento pour l’aide à la détermination de la flore vasculaire du département des Bouches-du-Rhône. Bulletin de la Société linnéenne de Provence, 247 p.
Pavon D. & Pires M., 2020. Flore des Bouches-du-Rhône. Naturalia.
Pavon D., Véla E. & Médail F., 2020. Are Mediterranean trees well known? Juniperus turbinata (Cupressaceae), a common but misunderstood taxon. Ecologia Mediterranea 46 (2) : 77-104.
Perrin J., 1913, réédition 2014, Les atomes. Flammarion, 74-84.
Pires M., Pavon D. & Médail F., 2018. La flore remarquable des Bouches-du-Rhône. Plantes, milieux naturels et paysages. Biotope, Mèze, 464 p.
Pollack G.H., 2019. The fourth state of water, beyond liquid, solid and vapor. In Osmosis and Diffusion, Ebner & Sons Publishers, chapitre 11 : 183-199.
Royer J.-M. & Ferrez Y., 2020. Contribution au prodrome des végétations de la France : les Festuco-Brometea Braun-Blanq. & Tüxen ex Klika & Hadač 1944. Documents phytosociologiques, 3e série, 13 : 1-302.
Sack L., Cowan P.D., Jaikumar N. & Holdbrook N.M., 2003. The hydrology of leaves: coordination of structure and function in temperate woody species. Plant, cell and environment 26 : 1343-1356.
Stafleu F.A & Lanjouw J.,1981. Index herbariorum, The herbaria of the world, Regnum Vegetabile. IAPT ed., 452 p.
Tassy A., 2012. Karsts côtiers et canyons sous-marins de la marge provençale au Cénozoïque : contrôle géodynamique, eustatique, hydrologique et structural. Thèse de doctorat d’État, Université d’Aix-Marseille.
Tison J.-M., Jauzein Ph. & Michaud H., 2014. Flore de la France méditerranéenne continentale. Naturalia, 2 078 p.
Valcarcel V. & Vargas P., 2010. Quantitative morphology and species delimitation under the general lineage concept: optimization for Hedera. American Journal of Botany 97 (9) :1555-1573.
Valcàrcel V., Guzmàn B., Medina N. G., Vargas P. & Wen J., 2017. Phylogenetic and paleobotanical evidence for late Miocene diversification of theTertiary subtropical lineage of ivies (Hedera L., Araliaceae). BMC Evolutionary Biology 17 : 146.
Viallet-Chabrand S., 2013. Modélisation des variations journalières de la conductance stomatique : apports d’une approche dynamique et conséquences sur l’efficience intrinsèque d’utilisation de l’eau chez le chêne. Thèse en biologie végétale et forestière, université de Lorraine.
Vidal A., 2004. Statistique descriptive et inférentielle avec Excel, approche par l’exemple. Presses universitaires Rennes, 176-182.
Villeneuve M. & Laville P., 2018. Mémoire explicatif de la carte géologique Aubagne-Marseille à 1/50000, 3° édition. BRGM Éditions, Service géologique national, 333 p.
Waisel Y., 1972. Biology of halophytes. In T.T. Kozlowski (ed.), Physiological ecology, Academic Press, New York : 2-379.
Webographie
Granier A., 2019. Les plantes et l’eau, le continuum sol-plante-atmosphère. INRAE [15/11/2021], https://www.plantes-et-eau.fr
Association infoclimat, https://www.infoclimat.fr
MNHN, https://science.mnhn.fr/institution/mnhn/collection/p/item/p04153886.
Liste des herbarium : /http://sweetgum.nybg.org/science/ih/herbarium-list
Tests statistiques, https://www.supagro.fr/cnam-lr/statnet/tables.htm
Cartes et photo aérienne, https://www.geoportail.gouv.fr
Référentiel de nomenclature syntaxonomique et référentiel de nomenclature taxonomique, INPN 2022, https://inpn.mnhn.fr
Remerciements
Direction et agents du Parc national des Calanques pour les autorisations de prélèvement et l’accompagnement sur l’île Maïre ; Hugh McAllister pour l’envoi de plants frais de plusieurs espèces du genre Hedera, sa caryologie et ses conseils ; Naoum Salamé (INRP-ENS Lyon) pour son conseil et appui dans la réalisation des matrices phylogénétiques ; Daniel Pavon et Errol Véla pour leurs conseils bibliographiques et leurs avis éclairés ; Jean-Marc Tison pour les échanges à propos de H. h. subsp. rhizomatifera, la relecture de cet article et ses suggestions ; Bruno de Foucault pour la relecture de cet article et ses suggestions ; Bruno Vila pour la conservation des types à Marseille « Herbier de la région méditerranéenne française, MARS herbarium, Université d’Aix-Marseille » ; Société d’horticulture et d’arboriculture des Bouches-du-Rhône : Virginie Lombard, pour l’accueil d’une parcelle de cultures expérimentales, et Serge Menicucci, pour son appui ; Thibault Vély pour avoir permis d’observer l’île Maïre à partir de la mer.