Les Gagea du Pont du Gard (30)
Title
The Gagea of the Pont du Gard (30)
Résumé
Trois espèces de gagées, Gagea bohemica, G. luberonensis et G. lacaitae ont été découvertes dans le périmètre du « site classé du Pont du Gard » (Vers-Pont-du-Gard, 30). L’inventaire détaillé des populations et les premiers résultats d’un suivi permanent sont présentés. Une étude morphométrique illustre la variabilité du critère « largeur des feuilles basales » pour les trois taxons dans le site.
Abstract
Three species of gagea, Gagea bohemica, G. luberonensis and G. lacaitae were discovered in the perimeter of the « Pont du Gard » classified site (Vers-Pont-du-Gard, 30). The detailed inventory of the populations and the first results of a permanent monitoring are presented. A morphometric study illustrates the variability of the criterion « width of basal leaves » for the three taxa in the site.
1. Le site classé du Pont du Gard
Créé en 2013, le « site classé de l’ensemble formé des gorges du Gardon, du pont du Gard et des garrigues nîmoises » couvre 7760 ha et concerne onze communes (Boyer 2020). Situé à l’est du département du Gard (région Occitanie, France), il est proche de plusieurs grandes agglomérations, notamment Nîmes (25 km au sud) et Avignon (20 km au nord-est). Ce « site classé » englobe entre autres le Grand site du Pont du Gard (407 ha) y compris une cinquantaine d’hectares de propriétés du Département du Gard acquises avec la part départementale de la Taxe d’Aménagement et intégrés au réseau des Espaces Naturels Sensibles Départementaux (ENSD).
Le Grand site est doté d’un Plan de protection des espaces naturels (EPCC du Pont du Gard, 2014) qui dresse, entre autres, un inventaire des enjeux du patrimoine naturel. L’ENSD quant à lui a fait l’objet d’une notice de gestion qui résume les enjeux du patrimoine naturel connus et les principaux axes de gestion conservatoire à envisager (Gaiadomo 2012). Aucun des deux documents ne mentionne la présence d’une espèce du genre Gagea dans le site classé ou alentours.
2. Méthodes
2.1. Prospections
Suite à la découverte de gagées dans le site par deux d’entre nous (CS & PB), une première journée de prospections complémentaires a été organisée le 16/03/2018, lors de laquelle plusieurs populations de Gagea spp. ont été inventoriées. Au vu de l’intérêt fort de cet enjeu nouveau pour le site, il a été décidé de poursuivre les investigations et de mettre en place un dispositif permanent de suivi. Cette action a eu lieu le 08/03/2019, de façon conjointe entre agents du Service Attractivité et Patrimoine Naturel du Département et botanistes de l’association Gard Nature et du Conservatoire d’espaces naturels d’Occitanie (CEN Occitanie). Enfin, une troisième journée d’inventaires et de suivis scientifiques a été réalisée par ces deux mêmes structures le 04/03/2022. L’ensemble des journées a été financé par le Département du Gard dans le cadre de son programme annuel d’actions avec le CEN Occitanie.
Les données relevées alimentent le Système d’Informations du CEN Occitanie et sont automatiquement versées au Système d’Information de l’Inventaire du Patrimoine Naturel (SINP ; https://inpn.mnhn.fr/informations/sinp/presentation).
2.2. Étude morphométrique
Au vu de l’importance de la largeur des feuilles basales (externes) pour la distinction de certains taxons, il nous a semblé intéressant d’étudier ce critère à l’échelle des populations recensées dans le site classé. À cette fin, nous avons réalisé, le 4 mars 2022, une série de mesures des deux feuilles externes de gagées fleuries (minimum une fleur). Les individus mesurés ont été sélectionnés de façon aléatoire, sans vue préalable sur l’appareil végétatif. Les mesures ont été réalisées par trois personnes différentes, à l’aide de pieds à coulisse permettant des mesures à précision d’un 50e de millimètre. Au total, 123 individus ont été mesurés.
L’ensemble des figures a été réalisé sous R (RStudio Team, 2020).
2.3. Suivi permanent
« Mettre en œuvre des suivis scientifiques, pour un gestionnaire, c’est à la fois tenter de comprendre les phénomènes naturels à tous les niveaux (espèces, habitats, écosystèmes, dynamiques temporelles…) et les décrire. C’est aussi évaluer son travail, les objectifs qu’il se sera fixés dans le cadre d’un plan de gestion pour ajuster ses actions » (Danancher et al. 2016).
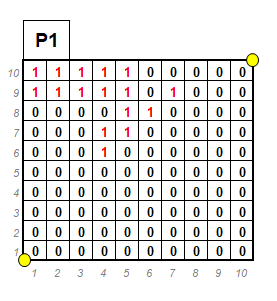
Comme évoqué plus haut, il a été décidé de mettre en place un suivi permanent, afin de disposer d’éléments précis et statistiquement robustes au sujet de l’évolution des populations dans le temps. Dans cet objectif, nous avons mis en place un transect de 5 placettes d’un mètre carré (photos 3&4), subdivisées en 100 mailles de 10 cm x 10 cm (figure 1). Nous y avons appliqué la méthode développée par Gauthier & Thompson (2013, détaillée par Gazaix 2015 ; voir aussi Gauthier et al. 2017 & 2019) qui permet un suivi quantitatif de la population sans distinction des individus. Une telle méthode non-invasive est particulièrement pertinente chez les gagées, puisqu’une distinction des plants est impossible sans déterrer les bulbes.
« La méthode consiste à répertorier maille par maille la présence ou l’absence de l’espèce étudiée et d’analyser ensuite si le nombre d’apparitions par an est plus grand ou plus faible que le nombre de disparitions. Les résultats sont analysés à l’aide du test Chi2 de McNemar et cela en comparant chaque année avec celle d’avant » (Gazaix 2015). Le résultat du test renseigne sur la probabilité que l’évolution observée soit significative.
Ainsi, sur les 5 placettes d’un mètre carré, des données de présence-absence sont produites sur 500 mailles de 100 cm2. Seules les mailles avec changements (gain ou perte) sont prises en compte (Edwards 1948).
À signaler que ce même type de suivi a été installé dès 2014 par le CEFE-CNRS (Gauthier et al., données non publiées) sur une population de Gagea cf. lacaitae dans la Réserve Naturelle Régionale des gorges du Gardon (Bernard 2020). Il sera alors sans doute intéressant de mettre en commun les résultats des suivis sur ces deux sites situés dans la même entité biogéographique.
3. Résultats
3.1. Taxons recensés
Les gagées observées dans le site peuvent être rattachées à trois taxons distincts :
1. Gagea bohemica (Zauschn.) Schult. & Schult.f., 1829
Bref historique
D’après Peterson et al. (2010), Gagea bohemica s.l. se compose de deux formes morphologiquement extrêmes (saxatilis et bohemica) qui, selon les opinions des divers auteurs, sont considérées comme des espèces séparées, des sous-espèces ou comme une seule espèce variable. Cette même étude a démontré, à partir de données moléculaires et morphologiques, l’impossibilité de différencier des taxons spécifiques et infraspécifiques au sein de ce groupe. De ce fait, Tison (2014b) considère Gagea saxatilis comme un « aspect immature de G. bohemica apparaissant sur les stations les plus sèches ».
Critères de détermination
Par rapport aux autres espèces du genre présentes en garrigues de France méditerranéenne, Gagea bohemica se distingue par deux principaux critères, un pédicelle floral plus court que le périgone correspondant (Tison 2014a) et des feuilles basales adultes subtrigones, épaisses comparativement à leur largeur, atteignant au maximum 1 mm de largeur (Tison 2014b).
Statuts
La Gagée de Bohème est une espèce protégée à l’échelle nationale, mais évaluée en « préoccupation mineure » sur la Liste Rouge des espèces menacées en France (UICN et al. 2018). Elle figure sur différentes listes rouges régionales (MNHN & OFB [Ed], 2003-2022), et est classée comme taxon « remarquable » sur la liste pour la première modernisation des ZNIEFF en Languedoc-Roussillon (Conservatoire botanique national méditerranéen de Porquerolles 2005).
Stations gardoises
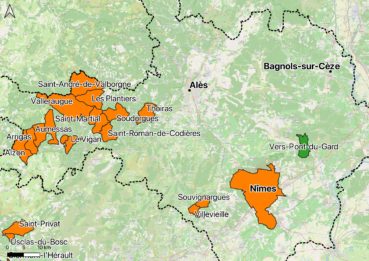
Les Cévennes gardoises constituent un bastion pour la Gagée de Bohème, l’espèce y est encore relativement fréquente sur les pelouses rocailleuses des crêtes sur schistes notamment (carte 1). Par contre, l’espèce est très rare dans la partie plaines et garrigues du département d’après SI Flore (FCBN 2016).
Seules deux mentions sont connues en garrigues nîmoises, l’une du bois de Campagne par l’abbé Souchard (Anonyme 1874) et l’autre par G. Cabanès (1891) des garrigues de Belair près de Caissargues. De ce fait, la présence de la Gagée de Bohème dans le Grand site des gorges du Gardon constitue une donnée inédite. Les stations actuelles les plus proches connues sont situées sur les communes de Villevieille et de Souvignargues, à environ 30 km à vol d’oiseau (FCBN 2016).
2. Gagea luberonensis J-M. Tison 1998
Bref historique
Gagea luberonensis est un taxon scientifiquement jeune, mentionné initialement par Girerd (1990) qui le rattache au groupe bohemica. En 1996, Tison émet l’hypothèse d’une origine hybride, en citant comme espèces parentes Gagea saxatilis et Gagea foliosa. Deux ans plus tard, le taxon est officiellement décrit comme Gagea ×luberonensis, hybride de Gagea bohemica et G. granatellii (Tison 1998b). En 2004 finalement, Tison élève le taxon au rang d’espèce : « D’abord décrit comme hybride local français […], ce taxon […] manifeste une autonomie largement suffisante pour être traité comme espèce ; son origine hybride reste à prouver, et, si elle est exacte, son parent à larges feuilles est plus probablement G. dubia que G. granatellii ». Dans ce même article, Tison signale l’existence de Gagea luberonensis « dans la Sierra Nevada, entre 1800 et 2500 m d’altitude », ainsi qu’en Crète. Peu après, Peruzzi & Bertolucci (2006) et Peruzzi (2008) mentionnent Gagea luberonensis dans plusieurs localités d’Italie centrale (Abruzzes), tout en rediscutant les hypothèses de parenté G. bohemica × « G. dubia » (ce dernier identifié plus tard comme G. ramulosa) vs G. bohemica × G. granatellii. Depuis 2009, les populations espagnoles de la Sierra Nevada sont supposées appartenir à un taxon autre que G. luberonensis, probablement encore G. bohemica × G. ramulosa (Tison, 2009 : 17 ; Tison et al. 2013 : 427) et celles de Crète, dans leur contexte, pourraient être d’origine hybride entre G. bohemica et le véritable G. dubia, à moins qu’elles ne représentent un stade immature de ce dernier, la seule tentative de culture s’étant avérée non concluante. Dans le travail de Tison et al. (2013), le second parent des populations italiennes n’a pas été identifié avec certitude et les plantes grecques et espagnoles n’ont pas pu être analysées. La taxonomie du groupe Gagea granatellii ayant évolué en parallèle, la parenté supposée de G. luberonensis est désormais G. bohemica × G. lacaitae (Tison 2014b). Quant à son aire de répartition, il est plus sûr de la limiter actuellement aux stations françaises : dans la mesure où la génétique confirme l’origine hybride de G. luberonensis et l’identité de ses parents, on peut assez sûrement exclure l’hypothèse d’une espèce indépendante qui se retrouverait inchangée de l’Espagne à la Crète ; il serait plus logique d’envisager plusieurs événements évolutifs distincts à partir d’espèces différentes.
Le rang spécifique des Gagea hybridogènes est surtout basé sur la mise en évidence de la réticulation du genre, en particulier dans la section Didymobulbos qui est en majorité apomictique et évolue exactement comme les genres Hieracium et Taraxacum (cf. par exemple Peterson et al. 2009). À ce titre, il existe obligatoirement un flou taxonomique dans l’état actuel des connaissances : on a pu jusqu’ici identifier l’origine mixte d’un taxon, mais non ses proportions parentales ; or, un simple hybride est défini indépendamment de ces proportions, mais une espèce hybridogène ne l’est pas. Autrement dit, ce qu’on appelle G. luberonensis inclut par défaut de possibles hybrides G. bohemica × G. luberonensis et G. lacaitae × G. luberonensis, qui, le cas échéant, seraient en théorie à séparer de G. luberonensis lui-même, mais, en raison du recouvrement morphologique lié à l’âge du bulbe, ne pourraient être caractérisés que par des analyses moléculaires plus fines. À première vue, les clones grêles des Gras (Ardèche) et de la Sainte-Baume (Var) pourraient être des hybrides avec G. bohemica et les clones robustes du Languedoc oriental, dont celui du Pont du Gard, des hybrides avec G. lacaitae, mais ceci reste donc hypothétique à ce jour.
En conclusion, Gagea luberonensis est à considérer comme un taxon endémique de France méridionale (Bouches-du-Rhône, Gard, Hérault, Var, Vaucluse), et son aire de répartition actuellement connue correspond à quelques détails près aux points affichées sur l’INPN (Inventaire national du patrimoine naturel, MNHN & OFB [Ed] 2003-2022),et GBIF (carte 2 ; GBIF Secreteriat 2021).
Critères de détermination
La Gagée du Luberon est caractérisée par une morphologie intermédiaire entre ses parents Gagea bohemica et G. lacaitae, avec une hampe florale velue (« aspect laineux », voir Chabert 2020) et optimalement développée au-dessus du sol, et des feuilles basales aplaties mais étroites (photo 7 ; au sujet des feuilles basales voir aussi Tison 2021). À noter que la description originelle (Tison 1998b) indique « feuilles basales […] larges de 1 mm ». Plus récemment, cette valeur se voit modifiée par ce même auteur, à respectivement < 2,5 mm (Tison 2014a) voire « 2 mm au maximum » (Tison 2014b, voir aussi Girerd & Roux 2011). Dans leur récente Flore des Bouches-du-Rhône, Pavon & Pires (2020 : 53) proposent quant à eux une fourchette allant de 1 à 3 mm, mais la valeur de 3 mm relève peut-être d’un amalgame entre une feuille basale proprement dite et une caulinaire inférieure à insertion souterraine, ce qui arrive fréquemment lorsque la première basale a disparu.
Statuts
Les listes de protection nationale et régionale sont antérieures à la description du taxon. De ce fait, la Gagée du Luberon ne bénéficie actuellement d’aucun statut de protection réglementaire, elle est toutefois classée « déterminante ZNIEFF » en région PACA (MNHN & OFB [Ed], 2003-2022). Le taxon est par ailleurs évalué « vulnérable » sur la Liste Rouge des espèces menacées en France (UICN et al. 2018). Côté région ex-Languedoc-Roussillon, la Gagée du Luberon ne figurait pas sur les listes pour la première modernisation des ZNIEFF (Conservatoire botanique national méditerranéen de Porquerolles 2005). Toutefois, elle pourrait obtenir un statut ZNIEFF en Occitanie si le critère de l’endémisme était retenu (travail en cours, comm. pers. F. Andrieu).
Stations gardoises
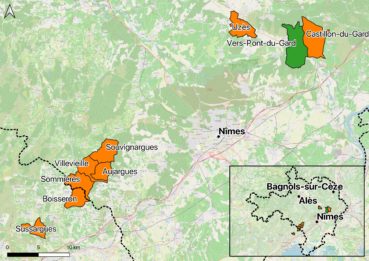
La Gagée du Luberon était connue à proximité mais pas encore sur la commune de Vers-Pont-du-Gard (carte 3).
3. Gagea lacaitae Terracc., 1904
Bref historique
Gagea lacaitae a été décrite par A. Terracciano (1904), à partir d’échantillons en provenance de Sicile et d’Espagne. Longtemps confondu avec Gagea foliosa ou avec G. granatellii dans tous les pays où il existe, avec des tendances dominantes variant d’un pays à l’autre, le taxon a refait surface lors de sa typification par Peruzzi & Tison (2004), avec illustration du lectotype conservé à l’herbier de Naples. Peu après, Ferrer Gallego et al. (2007) mentionnent Gagea lacaitae en France et font le lien avec le taxon « Gagea granatellii type A » évoqué par Tison (1998a). La distinction de Gagea granatellii et de G. lacaitae en France est explicitée par Tison et al. (2013) et dans les flores récentes (Tison 2014a,b).
Critères de détermination
Flora Gallica (Tison 2014a) ne cite qu’un seul critère pour la distinction de la Gagée de Lacaita de la Gagée du Luberon, à savoir la largeur de ses feuilles externes. Il existe d’autres critères qui ne sont pas indiqués puisque leur observation nécessiterait soit de déterrer le bulbe, soit de pratiquer des coupes anatomiques dans les feuilles basales. Entre autres, les deux feuilles basales ne sont pas homologues et la première, lors de la première année de la phase adulte (cf infra « Discussion »), n’a que 3 ou 5 faisceaux vasculaires en coupe transversale chez G. luberonensis, hybrides possibles compris, alors qu’elle en a plus de 5 chez G. lacaitae. Malheureusement, il est impossible d’identifier avec certitude la phase adulte et l’emplacement des feuilles 1 et 2 sans extraction du bulbe, et il est également impossible de compter les faisceaux vasculaires sans coupe anatomique, car ils sont disposés en deux couches chez G. lacaitae. Afin d’éviter toute atteinte de ce type aux taxons protégés que sont les Gagea, ces critères ne sont donc pas explicités dans les flores et il faut se rabattre sur des marqueurs imprécis, comme la simple largeur des feuilles qui ne fonctionne que dans la majorité des cas. C’est un exemple concret d’entrave de la connaissance par la législation.
Peruzzi & Tison (2004) signalent que la largeur des feuilles basales du lectotype de G. lacaitae est d’environ 2 mm, mais cette largeur est manifestement très diminuée par rétraction car l’échantillon n’avait pas été aplati après sa récolte. Certaines flores françaises récentes (Tison 2014 a,b ; Pavon & Pires 2020) indiquent une valeur égale ou supérieure à 3 mm chez les plantes fleuries, alors que d’autres ouvrages supposent une variabilité plus large, allant de 2 à 5 mm (Girerd & Roux 2011, Chabert 2020). Toutefois, la valeur de 2 mm oriente vers des floraisons en phase immature (cf. infra « Discussion »).
Par rapport à la Gagée de Granatelli, les taxons présents au Pont du Gard présentent une hampe florale bien visible et des tépales sans acumen (= non pincés ; photo 8).
Statuts
L’Inventaire National du Patrimoine Naturel affiche pour la Gagée du Lacaita le statut de protection réglementaire à l’échelle nationale (MNHN & OFB [Ed], 2003-2022). Le taxon est par ailleurs évalué « vulnérable » sur la Liste Rouge des espèces menacées en Rhône-Alpes (Conservatoires botaniques nationaux alpin et du Massif central, 2015). Côté région ex-Languedoc-Roussillon, Gagea lacaitae ne figure ni sur la liste pour la première modernisation des ZNIEFF (Conservatoire botanique national méditerranéen de Porquerolles 2005), ni sur celle actuellement en cours d’actualisation.
Stations gardoises
Les prospections ont permis de mettre en évidence d’assez importantes populations de Gagée de Lacaita sur des parcelles propriétés du département dans le périmètre du Grand site. L’espèce est connue sur la commune depuis 2012 (observation H. Fontes, source SI Flore, FCBN 2016).
Les années favorables comme 2018 l’espèce y est très florifère (photos 8&9).
3.2. Étude morphométrique
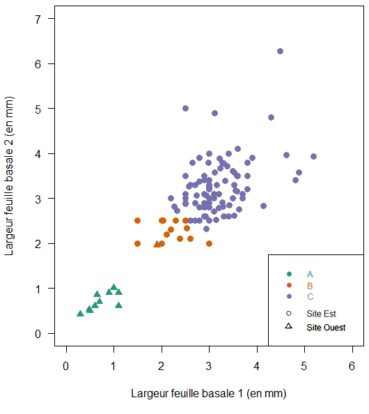
La figure 2 positionne les individus en fonction des deux valeurs mesurées. Nous y avons distingué les trois catégories suivantes :
- Moyenne de largeur des deux feuilles externes ≤ 1,1 mm
- Moyenne de largeur des deux feuilles externes ≤ 2,5 mm
- Moyenne de largeur des deux feuilles externes > 2,5 mm
La limite de « ≤ 2,5 mm » correspond à la valeur indiquée dans la clé du genre Gagea de Flora Gallica (Tison 2014a) pour G. luberonensis.
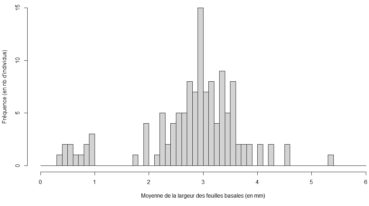
Ici, nous avons attribué les points aux trois catégories citées ci-dessus en fonction de la valeur des deux largeurs mesurées. Le nuage de points permet tout d’abord d’observer la morphologie singulière du groupe A et l’absence d’individus de transition avec le groupe le plus proche. Les valeurs réalisées par ce groupe permettent d’attribuer ces individus au taxon Gagea bohemica. Ensuite, est affiché en orange le groupe B correspondant au critère pour Gagea luberonensis. Ces individus semblent former une entité intermédiaire discrètement délimitée, mais nécessitant confirmation. À cette fin, et pour simplifier l’interprétation des données, nous avons réduit le jeu de données aux seules valeurs moyennes des largeurs, et calculé les fréquences par tranche de 0,1 mm (figure 3). Cette seconde représentation graphique ne permet plus de distinguer deux entités au-delà de 1,8 mm de largeur moyenne. Sur cette base, la distinction des taxons Gagea lacaitae et G. luberonensis dans le site paraît peu évidente.
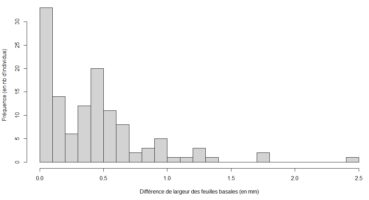
La distribution quelque peu étalée des points, en figure 2, découle de la différence de largeur entre les feuilles basales chez certains individus. Ce fait n’est pas anodin dans la mesure où les deux feuilles basales, d’un même individu, peuvent appartenir à deux catégories de tailles différentes. Sur les 123 individus mesurés, plus de 80 ont une différence de largeur comprise entre 0 et 0,5 mm (figure 4), et il n’est pas rare que la différence dépasse 0,5 mm. Toutefois, nos données au-delà de 1,5 mm sont probablement erronées. De manière générale, la différence paraît non négligeable et il serait intéressant de définir un procédé standardisé pour la prise en compte des deux mesures de largeur.
3.3. Inventaire détaillé des stations
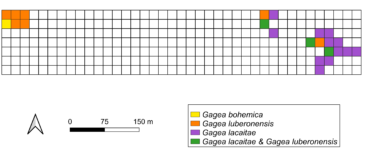
Sur la base des trois catégories précisées ci-dessus, et des données géolocalisées comprenant aussi la largeur des feuilles externes de chaque individu, nous avons dressé un inventaire détaillé des stations (carte 4). Il s’avère que la station Ouest abrite Gagea bohemica et G. cf. luberonensis, alors que le secteur Est présente des populations mixtes de ce dernier avec G. lacaitae.
La population de Gagea bohemica est la plus faible, nous l’estimons à quelques centaines d’individus, alors que celles des deux autres taxons dépassent probablement le millier, au vu des très nombreux pieds stériles présents.
Cette cartographie repose ainsi sur des valeurs facilement reproductibles et pourrait, de ce fait, constituer une base de données pour un suivi des populations à l’échelle du site.
3.4. Suivi sur placettes
Lors du relevé initial en 2019, la présence de Gagea spp. avait été notée dans 175 mailles (soit 35 %) du transect. En 2022, une légère régression est observée avec 38 gains pour 51 pertes. La valeur obtenue grâce au test Chi2 de McNemar (p = 0,168) correspond toutefois à une différence non significative. Nous pourrions en déduire que la population y est actuellement stable malgré les pressions observées sur le site. Notamment, les dégâts de prédation par les Sangliers, observés en 2019, n’ont pas eu d’impact trop néfaste sur la population de gagées. D’ailleurs, aucune prédation n‘a été constatée en 2022.
Reste à signaler que nous n’avions pas distingué les deux taxons présents lors du relevé initial et du premier suivi. Or, aussi bien Gagea bohemica que G. cf. luberonensis sont présentes sur le transect. Il serait intéressant de différencier ces deux taxons dès le prochain suivi.
Ce type de suivi, très limité dans l’espace mais plus propice à l’analyse statistique des évolutions observées, a permis de mettre en évidence la relative – et attendue – stabilité de la population mixte de Gagea bohemica et G. cf. luberonensis. Ainsi, le site est désormais doté de deux dispositifs de suivi à différentes échelles qui pourraient contribuer à l’évaluation de la gestion du site à moyen ou même long terme.
4. Discussion
La clarification des critères de distinction des Gagea connues en France au cours de ces vingt dernières années, notamment grâce à la publication des flores de référence (Tison 2014a,b), a permis d’établir des cartes de répartition paraissant déjà relativement cohérentes. Nos données ajoutent une commune à l’aire de répartition des gagées de Bohême et du Luberon, et incitent à chercher ces taxons sur d’autres communes des garrigues nord-nîmoises, notamment entre Uzès et Souvignargues (cartes 1&3).
Concernant Gagea luberonensis et G. lacaitae, un seul critère donné par les flores, par défaut (cf. supra), permet de les différencier. Jusqu’à présent, les deux taxons n’avaient pas encore fait l’objet d’étude morphométrique comparée. Nos mesures aléatoires d’un échantillon a priori représentatif d’une population mixte ne montrent pas de hiatus net entre les deux taxons, dans le site du Pont du Gard. Ceci est à relativiser par la possible origine hybride du clone occupant ce site (cf. G. lacaitae × G. luberonensis, cf. supra) et, quoi qu’il en soit, par le fait qu’il appartient au pôle de G. luberonensis s.l. le plus proche de G. lacaitae. À cette proximité morphologique, il faut ajouter l’imprécision liée à la phase ontogénique : les cultures expérimentales de ces taxons, réalisées dans les années 2000 grâce à l’aide du Conservatoire botanique national méditerranéen de Porquerolles, ont montré que la seconde feuille basale est plus étroite que la première lors de la phase immature, où se produisent déjà quelques floraisons, mais devient progressivement plus large qu’elle au cours de la phase adulte, jusqu’à + 15-20 % pour les rares individus arrivant à produire une troisième ou quatrième floraison avant de mourir. Il faut savoir aussi que la première feuille elle-même augmente légèrement en largeur chaque année durant toute cette période. Sur cette base, il est possible de trouver une feuille basale de G. luberonensis plus large qu’une feuille basale de G. lacaitae, même en se limitant aux formes typiques et aux plantes fleuries : la comparaison n’est significative que sur ce qui est comparable. Ainsi, dans les stations étudiées, nous n’avons pas réussi à déterminer avec certitude chaque individu de Gagea. En attendant d’autres éléments facilitant la détermination des gagées, nous suggérons de systématiquement associer des mesures précises de largeur des feuilles basales lors des inventaires de terrain, tout en essayant de se limiter autant que possible au début de la phase adulte, i.e. de ne mesurer que celles des individus ayant une hampe aérienne développée, portant 2 à 4 fleurs, et dépourvue de gros amas basal de bulbilles. Ceci sera toutefois biaisé par les individus produisant ces bulbilles en position franchement souterraine, donc non observables sans extraction.
Dans la mesure où l’objectif du gestionnaire consiste à conserver la biodiversité y compris les processus qui relient les espèces entre elles, la stratégie conservatoire consistera à préserver l’ensemble des zones de présence de Gagea spp. (voir aussi Fontes et al. 2019).
Bibliographie
Anonyme, 1874. Note sur deux espèces du genre gagea, nouvelles pour la Gard. Bulletin de la Société d’Étude des Sciences Naturelles de Nîmes 1 : 42-43.
Bernard P., 2020. Rapport d’activités 2020 de la Réserve Naturelle Régionale des gorges du Gardon. CEN Occitanie, 27 p..
Boyer J.-M., 2020. Rapport à la commission supérieure des sites, perspectives et paysages du 23 janvier 2020 – Renouvellement du label Grand Site de France du pont du Gard (département du Gard). – Rapport CGEDD n°012975-01, 22 p. https://cgedd.documentation.developpement-durable.gouv.fr/documents/Affaires-0011645/012975-01_rapport-publie.pdf;jsessionid=A5E550D7F6E340D5D57655FDF6F47EB4
Cabanès G., 1891. Matériaux pour le prodrome d’histoire naturelle du département du Gard – Partie botanique – Catalogue des plantes non mentionnées dans l’ouvrage de De Pouzolz et nouvelles pour la flore du département du Gard. Bulletin de la Société d’Étude des Sciences Naturelles de Nîmes 19 : 8-81.
Chabert J.-P., 2020. Le genre Gagea en Provence occidentale. Publié en ligne : http://jeanpierre.chabert.free.fr/Bota/Fiches/Gagea.pdf
Conservatoire botanique national méditerranéen de Porquerolles, 2005. Modernisation des ZNIEFF du Languedoc Roussillon. Espèces végétales déterminantes pour la constitution des ZNIEFF. Méthodes et résultats. Rapport Conservatoire botanique national méditerranéen de Porquerolles, Direction Régionale de l’Environnement Languedoc-Roussillon, 47 p.
Conservatoires botaniques nationaux alpin et du Massif central, 2015. Liste rouge de la flore vasculaire de Rhône-Alpes, 52 p. https://inpn.mnhn.fr/docs/LR_FCE/LR_regionale/Rh%C3%B4ne-Alpes/Livret+LR+Rh%C3%B4ne-Alpes_web.pdf
Danancher D., Besnard A., Dentant C., Doledec S., Gauthier P., Letourneau A., Miaud C., Pache G., Thompson J., Tully T., Vallod D. & Wolff A., 2016. Définir, mettre en œuvre et analyser des suivis scientifiques en espaces naturels, CEN Rhône-Alpes, 16 p. https://www.cen-rhonealpes.fr/wp-content/uploads/2016/10/Synthese-journee-suivi-scientifique.pdf
Edwards A.L., 1948. Note on the “correction for continuity” in testing the significance of the difference between correlated proportions. Psychometrika 13 (3) : 185-187.
EPCC du Pont du Gard, 2014. Plan de protection des espaces naturels du Pont du Gard 2013-2018 – Rapport phase 1 : diagnostic, enjeux, orientations de gestion, Document de travail-rapport provisoire. Rapport BRL ingénierie, ECO-MED, 59 p. & annexes.
FCBN, 2016. SI Flore – Système national d’Information flore, fonge, végétation et habitats. https://siflore.fcbn.fr/?cd_ref=&r=metro
Ferrer Gallego P.P., Laguna Lumbreras E., Alba Villegas S. & Tison J.-M., 2007. Sobre la presencia de Gagea lacaitae A. Terracc. en la flora valenciana. Acta Botanica Malacitana 32 : 67-78.
Fontes H., Gazaix A. & Papuga G., 2019. Heterogeneous forest structures favor persistence of the grassland Mediterranean geophyte Gagea lacaitae. Botany Letters, https://doi.org/10.1080/23818107.2019.1668295
Gaiadomo, 2012. Notice de gestion de l’Espace Naturel Sensible Départemental du Pont Du Gard. Rapport GAIADOMO, Conseil Général du Gard, 31 p. & annexes.
Gauthier P. & Thompson J.D., 2013. « C’est possible : suivre une population sans pouvoir identifier les individus ». – Espaces Naturels 41 : 27. @ : http://www.espaces-naturels.info/c-est-possible-suivre-population-sans-pouvoir-identifier-individus
Gauthier P., Pons V., Fisogni A., Murru V., Berjano R., Dessena S., Maccioni A., Chelo C., Doncieux A., Papuga G. & Thompson J.D., 2019. Assessing vulnerability of listed Mediterranean plants based on population monitoring. Journal for Nature Conservation 52 : 125758. https://doi.org/10.1016/j.jnc.2019.125758
Gauthier P., Pons V., Letourneau A., Klesczewski M., Papuga G. & Thompson J.D., 2017. Combining population monitoring with habitat vulnerability to assess conservation status in populations of rare and endangered plants. Journal for Nature Conservation 37 : 83-95. https://doi.org/10.1016/j.jnc.2017.03.005
Gazaix A., 2015. Bilan et stratégie des suivis scientifiques de la flore patrimoniale sur les sites gérés par le CEN L-R. – Rapport de stage Master 1ère année IEGB, Faculté des sciences de l’Université de Montpellier, Conservatoire d’espaces naturels du Languedoc-Roussillon : 51 p. & annexes.
GBIF Secretariat, 2021. Gagea luberonensis J.-M.Tison in GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org on 2022-02-12.
Girerd B., 1990. La flore du département du Vaucluse, nouvel inventaire. Éd. Barthélémy, Lyon, 393 p.
Girerd B. & Roux J.-P., 2011. Flore du Vaucluse. Éd. Parthénope, Méze : 1024 p.
MNHN & OFB [Ed], 2003-2022. Inventaire national du patrimoine naturel (INPN), Site web : https://inpn.mnhn.fr, Consulté le 12 février 2022.
Pavon D. & Pires M., 2020. Flore des Bouches-du-Rhône. Éd. Naturalia, Turriers, 351 p.
Peruzzi, L., 2008. Hybridity as a main evolutionary force in the genus Gagea Salisb. (Liliaceae). Plant Biosystems 142 : 179-184. DOI :10.1080/11263500701873042
Peruzzi L. & F. Bartolucci F., 2006. Gagea luberonensis J.-M. Tison (Liliaceae) new for the Italian flora. Webbia : Journal of Plant Taxonomy and Geography 61(1) : 1-12. DOI : 10.1080/00837792.2006.10670789
Peruzzi, L. & Tison J.-M., 2004. Typification and taxonomic status of eleven taxa of Gagea Salisb. (Liliaceae) described by Achille and Nicola Terracciano and conserved at Napoli (NAP). Candollea 59(2) : 325-345.
Peterson A., Harpke D., Peruzzi L., Levichev I., Tison J. -M. & Peterson J., 2009. Hybridization drives speciation in Gagea (Liliaceae). Plant Systematics and Evolution 278 : 133–148. https://doi.org/10.1007/s00606-008-0102-3
Peterson A., Harpke D., Peruzzi L., Tison J. -M., John H. & Peterson J., 2010. Gagea bohemica (Liliaceae), a highly variable monotypic species within Gagea sect. Didymobulbos. Plant Biosystems 144 (2) : 308-322. http://dx.doi.org/10.1080/11263500903374625
RStudio Team, 2020. RStudio: Integrated Development for R. RStudio, PBC, Boston, MA URL http://www.rstudio.com/.
Terracciano, A., 1904. Gagearum novarum diagnoses. Bollettino Societá Orticola di Palermo 2(3) : 3-10.
Tison J.-M., 1996. Révision des Gagea du groupe bohemica en France. Le Monde des plantes 455 : 11-17.
Tison J.-M., 1996. Le Gagea du Petit Luberon. Le Monde des plantes 455 : 17.
Tison J.-M., 1998a. Gagea granatellii (Parl.) Parl. en France. Le Monde des plantes 462 : 1-6.
Tison J.-M., 1998b. Note complémentaire sur quelques Gagea français. Le Monde des plantes 462 : 7-8.
Tison, J.-M., 2004. Identity and taxonomy of Gagea polymorpha Boiss. Candollea. 59 : 109-117.
Tison J.-M., 2009. Un update of the genus Gagea Salisb. (Liliaceae) in the Iberian peninsula. Lagascalia 29 : 7-22.
Tison J.-M., 2014a. Gagea Salisb. In J.-M. Tison & B. de Foucault (coords.), Flora Gallica, Flore de France, Biotope éditions, Mèze : 155-157.
Tison J.-M., 2014b. Gagea Salisb. In J.-M. Tison, Ph. Jauzein & H. Michaud, 2014. Flore de la France méditerranéenne continentale, Naturalia Publications, Turriers : 213-218.
Tison J.-M., 2021. Gagea luberonensis J.-M. Tison. In : Association pour l’inventaire de la flore du Var. Atlas cartographique de la flore vasculaire du Var. Éd. Association pour l’inventaire de la flore du Var/Naturalia : 139.
Tison J.-M & Peterson A., Harpke D. & Peruzzi L., 2013. Reticulate evolution of the critical Mediterranean Gagea sect. Didymobulbos (Liliaceae) and its taxonomic implications. Plant Systematics and Evolution 299 : 413-438. DOI : 10.1007/s00606-012-0731-4.
UICN France, FCBN, AFB & MNHN, 2018. La Liste Rouge des espèces menacées de France – Chapitre Flore vasculaire de France métropolitaine. Paris : 32 p. https://inpn.mnhn.fr/docs/LR_FCE/Liste_rouge_Flore_vasculaire_Metropole_2018.pdf
Remerciements
Les auteurs expriment leur gratitude aux personnes suivantes : Frédéric Andrieu, Jean-Pierre Ansonnaud, Romain Bartheld, Christophe Girod, Christine Marsteau (compléments bibliographiques), Elodie Klesczewski (relecture).