Essai de synthèse des fourrés orophiles des Betulo carpaticae-Alnetea viridis du Massif central
Title
Overview essay of Massif central Betulo carpaticae-Alnetea viridis mountain thickets
Résumé
Sur la base de relevés phytosociologiques inédits et provenant de la littérature, nous proposons une première synthèse régionale des fourrés d’optimum boréo-alpins de l’étage montagnard et subalpin du Massif central. Les formations structurées par Salix lapponum sont étudiées en détail, ainsi que les manteaux à Sorbus aucuparia. Nous considérons le Salicetum lapponum Zlatník1928 comme absent du Massif central, au profit de deux nouvelles associations végétales. Nous proposons également un syntaxon inédit relevant du Pruno petraeae-Sorbion aucupariae.
Abstract
Based on unprecedent plant sociological inventory and selected bibliography, we are proposing an initial regional description of Massif Central boreo-alpine optimum thickets encountered at mountain and subalpine levels. Deposits structured by Salix lapponum are thoroughly studied, as well as Sorbus aucuparia mantle. Salicetum lapponum Zlatník1928 is considered as absent from Massif central, in favour of two new plant associations. We are also proposing a new sub-association for an association belonging to the Pruno petraea-Sorbion aucupariae.
1. Introduction
Les fourrés orophiles de la classe des Betulo carpaticae-Alnetea viridis relaient en altitude les Rhamno catharticae-Prunetea spinosae et restent assez méconnus selon les secteurs géographiques. Cette classe a longtemps été incluse dans les Mulgedio alpini-Aconitetea variegati, et ce malgré la structuration par des arbustes appartenant essentiellement aux familles des Salicaceae et Betulaceae (de Foucault, 2021). À la suite de Bardat et al. (2004), une première synthèse nationale de ces fourrés est entreprise par de Foucault (2012). Elle sera par la suite largement complétée et amendée par les travaux de Boeuf (2011, 2014), eux-mêmes repris en grande partie par Mucina et al. (2016) et Lafon et al. (2024). Nous étudierons en détail les fourrés structurés par Salix lapponum et Salix bicolor, comparés avec leur homologue d’Europe centrale, ainsi que les fourrés relevant de l’alliance du Pruno-Sorbion. Enfin, une synthèse globale des syntaxons actuellement connus à l’échelle du Massif central sera proposée. Nous précisons que le terme de fourré est employé ici pour désigner l’ensemble des communautés végétales structurées par des phanérophytes dont des nano et microphanérophytes.
2. Bref rappel des connaissances régionales
Dans le Massif central, plusieurs travaux ont été menées par divers auteurs (Billy, 1997 ; Schaminée et al., 1992 ; Julve, 1983 ; Thébaud, 1988 ; Thébaud et al., 1992 ; de Foucault, 1987 ; Seytre, 2008), sans pour autant s’accorder clairement sur la place à accorder à ces fourrés dans le synsystème. Bien que faisant clairement mention d’une structuration par plusieurs espèces du genre Sorbus, Schaminée et al. (1992) intègrent le Senecioni cacaliastri-Calamagrostietum arundinaceae au sein du Calamagrostion arundinaceae (Mulgedio alpini-Aconitetea variegati). De même, le Salicetum lapponum Zlatník 1928 est cité dans de nombreuses publications régionales et nationales (Thébaud et al., 2014 ; Thébaud & Roux, 2018 ; Le Hénaff et al., 2021 ; de Foucault, 2012). Pour autant sa présence n’est pas clairement étayée avec la publication de relevés inédits et de comparaison avec les travaux des originaux de Zlatník (1928) et Matuszkiewicz & Matuszkiewicz (1974). À noter que Billy (1997) reprend la proposition de Julve (1993) en retenant le Salicetum bicoloris-lapponi Julve 1993 nom. inval. (art. 3b).
3. Méthodologie
3.1. Jeu de données et échantillonnage
Sur la base de relevés inédits effectués au cours de ces dernières années, et de la compilation d’anciens travaux régionaux et provenant d’Europe centrale, notre analyse porte sur l’exploitation de 71 relevés phytosociologiques. Ceux du Massif central proviennent des départements du Puy-de-Dôme, Cantal et Loire. Les relevés hors Massif central sont ceux publiés par Zlatník (1928) et Matuszkiewicz & Matuszkiewicz (1974) et rapportés au Salicetum lapponum Zlatník 1928.
3.2. Analyse des données
Les relevés ont été analysés à l’aide du logiciel Juice (Tichý, 2002). Pour ce faire, plusieurs classifications ascendantes hiérarchiques (CAH) ont été réalisés (en présence-absence). Les groupes mis en évidence ont été obtenus par la méthode de Ward (mesure de distance de Jaccard). Des analyses factorielles de correspondances (AFC) ont été menées sur les groupes obtenus précédemment. La mise en évidence des espèces caractéristiques des syntaxons obtenus a été faite au travers du logiciel Juice par le calcul de l’indice de fidélité Phi (Chytrý et al., 2002). Enfin, des analyses de correspondances canoniques (CCA), couplées avec la bio-indication des espèces renseignée dans la base de données Baseflor (Julve 1997) et Basebryo (Julve 1998), ont permis des caractérisations écologiques.
3.3. Syntaxonomie et nomenclature
La taxonomie suit le référentiel taxonomique national pour la faune, la flore et la fonge de la France métropolitaine et d’outre-mer (Gargominy et al., 2024). Les sous-espèces autonymes n’ont pas été précisées dans le corps du texte et les tableaux. Dans quelques cas relatifs aux espèces complexes, des groupes d’espèces ont été créés pour les analyses numériques. Il s’agit par exemple d’Alchemilla sect. Alchemilla, Myosotis du groupe scorpioides. Le synsystème phytosociologique suit le Catalogue des végétations de la France métropolitaine (Lafon et al., 2024).
4. Résultats
4.1. Classification hiérarchique
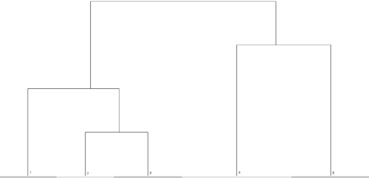
L’analyse (figure 1) permet de distinguer deux grands types de fourrés, les premiers structurés par des espèces du genre Salix (groupes 1 à 3), et le second, par des arbustes de la famille des Rosacées (Sorbus, Prunus, Aria) et Betula pubescens (groupes 4 et 5). Les deux groupes obtenus peuvent être interprétés comme correspondant à deux alliances décrites dans la littérature phytosociologique.
4.2. Résultats des AFC et CCA
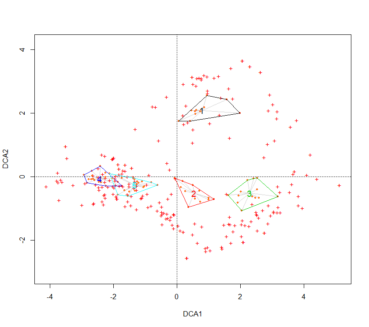
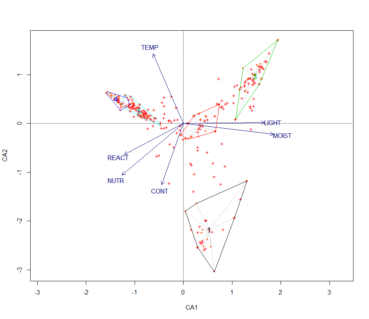
Une projection sur les deux premiers axes des clusters obtenus précédemment est présentée en figure 2. Ces graphiques présentent les groupes obtenus précédemment. On peut constater des différences fortes sur les communautés à Salix. L’axe 1 de l’AFC semble discriminer les fourrés selon un gradient d’humidité édaphique, ce que confirme la CCA (figure 3). En effet les principaux paramètres écologiques discriminants sont l’humidité édaphique, la richesse en éléments nutritifs et la réaction du sol. Le second axe de l’AFC est plus délicat à interpréter puisqu’il isole les relevés en provenance d’Europe centrale. La CCA semble indiquer que le paramètre de température serait une variable écologique explicative.
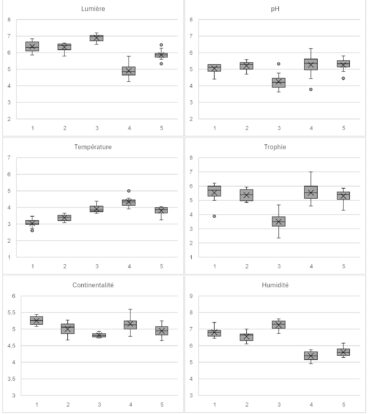
Ainsi, les communautés du Massif central semblent se discriminer selon un gradient d’humidité, avec la présence de communautés mésophiles (4 et 5), hygroclinophiles (1 et 2) et hygrophile (3). La richesse en éléments nutritifs permet de distinguer un ensemble de communautés mésotrophiles à mésoeutrophiles (1, 2, 4 et 5), et oligotrophile à oligomésotrophile (3). Le pH distingue une communauté acidiclinophile à acidiphile (3), le reste étant plutôt des communautés neutroclinophiles. Le paramètre de lumière est plus délicat à interpréter, néanmoins, il semblerait que les communautés 1 à 3 sont majoritairement constituées par des espèces affines de milieux ouverts (bas-marais, mégaphorbiaies subalpines, etc.). À l’inverse, les communautés 4 et 5 semblent comporter un lot plus important d’espèces affiliées généralement à des milieux forestiers. En dernier lieu, les paramètres de température et de continentalité indiquent qu’un des syntaxons (1) semble plus cryophile et présente une affinité continentale beaucoup plus prononcée.
Les graphiques de la figure 4 ont été réalisés avec les bases de trait de vie de Julve (1998 ; 2007), en présence-absence sans pondération avec les coefficients d’abondance.
4.3. Interprétations phytosociologiques
Les différentes communautés végétales inédites identifiées dans le cadre de cet article sont détaillées ci-dessous et décrites selon le synsystème retenu (Lafon et al., 2024). Un tableau synoptique est présenté, avec l’indice de fidélité (tableau 1) des syntaxons utilisés dans le cadre de l’analyse. Les tableaux détaillés des syntaxons nouveaux sont disponibles en annexe (tableaux 2 à 4). Enfin, un tableau synthétique des syntaxons des Betulo-Alnetea du Massif central est proposé (tableau 5).
Syntaxons inédits du Salicion helveticae
Rumici arifoli-Salicetum lapponum ass. nov. hoc loco, typus nominis : rel. 4352609 (voir tableau 2), retranscrit ci-dessous :
Salix lapponum 5, Salix bicolor r, Adenostyles alliariae 2, Rumex arifolius 1, Luzula desvauxii 3, Epilobium alpestre r, Geranium sylvaticum 2, Ranunculus aconitifolius r, Bistorta officinalis +, Crepis paludosa r, Lactuca alpina +, Poa chaixii +, Imperatoria ostruthium +, Trollius europaeus r, Mutellina adonidifolia r, Geum montanum r, Pedicularis foliosa r, Caltha palustris r, Angelica sylvestris 1, Chaerophyllum hirsutum 1, Deschampsia cespitosa r, Festuca heteromalla 1, Athyrium filix-femina r, Solidago virgaurea r, Anthoxanthum odoratum r, Agrostis capillaris r, Plagiomnium affine 1, Betula pubescens +, Epilobium alsinifolium r, Avenella flexuosa 1, Knautia arvernensis r, Libanotis pyrenaica r, Phyteuma spicatum r, Vaccinium myrtillus 2, Vaccinium uliginosum r, Hylocomium splendens 1, Rhytidiadelphus squarrosus 1.
Le tableau 2 propose neuf relevés de cette association, certains ayant été écartés (typicité floristique moindre, des relevés effectués sur des surfaces trop faibles). Saulaie subalpine mésotrophile à mésoeutrophile, marquée physionomiquement dans la plupart des cas par une strate dense et assez haute de Salix lapponum et plus rarement de Salix bicolor (photos 1 et 2). La strate herbacée est principalement constituée par des espèces des mégaphorbiaies subalpines. Du fait d’une humidité atmosphérique importante et d’écoulements superficiels (issus de la fonte des neiges), on peut également observer des espèces affines des Scheuchzerio-Caricetea nigrae et des Montio-Cardaminetea amarae (Festuca rivularis, Geum rivale, Myosotis martini, Saxifraga rotundifolia). Cette saulaie occupe généralement des versants pentus ou des zones de replats, mais non ou très faiblement engorgés en eau. Elle se développe principalement sur des roches volcaniques et est plutôt neutroclinophile. Elle est essentiellement présente dans le massif du Sancy et plus ponctuelle dans le massif du Cantal. À noter un relevé à Salix bicolor du massif du Forez, dépourvu de Salix lapponum, qui constitue une variante d’appauvrissement de l’association. Elle est extrêmement rare dans ce secteur et occupe de très faibles surfaces.
Violo palustris-Salicetum lapponum ass. nov. hoc loco, typus nominis : rel. 4352620 (voir tableau 3), retranscrit ci-dessous :
Salix lapponum 5, Salix bicolor 1, Viola palustris 1, Juncus filiformis r, Dactylorhiza maculata +, Festuca rivularis 3, Epikeros pyrenaeus r, Parnassia palustris +, Carex rostrata 1, Potentilla erecta +, Carex echinata 1, Comarum palustre 1, Molinia caerulea r, Luzula sudetica r, Ranunculus aconitifolius r, Crepis paludosa r, Veratrum album +, Adenostyles alliariae r, Caltha palustris 1, Deschampsia cespitosa r, Cirsium palustre +, Epilobium palustre +, Scapania undulata r, Brachythecium rivulare +, Aulacomnium palustre +, Pellia epiphylla r, Epilobium tetragonum r.
Le tableau 3 propose neuf relevés de cette association (photos 3 et 4), certains ayant été écartés (typicité floristique moindre, des relevés effectués sur des surfaces trop faibles). Cette saulaie oligotrophile à oligomésotrophile, acidiclinophile est, comme la précédente, dominée physionomiquement par Salix lapponum et dans certains cas par Salix bicolor. La strate herbacée est majoritairement dominée par des espèces des sols paratourbeux affines de la classe des Scheuchzerio-Caricetea nigrae, ce qui constitue l’une des caractéristiques essentielles de cette association. Elle occupe généralement des zones de replats très engorgés en eau, les sols présentent des phénomènes de turfigénèse. Cette saulaie se développe également sur le pourtour de zones tourbeuses. Un cortège réduit d’espèces des Mulgedio-Aconitetea tend à se maintenir dans cette communauté végétale (Luzula desvauxii, Bistorta officinalis, Ranunculus aconitifolius, Mutellina adonidifolia, Crepis paludosa), mais sans être dominant. Cette saulaie est floristiquement très différente et occupe un contexte écologique suffisamment distinct du Rumici arifoli-Salicetum pour proposer selon nous une autre association. Comme pour le Rumici arifoli-Salicetum, elle semble plus fréquente dans le massif du Sancy, mais est présente également dans les monts du Cantal. Le Violo palustris-Salicetum a été observé très ponctuellement dans les monts du Forez, souvent de façon fragmentaire et dans une variante à Salix bicolor dépourvue de S. lapponum. Là encore il s’agit de l’extrême irradiation septentrionale de cette association dans le Massif central.
Syntaxon inédit du Pruno petraeae-Sorbion aucupariae
Senecioni cacaliastri-Sorbetum aucupariae Schaminée & J. Jansen ex Boeuf, Theurillat & N. Simler in Boeuf 2014 betuletosum pubescentis subass. nov. hoc loco, typus nominis : rel. 2086683 (voir tableau 4), retranscrit ci-dessous :
Sorbus aucuparia 2, Aria edulis 1, Betula pubescens 3, Salix caprea 3, Rosa pendulina +, Abies alba 1, Sorbus aucuparia (semis ligneux) +, Rosa pendulina (semis ligneux) +, Calamagrostis arundinacea 1, Senecio cacaliaster 1, Doronicum austriacum 1, Bistorta officinalis r, Phyteuma spicatum r, Aconitum napellus subsp. vulgare i, Allium victorialis +, Saxifraga rotundifolia 1, Luzula desvauxii 1, Angelica sylvestris +, Imperatoria ostruthium +, Filipendula ulmaria r, Valeriana officinalis 1, Crepis paludosa +, Polygonatum verticillatum i, Poa chaixii 1, Adenostyles alliariae 3, Aconitum lycoctonum subsp. neapolitanum +, Geranium sylvaticum +, Rumex arifolius 1, Dryopteris filix-mas 1, Athyrium filix-femina 3, Poa nemoralis +, Rubus idaeus +, Solidago virgaurea r, Paris quadrifolia +, Avenella flexuosa +, Myosotis sylvatica 1, Cardamine flexuosa r, Lamium galeobdolon 2, Pulmonaria affinis +, Oxalis acetosella 1, Epilobium montanum +, Vaccinium myrtillus r, Gymnocarpium dryopteris 1, Vicia sepium +, Adoxa moschatellina +, Alchemilla glabra +, Deschampsia cespitosa +, Sambucus racemosa r.
Le tableau 4 propose huit relevés de cette sous-association (photos 5 et 6). Ce fourré mésotrophile à méso-eutrophile est principalement structuré par Sorbus aucuparia, Aria edulis et Betula pubescens. La strate herbacée héberge un ensemble d’espèces affines des mégaphorbiaies mésophiles subalpines des Mulgedio-Aconietea. Le cortège des espèces forestières des Carpino-Fagetea est également bien représenté. On peut observer dans cette sous-association deux variantes, la première liée à des expositions fraîches et bénéficiant d’apport en eau (ruissellement issu de la fonte des neiges). La seconde variante, mésophile et plus thermophile, fait la transition avec la sous-association typicum (Seytre, 2008). Enfin, un lot de relevés se différencie négativement par l’absence de ces cortèges d’espèces. Cette nouvelle sous-association est présente à la fois sur le massif des Monts-Dore et les monts du Cantal. Elle se développe principalement sur des roches volcaniques, modérément acides. Ce fourré semble être en lien dynamique avec les mégaphorbiaies mésophiles du Calamagrostion arundinaceae ou plus hygrophiles de l’Adenostylion alliariae qu’il va coloniser progressivement. La présence d’une strate arbustive permet de retenir et accumuler d’importantes quantités de neige, qui fondra au fur et à mesure du printemps. Ceci explique selon nous la présence d’une strate herbacée des Mulgedio-Aconietetea. Par évolution dynamique plus ou moins longue, le hêtre (présent de manière sporadique dans les relevés) tendra à supplanter cette strate arbustive et constituera les hêtraies subalpines (Doronico austriaci-Fagetum sylvaticae) du Massif central. Ce schéma dynamique pourra être remis en question avec le dérèglement climatique, du fait des chutes de neige moins importantes dans le Massif central (Serre, 2015).
5. Discussions
Les analyses effectuées dans le cadre de ce travail nous ont conduit à écarter la présence du Salicetum lapponum Zlatník 1928. En effet, bien que cette association soit également structurée par Salix lapponum, on peut noter la présence significative de Salix silesiaca, espèce absente de France. De plus, la flore herbacée est affine de l’ordre des Calamagrostietalia villosae (Calamagrostis villosa, Aconitum plicatum subsp. plicatum, Veratrum album subsp. lobelianum), considéré par de Foucault & Corriol (2013) comme absent de France. Le Rumici arifoli-Salicetum comporte à l’inverse fréquemment Salix bicolor et la strate herbacée est affine des Adenostyletalia alliariae. Ce fourré est probablement issu de l’évolution des mégaphorbiaies subalpines de l’Imperatorio ostruthii-Adenostyletum alliariae. Pour ces raisons nous considérons que le Rumici arifoli-Salicetum est une association vicariante du Salicetum lapponum décrit par Zlatník (1928). Cette dernière association est donc absente de France. À noter que de Foucault (2012) indique un néotype (relevé 9) pour l’association dans les travaux de Matuszkiewicz & Matuszkiewicz (1974), alors que Boeuf (2014) désigne un lectotype (relevé 30) dans les travaux de Zlatník (1928). En regardant plus en détail les travaux de ces auteurs, il semblerait que le Salicetum lapponum recouvre deux communautés distinctes. En effet le relevé 30 de Zlatník (1928) est très riche en espèces des bas-marais contrairement au second relevé de cet auteur et au tableau publié par Matuszkiewicz & Matuszkiewicz (1974). Ce travail devra être conduit par les phytosociologues d’Europe centrale afin de clarifier cette hypothèse. On peut également noter des liens floristiques et écologiques avec le Chaerophyllo hirsuti-Salicetum bicoloris Boeuf & Simler in Boeuf 2014, décrit des cirques glaciaires des Hautes-Vosges (Boeuf 2011, 2014). Le Rumici arifoli-Salicetum s’en distingue par un cortège floristique des Betulo carpaticae-Alnetea nettement plus diversifié. Nous intégrons dans cette association la variante à Salix des monts Dore du Crepido paludosae-Adenostyletum alliariae identifiée par Loos et Thébaud (2024), et ce pour des raisons structurelles. Les relevés fournis semblent indiquer une structuration par diverses phanérophytes du genre Salix, ce qui plaide pour l’intégration de ces relevés dans la classe des Betulo-Alnetea et non dans les Mulgedio-Aconitetea.
La reconnaissance du Violo palustris-Salicetum était pressentie depuis plusieurs années. On peut en effet trouver les premières traces de cette communauté végétale dans les travaux de Cusset & de Lachapelle (1962), mais qui ne peuvent être exploités, ainsi que dans Julve (1983) qui distingue une sous-association « salicetosum lapponi [1]» du Caricetum nigrae. Il note également dans un schéma fonctionnel que le Caricetum nigrae évolue vers le Selino pyrenaei-Juncetum acutiflori, qui lui-même sera colonisé naturellement par diverses espèces de saules, dont Salix lapponum. Le Hénaff et al. (2021) précisent également cette particularité mais sans en proposer de relevés. Les travaux de Billy (1997) ne peuvent non plus être exploités, ce dernier retenant la proposition de Julve (1993). De récentes investigations ont permis la réalisation de plusieurs relevés et de confirmer les hypothèses de ces auteurs. De plus, il est couramment noté dans la littérature que Salix lapponum est capable de coloniser et se développer dans des zones tourbeuses (Hroneš et al., 2018 ; Pajunen et al., 2010). Cette communauté végétale est toutefois plus rare que la précédente, et on l’observe assez rarement sur des surfaces étendues. Comme indiqué plus haut, nous faisons le choix de distinguer deux syntaxons (sur des bases floristiques et écologiques), mais elle pourrait dans les années à venir être subordonnée en tant que sous-association au Rumici-Salicetum du fait d’une strate arbustive identique.
La classification actuelle des saulaies subalpines semble difficilement applicable dans le Massif central. Les récentes synthèses (Bœuf, 2014 ; Lafon et al., 2024 ; Mucina et al., 2016) retiennent les propositions de Theurillat et al. (1995), à savoir le Salicion helveticae des substrats siliceux et le Salicion pentandrae, des substrats calcaires. À noter que selon certains auteurs, le Salicion pentandrae va du modérément acide à neutre, tout comme le Salicion helveticae (Preislerová et al., 2024). Cette distinction basée sur la lithologie s’avère donc peu aisée, notamment en dehors du massif alpin, où ces alliances ont été décrites. Cette opinion est également partagée par Lazare et al. (2019). Selon nos résultats, nous aurions dans le Massif central théoriquement les deux alliances mais qui seraient très difficilement discernables sur le terrain. De plus Salix lapponum, qui structure bien souvent ces communautés végétales, semble plutôt indifférent au pH (neutre à acide) selon Hroneš et al. (2018). En effet il n’est pas rare d’observer le Rumici arifoli-Salicetum et le Violo palustris-Salicetum en contact direct. Comme le souligne à juste titre Michalet et al. (2002), la disponibilité en eau pour les communautés végétales est un facteur écologique discriminant dans les massifs montagneux. En fonction de nos résultats et ceux de Lazare et al. (2019), il pourrait y avoir deux nouvelles alliances à décrire, non plus basées sur le pH, mais sur la disponibilité en eau. Nous aurions ainsi une alliance regroupant les communautés mésophiles à hygroclinophiles, différenciées par des espèces des Mulgedio-Aconitetea, et une seconde différenciée par des espèces des bas-marais des Scheuchzerio-Caricetea nigrae. Cette hypothèse devra être testée dans les années à venir sur la base d’un vaste tableau synthétique complet de la classe. Dans l’immédiat nous incluons les communautés du Massif central dans le Salicion helveticae, tout en admettant que ce choix n’est pas totalement satisfaisant. Retenir le Salicion pentandrae n’aurait guère été plus concluant. Ces résultats pourraient plaider selon nous pour le maintien de l’ordre des Salicetalia hastatae proposé par Boeuf (2014) et qui semble avoir un déterminisme écologique différent des Alnetalia alnobetulae. Toutefois cette question dépasse le cadre de cette étude et devra être discutée et approuvée à l’échelon national dans le cadre du programme du Catalogue de la végétation de la France métropolitaine (Lafon et al., 2024).
Le Senecioni-Sorbetum betuletosum se distingue aisément de la sous-association typicum, qui se développe sur des blocs et se caractérise par des taxons thermophiles tels que Laserpitium latifolium, Patzkea paniculata, Valeriana tripteris, Hylotelephium telephium. La distinction avec la sous-association sorbetosum chamaemespili est plus ténue. Cette dernière caractérise selon Boeuf (2014) les sorbaies mésohygrophiles, chionophiles acidiphiles des monts du Forez avec notamment la présence de Streptopus amplexifolius et Athyrium distentifolium, avec des espèces transgressives des Festucetalia spadiceae. Cette sous-association serait à rechercher dans les autres massifs montagneux du Massif central. Suivant le découpage proposé par Boeuf (2014), le pôle mésophile de ce fourré n’est pas caractérisé au rang de sous-association que nous proposons ici. De même, elle correspond à la variante à Cirisium erisithales sur basalte décrite par Schaminée et al. (1992) et au Sorbetum de Lachapelle in Cusset & de Lachapelle 1964 nom. inval. (art. 3f).
Les fourrés sur éboulis froids se rapportent selon Le Hénaff et al. (2021) au Ribeso petraei-Sorbetum aucupariae (Issler 1932) Boeuf & N. Simler in Boeuf 2014, dont on trouve une description détaillée dans Boeuf (2011). Cette communauté avait été identifiée à l’origine par Bignon (1986) dans le Massif central sous le nom de groupement à Prunus padus. Le tableau synthétique 5 (en annexe) compare les relevés de cet auteur avec ceux publiés par Boeuf (2011), il ne montre pas réellement de différence significative, tant floristiquement qu’écologiquement. Tout au plus, on notera que les relevés du Massif central présentent une variante pauvre en Sorbus aucuparia.
Roux (2017) intègre le Daphno mezerei-Coryletum avellanae dans le Sorbo mougeotii-Lonicerion alpigenae. Ce choix ne nous semble pas pertinent, cette association pouvant s’intégrer dans le Lonicero nigrae-Corylion avellanae selon de Foucault & Royer (2016). Hormis la présence de quelques espèces caractéristiques des rangs supérieurs (Crataegus monogyna, C. laevigata, Corylus avellana), cette association est assez pauvre en taxons caractéristiques de cette alliance. Roux (2017) indique que les cortèges différentiels sont plutôt affiliés aux milieux forestiers et des ourlets (Carpino-Fagetea, Galio-Urticetea, Epilobietea), ce qui pourrait plaider selon nous pour une intégration dans l’Astrantio-Corylion avellanae H. Passarge 1978 (Rhamno catharticae-Prunetea). De Foucault et Royer (2016) l’intègrent dans le Lonicero nigrae-Corylion avellanae, choix que nous suivons ici dans l’attente d’une meilleure connaissance de ces fourrés.
Le Roso pimpinellifoliae-Cotoneastretum integerrimi décrit par Billy (1997) est intégré par Thébaud et al. (2014) dans les Betulo-Alnetea, suivis par Le Hénaff et al. (2021). Comme pour l’association précédente, du fait d’une absence quasi totale des espèces caractéristiques de ces fourrés d’altitude, nous pensons que cette association ne peut s’intégrer dans cette classe. Bien que décrit selon une approche synusiale, cette communauté présente un caractère mésoxérophile qui se traduit par la présence de Cotoneaster integerrimus, Juniperus communis, Cytisus oromediterraneus et plus rarement Rosa spinosissima. De fait, cette association semble plutôt s’intégrer dans la classe des Rhamno catharticae-Prunetea. Le Lonicero nigrae-Corylion avellanae ne semble pas convenir, car cette alliance caractérise des syntaxons mésophiles. L’Amelanchiero ovalis-Buxion sempervirentis et plus particulièrement la sous-alliance du Cotoneastro integerrimi-Amelanchierenion ovalis semble pertinent, car caractérisant des communautés orophiles et xérophiles (de Foucault & Royer 2016).
Nous faisons le choix d’intégrer le Roso pendulinae-Sorbetum chamaemespili décrit par Billy (1997) dans le Senecioni-Sorbetum aucupariae sorbetosum chamaemespili. Sa description, basée selon une approche synusiale, ne semble pas montrer de réelle différence avec les groupements du Forez décrits par Schaminée et al. (1992). La description de Boeuf (2014) basée sur les travaux de Schaminée et al. (1992) est plus complète car elle s’appuie sur des relevés prenant l’ensemble de la communauté végétale et non pas restreint à la seule composante arbustive.
Le groupement à Sorbus mougeotii et Rhamnus alpina cité par Choisnet & Mulot (2008) semble pouvoir s’intégrer dans le Sorbo mougeotii-Lonicerion alpigenae et non dans le Pruno spinosae-Rubion ulmifolii. Une étude plus complète de ce syntaxon devra être mené dans les années à venir afin de caractériser cette communauté végétale.
6. Conclusion
Cette étude aura permis de clarifier ces communautés végétales du Massif central avec la description de trois nouveaux syntaxons. Pour deux d’entre eux (Rumici-Salicetum et Violo-Salicetum), la zone biogéographique du Massif central possède une forte responsabilité de conservation au niveau national. Ces communautés végétales sont particulièrement sensibles au phénomène de drainage (notamment le Violo-Salicetum) que l’on peut occasionnellement observer dans les monts Dore, ce qui a pour conséquence une minéralisation importante de la matière organique et une forte eutrophisation du fourré. Le changement climatique pourrait avoir de graves répercussions à plus ou moins long terme sur ces fourrés subalpins. De plus, les syntaxons du Salicion helveticae relèvent de l’habitat 4080 – Fourrés de Salix spp. subarctiques.
Synsystème des syntaxons cités
Betulo carpaticae-Alnetea viridis Rejmánek ex Boeuf, Theurillat, Willner, Mucina, N. Simler in Boeuf 2014
Alnetalia alnobetulae Rübel ex Karner & Willner in Willner & G. Grabherr 2007 nom. mut. Boeuf 2014
Pruno petraeae-Sorbion aucupariae (Rameau in Rameau, D. Mans. & Dumé 1993) Seytre & Boeuf in Boeuf 2011
Ribeso petraei-Sorbetum aucupariae (Issler 1932) Boeuf & N. Simler in Boeuf 2012 (syn. groupement à Prunus padus in Thébaud, C. Roux, C.-E. Bernard & Delcoigne 2014 ; groupement à Prunus padus et Ribes petraeum Bignon 1986 ; Sorbo aucupariae-Loniceretum prunetosum padi Billy 1997 nom. inval.)
Senecioni cacaliastri-Sorbetum aucupariae Schaminée & J. Jansen ex Boeuf, Theurillat & N. Simler in Boeuf 2014
typicum
sorbetosum chamaemespili Boeuf 2014 (incl. Roso pendulinae-Sorbetum chamaemespili Billy ex Thébaud, C. Roux, C.-E. Bernard & Delcoigne 2014)
betuletosum pubescentis subass. nov. (syn. Sorbetum Lachapelle in Cusset & Lachapelle 1964 nom. inval. (3f) ; Senecioni cacaliastri-Calamagrostietum sorbetosum var. à Cirsium eristhales Schaminée et al. 1992)
Sorbo mougeotii-Lonicerion alpigenae B. Foucault ex. B. Foucault 2024
Sorbo aucupariae-Loniceretum nigrae B. Foucault 1987
Groupement à Sorbus mougeotii et Rhamnus alpina Choisnet & Mulot 2008
Salicion helveticae Rübel ex Theurillat in Theurillat, Aeschimann, Küpfer & Spichiger. 1995
Rumici arifoli-Salicetum lapponum ass. nov. (syn. Salicetum bicolori-lapponum Julve 1993 nom. inval. p.p. ; incl. Crepido paludosae-Adenostyletum alliariae cirsietosum palustris Loos & Thébaud 2024 var. à Salix)
Violo palustris-Salicetum lapponum ass. nov. (syn. Salicetum bicolori-lapponum Julve 1993 nom. inval. p. p.)
Rhamno catharticae-Prunetea spinosae Rivas Goday & Borja ex Tüxen 1962
Prunetalia spinosae Tüxen 1952
Amelanchiero ovalis-Buxion sempervirentis O. Bolòs & Romo 1989
Cotoneastro integerrimi-Amelanchierenion ovalis B. Foucault & Julve ex B. Foucault & J.-M. Royer 2016
Roso pimpinellifoliae-Cotoneastretum integerrimi Billy ex Thébaud, C. Roux, C.-E. Bernard & Delcoigne 2014
Sambucetalia racemosae Oberd.ex H. Passarge in Scamoni 1963
Lonicero nigrae-Corylion avellanae B. Foucault & Julve ex B. Foucault & J.-M. Royer 2016
Daphno mezerei-Coryletum avellanae C. Roux in Thébaud, C. Roux, C.-E. Bernard & Delcoigne 2014
[1] Cette sous-association peut être juste interprétée comme une phase dynamique du bas-marais, qui est en cours de structuration vers un fourré et non comme un syntaxon autonome.
Bibliographie
Bardat J., Bioret F., Botineau M., Boullet V., Delpech R., Géhu J.-M., Haury J., Lacoste A., Rameau J.-C., Royer J.-M., Roux G. & Touffet J., 2004. Prodrome des végétations de France. Patrimoines naturels 61 (Muséum national d’histoire naturelle, Paris) : 1-171 p.
Bignon J.-J., 1986. Étude phytosociologique des lisières des hêtraies montagnardes dans le massif des monts Dore. D.E.A, Univ. Paris Sud-Orsay, 38 p.
Billy F., 1997. Les forêts et leurs lisières en Basse-Auvergne. Bulletin de la Société botanique du Centre-Ouest, n. s., n° spécial 15 : 1-329.
Boeuf R., 2010 (publié 2011). Le référentiel des types forestiers d’Alsace : apports phytosociologiques. Revue forestière française LXII (3-4) : 331-364.
Boeuf R., 2014. Les végétations forestières d’Alsace : référentiel des types forestiers du type générique au type élémentaire ; relations entre les stations forestières, les communautés forestières, les habitats et les espèces patrimoniales. Office national des forêts (Direction territoriale Alsace & Direction de l’environnement et du développement durable) / ministère de l’Alimentation, de l’Agriculture et de la Pêche, Service régional de la forêt et du bois Alsace, imprimerie Scheuer, I (textes), 371 p.
Choisnet G. & Mulot P.-E., 2008. Catalogue des végétations du Parc naturel régional des Monts d’Ardèche. Conservatoire botanique national du Massif central / Conseil régional Rhône-Alpes, 263 p.
Chytrý M., Tichý L., Holt J. & Botta-Dukát Z., 2002. Determination of diagnostic species with statistical fidelity measures. Journal of Vegetation Science 13 : 79-90.
Cusset G. & de Lachapelle B., 1961 (publié 1962). Études botaniques dans les monts Dore. Revue de la Société d’histoire naturelle d’Auvergne, n. s., 27 (1-4) : 2-82.
Foucault B. (de), 1987. Données phytosociologiques sur la végétation observée lors de la 13e session de la Société botanique du Centre-Ouest en Aubrac et Margeride. Bulletin de la Société botanique du Centre-Ouest, n. s., 18 : 337-361.
Foucault B. (de), 2012. Contribution au prodrome des végétations de France : les Betulo carpaticae-Alnetea viridis Rejmánek in Huml, Leps, Prach & Rejmánek 1979. Journal de botanique de la Société botanique de France 60 : 47-68.
Foucault B. (de), 2021. Essai de synthèse phytosociologique sur les fourrés sempervirents méditerranéens. Carnets botaniques 51 : 1-42, https://doi.org/10.34971/D6BN-RG49.
Foucault B. (de) & Corriol G., 2013. Contribution au prodrome des végétations de France : les Mulgedio alpini-Aconitetea variegati Hadac & Klika ex Klika 1948. Journal de botanique de la Société botanique de France 61 : 49-87.
Foucault B. (de) & Royer J.-M., 2016. Contribution au prodrome des végétations de France : les Rhamno catharticae-Prunetea spinosae Rivas Goday & Borja ex Tüxen 1962. Documents phytosociologiques, série 3, 2 : 152-345.
Gargominy O. et al., 2024. TAXREF v17.0, référentiel taxonomique pour la France. PatriNat (OFB-CNRS-MNHN-IRD), Muséum national d’Histoire naturelle, Paris. Archive de téléchargement contenant 8 fichiers générés le 10 janvier 2024, https://inpn.mnhn.fr/telechargement/referentielEspece/taxref/17.0/menu.
Hroneš M., Macurová S., Hradílek Z., Hekera P. & Duchoslav M., 2018. Habitat conditions, stage structure and vegetation associations of geographically isolated subalpine populations of Salix lapponum L. (Salicaceae) in the Krkonoše Mts (Czech Republic). Biologia 73 : 1-14, https://doi.org/10.2478/s11756-018-0051-4.
Julve Ph., 1983. Les groupements de prairies humides et de bas-marais : étude régionale et essai de synthèse à l’échelle de l’Europe occidentale. Thèse, Université de Paris-Sud XI, Faculté des Sciences d’Orsay, 225 p.
Julve Ph., 1998 ff. Baseflor. Index botanique, écologique et chorologique de la Flore de France, v. 2024. Programme Catminat, https://www.tela-botanica.org/projets/phytosociologie/porte-documents.
Julve Ph., 1993. Synopsis phytosociologique de la France (communautés de plantes vasculaires). Lejeunia, n. s., 140 : 1-160.
Julve Ph., 2007. Basebryo. Écologie des bryophytes d’Europe, v. 25/07/2014, http://perso.wanadoo.fr/
philippe.julve/catminat.htm [consulté le 03/01/2025].
Lafon P., Argagnon O., Belaud A., Catteau E., Causse G., Corriol G., Culat A., Delassus L., Dumoulin J., Gaudillat V., Goret M., Mangeat M., Millet J., Noble V., Paulin D., & Soucanye de Landevoisin C.-H., 2024. Catalogue de la végétation de France métropolitaine (CatVeg) ; harmonisation jusqu’au rang de la sous-alliance et répartition départementale. Bulletin de la Société botanique du nord de la France, numéro spécial, 372 p.
Lazare J.-J., Riba S. & Boeuf R., 2019. Contribution à l’étude des groupements des Betulo carpaticae-Alnetea alnobetulae dans les Pyrénées. Botanique 4 : 37-57.
Le Hénaff P.-M., Hostein C., Dumont M. & Pradinas R., 2021. Catalogue des végétations des réserves naturelles nationales du massif du Sancy. Conservatoire botanique national du Massif central/Direction régionale de l’environnement, de l’aménagement et du logement Auvergne-Rhône-Alpes, 215 p.
Loos M. & Thébaud G., 2024. Contribution à l’étude des formations orophiles à hautes herbes (Mulgedio alpini-Aconitetea variegati, habitats 6430 et Festucetalia spadiceae Barbero 1970) du Massif central français : analyse des données phytosociologiques et classification régionale. BIOM 5 (2) : 5-52.
Matuszkiewicz W. & Matuszkiewicz A., 1974. Carte de la végétation du Parc national de Korkonosze (Sudètes occidentales). Zaklad Ochrony Przrody Polskiej Akad. Nauk 40 : 45-112.
Michalet R., Gandoy C., Joud D., Pagès J.-P. & Choler P., 2002. Plant community composition and biomass on calcareous and siliceous substrates in the northern French Aps: comparative effects of soil chemistry and water status. Arctic, Antarctic, and Alpine Research 34 (1) :102-113.
Mucina L., Bültmann H., Dierßen K., Theurillat J.-P., Raus T., Čarni A., Šumberová K., Willner W., Dengler J., Gavilán García R., Chytrý M., Hájek M., Di Pietro R., Iakushenko D., Pallas J., Daniëls F.J.A., Bergmeier E., Santos Guerra A., Ermakov N., Valachovič M., Schaminée J.H.J., Lysenko T., Didukh Y.P., Pignatti S., Rodwell J.S., Capelo J., Weber H.E., Solomeshch A., Dimopoulos P., Aguiar C., Hennekens S.M. & Tichý L., 2016. Vegetation of Europe: hierarchical floristic classification system of vascular plant, bryophyte, lichen, and algal communities. Applied Journal of Vegetation Science 19 (1) : 3-264.
Pajunen A.M., Kaarlejärvi E., Forbes B.-C. & Virtanen R., 2009. Compositional differentiation, vegetation-environment relationships and classification of willow-characterised vegetation in the western Eurasian Arctic. Journal of Vegetation Science 21 : 107-119.
Preislerová Z., Marceno C., Loidi J., Bonari G., Borovyk D., Gavilán R.G., Golub V., Terzi M., Theurillat J.-P., Argagnon O., Bioret F., Biurrun I., Campos J.A., Capelo J., Čarni A., Çoban S., Csiky J., Ćuk M., Ćušterevska R., Dengler J., Didukh Ya., Dítě D., Fanelli G., Fernández-González F., Guarino R., Hájek O., Iakushenko D., Iemelianova S., Jansen F., Jašková A., Jiroušek M., Kalníková V., Kavgaci A., Kuzemko A., Landucci F., Lososová Z., Milanović Đ., Molina J.A., Monteiro-Henriques T., Mucina L., Novák P., Nowak A., Pätsch R., Perrin G., Peterka T., Rašomavičius V., Reczyńska K., Rusina S., Sánchez Mata D., Santos Guerra A., Šibík J., Škvorc Ž., Stešević D., Stupar V., Świerkosz K., Tzonev R., Vassilev K., Vynokurov D., Willner W. & Chytrý M., 2024. Structural, ecological and biogeographical attributes of European vegetation alliances. Applied Vegetation Science 27 : 1-13, https://doi.org/10.1111/avsc.12766.
Roux C., 2017. De la Limagne à la chaîne des Puys – Approche analytique intégrative pour l’étude des végétations actuelles et potentielles en moyenne montagne tempérée. Thèse d’université, Éditions Revoir, 339 p.
Schaminée J.H.J., Jansen J. & Hennekens S.M., 1992. Scrub communities dominated by Sorbus species in the subalpine zone of the monts du Forez (Massif central, France). Proceedings of the Koninklijke Nederlandse Akademie van Wetenschappen, series C, Biological and Medical Sciences, 95 (4) :473-497.
Serre F., 2015. Les singularités du climat et son évolution récente dans le massif des Monts Dore et dans la réserve naturelle nationale de Chastreix-Sancy. Réserve naturelle nationale de Chastreix-Sancy / Direction régionale de l’Aménagement, de l’Environnement et du Logement Auvergne, 48 p.
Seytre L., 2008. Caractérisation des hêtraies subalpines médio-européennes à Acer et Rumex arifolius relevant de la directive “Habitats” en Auvergne (9140). Conservatoire botanique national du Massif central / Direction régionale de l’Environnement Auvergne, 38 p.
Thébaud G., 1988. Le Haut-Forez et ses milieux naturels. Apports de l’analyse phytosociologiques pour la connaissance écologique et géographique d’une moyenne montagne cristalline subatlantique. Thèse de doctorat d’État, Clermont-Ferrand, 330 p.
Thébaud G., Schaminée J.H.J. & Hennekens S.M., 1992. Contribution à l’étude de l’étage subalpin des moyennes montagnes ouest-européennes : quelques groupements végétaux foréziens comparés à leurs homologues d’autres massifs. Bulletin de la Société botanique du Centre-Ouest, n. s., 23 : 45-63.
Thébaud G., Roux C., Bernard C.-É. & Delcoigne A., 2014. Guide d’identification des végétations du nord du Massif central. Associations végétales et habitats naturels. Presses universitaires Blaise-Pascal, Clermont-Ferrand, 296 p.
Thébaud G. & Roux C., 2018. Végétations montagnardes et subalpines du Massif central français. Botanique 4 : 111-138.
Theurillat J.-P., Aeschimann D., Küpfer Ph. & Spichiger R., 1995. The higher vegetation units of the Alps. Colloques phytosociologiques XXIII, Large area vegetation surveys : 189-238.
Tichý L., 2002. Juice, software for vegetation classification. Journal of Vegetation Science 13 : 451-453.
Zlatník A., 1928. Aperçu de la végétation des Krkonose (Riesengebirge). Preslia 7 : 94-152.
Remerciements
Nous remercions l’ensemble des collègues qui ont accepté de relire ce travail et d’y apporter des compléments permettant d’améliorer la qualité de cet article, à savoir Nicolas Bianchin, Emmanuel Catteau, Aurélien Culat, Rémi Guisier, Colin Hostein, Mathieu Mercier et Nicolas Steinmetz. Sans oublier Jaoua Celle pour son aide concernant la détermination des échantillons de bryophytes, Luce Mansot pour la relecture finale de cet article et Erwan Le Gloanec pour son aide à la traduction du résumé en anglais.