Contribution à l’étude phytosociologique des prairies mésohygrophiles à hygrophiles des Préalpes de Grasse (Alpes-Maritimes, Alpes-de-Haute-Provence et Var)
Title
Contribution to the phytosociological study of the mesohygrophilous to hygrophilous meadows of the Grasse Prealps (Alpes-Maritimes, Alpes-de-Haute-Provence and Var)
Résumé
Trois associations nouvelles de prairies mésohygrophiles à hygrophiles sont décrites selon la méthode phytosociologique dans les Préalpes de Grasse, aux confins des Alpes-Maritimes, des Alpes-de-Haute-Provence et du Var : le Klaseo lycopifoliae-Filipenduletum vulgaris (Arrhenatherion elatioris), le Carici hartmanii–Sanguisorbetum officinalis (Molinion caeruleae) et l’Achilleo ptarmicae–Caricetum distichae (Mentho arvensis–Eleocharition palustris).
Abstract
Three new mesohygrophilous to hygrophilous meadows are described with phytosociological relevés in the Grasse Prealps, in the extreme southeast of France: Klaseo lycopifoliae-Filipenduletum vulgaris (Arrhenatherion elatioris), Carici hartmanii–Sanguisorbetum officinalis (Molinion caeruleae) and Achilleo ptarmicae–Caricetum distichae (Mentho arvensis–Eleocharition palustris).
1. Introduction
À une quinzaine de kilomètres de la zone littorale surpeuplée des Alpes-Maritimes, les Préalpes de Grasse offrent de grandes étendues naturelles au relief karstique, façonnées par des siècles de pastoralisme, abritant une flore d’une grande richesse et d’une originalité reconnue, avec 38 taxons endémiques et subendémiques des Alpes maritimes (Barbero, Loisel & Poirion, 1972 ; Diadema & Noble, 2011). Si historiquement la majorité des botanistes s’est essentiellement intéressée à la flore du karst (Poirion, 1961), ce n’est que tardivement, à l’orée du xxie siècle, que l’intérêt s’est porté sur la flore des zones humides, qui s’est révélée d’une égale richesse, notamment grâce aux prospections réalisées par des botanistes amateurs dans le bassin de l’Estéron dans un cadre associatif (Alziar et al., 1998 ; Offerhaus et al., 1999 ; Salanon et al., 2002), aux inventaires réalisés lors de la mise en place du réseau Natura 2000 (Collectif, 2004) ou lors d’étude d’impact (Salanon, 1999). En revanche, la végétation des Préalpes de Grasse, et sa description phytosociologique, demeurent encore imparfaitement connues. Celle-ci a fait l’objet de plusieurs travaux dans la deuxième moitié du xxe siècle, portant exclusivement sur les associations de pelouses xérophiles et de garides supraméditerranéennes à oroméditerranéennes (Guinochet, 1975a, 1975b ; Barbero, 1972 ; Barbero & Loisel, 1971 ; Barbero, Loisel & Quézel, 1972). En 2000, dans le cadre de l’élaboration du document d’objectifs du site Natura 2000 FR9301570 « Préalpes de Grasse » (Collectif, 2004), des prospections phytosociologiques effectuées notamment sur le plateau de Caussols ont mis en évidence la présence de prairies hygrophiles à Molinia caerulea bien caractérisées et relevant du Molinion caeruleae W. Koch 1926, alliance faiblement méditerranéenne jusque là jamais signalée dans la dition. Des investigations menées par la suite dans diverses localités des Préalpes de Grasse ont permis de retrouver cette association originale qui est décrite ici, ainsi qu’une association répandue de prairie de fauche mésohygrophile et une communauté de prairie inondable à Carex disticha.
2. Présentation de la dition
Les Préalpes de Grasse sont situées très majoritairement dans le département des Alpes-Maritimes et débordent marginalement à l’ouest dans le Var et les Alpes-de-Haute-Provence. Selon Barbero, Loisel & Poirion (1972), elles sont délimitées par les sommets suivants : la Bernarde (1 941 m) au nord-ouest, le mont Vial (1 549 m) au nord-est, le mont Lachens (1 715 m) au sud-ouest et la chaîne des Baous (800 m) au sud-est. Le relief est caractérisé par un ensemble de chaînons calcaires parallèles dirigés d’ouest en est, séparés par des vallées dont le sous-sol marneux imperméable est colmaté par des limons et autres apports colluvionnaires. Ces vallées sont parcourues par des cours d’eau permanents, comme les affluents de l’Estéron et de l’Artuby, ou temporaires, s’engouffrant alors dans le karst au contact du calcaire jurassique (l’Embut de Caussols, poljé de Caille). Les plaines occupant ces vallées offrent un paysage verdoyant (photo 1) contrastant fortement avec la végétation xérophile méditerranéenne des versants sud et des plateaux karstiques : prairies de fauche, marécages et cultures céréalières ou maraîchères. Les Préalpes de Grasse sont comprises ici comme un district phytogéographique propre, faisant partie d’une région plus vaste, les Préalpes provençales orientales (Tison et al., 2014), également appelées secteur Haut-Provençal par Barbero, Loisel & Poirion (1972). La végétation appartient principalement aux étages supraméditerranéen et montagnard, avec un grand développement de la série occidentale du chêne pubescent, notamment ses stades de dégradation, les lavandaies et garides à Genista cinerea. La partie ouest, plus montagnarde, se couvre sur les plateaux de pinèdes de pin sylvestres, de hêtraies et sapinières dans les ubacs.
2.1 Climatologie
Les données météorologiques consultées proviennent du modèle AURELHY de Météo-France, sur la période 1981-2010. Cette méthode permet d’afficher sur une grille aux mailles de 1 km x 1 km des valeurs calculées par interpolation des normales mesurées aux postes de mesure, prenant en compte l’influence du relief sur les températures et les précipitations (Canellas et al., 2014). Dans les sites étudiés, au niveau des fonds de vallées, la température moyenne annuelle est comprise entre 8,4 °C à Ubraye et 9,9 °C à Caussols . La température minimale moyenne du mois le plus froid (m), janvier, varie entre -6,2 °C à Ubraye et -0,6 °C à Caussols, et la température maximale moyenne du mois le plus chaud varie entre 23,4 °C à Caussols en août et 26,2 °C à Peyroules en juillet. Le nombre moyen de jours de gel annuel est conséquent, compris entre 69 à Caussols et 164 à Ubraye. Les épisodes de grand froid ne sont pas exceptionnels, un record de basse température étant d’ailleurs détenu dans la région avec -41 °C à Gréolières-les-Neiges le 6 mars 1971 (https://www.infoclimat.fr/historic-details-evenement-423-records.html). L’enneigement (photo 2) est très variable d’une année à l’autre et suit la tendance générale à la baisse de l’épaisseur du manteau neigeux et de l’importance des chutes de neiges constatée dans les Alpes-Maritimes entre 1973 et 2010 (Martin & Carrega, 2011). Concernant les précipitations, les données météorologiques mettent en évidence un gradient croissant d’ouest en est. En effet, soumises à l’influence du climat ligure, les Préalpes de Grasse bénéficient de précipitations plus importantes que les chaînes provençales situées plus à l’ouest (centre et haut-Var, Verdon). La hauteur moyenne annuelle des précipitations (P) est comprise entre 1 013 mm à Peyroules et 1 187 mm à Caussols. Le mois le plus arrosé est octobre (photo 3) avec des valeurs moyennes comprises entre 124,3 mm à Ubraye et 169 mm à Caussols. Le mois le plus sec est juillet avec des valeurs moyennes comprises entre 31 mm à Caussols et 47,9 mm à Ubraye. Ces caractéristiques climatiques permettent de rattacher les sites étudiés à l’ombroclimat humide (800 < P < 1 200 mm), et pour la majorité des sites au bioclimat montagnard à hiver très froid (-3 °C < m < -7 °C) selon les critères de Géhu et al. (1984). Le site de Caussols appartient quant à lui plutôt au bioclimat supraméditerranéen à hiver froid (12 > T > 8 et 0 °C > m > -3 °C).
3. Méthodes
L’ensemble des relevés a été effectué dans la partie centrale et surtout occidentale des Préalpes de Grasse, aux confins des départements des Alpes-Maritimes, des Alpes-de-Haute-Provence et du Var. Les sites de zones humides à prospecter ont été sélectionnés à l’aide des cartes topographiques de l’Institut national de l’information géographique et forestière (IGN) et de photos aériennes. Les relevés de végétation ont été réalisés selon la méthode phytosociologique sigmatiste (Royer, 2009). La nomenclature floristique suit le référentiel taxonomique de l’Inventaire national du patrimoine naturel TAXREF v. 12. La nomenclature phytosociologique utilisée suit sauf indication contraire les déclinaisons par classe du Prodrome des végétations de France (Foucault, 2016 ; Foucault & Catteau, 2012 ; Royer & Ferrez, 2019).
4. L’association à Klasea lycopifolia et Filipendula vulgaris
Klaseo lycopifoliae–Filipenduletum vulgaris Offerhaus & Bravet ass. nov. hoc loco, typus nominis hoc loco : relevé 4 du tableau 1 hoc loco.
4.1 Physionomie
C’est une prairie de fauche de hauteur moyenne à élevée, à optimum de floraison fin juin, marquée par l’abondante floraison blanche de Filipendula vulgaris, Stellaria graminea, Galium boreale et jaune de Galium verum et Lathyrus pratensis (photos 4 et 5). Parmi les graminées, Deschampsia cespitosa est l’espèce la plus recouvrante. Alopecurus pratensis, Avenula pubescens, Phleum nodosum, Poa pratensis et P. trivialis sont ensuite les espèces les mieux représentées. Début juillet, les prairies sont ornées des nombreux capitules de fleurs roses longuement pédonculés de Klasea lycopifolia, ou parfois les abondantes têtes de fleurs pourpres de Sanguisorba officinalis. La prairie est fauchée au cours du mois de juillet. En septembre, les fleurs roses de Colchicum autumnale viennent égayer les prairies en annonçant l’automne.
4.2 Composition floristique et synsystématique
L’association est caractérisée par la combinaison de Deschampsia cespitosa, Alopecurus pratensis, Filipendula vulgaris, Stellaria graminea, Klasea lycopifolia et Thalictrum simplex subsp. simplex. Les espèces caractérisant l’Arrhenatherion elatioris et les unités supérieures (Arrhenatheretalia et Arrhenatheretea elatioris) sont nombreuses avec Lathyrus pratensis, Avenula pubescens, Vicia cracca, Rhinanthus minor, Arrhenatherum elatius, Trisetum flavescens, Tragopogon pratensis subsp. orientalis, Ranunculus acris, Galium verum, Trifolium pratense, Centaurea jacea, Poa pratensis, Rumex acetosa subsp. acetosa, Poa trivialis, Cerastium fontanum subsp. vulgare, etc. Au sein de l’alliance de l’Arrhenatherion, la présence de Colchicum autumnale, Narcissus poeticus, Phyteuma orbiculare, Sanguisorba officinalis, Achillea roseo–alba, A. ptarmica subsp. ptarmica permet de rattacher l’association à la sous-alliance mésohygrophile du Colchico autumnalis–Arrhenatherenion elatioris (Foucault, 2016). On note la présence de plusieurs espèces transgressives des prairies hygrophiles du Molinion caeruleae avec lesquelles l’association est très souvent en contact, principalement Galium boreale et Molinia caerulea. Parmi les autres compagnes, on trouve notamment les espèces caractérisant le Bromion erecti et les Festuco–Brometea erecti : Phleum nodosum, Briza media, Bromopsis erecta, Koeleria pyramidata et Plantago media qui sont les mieux représentés.
4.3 Écologie
Cette association mésohygrocline mésotrophile se développe à l’étage montagnard et a été observée à une altitude comprise entre 1 016 et 1 165 m (altitude moyenne de nos relevés : 1 092 m).
Localisation des relevés du tableau 1 (A.-M. = Alpes-Maritimes, A.H.P. = Alpes-de-Haute-Provence) – rel. 1 : A.-M., Saint-Auban, Les Collets, 27/06/2004 ; rel. 2 : A.-M., Caille, Camp de Cavaou, 09/07/2005 ; rel. 3 : Var, La Bastide, le Plan de Finiel, 23/06/2021 ; rel. 4 : A.-M., Saint-Auban, Les Colettes, 23/06/2021 ; rel. 5 : Var, La Bastide, le Plan de Finiel, 23/06/2021 ; rel. 6 : A.-M., Saint-Auban, Les Lattes, 23/06/2021 ; rel. 7 : A.-M., Saint-Auban, Les Collets, 23/06/2021 ; rel. 8 : A.-M., Saint-Auban, Le Pré des Saules, 23/06/2021 ; rel. 9 : A.-M., Caussols, Les Grands Prés, 26/06/2014 ; rel. 10 : A.-M., Caussols, Les Grands Prés, 03/07/2004 ; rel. 11 : A.-M., Caille, Les Courtilès, 18/06/2021 ; rel. 12 : A.-M., Séranon, Le Rieutort, 18/06/2021 ; Rel. 13 : A.-M., Caille, Les Sagnes, 18/06/2021 ; rel. 14 : A.H.P., Peyroules, Le Mousteiret, 18/06/2021 ; rel. 15 : A.-H.-P., Peyroules, en rive droite de l’Artuby près de la Foux, 23/06/2021 ; rel. 16 : A.-M., Saint-Auban, les Colettes, 06/06/2004 ; rel. 17 : A.-M., Andon, L’Embut, 18/06/2021 ; rel. 18 : A.-M., Andon, croisement de la D 2 et de la D 502, 18/06/2021.
5. L’association à Carex hartmanii et Sanguisorba officinalis
Carici hartmanii–Sanguisorbetum officinalis Offerhaus & Frachon ass. nov. hoc loco, typus nominis hoc loco : relevé 4 du tableau 2 hoc loco.
5.1 Physionomie
Il s’agit d’une prairie hygrophile marécageuse, non amendée. Elle est généralement dominée par Molinia caerulea. D’autres espèces à fort pouvoir colonisateur développant des touradons comme Deschampsia cespitosa ou plus rarement Carex paniculata peuvent imprimer une physionomie à l’association. Les faciès saisonniers sont variés : au mois d’avril, les prés humides se revêtent de jaune avec la floraison en masse de Taraxacum aginnense ; en mai-juin, ils se parent de blanc et de jaune avec Narcissus poeticus et Trollius europaeus ; fin juin, l’été s’annonce avec la floraison rougeoyante de Sanguisorba officinalis (photo 6).
5.2 Composition floristique et synsystématique
L’association est riche en caractéristiques du Molinion caeruleae. Les plus fréquentes sont Sanguisorba officinalis, Succisa pratensis, Ophioglossum vulgatum, Galium boreale, Carex hartmanii, Carex tomentosa, Lotus maritimus, Serratula tinctoria ; Trollius europaeus paraît être une bonne différentielle du Molinion caeruleae dans la dition. Parmi les espèces caractérisant l’ordre des Molinio caeruleae–Caricetalia davallianae Julve 1983 em. B. Foucault 1984 et de la sous-classe des Molinio caeruleae–Caricenea nigrae (Julve 1983) B. Foucault 1984, les espèces de haute fréquence sont Carex panicea, Molinia caerulea, Dactylorhiza majalis, Succisa pratensis, Carex davalliana, C. hartmanii. L’optique d’un rattachement du Molinion caeruleae à la classe des Scheuchzerio palustris–Caricetea nigrae Tüxen 1937 tel que proposé par de Foucault (1984) et Julve (1998) est ici adopté. L’association est caractérisée notamment par la présence d’espèces de bas-marais basiphiles du Caricion davallianae Klika 1934 (Carex davalliana, C. lepidocarpa, C. hostiana, Eriophorum latifolium), ce qui permet de la rattacher à la sous-alliance du Carici davallianae–Molinienion caeruleae B. Foucault & Géhu 1980. Parmi les espèces compagnes, la classe des prairies hygrophiles des Agrostietea stoloniferae Oberd. 1983 est bien représentée, avec Deschampsia cespitosa, Equisetum palustre, Trifolium hybridum var. elegans, Carex hirta, Achillea ptarmica subsp. ptarmica, Thalictrum simplex subsp. simplex, Juncus inflexus, Galium palustre. Les autres espèces prairiales les plus fréquentes, caractérisant la classe des Arrhenatheretea elatioris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952, sont Alopecurus pratensis, Narcissus poeticus, Ranunculus acris, Centaurea jacea, Lathyrus pratensis, Colchicum autumnale. Les compagnes du Bromion erecti W. Koch 1926 et des Festuco valesiacae–Brometea erecti Braun-Blanq. & Tüxen ex Klika & Hadač 1944 sont moins nombreuses et leur abondance moindre : Galium verum, Briza media, Carex flacca sont les plus fréquentes. Le Carici hartmanii–Sanguisorbetum officinalis présente des similitudes avec le Trollio europaei–Molinietum caeruleae Guin. 1955 décrit du Jura (Foucault, 1978). Il s’en différencie positivement par la constance de Sanguisorba officinalis et la présence élevée de Carex hartmanii et d’Ophioglossum vulgatum notamment. Parmi les compagnes hygrophiles, Trifolium hybridum var. elegans, Thalictrum simplex et Achillea ptarmica subsp. ptarmica, bien représentés dans le Molinion des Préalpes de Grasse, sont absentes du Trollio–Molinietum. Plus récemment, Lavagne et Rebuffel (2002) ont entrepris l’étude des zones humides du Var, qui touche l’extrémité occidentale de notre dition, mais sans décrire formellement d’associations. Le Carici hartmanii–Sanguisorbetum officinalis peut se reconnaître partiellement dans des relevés attribués par les auteurs soit à un Molinietum mediterraneum, soit à l’Achilleo ptarmicae–Sanguisorbetum officinalis des auteurs, ce dernier défini comme un groupement occupant les drains parcourant les plans inondables.
5.3 Spectre chorologique
L’association est remarquablement dépourvue d’espèces méditerranéennes, alors que les stations les plus méridionales se situent pourtant à seulement une vingtaine de kilomètres de la mer. L’élément eurasiatique représente 35 % du total des espèces, l’élément européen au sens large 17 %, l’élément paléotempéré 11 %, l’élément eurosibérien 10 %, l’élément circumboréal 10 %, l’élément euryméditerranéen 5 %, les 11 % restants se répartissant entre les éléments amphiatlantique, holarctique, subcosmopolite, orophyte européen et sud-européen.
5.4 Écologie
L’association se développe à l’étage montagnard, à une altitude comprise entre 1 019 et 1 230 m (altitude moyenne de nos relevés : 1 095 m), dans les mêmes types de localités que l’association précédente, mais occupe les dépressions marécageuses souvent situées en bordure d’un ruisseau. Bien que la fauche n’ait pas été observée dans ce type de prairie, elle est néanmoins possible.
Localisation des relevés du tableau 2 (A.-M. = Alpes-Maritimes, A.H.P. = Alpes-de-Haute-Provence) – rel. 1 : A.-M., Caille, vallon de l’Antre, 09/07/2005 ; rel. 2 : A.-M., Séranon, rive droite du Rieu-Tort, en face de la balise de randonnée n° 211, 01/07/2005 ; rel. 3 : A.H.P., Peyroules, le Mousteiret, 01/07/2005 ; rel. 4 : A.-M., Saint-Auban, les Colettes, 06/06/2004 ; rel. 5 : A.-M., Saint-Auban, le Pré des Saules, le long de la piste de Clos de Sestier, 06/06/2004 ; rel. 6 : A.-M., Saint-Auban, Les Collets, 27/06/2004 ; rel. 7 : A.-M., Saint-Auban, le Pré d’Oulle, 13/06/2004 ; rel. 8 : A.-M., Saint-Auban, les Colettes, 06/06/2004 ; rel. 9 : A.-M., Saint-Auban, Les Collets près des Lattes, 27/06/2004 ; rel. 10 : A.-d.-H.-P., Ubraye, La Palud, 27/06/2004 ; rel. 11 : A.-M., Andon, Thorenc, en face du croisement de la route menant à la station climatique, en rive droite de la Lane, 03/07/2004 ; rel. 12 : A.-M., Andon, Thorenc, bord de la Lane, en face de l’Ubac des Quatre Tours, 03/07/2004 ; rel. 13 : A.-M., Caussols, le Grand Pré, 26/06/2014 ; rel. 14 : A.-H.-P., Peyroules, le Plan de l’Arbre, 01/07/2005 ; rel. 15 : A.-M., Caussols, le Grand Pré, 03/07/2004 ; rel. 16 : Var, la Bastide, le Plan de Finiel, en rive droite du Rieu-Tort, à l’est du CD 21, 01/07/2005.
6. L’association à Achillea ptarmica et Carex disticha
Achilleo ptarmicae–Caricetum distichae Offerhaus & Bravet ass. nov. hoc loco, typus nominis hoc loco : relevé 3 du tableau 3 hoc loco.
Dans le niveau topographique le plus bas des plaines longuement inondables, se développe une association caractérisée par Carex disticha, Eleocharis palustris, Achillea ptarmica et Mentha arvensis (photo 7). Bien que n’ayant pu réunir que cinq relevés tant les conditions stationnelles favorables sont rares dans la dition, nous proposons toutefois de nommer cette végétation originale qui ne semble pas être décrite. Elle appartient nettement à la classe des Agrostietea stoloniferae et semble pouvoir se rattacher à l’alliance du Mentho arvensis-Eleocharition palustris dans l’ordre des Deschampsietalia cespitosae (Foucault & Catteau, 2012).
Localisation des relevés du tableau 3 (A.-M. = Alpes-Maritimes, A.H.P. = Alpes-de-Haute-Provence) – rel. 1 : Var, La Bastide, Tuart Grangon, 03/07/2004 ; rel. 2 : A.-M., Caille, Camp de Cavaou, 09/07/2005 ; rel. 3 : A.-M., Caille, vallon de l’Antre, 09/07/2005 ; rel. 4 : A.-M., Séranon, en contrebas du CD 6085, près de N.-D. de Gratemoine ; rel. 5 : A.H.P., le Mousteiret, 18/06/2021.
7. Approche systémique
L’existence de ces prairies est liée à un modelé géomorphologique de type karstique. Elles occupent souvent de grandes surfaces sur les plaines marneuses du Crétacé, imperméables et parcourues par des cours d’eau temporaires (Caussols, Caille) ou permanents (affluents de l’Estéron et de l’Artuby). La végétation de ces plaines marneuses est composée d’une mosaïque d’associations végétales que l’on retrouve d’une station à l’autre.
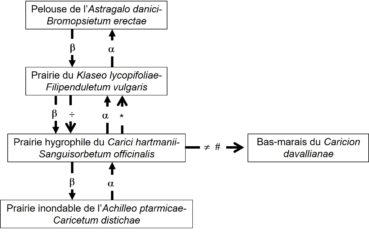
Ces communautés s’organisent selon un gradient d’humidité du sol, qui est fonction de la pente et de l’intensité du drainage. En partant des zones les plus sèches et en allant vers les plus humides, on peut établir le zonage suivant : les zones en faible pente ou sur des croupes sont occupées par une pelouse du Bromion erecti sur sol profond (sous-alliance Mesobromenion erecti), d’une grande richesse floristique ; cette pelouse, décrite par Guinochet (1975b) comme un Mesobrometum sur la base de seulement quatre relevés, a été récemment élevée au rang d’association propre par Royer et Ferrez (2019) sous le nom d’Astragalo danici–Bromopsietum erectae (Guin. 1975) J.-M. Royer & Ferrez 2020. À un niveau topographique moyen, c’est la prairie de fauche du Klaseo lycopifoliae–Filipenduletum vulgaris qui occupe de vastes surfaces (photo 8). À un niveau inférieur, c’est la prairie marécageuse à molinie du Molinion caeruleae. À un niveau légèrement plus bas, dans des dépressions linéaires qui suivent la pente, on peut observer fréquemment une formation de grandes laîches, Carex paniculata et parfois C. elata, qui forment des touradons. La flore qui accompagne ces cariçaies n’est guère différente de celle du Molinion adjacent et il est difficile de ranger ces formations dans les Caricetalia elatae. Dans de rares stations, une communauté de bas-marais peut s’observer en bordure de la prairie à molinie, se rattachant au Caricion davallianae Klika 1934, illustrée par le relevé suivant du 03/07/2006 provenant de Thorenc (Alpes-Maritimes), sur 30 m², recouvrement 100 % : Carex hostiana 1, Parnassia palustris 1, Eriophorum latifolium 3, Epipactis palustris 1, Schoenus nigricans 3, Triglochin palustre 2, Pinguicula vulgaris 2, Carex panicea +, Molinia caerulea 1, Carex davalliana 2, Potentilla erecta 2, Carex rostrata +, Gentiana pneumonanthe 1, Carex paniculata 1, Equisetum palustre +, Juncus articulatus + Vicia cracca +. Enfin, les localités les plus inondables des grands poljés comme celui de Caille sont occupées par la prairie de l’Achilleo ptarmicae-Caricetum distichae. Le graphe de la figure 1 présente les relations spatio-temporelles observées ou supposées entre les associations.
8. Intérêt patrimonial et conservation
Cet ensemble d’associations végétales mésohygrophiles à hygrophiles représente un écosystème de zone humide globalement encore bien conservé, assez exceptionnel au niveau régional, d’une grande richesse floristique, abritant de nombreux éléments patrimoniaux. Le Klaseo lycopifoliae–Filipenduletum vulgaris constitue un habitat d’intérêt communautaire : « 6510 Prairies de fauche de basse altitude (Alopecurus pratensis, Sanguisorba officinalis » et représente l’habitat d’espèce optimal de Klasea lycopifolia dans les Préalpes de Grasse, espèce de l’annexe II de la directive Habitats et protégée au niveau régional. Cette prairie contient d’autres espèces rares comme Thalictrum simplex, Achillea ptarmica, Lathyrus nissolia, Trifolium hybridum var. elegans, Galium boreale.
Le Carici hartmanii–Sanguisorbetum officinalis constitue un autre habitat naturel d’intérêt communautaire : « 6410 prairies humides du Molinion caeruleae ». L’association héberge plusieurs espèces rares à très rares dans la région, dont certaines (*) sont protégées : Achillea ptarmica, Carex hartmanii*, C. hostiana, Gentiana pneumonanthe, Ophioglossum vulgatum*.
L’Achilleo ptarmicae–Caricetum distichae abrite aussi des espèces rares régionalement comme Achillea ptarmica, Carex disticha (Salanon et al., 2002), Mentha arvensis. Véritables joyaux botaniques, l’avenir de ces associations et leur maintien dans un bon état de conservation paraissent incertains en raison de nombreuses menaces : l’augmentation des températures moyennes conjuguée à une diminution de la pluviométrie au printemps et en été et de l’enneigement hivernal dans un contexte de changement climatique, la pratique d’une agriculture et d’un pastoralisme non respectueux des milieux humides (changement de pratiques agricoles, mise en culture, drainage, surpâturage bovin et équin), le développement touristique (parc animalier), sans compter les nombreux parcs photovoltaïques de pleine nature en projet dans le secteur.
9. Conclusion
Les Préalpes de Grasse, région naturelle au relief principalement karstique, recèlent à l’étage montagnard des zones humides insoupçonnées d’un très grand intérêt écologique et floristique, dont les communautés végétales demeuraient jusqu’ici encore méconnues. L’étude phytosociologique de ces milieux a permis de définir trois nouvelles associations : le Klaseo lycopifoliae-Filipenduletum vulgaris, prairie de fauche mésohygrophile de l’Arrhenatherion elatioris, le Carici hartmanii-Sanguisorbetum officinalis, prairie marécageuse s’intégrant au Molinion caeruleae, et l’Achilleo ptarmicae-Caricetum distichae, prairie hygrophile inondable relevant du Mentho arvensis–Eleocharition palustris, allliance nouvellement signalée dans la région. Ces habitats fragiles, dont deux sont d’intérêt communautaire, sont l’objet de menaces grandissantes d’ordre anthropique, qui nécessiteraient des mesures de protection, comme un arrêté préfectoral de protection de biotope, ou a minima la concrétisation du projet de site Natura 2000 du Haut-Estéron, en discussion depuis de nombreuses années.
Bibliographie
Alziar G., Fiammengo R., Lafaye J.-C., Lemaître J., Offerhaus B., Rocchia A., Rousseau M., Rymarczyk F. & Salanon R., 1998. Flore vasculaire du bassin de l’Estéron (Alpes-Maritimes et Alpes-de-Haute-Provence). I – Liste des taxons. Biocosme mésogéen 14 (2-3) : 55-114.
Barbero M., 1972. Études phytosociologiques et écologiques comparées des végétations orophiles alpine, subalpine et mésogéenne des Alpes maritimes et ligures. Thèse de doctorat d’État, université d’Aix-Marseille, I : 1 – 418.
Barbero M. & Loisel R., 1971. Contribution à l’étude des pelouses à brome méditerranéennes et méditerranéo-montagnardes. Anales del Instituto Botánico A.J. Cavanilles XXVIII : 91-165.
Barbero M., Loisel R. & Poirion L., 1972. L’originalité biogéographique des Préalpes de Grasse. Riviéra scientifique 59 (4) : 81-92.
Barbero M., Loisel R. & Quézel P., 1972. Étude phytosociologique des pelouses à Anthyllis montana, Ononis striata, Sesleria coerulea en France méridionale. Bulletin de la Société botanique de France 119, 92e session extraordinaire : 141-168.
Canellas C., Gibelin A.-L., Lassègues P., Kerdonduff M., Dandin P. & Simon P., 2014. Les normales climatiques spatialisées Aurelhy 1981-2010 : températures et précipitations. La Météorologie 85, 47-55.
Chouard P., 1950. Esquisse de la géographie botanique du plateau karstique de Caussols (Alpes-Maritimes). Bulletin de la Société botanique de France 97 : 202-224.
Collectif, 2004. Réseau Natura 2000, site des Préalpes de Grasse FR 93015705 (PSIC) et FR93120002 (ZPS). Document d’objectifs. Partie B – Plan de gestion détaillé par habitats et par espèces. Préfecture des Alpes-Maritimes, 395 p.
Diadema K. & Noble V. (sous la direction de), 2011. La flore des Alpes-Maritimes et de la Principauté de Monaco. Originalité et diversité. Turriers, Naturalia Publications, 504 p.
Foucault B. (de), 1978. Données pour le Trollio–Molinietum coeruleae Guin. 1955 du Jura français. Colloques phytosociologiques V, La végétation des prairies iniondables : 245-248.
Foucault B. (de), 1984. Systémique, structuralisme et synsystématique des prairies hygrophiles des plaines atlantiques françaises. Thèse de doctorat d’État, université de Rouen, 675 p.
Foucault B. (de), 2016. Contribution au prodrome des végétations de France : les Arrhenatheretea elatioris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952. Documents phytosociologiques, 3e série, 3 : 5-217.
Foucault B. (de) & Catteau E., 2012. Contribution au prodrome des végétations de France : les Agrostietea stoloniferae Oberd. 1983. Journal de botanique de la Société botanique de France 59 : 5-131.
Géhu J.-M., 1984. Sur les étages bioclimatiques de la région eurosibérienne française. Documents phytosociologiques, NS, VIII : 29-43.
Guinochet M., 1975a. Contribution à la connaissance des Ononido–Rosmarinetea Br.-Bl. 1947 des Alpes Maritimes, suivie de quelques remarques à propos du Calycotomo–Myrtetum Guinochet 1944. Phytocoenologia 1 (4) : 460-469.
Guinochet M., 1975b. Sur quelques associations de pelouses des Préalpes de Grasse. Anales del Instituto Botánico A.J. Cavanilles 32 (2) : 1291-1314.
Julve Ph., 1998. Baseveg. Répertoire synonymique des groupements végétaux de France. Version 2020. http://perso.wanadoo.fr/philippe.julve/catminat.htm
Lavagne A. & Rebuffel G., 2002. Étude des marais et prairies marécageuses du nord-est et du centre-est du département du Var (France). Bulletin de la Société linnéenne de Provence 53 : 91-120.
Martin N. & Carrega P., 2011. L’enneigement dans les Alpes du Sud en France : évolution temporelle et relation avec la circulation atmosphérique. XXIVe colloque de l’Association internationale de climatologie, septembre 2011, Rovereto, Italie.
Offerhaus B., Rymarczyk F. & Alziar G., 1999. Observations chorologiques sur quelques plantes vasculaires des Alpes-Maritimes (France), notamment du bassin de la rivière Estéron. Biocosme Mésogéen 15 (2) : 211-218.
Poirion L., 1961. La végétation du karst des Préalpes de Grasse. Riviera scientifique 46-48 : 35-54.
Royer J.-M., 2009. Petit précis de phytosociologie sigmatiste. Bulletin de la Société botanique du Centre–Ouest, n° sp. 33 :1-86.
Royer J.-M. & Ferrez Y., 2019. Contribution au prodrome des végétations de France : les Festuco – Brometea Braun-Blanq. & Tüxen ex Klika & Hadač 1944. Documents phytosociologiques, 3e série, 13 : 5-276.
Salanon R., 1999. Parc animalier de Saint-Auban, Alpes-Maritimes. Patrimoine floristique et biotopes remarquables. Rapport d’étude, Conseil général des Alpes-Maritimes, Nice, 67 p.
Salanon R., Offerhaus B. & Rymarczyk F., 2002. Carex acuta L. et Carex disticha Huds. dans les Préalpes de Grasse et de Castellane (Alpes-Maritimes et Alpes-de-Haute-Provence). Riviera Scientifique 86 : 39-44.
Tison J.-M., Jauzein Ph. & Michaud H., 2014. Flore de la France méditerranéenne continentale. Conservatoire botanique national méditerranéen, Naturalia Publications, Turriers, 2078 p.
Remerciements
Ils s’adressent à Corinne Frachon et Pauline Bravet pour leur contribution à la réalisation des relevés sur le terrain, ainsi qu’à Thomas Bravet pour son autorisation d’utiliser ses photos de la plaine de Caille.