À propos de fougères alimentaires
Title
About some food ferns
Résumé
Considérée comme insolite par la plupart de nos contemporains, la consommation traditionnelle de fougères comme légume varie beaucoup selon les zones climatiques. Les exemples proposés dans cette étude montrent qu’elle subsiste encore par endroits dans les pays tempérés, mais ne concerne que quelques rares espèces utilisables parmi la flore assez réduite des ptéridophytes qui s’y trouvent. Dans les zones chaudes, au contraire, leur utilisation y est beaucoup plus importante car la possibilité de trouver des espèces consommables au sein de la profusion des ptéridophytes présents est très élevée.
Abstract
Considered unusual by most of our contemporaries, the traditional consumption of ferns as a vegetable varies greatly according to the climatic zones. The examples given in this study show that it still exists in places in temperate countries but concerns only a few rare usable species among the fairly small flora of pteridophytes found there. In hot areas, on the contrary, their use is much greater because the possibility of finding consumable species within the profusion of pteridophytes that develop there is very high.
Avertissement aux lecteurs
Les génomes des fougères ont une taille particulièrement élevée (par exemple la séquence de Ceratopteris richardii Brongn., établie en 2020, présente un génome de 7,46 milliards de paires de bases et 39 chromosomes). L’établissement de ces séquences demande du temps et la coopération de plusieurs équipes. Il en résulte que la classification des fougères est toujours en pleine évolution ; ainsi des espèces ont changé de noms, voire de genres et même de familles. Par ailleurs certaines espèces se sont révélées être des hybrides, comme Pteris ×caudatum que l’on retrouve en Guyane (Dumas, 2002). De plus la prolifération des synonymes complique singulièrement les identifications. En conséquence, la littérature utilisée ne comportant pas ces nouvelles avancées, les noms cités dans notre article sont pour la plupart ceux qui figurent dans les études consultées. Dans la mesure du possible, nous avons indiqué le nom officiel récent, mais conservé en synonymie la dénomination ancienne qui se rapporte spécifiquement aux articles pris en compte (indiqué entre parenthèse).
1. Introduction
Bien connus des groupes humains, les fougères ne sont généralement pas considérées comme plantes alimentaires. Toutefois la consommation de quelques espèces a encore lieu de nos jours, mais celle-ci varie considérablement selon les pays. Très rare dans les régions tempérées, hormis au Canada, elle est assez fréquente dans les pays subtropicaux et tropicaux en raison d’un nombre important de fougères représentées. En conséquence, les probabilités de trouver des espèces comestibles sont évidemment plus fortes. C’est d’ailleurs au cours de voyages en Asie subtropicale et tropicale (Bhoutan, Viêt-nam, Cambodge, Indonésie en particulier) que nous avons pris conscience de l’utilisation de certaines fougères comme légume. En effet, divers marchés locaux, au Nord-Viêt-nam par exemple, offrent sur les étalages des marchands des amas de frondes fraîches destinées à la confection de plats cuisinés (planche 1).
Au cours du xixe siècle et de la première moitié du xxe siècle, certains auteurs ont abordé le sujet des fougères alimentaires. On trouve ces informations dans les récits des voyageurs qui ont décrit les us et coutumes des ethnies qu’ils visitaient. C’est le cas, par exemple, de J. H. Maiden qui publie, en 1889, un ouvrage sur l’usage des plantes sauvages d’Australie et d’A. Chevalier (1951) qui recense les plantes utiles d’Océanie.
Une des premières études spécifiques consacrées aux fougères alimentaires est apparemment celle de B. Copeland (1942), mais cet auteur traite essentiellement d’essais de mise en culture pour évaluer la rentabilité d’un petit nombre d’espèces considérées comme source importante de nourriture. D’autres études concernant la consommation de fougères ont d’ailleurs été publiées par la suite (May, 1978 ; Jones,1987, par exemple).
Un des aspects singuliers dans lesquels les fougères sont mises à contribution est celui qui concerne la fabrication du « pain de fougère ». Violet, qui a connaissance de ce type de préparation, se demande dans son étude régionale parue en 1946, au chapitre Famines et le pain de fougère (p. 91 et sq) : « ce que pourrait être au juste ce pain fabriqué par nos ancêtres au cours des terribles famines qui désolèrent autrefois notre pays ». Goubeau (1950) indique que la racine traçante de Pteris aquilina (aujourd’hui Pteridium aquilinum) séchée et moulue fut utilisée, en mélange avec de la farine de seigle, pour fabriquer un pain grossier, mais précieux dans les temps de disette. Cet auteur (p. 49) précise encore que « …ce pain n’est pas seulement une spécialité de la région Tournus-Mâcon, puisqu’il était aussi connu au Creusot et il devait être confectionné partout où pousse la fougère aigle et additionné de son ou de farine de seigle ou même de sarrazin ou peut être fabriqué seulement avec la fougère quand le manque d’éléments était trop grand ».
Dans les pays tempérés de la planète, et plus particulièrement en Europe occidentale, cette consommation reste toutefois anecdotique. Il faut dire que les fougères, dont l’aspect diffère beaucoup de celui des plantes alimentaires habituelles, n’ont pas retenu l’attention des populations, d’autant plus que certaines d’entre elles ont la réputation d’être toxiques (Prelli & Boudrie, 2021 : 223).
À l’inverse, en Asie ou en Afrique, la participation des fougères à l’alimentation traditionnelle est courante et très variée. On note cependant que les espèces dont il est fait état dans ces pays sont majoritairement originaires des contrées tropicales et subtropicales. Dans les pays chauds, il existe effectivement de nombreuses espèces qui ont souvent de grandes dimensions et dont les rhizomes, les stipes et les frondes (ou feuilles), riches en substances nutritives, sont exploités de façon coutumière.
Depuis quelques années, les ethnobotanistes recensent les utilisations alimentaires et médicinales des fougères dans diverses régions du monde (Grenand et al., 2004 ; Botineau, 2022). Bien que non exhaustifs, les exemples choisis dans cette étude ne concernent que des espèces consommées. Cet aperçu permet ainsi d’évaluer le potentiel nourricier favorable de ces plantes particulières. En effet, elles contribuent incontestablement à l’alimentation humaine dans plusieurs contrées du monde comme on va le voir au cours de cet exposé (collecte de plantes sauvages, mais aussi développement de véritables cultures vivrières). Dans ces recensements figurent majoritairement ceux des zones subtropicales et tropicales de l’Asie et de l’Afrique.
Les inventaires asiatiques
En Chine, les espèces classiquement utilisées ont été dénombrées en 2012 par Yujing Liu et al. Cet inventaire ethnobotanique est remarquable puisqu’il recense 52 espèces (dont quatre variétés), catalogue dans lequel sont indiqués les parties des plantes et les produits qu’on en obtient (soupes, purées, alcool, etc.). Ces auteurs estiment qu’en Chine le nombre d’espèces alimentaires pourrait dépasser cent quarante ! Nous ne présenterons pas la totalité des taxons recensés dans leur étude, mais nous en indiquerons quelques-unes à titre d’exemple ; le lecteur intéressé pourra aisément consulter ce travail qui est accessible en ligne (cf. bibliographie).
À l’instar de ce qui été réalisé en Chine par Yujing Liu et al., Bajracharya et Bajracharya (2022) ont recensé, pour le Népal, trente-trois fougères comestibles. Pour chacune d’entre elles, ils précisent quelles sont les parties utilisées dans l’alimentation et abordent également les méthodes ancestrales pratiquées dans le domaine de la médecine traditionnelle (ethnomédecine), les études modernes sur les drogues fournies par la nature (pharmacognosie), ainsi que les éléments biochimiques qui ont pu être identifiés dans ces végétaux (phytochimie). Dans l’État de l’Uttar Pradesh (Inde), Joshi (1997) a recensé quarante-quatre espèces de fougères qui comportent à la fois des taxons alimentaires et médicinaux.
Les inventaires africains
En Afrique, une étude ethnobotanique détaillée, publiée en 2012, a été conduite par J. de D. Mangambu-Mokoso et son équipe dans la zone du parc national de Kahuzi Biega, en République démocratique du Congo (RDC). Ce travail met l’accent sur les usages alimentaires et médicinaux traditionnels de 41 espèces de ptéridophytes, par les tribus pygmées. Les auteurs soulignent par ailleurs les diverses menaces qui pèsent sur ces espèces et proposent des stratégies de conservation.De son côté, A. Maroyi (2014) a recensé en Afrique subsaharienne vingt-quatre taxons appartenant à quatorze genres et onze familles, utilisés en alimentation humaine. Ces végétaux sont consommés, pour la plupart, crus ou en salade sous forme de frondes auxquelles il faut ajouter parfois les rhizomes comestibles. Parmi ces fougères, l’auteur remarque que Pteridium aquilinum (L.) Kuhn est l’espèce comestible la plus courante : elle est utilisée en Angola, au Cameroun, en RDC, au Gabon, à Madagascar, au Nigeria et en Afrique du Sud. Elle est suivie par ordre d’importance de Ophioglossum reticulatum L. (Afrique du Sud, Swaziland et Zanzibar), Ceratopteris thalictroides (L.) Brongn. (Madagascar et Swaziland), Diplazium sammatii (Kuhn) C. Chr. (RDC et Nigéria), Nephrolepis biserrata Sw. (RDC et Nigeria) et Ophioglossum polyphyllum A. Braun ex Seub.(Namibie et Afrique du Sud).
Nous proposons donc de montrer aux lecteurs, par un certain nombre d’exemples pris « aux quatre coins du monde », que la consommation de fougères par l’Homme est une réalité qui dépend généralement des traditions culinaires, des espèces recherchées pour leurs saveurs mais aussi de leur collecte nécessaire lors de la survenue de pénuries alimentaires.
Cette présentation comporte deux parties distinguées selon les situations géographiques et climatiques, la première traitant des espèces vivant dans les zones tempérées du globe, tandis que la seconde partie concerne celles existant dans des univers tropicaux luxuriants. Si cette distinction met en lumière la disproportion taxonomique qui prévaut entre ces deux zones, elle n’est pas aussi tranchée qu’il n’y paraît. En effet, un certain nombre d’espèces se développent aussi bien dans les pays tempérés que dans les zones chaudes. Afin d’éviter des répétitions, la présentation de ces taxons ubiquistes sera effectuée dans le cadre des espèces de climat mésotherme avec une indication sur leur extension dans les pays chauds.
La dénomination, la répartition géographique, le biotope et l’utilisation sont présentés avec, dans la mesure du possible, une indication de préparation culinaire.
Pour compléter ce tour d’horizon, il est envisagé de proposer par la suite les fougères aux vertus médicinales. Certaines espèces possèdent, en effet, des propriétés singulières qui ont été reconnues empiriquement par tous les groupes humains depuis la préhistoire, afin de soigner hommes et animaux. Elles ont fait l’objet, ces dernières années, d’études biochimiques approfondies réalisées par plusieurs laboratoires pharmacologiques. Dans le monde, les fougères thérapeutiques sont beaucoup plus nombreuses que les espèces alimentaires. Devant l’ampleur de la masse d’informations, nous présenterons dans un prochain article uniquement les 84 fougères qui figurent dans l’ouvrage de pharmacopée traditionnelle du Viêt-nam, publié par le médecin-professeur Võ Văn Chi (1997) et qui nous servira de guide.
2. Les Fougères
2.1. Les formes anciennes
Ces végétaux, qui appartiennent à l’embranchement des ptéridophytes, sont des plantes vivaces primitives (Taylor et al., 2009). Les plus anciennes fougères apparaissent au Dévonien supérieur telles que les divers Racophyton (Leclercq 1951) il y a 365 millions d’années environ.
Au Carbonifère, on assiste à un développement considérable des fougères, dont la plupart sont arborescentes comme Pecopteris (Krings & Schultka, 2002) et Psarionius. Ces fougères associées aux Lycopodiacées (Lepidendron), aux Equisétales (Calamites) et aux Sigillaires ont constitué d’immenses forêts denses sous un climat chaud et humide. Leur disparition (enfouissement) provoquée par divers évènements géologiques ont engendré de puissantes formations charbonneuses qui ont été particulièrement exploitées depuis la révolution industrielle.
Le groupe des Pteridospermatophytes (fougères « à graines », en réalité « à ovules ») qui apparaît au Dévonien moyen va se développer durant 250 millions d’années, puis disparaître au Crétacé vers 120 Ma.
2.2. Les fougères actuelles
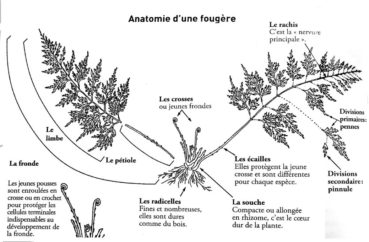
Le nombre des fougères sensu stricto qui vivent actuellement sur l’ensemble du globe est considérable puisqu’il atteindrait 11 916 espèces, selon The Pteridophyte Phylogeny Group (2016).
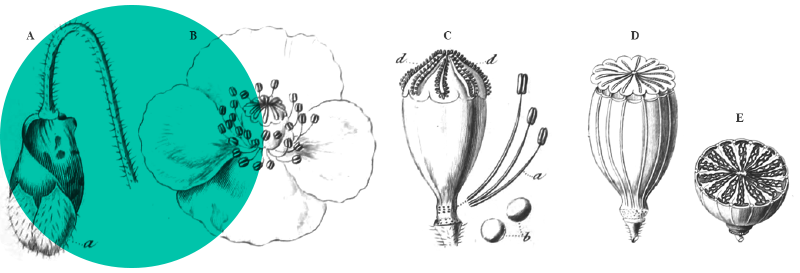
La plupart d’entre elles sont herbacées, mais il existe aussi des formes arborescentes (Large & Braggins, 2004). Elles se répartissent selon les divers habitats dans lesquels elles prospèrent : certains taxons sont épiphytes et vivent accrochées aux arbres ou aux rochers ; d’autres, terrestres, sont bien ancrées dans le sol. Leur constitution est aussi variable, il existe en effet des espèces à feuillage caduc, d’autres à feuillage persistant. Leur système racinaire est toujours lié à un rhizome, une tige généralement souterraine et horizontale qui donne naissance aux frondes et aux racines adventives (figure 1). Les espèces qui présentent des frondes fertiles et des frondes stériles distinctes, comme par exemple les quatre fougères de la planche 2, sont considérées comme des formes archaïques.
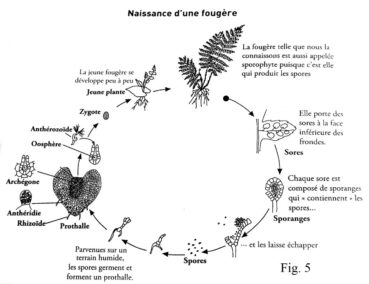
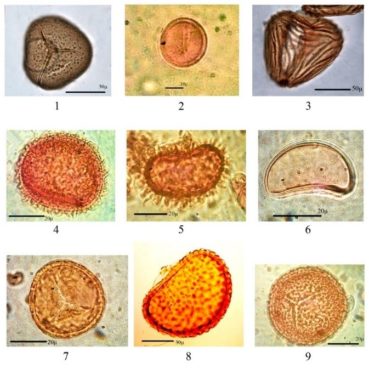
Les frondes fertiles ne forment pas de fleurs, mais produisent, sur leur revers, des sores qui contiennent des sporanges dans lesquels naissent les spores qui assurent la reproduction ; ces dernières présentent des morphologies caractéristiques qui sont propres à chaque espèce (planche 3). La germination de ces spores conduit à la formation d’une fine lame végétale, le prothalle, qui abrite sur sa face inférieure un archégone (organe femelle à n chromosomes) et à sa périphérie l’anthéridie (organe mâle) qui renferme des anthérozoïdes à n chromosomes. La présence d’un film d’eau conduira les anthérozoïdes jusqu’à l’oosphère afin de la féconder. Une plante à 2n chromosomes pourra alors naître et le prothalle disparaîtra, sauf exception, laissant place au sporophyte qui donnera les frondes de la nouvelle fougère (figure 2). Dans les zones désertiques, l’eau nécessaire à la reproduction faisant défaut, les fougères se reproduisent directement par émission de spores, pratique qui s’apparente à l’apogamie [1].
L’utilisation de fougères comme plante nourricière est apparemment pratiquée depuis fort longtemps et remonterait, à notre connaissance, au moins au Paléolithique supérieur (Revedin et al., 2010 ; cf. § Botrychium). Pour les périodes plus récentes, Néolithique et Antiquité, il n’y a en Europe apparemment aucune information sur la consommation de fougères alimentaires. Dans son ouvrage encyclopédique sur Les plantes alimentaires à travers les âges et à travers les peuples, Bois (1937) cite toutefois deux espèces (Adiantum capillus-veneris L. et Pteridium aquilinum Kuhn), mais ne dit rien sur l’origine chronologique de leur emploi.
De leur côté, Keller et Prance (2015) citent diverses études dans lesquelles une utilisation alimentaire très ancienne de fougères est révélée dans des gisements archéologiques d’Océanie et d’Asie. Anderson et White (2001) suggèrent que Cyathea était consommée, « il y a au moins 888 ans sur l’île Norfolk ». Houghton (1978) démontre une utilisation ancienne excessive de rhizomes de fougères mise en évidence par l’analyse de traces observées sur des dents humaines altérées découvertes en Nouvelle-Zélande. Zhang (2007) assure qu’on utilisait des fougères comestibles il y a au moins trois mille ans en Chine.
3. Les fougères des zones tempérées
Dans les régions tempérées, la tradition de cueillettes de crosses de fougères se maintient exceptionnellement et a même disparu dans bon nombre de contrées. Cette désaffection apparente est probablement due à la prise en compte des informations parues dans les ouvrages consacrés aux plantes médicinales. En effet, ces livres mettent l’accent sur l’existence d’espèces toxiques au sein du groupe des fougères. Ils n’abordent pas les possibilités alimentaires de certaines d’entre elles, mais traitent essentiellement de leurs effets thérapeutiques en médecines humaine et vétérinaire. Comme on va le constater, il y a néanmoins, plusieurs d’espèces qui sont toujours recherchées par des amateurs pour leur valeur gustative, sinon nourricière.
1. Adiantum capillus-veneris (Pteridaceae ; photo 1)
Cette fougère se rencontre en Europe du Sud, en région méditerranéenne (Jahns, 1989), près des cascades et des fontaines. Elle existe aussi dans les zones septentrionales tempérées comme celles d’Amérique du Nord (Canada). Elle se développe le long de parois ombragées et humides et est considérée comme caractéristique de la classe de végétation des Adiantetea capilli-veneris (falaises continentales humides). Au Canada, seules deux populations subsistent en Colombie-Britannique, à la faveur de la présence des sources d’eau chaude de Fairmount Spring, qui leur apporte chaleur et humidité. Le COSEPAC (2000) estime que ces deux populations sont en danger de disparition[2].
À l’instar de la conservation dans du vinaigre des bourgeons floraux de Capparis spinosa (câpres) et des fruits de cet arbuste, particulièrement en Italie (cucunci) et en Espagne (alcaparrones), les jeunes pousses (crosses) du capillaire sont conservées de manière identique, tandis que ses frondes crues sont ajoutées à la salade pour lui donner une meilleure saveur (Vaga, 1975).
Bois (1937, tome IV) indique par ailleurs que ses frondes étaient utilisées pour faire une boisson théiforme. Dorvault (1928, p.1962-63) cite diverses spécialités bavaroises faites à partir de sirop de capillaire, l’une dite « à l’eau » qui est une infusion de thé additionnée de sirop de capillaire[3], une dite « au lait » dans laquelle on ajoute au mélange précédent du lait ou de la crème, et une autre « au chocolat » dont la recette est complétée par du chocolat.
Couplan (2009, p 48) précise que l’infusion de frondes est légèrement aromatique et agréable au goût, et que le sirop mélangé à du lait forme « la bavaroise », boisson très en honneur au xviiie siècle. Par ailleurs, ce même auteur indique que « les crosses, jeunes et tendres, sont consommées crues, en salade ou cuites comme légume en Bosnie ». Selon Fournier (1948, III, p.201) les « bavaroises de jadis » étaient faites avec un sirop de capillaire fait à raison de 20 g de fronde, 340 g d’eau et 640 g de sucre, mélangé à du lait.
2. Adiantum pedatum (Pteridaceae)
Cette espèce est originaire des zones tempérées de l’est de l’Amérique du Nord et de l’Asie du Sud-Est. Elle vit à l’ombre, sur un sol drainé, riche et légèrement acide, toujours frais.
En Amérique du Nord, on faisait également du thé et du sirop médicinal avec ses frondes (Couplan, 2009). Ce sirop entre, comme on vient de le voir, dans la confection de la crème bavaroise. Le sirop de capillaire est réalisé avec deux grosses poignées de frondes, lavées et disposées dans une casserole et couvertes d’eau. Le tout est porté à ébullition durant quinze minutes, puis infusé environ une heure feu éteint. Les frondes sont égouttées et pressées pour en extraire tout le suc. La solution est filtrée et sucrée, puis cuite encore quinze minutes pour réduire son volume.
Offerte autrefois aux dames lors des soirées d’hiver, la crème bavaroise est composée par un mélange miel et de sirop de capillaire auquel on joint du thé et du lait en fouettant l’ensemble de façon qu’il devienne mousseux. On termine la préparation en ajoutant de la crème fraîche et de l’eau de fleurs d’oranger. Certaines fois, on agrémentait la préparation avec un jaune d’œuf et du kirsch.
On se rend compte ainsi que les recettes concernant la préparation de « bavaroises » à base d’Adiantum sont multiples et varient d’un auteur à l’autre !
3. Asplenium septentrionale (L.) Hoffm. (Aspleniaceae)
Cette plante héliophile qui vit sur des falaises et des rochers siliceux a une répartition circumboréale. Elle est plus fréquente en montagne, mais peut se rencontrer à basse altitude dans des sites rocailleux.
En Catalogne, les frondes entrent dans la composition d’un ratafia de vin à base de noix vertes (Couplan, 2009, p. 48). Bonet et Vallès (2002, p. 237) indiquent une autre recette plus complexe de cette boisson, dans laquelle on ajoute aux frondes de cette fougère diverses plantes aromatiques comme la menthe, le thym, le romarin, le fenouil, l’origan, la sauge, l’ortie, la citronnelle, l’estragon, la camomille, le basilic, le sureau, la mélisse, le tilleul, ainsi que des épices comme le poivre, les clous de girofle, la cannelle, la vanille, la muscade, l’anis étoilé, la réglisse, le gingembre, la cardamome, etc.
4. Asplenium trichomanes L. (Aspleniaceae ; photo 2)
C’est une petite fougère à feuilles alternes qui pousse dans les interstices des vieux murs de pierres calcaires ou siliceuses. Extrêmement résistante à la dessiccation et au froid, elle ne craint pas l’altitude (jusqu’à 2000 m selon Prelli & Boudrie, 2021). Cette espèce cosmopolite est répandue sur presque toute la surface du globe, aussi bien dans les régions tempérées des deux hémisphères que dans les régions montagneuses tropicales.
Les frondes ont des propriétés émollientes, anti-inflammatoires, expectorantes et apéritives. L’apéritif est constitué par une macération de frondes dans du sirop mélangé à du lait pour former une bavaroise, comparable à celle faite avec des frondes de Adiantum capillus-veneris ou d’Asplenium septentrionale.
5. Athyrium atkinsonii Bedd. (Athyriaceae)
Nombreux synonymes.
C’est une fougère asiatique dont la distribution comprend l’Assam, la Chine (Centre-Nord, Centre-Sud et Sud-Est), l’Himalaya occidental et oriental, le Japon, le Myanmar, le Népal, le Pakistan, Taiwan, le Tibet, le Viêt-nam. Elle vit principalement dans le biome tempéré.
Au Népal, les jeunes frondes de cette espèce de haute altitude sont utilisées comme légume dans l’ouest du pays (Kandel, 2020 ; Bajracharya & Bajracharya, 2022).
6. Athyrium filix-femina (L.) Roth (Athyriaceae)
Syn. : Polypodium filix-femina L., Asplenium filix-femina (L.) Bernh., Aspidium filix-femina (L.) Sw.
L’espèce type se rencontre plus généralement dans les régions tempérées de l’hémisphère nord (Asie, Amérique du Nord, Europe). Elle est assez commune en France, sauf dans le Sud-Ouest et en région méditerranéenne. Elle se trouve également en montagne jusqu’à plus de 2 000 m. Vivant dans les stations fraîches, à hygrométrie élevée, elle se rencontre dans les forêts humides de feuillus ou de résineux, dans les prairies humides et ombragées de montagne, dans les endroits pierreux humides et aux bords des fossés (Jahns, 1989).
Il existerait une variété américaine Athyrium filix-femina var. michauxii Mett. (dénomination citée dans les études de Toupal & Hollenback,2009 : 97) qui serait commune dans la vallée du fleuve Saint-Laurent, au Québec (Marie-Victorin,1964). Actuellement, ce nom est synonyme de Athyrium angustum (Willd.) C. Presl (FNA s.d.). Dans cette province, le groupe ethnique des Potawatomi récolte les feuilles au début du printemps pour faire de la soupe (Toupal, 2006). Turner et al. (1992) signalent que plusieurs tribus nord-amérindiennes (Makah, S’Klallam, Quileute, Quinault, Tanaina) rôtissent les rhizomes de cette fougère après les avoir largement pelés.
7. Athyrium monomachii (Kom.) Kom. (Athyriaceae)
Syn : Athyrium multidentatum (Döll) Ching (cette dénomination est utilisée dans les études de Yujing Liu et al., 2012), Aspidium filix-femina (L.) Sw. var. multidentatum Döll.
C’est une espèce de fougère commune dans le nord-est de la Chine qui se nomme hou tui en chinois, ce qui signifie « pattes de singe » à cause des poils jaunes des pétioles. Très savoureuses et parfumées, ses frondes sont sautées ou cuites pour la soupe (Yujing Liu et al., 2012).
8. Athyrium strigillosum (T. Moore ex Lowe) T. Moore ex Salomon (Athyriaceae)
Selon l’index de Kew, cette espèce se rencontre au Pakistan, au Népal, dans le sud de la Chine, au Myanmar, à Taiwan, au sud du Japon. Elle vit principalement dans le biome tempéré dans des forêt humides ou le long des berges et des lits de ravins bien ombragés.
Au Népal, les jeunes frondes sont consommées comme légume par les habitants de Godawari, district de Lalitpur (Kandel, 2020 ; Ojha & Devkotah, 2021, Bajracharya & Bajracharya, 2022).
9. Botrychium lunaria (L.) Sw. (Ophioglossaceae ; photo 3)
Bien qu’assez rare, cette petite fougère présente une large distribution géographique qui s’étend en Europe (de l’Islande à l’Andalousie), en Asie du Nord (de la Russie au Japon en passant par le Caucase et l’Himalaya), en Amérique du Nord (de l’Alaska au Groenland, en passant par les Montagnes Rocheuses), en Amérique du Sud, en Australie et en Nouvelle-Zélande. C’est une héliophile essentiellement montagnarde qui vit sur des pelouses rases au sol siliceux ou sur calcaire décalcifié. En région laurentienne, au Québec, elle prospère aussi sur les rivages et particulièrement sur les graviers maritimes (Marie-Victorin, 1964).
Couplan (2009) indique que l’on utilise ses jeunes frondes fertiles, très tendres, qui croquent sous la dent et qui ont un goût agréable avec une texture farineuse. Dans le haut Jura, certaines personnes la consommaient naguère en salade. Dans le Vercors, Botrychium lunaria était utilisé pour préparer la « liqueur de bon raisin ».
L’analyse des grains d’amidon fixés sur un pilon découvert sur le site préhistorique de Kostienki VI (culture du Gravettien ancien) montre qu’ils proviennent des racines de Typha et des rhizomes de Botrychium. L’identification de ces deux plantes aux organes souterrains riches en amidon et faciles à broyer met en lumière la consommation de farine végétale, issue en partie de cette fougère spécifique. Il y a trente mille ans environ, nos ancêtres du Paléolithique supérieur avaient trouvé une réelle ressource énergétique tirée de cette petite fougère (Revedin et al., 2010).
10. Botrypus virginianus (L.) Michx. (Ophioglossaceae ; photo 4)
Syn. : Botrychium virginianum (L.) Sw.
Comme l’espèce précédente, ce taxon a également une vaste distribution puisqu’on le trouve en Europe, en Amérique (États-Unis, Mexique jusqu’en Uruguay) et en Asie (Oural jusqu’au Japon). C’est une espèce montagnarde qui vit dans des bois riches et humides à ombre dense.
Dans les régions himalayennes, on a consommé ses jeunes pousses (crosses) après cuisson à l’eau (Couplan, 2009).
11. Christella procera (D. Don) Mazumdar (Thelypteridaceae)
Syn : Thelypteris procera (D. Don) Fraser-Jenk. (ce nom est indiqué dans l’étude de Poudel & Joshi, 2021).
L’aire de répartition naturelle de cette espèce s’étend de l’Himalaya à la Chine (nord-ouest du Yunnan) et à l’Indochine. Il pousse principalement dans le biome tempéré.
Cette fougère est consommée au Népal (Poudel & Joshi, 2021).
12. Claytosmunda claytoniana (L.) Metzgar & Rouhan (Osmundaceae)
Syn : Osmunda claytoniana L. (cité sous ce nom dans les études de Ohwi, 1965, Ojha & Devkotah, 2021, et Bajracharya & Bajracharya, 2022).
Elle vit à haute altitude dans les prairies humides et ombragées du domaine forestier Au Népal, les frondes sont utilisées comme légume dans les districts de Dhunche, Rasuwa (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
13. Diplazium maximum (D. Don) C. Chr. (Athyriaceae)
Syn. : Allantodia gigantea (Baker) Ching, Asplenium maximum D. Don (ce dernier nom est utilisé dans les études de Ojha & Devkotah, 2021, et Bajracharya & Bajracharya, 2022).
Cette fougère asiatique vit dans les contrées tempérées du Bhoutan, de l’ Inde, de la Chine, au nord-est du Myanmar au Népal, au Viêt-nam, à Bornéo, etc. On la rencontre de 900 m à 1 800 m d’altitude, à mi-ombre.dans des vallées et des forêts de feuillus et d’arbres à feuilles persistantes, à côté de ruisseaux sur sol humide et riche en humus.
En Chine, on mange les frondes tendres sautées, en soupe ou cuisinées après salaison (Yujing Liu et al., 2012). Au Népal, cette fougère, qui a une crosse plus épaisse et plus substantielle que celles des espèces D. esculentum et D. kawakamii, est vendue sur les marchés sur une courte saison en juillet-août (Kandel, 2021). Ses pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
14. Diplazium stoliczkae R.H. Bedd. (Athyriaceae)
Cette fougère asiatique vit dans le biome tempéré du centre du Népal à la Chine (Yunnan) et au nord de l’Indochine.
Au Népal, les pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
15. Dryopteris expansa (C. Presl) Fraser-Jenk. & Jermy (Dryopteridaceae)
Cette espèce s’observe en Eurasie (sauf dans ses zones méridionales) jusqu’à l’Altaï, au Groenland et en Amérique du Nord (du sud de l’Alaska jusqu’à Terre-Neuve et de la Californie sur le Pacifique jusqu’à la Caroline du Nord sur l’Atlantique). Répandue dans les sous-bois humides et les marécages, elle vit souvent sur des souches et rondins en décomposition. On la rencontre aussi sur les pentes rocheuses, entre 50 m et 1 500 m d’altitude.
En Amérique du Nord, les tribus amérindiennes de la Colombie-Britannique, ainsi que les groupes du sud-ouest de l’Alaska et de l’ouest de Washington en consomment les rhizomes dont la récolte se fait au début de l’automne.
Selon Kuhnlein & Turner (1991 : 33) et Turner et al. (1992), cette espèce se distingue par la disposition de ses rhizomes qui rappellent la forme d’un amas de bananes ou l’image des doigts de deux mains jointes.
Ces rhizomes doivent être ronds, charnus et de couleur claire ; dans le cas contraire (plats et sombres), ils ne sont pas bons à manger. Amers lorsqu’ils sont consommés crus, ils développent après cuisson une saveur riche et sucrée qui a été comparée à la texture et au goût des patates douces. Ils doivent être cuits au four, puis pelés pour enlever les écailles avant d’être mangés. On les prépare souvent avec de la graisse ou de l’huile animale ou de poisson (Kuhnlein & Turner 1991).
Turner et al. (1992) précisent que les Amérindiens de la côte pacifique, les Nuxalka-Bella Coola, cuisent les rhizomes dans des fosses, souvent en hiver, lorsque la nourriture se fait rare. Cette cuisson dénature la thiaminase qui peut induire une carence en vitamine B1. La consommation de cette fougère implique donc une certaine prudence.
Elles sont rarement consommées aujourd’hui et sont surtout connues des personnes âgées. Leur composition est similaire à celle de la pomme de terre commune, mais les éléments Ca, Mg, Zn, Cu, et Mn y sont présents en plus grande quantité.
Kuhnlein et Turner (1991) citent l’étude de Kari, parue en 1987, qui note que les Tanaina, peuple autochtone de l’Alaska, fabriquaient également un type de bière en faisant bouillir le rhizome de ce Dryopteris : cuits, ils étaient mis à fermenter avec du houblon, du sucre, de la purée de pommes de terre ou de la semoule de maïs et de la levure. L’auteur pense que cette pratique historique a été enseignée par les Russes qui occupaient la région à l’époque.Au printemps, les Amérindiens récoltent également les crosses pour préparer des soupes. Les Inuits les font bouillir et les mangent avec de l’huile de phoque et du poisson séché (Turner et al.,1992).
16. Dryopteris filix-mas (L.) Schott (Dryopteridaceae)
Syn. : Polystichum filix-mas (L.) Roth (ce nom est utilisé dans l’étude de M. Coquillat, 1950 : 173).
C’est une espèce que l’on observe dans les régions tempérées et froides de l’hémisphère nord principalement. Elle est commune en France, sauf dans les régions méditerranéennes et le bassin aquitain. Elle existerait aussi en Afrique du Nord.
On l’observe dans les stations fraîches, humides et ombragées, et peut prospérer jusqu’à 2 000 m. Elle se situe ainsi sur les bordures de haies, les abords de fossés, les talus ombragés et frais et sous les couverts forestiers, aussi bien de feuillus et que de résineux. Ses rhizomes sont courts, mais volumineux.
On utilise ses jeunes pousses (crosses) et ses rhizomes qui sont récoltés en été et au début de l’automne. En Scandinavie et au Québec, les crosses sont consommées cuites, comme des asperges. En Sibérie, les rhizomes bouillis dans la bière confèrent à cette boisson un parfum de framboise. Durant les famines du xviie siècle en Europe, le rhizome séché et pulvérisé servait à faire du pain (Coquillat, 1950, p 173). Lieutaghi (1996, p. 239) signale également que le rhizome mêlé à du pain était consommé autrefois en Auvergne.
Sa consommation est toutefois dangereuse, car elle est toxique. En effet, une thiaminase, des tanins et un hétéroside cyanogénétique ont été isolés dans la jeune plante. Elle contient aussi de la filicine brute qui fournit des dérivés du phloroglucinol : aspinidol, albasidine, phloraspirine et acide filicinique. Le filicinylbutanone est le principe actif toxique dans la plante. C’est un poison nerveux, sa toxicité est principalement mydriatique, mais elle provoque aussi nausées, vomissements, troubles digestifs, troubles de la vue (cécité éventuelle), altération du foie avec observation d’ictère.
Curieusement ses frondes sont utilisées comme apport alimentaire pour les porcs qui en retirent de l’embonpoint (Cazin, 1868, p. 439 ; Goubeau, 1950 ; Coquillat, 1950 ; Daumas, 2002). Mêlées à de la paille, elles constituent un fourrage de remplacement. Il s’agit ici d’un exemple indirect de l’utilisation d’une fougère par des animaux pour qu’à terme le genre humain en tire un réel bénéfice alimentaire.
17. Marsilea quadrifolia (Marsileaceae ; photo 5)
Cette petite fougère semi-aquatique, dont la forme des frondes rappelle celle d’une feuille de trèfle à quatre folioles, présente une grande répartition qui s’étend de l’Europe à l’Asie orientale tropicale (Inde, Chine, péninsule indochinoise ; Pham Hoang Ho, 1999, 1 : 211). Elle vit dans les marécages, dans les étangs peu profonds, sur la bordure des plans d’eau stagnante (mares, fossés) et sur les terrains temporairement inondés. C’est une fougère rare et protégée en France.
On utilise ses frondes et ses pétioles. En Chine ses « feuilles » sont sautées avec de l’ail haché et agrémentées de sauce de soja. Au Cambodge, elles sont consommées crues comme légume (Martin, 1971). Au Viêt-nam, les paysans utilisent les jeunes feuilles comme légume sauvage, fraîches ou poêlées, et pour faire une soupe avec de la viande ou des petites crevettes. Elles ont un goût sucré et légèrement amer et des propriétés rafraîchissantes. 100 g de jeunes frondes contiennent environ 84,2 g d’eau, 4,6 g de protéines, 1,6 g de glucides, 0,72 mg de carotène et 76 mg de vitamine C (Tanaka & Nguyen, 2007).
Autrefois, en Australie, les indigènes les ramassaient, les broyaient entre deux pierres pour en faire une sorte de farine ou de semoule, qu’ils transformaient en pâte (Maiden, 1889, p.42-44). Il est vraisemblable qu’il s’agisse d’un autre taxon car on sait maintenant qu’il existe au moins six espèces de Marsilea dans ce pays.
Au Népal, les pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021). Au Viêt-nam, toute la plante est consommée crue ou cuite à l’eau pour faire une soupe acide aux crabes, poissons, crevettes en mắm[4] (Tồng Cục Hậu Cần & Cục Quân Nhu, 2007, p. 198). Au Laos, elle est couramment utilisée dans l’alimentation à l’état cru en guise de salade sans aucun apprêt ; on la trouve sur les marchés à peu près en toute saison (Vidal, 1967).
18. Matteuccia struthiopteris (L.) Tod. (Onocleaceae ; planche 4)
Syn. : Struthiopteris germanica Willd.
Cette espèce fait partie des fougères à large distribution géographique. En effet, elle se rencontre en Europe, surtout centrale et boréale, en Asie et Amérique boréales. En France, elle est assez rare, mais on peut l’observer en Lorraine et en Alsace dans les Vosges. Cette espèce vit sur sol acide, au bord des ruisseaux et parfois sur des troncs d’arbre.
On utilise ses jeunes pousses encore en crosses (dénommées têtes de violon) que l’on débarrasse de leurs écailles. Cuites deux fois à l’eau bouillante pendant dix minutes, sa toxicité disparaît à la cuisson. Leur goût rappelle celui des asperges, des épinards et des artichauts. C’est sans doute la fougère dont les recettes culinaires sont les plus couramment présentées et détaillées sur internet (sautées dans de l’huile d’olive, mélangées avec des tranches de mandarine ou assaisonnées au jus de citron, etc.).
En Amérique du Nord, les crosses sont consommées à la manière des asperges : bouillies ou rôties (Toupal, 2006). Symbole de l’arrivée des beaux jours, les Canadiens et les New-Yorkais vont les cueillir en famille dans les bois. Poêlées, ils les mangent avec une vinaigrette à la moutarde ou les incorporent dans des omelettes avec du fromage et des fines herbes. Cette consommation traditionnelle est toujours pratiquée par différentes tribus amérindiennes : les Potéouatamis du haut Mississipi, les Malécites des vallées de Penobscot et de la rivière Saint-Jean, du Maine et du Nouveau-Brunswick, les Micmacs, les Abénakis, les Passamaquoddy et les Penobscot. Plus tard, certains peuples autochtones les ont vendues comme légumes verts de printemps aux colons européens. Dans les années 1880, les Malécites de St. Mary en proposaient sur les marchés de la région de Fredericton. Ces crosses de fougère ont gagné en popularité dans toute la région. Elles sont cuites et mangées comme des asperges et aujourd’hui de nombreuses personnes les congèlent pour l’hiver (Kuhnlein & Turner, 1991, p. 33-34). Au Japon, ces crosses servent à faire des beignets (tempura) revenus dans une sauce au soja (Couplan, 2009).
19. Onoclea sensibilis L. (Onocleaceae)
On rencontre cette espèce au nord-est de l’Amérique du Nord et en Asie orientale. Elle vit dans des milieux acides aux sols gorgés d’eau (sols marécageux, rives de cours d’eau).
Couplan (2009) indique que certains Amérindiens consomment le rhizome après cuisson. Kuhnlein et Turner (1991) signalent que les Iroquois cuisent également les crosses (têtes de violon) comme légumes.
20. Ophioglossum polyphyllum Braun ex Seub. (Ophioglossaceae)
Syn. : Ophioglossum regulare (Schtdl.) C. Chr., O. capense (Schtdl.) C. Chr.
Cet ophioglosse se rencontre dans les zones tempérées et subtropicale d’une très grande partie du globe : Afrique du Nord, Canaries, Afrique tropicale et Afrique du Sud, Asie (Arabie, Afghanistan, Inde, Tibet) Australie (Queensland), ainsi qu’au sud de l’Amérique du Nord (Arizona, Texas, Mexique). Il pousse dans des endroits plutôt dégagés, dans des sols pauvres gréseux temporairement humides, mais il est absent des forêts ; il forme des colonies qui peuvent dépasser une centaine d’individus.
Au Tibet, les jeunes frondes sont récoltées à la mi-juillet, compte-tenu des conditions climatiques. Cette fougère constitue un précieux légume qui entre dans une soupe locale. Elle est considérée comme la meilleure herbe potagère disponible car ses teneurs en thréonine, valine, isoleucine et tyrosine, remarquablement élevées (24%), en font un légume protéagineux dont la teneur en acides aminés est bien équilibrée. Ses proportions relatives d’acides gras saturés / mono-insaturés / poly-insaturés qui représentent respectivement 24,6% / 16,5% / 29,7%, lui confèrent une importante valeur nutritionnelle qui complète les régimes alimentaires locaux (Lognay et al., 2008).
21. Ophioglossum vulgatum L. (Ophioglossaceae)
Cette fougère présente une large distribution : en Asie (Népal, Chine, Inde, Sri Lanka, Corée, Japon), en Australie, en Amérique du Nord et en Europe. Vivant dans la plupart des zones tempérées de l’hémisphère nord, cette petite fougère pousse naturellement dans les prairies humides oligotrophes basiques, en particulier après un incendie.
Au Népal, on la consomme entière (Bajracharya & Bajracharya, 2022). En effet, elle ne possède qu’une fronde stérile engainant une fronde fertile très modifiée.
22. Osmunda claytoniana L. (Osmundaceae)
De large distribution géographique, cette grande fougère caduque qui vit sur sol frais se rencontre dans les zones tempérées d’Asie : ouest, centre et est du Népal, Chine (Chongqing, Guizhou, Hubei, Hunan, Liaoning, Sichuan, Xizang et Yunnan), Taiwan, dans le nord de l’Inde (Sikkim, Arunachal, Darjeeling, Uttarakhand, Himachal), au Pakistan, au Bhoutan, en Corée, au Japon, en Russie orientale et en Amérique du Nord. Elle vit à haute altitude dans les prairies humides et ombragées du domaine forestier
Au Népal, les frondes sont utilisées comme légume dans les districts de Dhunche, Rasuwa (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
23. Osmunda japonica (Osmundaceae)
Originaire de l’est de l’Asie, cette osmonde se rencontre depuis l’Extrême-Orient russe jusqu’aux montagnes de l’Himalaya, à Taiwan, en Chine, en Corée, au Viêt-nam et au Japon. Plante calcifuge, elle vit en milieu humide (sous-bois, bordures de ruisseaux, rocailles suintantes).
Particulièrement répandue au Japon, ses jeunes pousses, très appréciées, sont consommées comme des légumes et entrent dans la préparation de plats traditionnels. En Chine, on fait des nouilles avec l’amidon tiré de son rhizome (Yunjing Liu et al., 2012).
24. Osmunda regalis (Osmundaceae ; planche 2, C)
L’osmonde royale est une espèce cosmopolite présente en Afrique, en Amérique, en Asie et dans presque toute l’Europe, sauf l’extrême Est. Elle se cantonne dans des régions au climat relativement doux. Dans les pays tempérés, on la trouve en plaine ; dans les pays tropicaux, on la rencontre en montagne.
Les crosses sont tendres et comestibles, mais elles ont un goût âcre. Au Japon, on les fait bouillir dans de l’eau avec des cendres de bois, puis on les consomme en légume ou en soupe. Elles sont aussi mises à sécher ou conservées au sel. Le rhizome contient du mucilage (Couplan, 2009).
En Afrique tropicale, les jeunes pousses sont consommées chez les Tembo et les Pygmées (Mangambu Mokoso et al., 2012).
25. Osmundastrum cinnamomeum (L.) C. Presl (Osmundaceae)
Syn. : Osmunda cinnamomea L. (c’est ce nom qui figure dans les référentiels utilisés).
On trouve ce taxon dans la moitié orientale de l’Amérique du Nord, en Amérique du Sud, en Asie tempérée et tropicale (Japon, Chine, Corée, Taiwan, Thaïlande, Myanmar, Viêt-nam et au sud de la Sibérie). Dans les pays d’Asie, il s’agit probablement de la sous-espèce asiaticum (Fernald) Fraser-Jenk. Cette fougère pousse dans les bois, les marais et les tourbières.
À Saint-Pierre-et-Miquelon, les enfants, qui mangent la base du pétiole tendre, succulente et sucrée, l’appellent « noix sauvage » (Le Hors, 2009). Kuhnlein et Turner (1991) précisent que les Iroquois mâchent la base des frondes, tandis que les Menominis consomment les frondes bouillies. Selon le père Louis-Marie (1931), le rhizome serait légèrement astringent.
En Chine, on utilise ses frondes cuisinées avec d’autres aliments pour faire de la soupe (Yunjing Liu et al., 2012).
26. Polypodium cambricum (Polypodiaceae)
Syn. Polypodium australe Fée var. cambricum, P. serratum (Willd.) A. Kern.
Originaire de l’Europe de l’Ouest et du Sud, ce polypode fructifie très tôt : de janvier à mars. Il vit en sous-bois, sur un sol drainant, humifère, acide ou calcaire, au soleil ou à mi-ombre. C’est un excellent couvre-sol pour les rochers, les murets et les pentes rocailleuses.
Ses rhizomes sont grignotés comme de la réglisse.
27. Polypodium glycyrrhiza D.C. Eaton (Polypodiaceae)
Syn. : Polypodium vulgare var. occidentale Hook.
Cette fougère se rencontre sur la côte pacifique de l’Amérique du Nord : du nord de l’Alaska au Nouveau-Mexique. C’est une plante épiphyte qui pousse sur des branches et des troncs d’arbres, comme sur l’érable à grandes feuilles, mais on la trouve également sur des talus d’éboulis.
On utilise ses rhizomes qui ont une forte saveur de réglisse en raison de la présence de polypodoside A, dont le pouvoir sucrant est six cents fois plus élevé que celui du sucre (Kim et al., 1988).
Les rhizomes ont été utilisés comme gomme à mâcher pour stimuler l’appétit et comme édulcorant de la bouche par plusieurs tribus amérindiennes telles que les Shishalh, Halkomelem, Nuxalke, Squamish, Comox, Haida, Nuu-chah-nulth par exemple. Ils étaient particulièrement appréciés des enfants et des chasseurs. Ces rhizomes étaient parfois utilisés pour adoucir l’infusion du thé du Labrador (Rhododendron groenlandicum (Oeder) Kron & Judd ; Kuhnlein & Turner, 1991).
28. Polypodium vulgare L. (Polypodiaceae)
C’est une petite fougère abondante dans toute l’Europe tempérée, jusqu’à 2 200 m d’altitude, mais elle est rare en région méditerranéenne. Elle est particulièrement commune en Amérique du Nord, sur la côte ouest tempérée. C’est une espèce péri-forestière, qui affectionne les stations ombragées à mi-ombragées. Elle se rencontre sur les talus, les vieux murs, les anfractuosités des rochers, à la base de troncs et dans les sous-bois rocailleux. C’est une des rares plantes épiphytes de nos contrées. Elle sporule de juin à octobre.
On utilise son rhizome qui a une saveur douce et sucrée proche de celle de la réglisse. Il est mâchonné par les enfants des campagnes européennes. Sa douceur est due à la présence d’une saponine (l’osladine) dont le pouvoir sucrant est cinq cents fois plus intense que celui du sucre.
Couplan (2009) indique qu’on a parfois utilisé ses rhizomes pour édulcorer les plats et qu’un confiseur de Die (Drôme) en mettait dans son nougat. Cet auteur note qu’il était consommé par les bergers polonais et qu’il l’est encore en Bosnie.
29. Polystichum acrostichoides (Michx). Schott (Dryopteridaceae)
Cette grande fougère qui vit en Amérique du Nord (USA, Canada) est très répandue dans les prairies et les bois montueux.
Les jeunes frondes étaient autrefois consommées comme légumes verts par les Iroquois (Herrick, 1997).
30. Polystichum munitum (Kaulf.) C. Presl (Dryopteridaceae)
Cette espèce américaine se rencontre du sud de l’Alaska au sud de la Californie. Elle affectionne les sous-bois de forêts humides de conifères en basse altitude.
Récoltés en hiver, ses rhizomes sont cuits et consommés avec de la graisse ou des œufs de saumon par plusieurs groupes amérindiens de la côte nord-ouest de l’Amérique du Nord. Ils sont considérés comme des « aliments de famine » (Kuhnlein & Turner 1991).
31. Polystichum squarrosum (D. Don) Fée (Dryopteridaceae)
Basionyme : Aspidium squarrosum D. Don.
Cette espèce asiatique pousse principalement dans le biome tempéré. On la rencontre au Népal, au Bhoutan, en Chine (Xizang), en Inde (Arunachal, Sikkim, Darjeeling, Uttarakhand, Himachal, Jammu-et-Cachemire) et au Pakistan. Elle prospère près des cours d’eau et à l’ombre des arbres.
Au Népal, on consomme ses pousses (Bajracharya & Bajracharya, 2022).
32. Polystichum setiferum (Forssk.) T. Moore ex (Dryopteridaceae ; planche 5)
Distribuée en Europe de l’Ouest, surtout méridionale, en Asie tempérée et en Afrique du Nord, cette fougère se rencontre dans les montagnes humides à hivers doux du domaine méditerranéen, mais aussi jusqu’au S-W de l’Angleterre. Elle pousse sur des sols humifères à argileux, légèrement acides ou neutres, frais, bien drainés car elle redoute l’humidité stagnante.
En Sardaigne sud-orientale, les frondes de cette fougère sont incluses dans les fromages frais à pâte molle faits avec du lait de chèvre ou de brebis. Lors de la production de cette spécialité, on dépose le caillé dans des récipients en bois de poirier sauvage contenant quatre ou cinq lits de frondes intercalés qui lui confèrent un arôme incomparable et une délicate saveur herbacée. Sa production est typique de la région de la Barbagia inférieure, qui comprend les villages de Seulo, Olzai, Esterili et Villagrande (https://italian-traditions-com). Ce fromage, dont la conservation est de courte durée, est généralement servi peu après sa fabrication, en entrée ou utilisé comme ingrédient pour les desserts. Il se marie parfaitement avec le vin blanc (doc. Web : Quality Find ; E. A., 2018). En raison d’une possible toxicité des frondes, sa production est actuellement assez restreinte.
33. Pteridium aquilinum (L.) Kuhn (Dennstaedtiaceae ; photo 6)
Très complexe, la taxonomie de cette fougère n’est pas encore établie de façon définitive. Thomson (2000) cite ainsi sept espèces et deux sous-espèces.
C’est une véritable espèce cosmopolite qui prospère en Europe, en Amérique du Nord, en Amérique du Sud tropicale, en Asie tempéré et tropicale, en Afrique tropicale. En fait, les seules régions du globe où l’on ne rencontre apparemment pas ce Pteridium sont la partie tempérée de l’Amérique du Sud, les régions polaires et les déserts. Nous verrons plus loin que, sous les tropiques, elle existe sous diverse formes ou sous espèces. À Saint-Pierre-et-Miquelon, c’est la sous-espèce Pteridium aquilinum (L.) Kuhn subsp. latiusculum (Desv.) Hultén qui serait présente (Dumas, 2002). Cette fougère se développe dans des stations en pleine lumière ou semi-ombragées, souvent sur des sols pierreux ou sableux et acides et assez profonds. Elle est indifférente à l’humidité du sol.
On utilise ses jeunes pousses (crosses) et ses rhizomes riches en amidon. Toutes les parties de la fougère aigle sont toxiques crues ; elles doivent toujours être cuites. Il arrive que les pousses soient si riches en hétéroside cyanogénétique qu’à la cuisson elles dégagent une forte odeur d’amande amère (due à l’aldéhyde benzoïque libéré en même temps que l’acide cyanhydrique). Elles seraient dangereuses, mais leur amertume prononcée empêche de les consommer. Cette espèce contient également de la thiaminase, qui est une antivitamine B1.
En 2019, Bruneton publie une bibliographie commentée relative aux propriétés toxiques du ptaquiloside contenu dans les rhizomes, chez l’homme et chez les animaux domestiques et sauvages. Bois (1937) précise toutefois que ses rhizomes ont servi anciennement à parfumer la bière !
Dorvault (1928, p.781 et 804) indique que ses rhizomes contiennent de nombreuses substances, parmi lesquelles figurent l’acide filicique, une huile essentielle contenant du cinéol, de la filmarone, une cire, un tanin, etc., qui ont, pour certaines d’entre elles, des propriétés antihelminthiques.
En Europe, les crosses de la fougère grand aigle sont préparées comme des asperges, tandis que ses rhizomes épais sont moulus. Le résultat tamisé, mélangé à de la farine, donne du pain ou une bouillie. Le pain de fougères était fait avec des rhizomes séchés, moulus et mélangés à de la farine de seigle (Coquillat, 1950, p.173, 174). Cet auteur indique qu’aux Canaries « une misérable sorte de pain était faite par le mélange de sa farine avec de la farine d’orge ». De son côté, Couplan (2009) signale qu’on peut couper le rhizome, le cuire et en faire une purée et que le pain de fougère, dont on a parlé plus haut, « formait parfois la base de l’alimentation dans certaines régions de France en période de disette », utilisation qui avait également cours en Pologne. « En Sibérie, on mettait à fermenter les rhizomes avec les 2/3 de leur poids de malt pour en faire une sorte de bière ».
En Asie, au Japon et en Chine (observations L. Cardin), les jeunes frondes de cette fougère sont récoltées au printemps. Elles sont employées fraîches ou sèches comme légume. (Chevalier, 1951, p. 41). Cette consommation traditionnelle est importante comme le montre une enquête faite dans la région de Krasnoïarsk (Sibérie centrale) qui révèle « qu’on « récolte chaque année environ 1000 tonnes de fougère grand aigle (Pteridium aquilinum) principalement pour le marché japonais » (Biloso-Moyenne, 2008, p. 26).
Les cuisiniers coréens et japonais font traditionnellement tremper les pousses dans de l’eau et de la cendre pour les détoxifier avant de les manger. Le ptaquiloside[5] dégénère également à température ambiante et se dénature presque complètement à la température d’ébullition.
En Amérique du Nord, le rhizome amylacé, donc riche en glucides, est cuit dans un four souterrain. Il est mangé tel quel et les fibres sont recrachées (Gallé, 2011, p.168). Selon Maiden (1889) diverses tribus amérindiennes en faisaient un usage alimentaire comme les Nlaka’pamux et les Nuxalk de Colombie-Britannique ainsi que les Malécites du Nouveau-Brunswick et du Maine. À partir de la farine extraite des rhizomes rôtis, d’autres tribus fabriquaient un type de pain. Ce procédé semble récent, mais Norton (1981) montre qu’il s’agit plutôt d’une pratique ancienne qui avait lieu sur la côte nord-ouest et indique que certaines tribus mangeaient les rhizomes frais, alors que d’autres les consommaient séchées après cuisson (Kuhnlein & Turner, 1991).
Les crosses tendres de la sous-espèce latiusculum sont consommées comme des asperges à Saint-Pierre-et-Miquelon, ainsi qu’en Colombie-Britannique par les Ojibwas, les Sechelt, les Halkomelem, les Nuu-chah-nulth et les Nlaka’pamux.
Au Japon, une corrélation a toutefois été établie entre l’ingestion de ces pousses et la fréquence des tumeurs, notamment œsophagiennes et gastriques chez l’homme (Dumas, 2002). Cet auteur (p. 368) insiste sur cette dangerosité tumorale puisqu’il écrit : « Cette espèce est traditionnellement utilisée dans l’alimentation des Japonais qui détiennent le triste record du taux de cancer de l’estomac ». Il précise d’ailleurs que « Tous les organes de la plante sont toxiques mais les jeunes frondes et les spores seraient plus chargées en produits carcinogènes ». Il convient donc d’envisager la consommation de ce Pteridium avec une extrême prudence, car c’est une plante connue pour contenir plusieurs composés toxiques, tels qu’un hétéroside cyanogénétique (prunasine) produisant du cyanure au moment de la digestion, une enzyme, la thiaminase, qui réduit les réserves de thiamine du corps et au moins deux cancérogènes puissants, la quercétine et le kaempférol. On pense qu’une autre toxine non identifiée est une substance naturelle imitant l’effet mutagène et cancérigène des radiations. De fait, l’ingestion non contrôlée peut provoquer des troubles nerveux, des hémorragies intestinales, des tumeurs, etc. La présence de ces composés dangereux oblige d’effectuer impérativement une cuisson soutenue des crosses (et des rhizomes) qui éliminera la plupart de ces toxines (Gallé, 2011 ; Bruneton, 2019). Aux Açores, les porcs semblent paradoxalement insensibles à cette espèce, car, se régalant de ses rhizomes, ils permettent ainsi de nettoyer les prairies de cette plante envahissante allélopathique.
Cette fougère cosmopolite existe aussi abondamment dans les zones tropicales. Elle présente en réalité plusieurs formes (statut de sous-espèces, voire d’espèces maintenant) selon les régions : à la Réunion (f. aquilinum), en Guyane (f. caudatum, qui est un hybride), dans la péninsule indochinoise jusqu’en Nouvelle-Calédonie (f. esculentum) entre autres (Dumas, 2002, p. 360). En 1908, la forme tropicale esculentum a été distinguée par un nom binominal spécifique, P. esculentum (G. Forst.) Cockayne. C’est une fougère qui est consommée par de nombreux peuples. Originaire de l’hémisphère sud (Australie, Nouvelle-Zélande, Malaisie, Polynésie et Nouvelle-Calédonie), cette espèce se trouve également en Asie (Japon, péninsule indochinoise, etc.). Comme pour l’espèce aquilinum, on utilise les rhizomes ainsi que les jeunes frondes.
Les rhizomes sont séchés à l’air afin de pouvoir être stockés et devenir plus légers. Pour la consommation, ils sont brièvement chauffés et attendris avec un pilon ; l’amidon est alors tiré des fibres pour les repas quotidiens. Au Japon, l’amidon de cette fougère est appelé warabi-ko. Il est obtenu à partir de rhizomes coupés en morceaux, pilés, lavés, décantés puis séchés. Mélangé à de la farine de blé ou de la farine de riz, cet amidon permet de faire des gâteaux (Nagai & Maurai, 1884 ; Van der Burg, 2015). En Australie, les aborigènes mangent ces rhizomes riches en amidon après avoir les avoir réduits en pâte, crus ou grillés (Chevalier, 1951).
Les Maoris de la Nouvelle-Zélande les utilisent (patu aruhe) comme aliment de base. Copeland (1942) souligne d’ailleurs que les rhizomes de Pteridium esculentum sont une source importante de nourriture pour les Polynésiens. Cependant, Vieillard et Deplanche (2005, p. 91-92) affirment que les rhizomes durs et amers de cette espèce sont peu prisés et ne sont guère employés que dans les cas extrêmes. En Nouvelle-Calédonie, les jeunes frondes non déroulées ont, après cuisson, une saveur de noisette. C’est un met très apprécié des Kanaks. Le rhizome peut également être utilisé pour parfumer la bière (Baudoin, 2019). Au Cambodge, les jeunes pousses sont consommées en guise de légumes (Martin, 1971). En Afrique tropicale, plusieurs groupes ethniques d’Angola, du Congo et des pays voisins consomment les frondes : on les cuit pendant une heure, on y ajoute de la pâte d’arachide ou des graines de courge (Mangambu-Mokoso et al., 2012). Van der Burg (2015) précise qu’au Cameroun ses frondes sont consommées avec Vernonia amygdalina Delile (une astéracée) et Triumfetta rhomboidea Jacq. (une malvacée).
Au Vanuatu où elle se nomme waï, c’est une fougère très répandue. On cuisine les jeunes feuilles. Les pennes sont détachées du rachis et cuites dans l’eau, dans du lait de coco ou dans un bouillon. On prépare le plat avec un oignon coupé en morceaux, un taro râpé, de la viande de bœuf, du sel et du poivre. On mélange l’ensemble avec un verre de lait de coco de façon à faire une pâte. On introduit ce mélange dans un chaume de bambou que l’on obture avec une feuille d’arbre, puis on pose ce tube sur de la braise. On retrouve le détail de cette préparation de Leslie Tsione (« Le Laplap de fougères des îles, cuit dans du bambou ») dans un petit film réalisé en 2018 par Anne-Eve Tefaatau et Sébastien Brault, accessible à l’adresse suivante : https://www.youtube.com/watch?v=WPSmQv0hrtU.
Cette espèce qui vit dans les pays tempérés est considérée comme potentiellement cancérigène. Étant donné sa consommation étendue dans les pays chauds, on peut penser qu’il s’agit de formes chimiquement distinctes (chémotype[6]) qui seraient alors non toxiques.
34. Selliguea capitellata (Mett.) X.C. Zhang & L.J. He (Polypodiaceae)
Syn. : Arthromeris wallichiana (Spreng.) Ching (ce nom est utilisé par Poudel & Joshi, 2021 : 85).
L’aire de répartition naturelle de cette espèce s’étend de l’Himalaya (Népal, Bhoutan, nord de l’Inde) au sud de la Chine centrale et à l’Indochine (nord du Viêt-nam). Cette espèce se développe principalement dans le biome tempéré, dans des endroits ombragés, sur des troncs d’arbres moussus, des branches épaisses et des rochers, à des altitudes comprises entre 1 300 à 2 800 m.
Au Népal, ses jeunes frondes tendres sont cuites et utilisées comme légume (Poudel & Joshi, 2021).
35. Struthiopteris spicant (L.) Weiss (Blechnaceae ; photo 7).
Syn. : Blechnum spicant (L.) Roth (nom utilisé dans l’article de Kuhnlein & Turner, 1991), Lomaria spicant Desv.
Cette espèce a une répartition holarctique : Europe, Asie tempérée (Japon), Madère, Açores, Canaries, Amérique boréale. Assez commune dans une grande partie de la France, elle est néanmoins en voie de disparition dans le Centre et l’Île-de-France (INPN). Dans la région PACA, elle est rangée dans les espèces protégées. Elle se rencontre essentiellement en forêts ou à proximité (lisières et bords de chemins forestiers). Elle vit généralement en climat atlantique de plaine ou en zone de montagne dans des vallons frais et humides, toujours sur des sols perméables, frais et acides, le plus souvent siliceux.
En Europe, les frondes semblent avoir été consommées en période de disette. Les Amérindiens d’Amérique du Nord (tribus des Ditidaht et Nootkas ou Nuu-chah-nulth) mâchent les pousses (crosses) pour supprimer la sensation de faim (Kuhnlein & Turner, 1991).
Ce tour d’horizon des fougères alimentaires des zones tempérés du globe montre qu’une bonne trentaine d’espèces ont fait (ou font encore) partie des plantes sauvages cuisinées. Cependant on peut remarquer que certaines d’entre elles ont été consommées incidemment, en situation de disette particulièrement sous forme de pain.
Pratiquement ignorée par la plupart de nos contemporains occidentaux, la récolte des fougères à des fins alimentaires a donc quasiment disparu dans nos régions. Il existe cependant un cas particulier constitué par l’usage des « têtes de violon » de la fougère allemande ou fougère plume d’autruche (Matteuccia struthiopteris). Ainsi, au Québec, on la ramasse en famille à la fin de l’hiver pour confectionner des préparations culinaires insolites.
4. Les fougères des régions chaudes du globe
En raison du trop grand nombre d’espèces, il ne sera présenté ici que quelques taxons à titre d’exemple.
35. Abacopteris nudata (Roxb.) S.E. Fawc. & A.R. Sm. (Thelypteridaceae)
Syn : Thelypteris nudata (Roxb.) C.V. Morton (nom cité dans l’article de Ojha & Devkotah, 2021).
Cette fougère asiatique se rencontre en Assam, au Bangladesh, en Chine du centre-sud, à l’est et à l’ouest de l’Himalaya, en Inde, au Myanmar, au Népal, en Thaïlande, au Tibet, au Bhoutan, en Indonésie et au Viêt-nam. Son biome tropical humide est constitué par des forêts clairsemées ombragées sur les pentes étagées entre 100 et 1 600 m.
Au Népal, les jeunes pousses sont utilisées comme légumes (Ojha & Devkotah, 2021).
36. Acrostichum aureum (Pteridaceae ; photo 8)
Cette espèce se trouve en Asie, Amérique tropicale et en Océanie. C’est une grande fougère à limbes pennés qui pousse dans les marécages de mangroves et autres endroits humides, en particulier sur les diguettes des rizières. Supportant les eaux saumâtres, on la trouve aussi dans les mangoves.
Au Cambodge, les jeunes pousses sont consommées (Chevalier, 1951 ; Rollet, 1975).
Dans l’État indien de Goa, la fougère est consommée cuite dans une sauce épicée à base de noix de coco (tonak). Ce plat est considéré comme un mets délicat par la population locale.
37. Acrostichum danaefolium & Fisch. (Pteridaceae)
Cette espèce tropicale américaine prospère dans les zones nord et sud du continent, dans la mangrove et jusqu’à 200 m au-dessus du niveau de la mer. Commune et largement distribuée en Floride, elle pousse vigoureusement en plein soleil.
En Colombie, ses frondes dépliées sont consommées comme des asperges (Jimenez-Alvarez, 2011).
38. Alsophila australis Br. (Cyatheaceae)
Syn. : Cyathea australis (R. Br) Domin (nom cité dans Chevalier, 1951, et Maiden 1889).
Cette fougère, qui se trouve en Australie (Queensland, Nouvelle-Galles du Sud, Victoria, ainsi que dans l’île de Norfolk), pousse dans les forêts humides et ombragés, à la fois côtières et de montagne, à une altitude allant jusqu’à 1 280 m.
Pour s’en nourrir, on retire de son stipe de l’amidon (Chevalier, 1951 p. 42). Maiden (1889) précise qu’en Australie (trad.) « la pulpe du haut du tronc est pleine d’amidon et est consommée crue ou rôtie par les aborigènes. Cette substance blanchâtre se trouve au milieu de l’arbre, de la base à l’apex, et lorsqu’elle est bouillie, elle a le goût d’un mauvais navet ».
39. Alsophila celsa M. Tryon (Cyatheaceae)
Syn. : Cyathea excelsa Sw.
Cette fougère arborescente est endémique des Mascareignes (Maurice, Réunion). Elle est commune dans les forêts humides ombragées entre 200 et 2 000 m d’altitude.
On extrait de l’amidon de la moelle interne du stipe (Chevalier, 1951).
40. Alsophila dregei (Kunze) R.M. Tryon (Cyatheaceae)
Syn : Cyathea dregei Kunze (nom cité dans Mangambu-Mokoso, 2012).
Cette fougère vit en Afrique centrale (Congo…) et du Sud (Lesotho, Madagascar…) sur des terrains pauvres plus ou moins arides en altitude.
Au Congo, les moelles internes du stipe des jeunes plantes sont comestibles et mangées crues par les chasseurs (Mangambu-Mokoso et al., 2012).
41. Alsophila latebrosa ex Hook. (Cyatheaceae)
Syn : Cyathea latebrosa (Wall. ex Hook.) Copel.
On observe cette fougère géante au Cambodge, Laos, Viêt-nam, Thaïlande, Malaisie, Inde, Indonésie (Bornéo et Sumatra). Elle vit en forêt dense.
Martin (1971) note qu’au Cambodge les jeunes feuilles sont consommées cuites en guise de légume.
42. Alsophila manniana (Hook.) R.M. Tryon (Cyatheaceae)
Syn : Cyathea manniana Hook. (nom qui figure dans le travail de Mangambu-Mokoso et al., 2012).
On trouve cette fougère en Afrique centrale, principalement au Congo. Elle se développe sur le sol sablo-argileux des sites humides, au bord des rivières, surtout dans les environs de marais.
Les moelles des jeunes plantes sont comestibles et mangées crues par les chasseurs. Le gorille des plaines (Gorilla beringei graueri) en consomme également (Mangambu-Mokoso et al., 2012).
43. Alsophila smithii (Hook. f.) R.M. Tryon (Cyatheaceae)
Syn. : Cyathea smithii Hook.
Endémique de Nouvelle-Zélande, cette espèce rustique de sous-canopée froide et humide se développe à des altitudes plus élevées et dans l’extrême sud du pays. Elle est présente sous les Podocarpus et dans les forêts de feuillus.
La moelle est traditionnellement utilisée comme source d’amidon, mais, comme elle est riche en résine, ce serait probablement un aliment de dernier recours à cause de son goût particulier. On la collecte toute l’année. Il convient de signaler que la pratique de récupérer le cœur tendre du stipe tue l’arbre ; son utilisation n’est donc envisageable que dans un cas de survie (Crowe, 2004)
44. Alsophila spinulosa ( ex Hook.) R.M. Tryon (Cyatheaceae)
Syn. : Cyathea spinulosa Wall. ex. Hook. (nom employé par Kandel, 2021, et Ojha & Devkotah, 2021).
Cette fougère est largement répartie en Asie, notamment en Chine, au Népal, en Inde, au Bhoutan, au Myanmar, en Thaïlande, au Viêt-nam, aux Philippines et au Japon. Elle se développe sur les sols humifères des zones forestières ombragées.
Les « tiges » comestibles sont riches en amidon. Au Népal, les jeunes pousses de la plante sont cuites comme des épinards (Kandel, 2021 ; Ojha & Devkotah, 2021).
45. Alsophila tahitensis (Cyatheaceae)
Syn. : Cyathea affinis (G. Forst.) Sw. (nom cité dans les articles de Jacq & Butaud, 2013, et de Testard de Marans, 1887-1888).
C’est une fougère arborescente, de 2 à 6 m de hauteur, originaire des îles de la Polynésie (Fidji, Samoa, Australes, Tahiti et Marquises). Elle vit dans les vallons des forêts tropicales pluvieuses et nuageuses (rain et cloud forests ; Murdock & Smith, 2003).
Les jeunes pousses de A. tahitensis sont consommées aux îles Marquises (Jacq & Butaud, 2013) comme plantes alimentaires d’appoint ou de disette à Hiva Oa, selon Testard de Marans (1887-1888).
46. Alsophila tricolor (Colenso) R.M. Tryon (Cyatheaceae ; photo 9)
Syn : Cyathea dealbata (G. Forst.) Sw. (cité dans Chevalier,1951).
Endémique de Nouvelle-Zélande, elle pousse en forêt tropicale humide. On extrait de la moelle interne du stipe de l’amidon alimentaire (Chevalier, 1951). Lors d’un voyage en Nouvelle-Zélande, l’un de nous (L.C.) a appris de son guide une curieuse anecdote : lors de conflits nocturnes entre tribus maories, les guerriers disposaient sur le sol des frondes retournées argentées afin que le reflet de la lumière de la Lune jouât le rôle de fléchage pour le retour à travers la forêt.
Par ailleurs, elle est l’emblème des All Blacks : le maillot noir de cette équipe de rugby est effectivement orné de la fougère d’argent.
47. Alsophila vieillardii (Mett.) R.M. Tryon (Cyatheaceae)
Syn. : Cyathea vieillardii Mett. (cité dans Chevalier,1951).
Elle croît en Nouvelle-Calédonie et au Vanuatu, dans les forêts denses, humides, ou dans des zones dégradées, depuis le niveau de la mer jusqu’à 1 500 m.
On extrait de l’amidon de la moelle interne du stipe (Chevalier, 1951) et une substance mucilagineuse comestible de la base des frondes. En effet, les Canaques récoltent par incision, dans le stipe ou à la base des frondes, un suc mucilagineux qui se coagule en une sorte de gelée assez fade et peu nourrissante (Coiffier, 2013).
48. Ampelopteris prolifera (Retz.) Copel. (Thelypteridaceae)
Cette espèce est très largement répandue dans les zones tropicales de l’Ancien Monde, en Afrique (Sénégal, Guinée, Cameroun, Tanzanie, Madagascar, îles Mascareignes, Afrique du Sud, etc.) et en Asie continentale tropicale, jusqu’au nord-est de l’Australie et la Nouvelle-Calédonie. Elle se développe en général en plein soleil et on la trouve fréquemment dans des marais d’eau douce ou au bord des rivières, des étangs et des lacs, jusqu’à 1 250 m d’altitude ; son rhizome pousse souvent dans l’eau.
En Chine, on consomme ses jeunes frondes et son rhizome sautés ou sous forme de soupe (Yujing Liu et al., 2012). En Inde, on mange les jeunes frondes comme légume frais ou cuit.
49. Angiopteris confertinervia Ching ex C. Chr. & Tard. (Marattiaceae)
Syn. : Angiopteris repandula Vriese.
Cette fougère est présente en Chine (Yunnan), au nord du Viêt-nam et au Laos (Lindsay. & Middleton, 2012). Elle s’installe en forêt entre 100 et 200 m d’altitude.
On consomme ses jeunes frondes et son rhizome. Au Viêt-nam, les jeunes frondes débarrassées des fibres sont coupées et sautées à la poêle ou transformées en soupe (canh). Lavés, écorcés et coupés finement, les rhizomes sont trempés dans de l’eau durant une nuit, puis cuits dans de l’eau ou sautés avec du riz (Tồng Cục Hậu Cần & Cục Quân Nhu, 2007). Au Cambodge les jeunes feuilles sont mangées crues (Dy Phon, 2000).
50. Angiopteris crassipes Wall. ex C. Presl (Marattiaceae)
Cette espèce asiatique est présente au Cambodge, au Viêt-nam, au Myanmar, en Inde et en Chine méridionale. C’est une fougère de la forêt dense.
Au Cambodge, ses jeunes feuilles sont consommées comme légume (Martin, 1971).
51. Angiopteris esculenta Ching (Marattiaceae)
Syn. : A. acuta Ching, A. parvifolia Ching & Fu.
Sa répartition s’étend du sud-est du Tibet au Yunnan (Chine). Cette fougère pousse principalement dans un biome subtropical.
On extrait de l’amidon de ses rhizomes pour faire des gâteaux ou en mélange avec d’autres aliments (Yujing Liu et al., 2012).
52. Angiopteris evecta (G. Forst.) Hoffm. (Marattiaceae ; photos 10 et 11)
Cette fougère présente une vaste répartition ; en effet on la rencontre en Nouvelle-Calédonie, en Australie, en Polynésie, en Mélanésie, au Viêt-nam, à Bornéo, à Sumatra, en Malaisie, en Nouvelle-Guinée, ainsi qu’à Madagascar. Elle prospère en forêt tropicale sur les sols humides des ravins et des vallées. La dispersion de manière explosive de ses spores en fait sa particularité. Il s’agit d’une plante odorante dont les jeunes feuilles servaient à parfumer le monoï et les tapas (Jardin botanique de Papeete).
De toutes les fougères comestibles, c’est la plus précieuse et la plus recherchée, à cause de la grande quantité de matières nutritives qu’elle renferme (Vieillard & Deplanche, 2005). On utilise ses crosses charnues, son stipe et son rhizome. Ce dernier contient du mucilage, une certaine quantité d’amidon semblable au sagou. La moelle de sa « tige » est utilisée comme source de nourriture par les aborigènes australiens (Maiden, 1889, p. 21). De son côté, Chevalier (1951) indique que les Tahitiens mangent les jeunes pousses et que les Canaques consomment ses rhizomes riches en matières nutritives. Henry (2004) précise que, dans les îles de la Société, le stipe qui a un goût âcre devient comestible après macération dans l’eau et cuisson, mais n’était utilisé qu’en période de disette.
53. Angiopteris fokiensis Hieron. (Marattiaceae)
La répartition naturelle de cette espèce s’étend du centre-sud de la Chine au sud du Japon. C’est une plante vivace qui pousse principalement dans le biome subtropical.
On extrait de l’amidon de leurs rhizomes pour en faire des gâteaux ou en mélange avec d’autres aliments. (Yujing Liu et al., 2012).
54. Asplenium bulbiferum G. Forst. (Aspleniaceae)
Syn. : nombreux tels que A. marinum var. bulbiferum (G. Forst.) F. Muell., Caenopteris bulbifera (G. Forst) Desv., Chamaefilix bulbifera (G. Forst.) Farw. par exemple.
L’aire de répartition naturelle de cette espèce tropicale épiphyte comprend les îles Mariannes et la Nouvelle-Zélande. Elle pousse dans la plupart des zones forestières de ces pays. En fin de saison, la plante produit à la surface supérieure des frondes, une grande quantité de bulbilles qui vont devenir de nouvelles plantes.
Les Maoris l’utilisent comme plante alimentaire, ils récoltent les jeunes frondes qui sont consommées crues ou cuites comme légume (Crowe, 2004).
55. Asplenium nidus L. (Aspleniaceae ; photo 12)
Cette espèce est originaire des régions tropicales d’Asie et de Polynésie. C’est une plante épiphyte qui vit dans une atmosphère très humide et demande une lumière diffuse et une température de l’ordre de 20 °C.
À Taiwan, les feuilles de cette fougère sont vendues en bottes sur les marchés. Riche en vitamine C, calcium, fer et zinc, cette fougère fait partie de certains plats cuisinés dans lesquels elle est mélangée à des condiments. On apprécie le croquant de ses feuilles larges d’environ deux à trois centimètres.
À Lifou, qui fait partie des îles de la Société, la tribu de Mucaweng fête tous les ans la fougère nid d’oiseau qui est leur symbole culturel. C’est aussi une spécialité culinaire qui se déguste après avoir éliminé le morceau le plus dur de la nervure. Les jeunes frondes sont cuites dans de l’eau bouillante comme des légumes verts, pour accompagner les poissons, les viandes, les fruits de mer ou le « bougna[7] ». On peut également les consommer en salade ou en soupe (Baudoin, 2019).
56. Azolla filiculoides Lam. (Salviniaceae ; photo 13)
Originaire d’Amérique du Sud, cette petite fougère aquatique flottante a été introduite en Europe et dans divers pays tropicaux pour lutter contre la malaria. Le tapis formé empêche les larves de moustiques de venir respirer à la surface. Elle peut pulluler et devenir invasive, cependant elle se révèle utilisable en tant que biofertilisant dans des conditions de terres arides et comme agent de détoxification vis-à-vis des métaux lourds.
En Colombie, la plante est consommée frite, sautée, cuite au four ou ajoutée à des soupes ou à des salades. Cette espèce est importante car elle est considérée comme pouvant être un complément alimentaire lors des expéditions sur Mars (Jimenez-Alvarez, 2011, p.136).
57. Asplenium oblongifolium Colenso (Aspleniaceae)
Plusieurs synonymes figurent dans les flores, par exemple A. lucidum G. Forst., Tarachia lucida (G. Forst.) Momose.
Cette espèce est endémique de Nouvelle-Zélande. Sa distribution s’étend de la zone côtière à la montagne, mais principalement dans les basses terres. Elle occupe une gamme variée d’habitats allant des falaises et des amas de roches à la forêt profonde où elle peut être épiphyte ou pousser sur le sol.
Ses frondes, qui mesurent de 15 à 150 cm de long, sont vert brillant dessus et vert terne dessous. Les crosses sont récoltées au printemps et en été. Les jeunes pousses frisées ou crosses, qui étaient consommées par les Maoris comme légumes verts, ont été remplacées par le chou sauvage (Brassica oleracea). Colenso (1880) les décrit comme « très succulentes et mucilagineuses » (Crowe, 2004).
58. Austroblechnum lanceolatum (R. Br.) Gasper & V.A.O. Dittrich (Blechnaceae)
Syn. : Blechnum chambersii Tindale.
Cette espèce se rencontre en Australie, en Nouvelle-Zélande, aux Samoa et Fidji. Ses frondes mesurent de 15 à 60 cm de long et sont généralement vertes, bien que les plus jeunes soient souvent rouge vif, phénomène que l’on observe d’ailleurs chez plusieurs Blechnacées. En Nouvelle-Zélande, elle est commune et vit généralement près des cours d’eau, jusque dans la forêt de montagne.
Les frondes sont collectées au printemps et en été, les Maoris les cuisinent dans un four en terre et les mangent sous forme de verdure (Crowe, 2004).
59. Botrychium lanuginosum Wall. ex Hook. & Grev. (Ophioglossaceae)
L’aire de répartition naturelle de cette espèce est l’Asie tropicale et subtropicale. Vivant principalement dans le biome subtropical, elle pousse sur des pentes montagneuses plutôt sèches, dans les fourrés ou dans les crevasses vaseuses des falaises à l’ombre légère, à moyenne altitude.
Au Népal, les pousses sont cuites comme légume (Ojha & Devkotah, 2021).
60. Ceratopteris pteridoides (Hook.) Hieron. (Pteridaceae)
Cette fougère se rencontre aux Antilles, en Amérique centrale, en Amérique du Sud (de Vol,1957), mais aussi en Asie. (Malaisie, selon Johnson, 1961, en Chine selon Dong et al., 2012). Aquatique à semi-aquatique, elle vit dans les marécages, les tourbières, les canaux, les étangs, les lacs, les fossés, les marais.
Les jeunes frondes tendres sont consommées vertes et sont désignées sous le nom commun de « laitue d’eau ». Copeland (1942) pense que sa culture est prometteuse car elle est plus succulente que C. thalictroides.
61. Ceratopteris thalictroides (L.) Brongn. (Pteridaceae ; photo 14)
Syn. : Acrostichum thalictroides L., Ceratopteris siliquosa (L.) Copel.
Cette fougère amphibie est répandue dans le monde entier dans les basses terres tropicales, en particulier dans l’Ancien Monde. Elle est particulièrement commune dans les estuaires et les marais de l’Afrique de l’Ouest. Elle vit dans les marécages et les cours d’eau à faible débit. En Asie tropicale, elle très fréquente sur les bords des rizières. On utilise ses crosses avant qu’elles ne se soient déroulées
Elle est communément consommée dans toute l’Asie du Sud-Est (Vidal, 1959). Au Viêt-nam, les jeunes feuilles et pousses préparées par ébullition sont consommées comme des asperges ou bien transformées en soupe comme d’autres légumes à feuilles (Tanaka & Nguyen, 2007).
La seule mention de sa consommation en Afrique provient de Madagascar où elle est mangée à la manière du cresson de fontaine. En Malaisie et au Japon, c’est un légume de luxe bien établi. Les crosses, cuites ou blanchies, se mangent en salade et constituent un excellent légume vert (Van der Burg, 2015). Au Népal les pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021). Leur consommation impose toutefois une certaine prudence car on sait maintenant que ces Ceratopteris sont cancérigènes.
62. Cheiroglossa palmata (L.) C. Presl (Ophioglossaceae)
Syn. : Ophioglossum palmatum.
Son aire de distribution est vaste puisqu’on la trouve en Amérique tropicale (Floride, Mexique, Antilles, Colombie), en Asie du Sud (Viêt-nam) et en Afrique (Madagascar, Seychelles, Réunion). C’est une fougère terrestre qui prolifère sur l’humus forestier, mais elle peut être épiphyte et se développe alors sur les bases foliaires du palmier nain Sabal palmetto.
On en fait une boisson nutritive par décoction de souches et un plat qui devient mucilagineux quand on la cuit (Murillo, 1983 ; Jimenez-Alvarez, 2011).
63. Cibotium barometz (L.) J. Sm. (Cibotiaceae)
Sa répartition se situe en Asie du Sud-Est : en Chine, au sud du Japon, dans le nord-est de l’Inde, au Myanmar, dans la région indochinoise, en Malaisie et en Indonésie. Cette fougère des forêts denses vit dans des ravines ombragées et humides.
Récoltées vers 500 m d’altitude dans le centre du massif des Cardamomes, au Cambodge, ses frondes sont consommées comme légumes par les habitants de la région (Martin, 1969).
64. Cyathea epaleata (Holttum) Holttum (Cyatheaceae).
Endémique des îles de la Société, cette espèce pousse principalement dans le biome tropical humide (bords de rivière, vallons forestiers. À Tahiti on la trouve dans les forêts de crête au-dessus de 700 m, mais elle y est rare. Jacq et Butaud (2013) la signalent comme plante alimentaire dans l’île de Raiatea, sans préciser malheureusement quelle partie de la plante est consommée.
65. Cyclogramma auriculata (J. Sm.) Ching (Thelypteraceae)
Syn. : Thelypteris auriculata (J. Sm.) K. Iwats et Cyclosorus auriculata (J. Sm.) C.M. Kuo (noms cités dans l’étude de Bajracharya & Bajracharya, 2022).
Son aire de répartition comprend le Népal, la Chine (Guangxi, Guizhou, Xizang et Yunnan), l’Inde (Arunachal, Sikkim, Darjeeling, Uttarakhand et Himachal), le Bhoutan. On trouve cette espèce le long des berges des rivières et des lisières de forêts.
Au Népal, on consomme ses jeunes pousses (Bajracharya & Bajracharya, 2022).
66. Dicranopteris pedata (Houtt.) Nakaike (Gleicheniaceae)
Syn. : Gleichenia dichotoma (Thunb.) Hook. (nom cité par Maiden, 1889, p. 33, et Vieillard & Deplanche, 2005).
D’après Flora of China, cette espèce se rencontre en Chine, en Inde, en Indonésie, au Japon, en Malaisie, au Népal, à Singapour, à Sri Lanka, en Thaïlande et en Australie. Au Viêt-nam cette espèce est enregistrée sous le nom de Dicranopteris dichotoma (Thunb.) Bernh. (Pham Hoang Ho, 1999, p. 81). Elle prospère dans les vallées et les reliefs forestiers entre 100 et 2200 m.
Selon Maiden (1889), les aborigènes ont utilisé la « racine » de cette fougère dans le but d’extraire l’amidon pour l’alimentation.
67. Diplazium esculentum (Retz) Sw. (Athyriaceae ; photo 15)
Syn. : Hemionitis esculenta Retz., Callipteris esculenta (Retz.) J. Sm.
Cette espèce présente une grande répartition qui s’étend de l’Asie (Tibet, Inde, Sri Lanka, Chine, péninsule indochinoise, Philippines) à l’Afrique (Réunion et en culture à l’île Maurice) et à la Polynésie. On l’observe depuis le niveau de la mer jusqu’à 2 000 m d’altitude, dans des endroits ouverts à sol humide tels que vallées fraîches et rives de rivières.
Selon Roy & Chaudhuri (2020), cette espèce est considérée comme l’une des fougères sauvages comestibles les plus consommées dans le monde. On utilise ses longues frondes dont la pointe, toujours recroquevillée, est juteuse et tendre. Les très jeunes feuilles, croquantes, se mangent en salade accompagnée de sauce sambal (piments, oignons, ail, citronnelle, vinaigre…) avec du riz. En revanche, bouillies, elles sont utilisées comme des jeunes pousses d’épinard. Les très jeunes frondes peuvent être bouillies, frites ou utilisées en soupe. Selon Tanaka et Nguyen (2007) 100 g de jeunes frondes contiennent 3,6 g de protéines, 1,5 g de glucides et environ 25 mg de vitamine C ; elles sont également riches en fer, en phosphore et en potassium.
Au Népal, les jeunes frondes de cette espèce très commune sont largement collectées et vendues en petits paquets sur les marchés ; elles sont consommées comme légumes (Kandel, 2020). Au Viêt-nam, les jeunes frondes lavées sont cuites à l’eau, trempées dans de la saumure de poisson (nước mắm) diluée, sautées ou transformées en soupe. Il est possible de cuisiner de nombreux plats, d’en faire des salades, un canh, etc. (Tồng Cục Hậu Cần & Cục Quân Nhu, 2007, p. 166). Chez la minorité Srê (hauts plateaux du Viêt-nam) les frondes sont consommées cuites en soupe avec de la viande (Dournes, 1973). Elle est également consommée par les habitants des îles Cham (centre Viêt-nam ; Pham & Nguyen, 2013).
À Sri Lanka, Les jeunes frondes sont généralement cuites avant consommation pour éviter l’amertume ; elles sont servies en salade de légumes, en soupe ou ragoût. Leur saveur ressemble à celle des asperges trop cuites (Prathibhani & Kumarihami, 2022).
68. Diplazium expansum Willd. (Athyriaceae)
Son aire de répartition naturelle s’étend du Mexique à la Guyane et au Pérou. Cette grande fougère se trouve le long des berges des cours d’eau, des ravins rocheux et des clairières à haute altitude en situation semi-ombragée sur un sol humide limono-sableux.
Alimentaire, elle est une bonne source de vitamines A et C. Ses qualités nutritionnelles sont comparables à celles des légumes verts comme les épinards, asperges, blettes, etc. Elles accompagnent les aliments qui fournissent les protéines nécessaires à l’organisme (Pacheco & Bautista, 2001).
69. Diplazium kawakamii Hayata (Athyriaceae)
Son aire de répartition naturelle s’étend des Grandes Antilles jusqu’en Bolivie, présente en Guyane mais absente au Brésil. Cette grande fougère se trouve le long des berges des cours d’eau, des ravins rocheux et des clairières à haute altitude en situation semi-ombragée sur un sol humide limono-sableux.
Dans l’est du Népal, dans le district d’Ilam, les jeunes frondes qui se déroulent sont utilisées comme légume (Kandel, 2020).
70. Diplazium lonchophyllum Kunze (Athyriaceae)
Espèce rare dont l’aire de répartition s’étend de la Louisiane jusqu’en Équateur. Elle se développe sur des pentes boisées humides.
Riche en vitamines A et C, elle a des qualités comparables à celles des épinards, asperges, blettes, etc. (Pacheco & Bautista, 2001).
71. Diplazium maximum (D. Don) C. Chr. (Athyriaceae)
Syn : Allantodia gigantea (Baker) Ching (nom cité dans l’étude de Yujing Liu et al., 2012).
On la rencontre en Afghanistan, en Chine, au Tibet, en Inde, au Népal, au Bhoutan, en Birmanie, au Viêt-nam et au Japon. Elle vit dans des vallées couvertes de forêts de feuillus à feuilles persistantes, à côté de ruisseaux, entre 900 et 1 800 m, sur sol humide et riche en humus, à mi-ombre.
On mange les frondes tendres sautées, en soupe ou cuisinées après salaison (Yujing Liu et al., 2012). Au Népal, cette fougère, qui a une crosse plus épaisse et plus substantielle que celles de D. esculentum et D. kawakamii, est vendue sur les marchés sur une courte saison en juillet-août (Kandel, 2020). Au Bouthan, l’un de nous (L.C.) a mangé des crosses cuites au goût délicat d’asperge.
72. Diplazium proliferum (Lam.) Thouars (Athyriaceae)
Syn. : Asplenium proliferum Lam., Callipteris accedens (Blume) J. Sm.
C’est une fougère présente à Madagascar, en Afrique tropicale, aux Mascareignes (Réunion, Maurice, Rodrigues), en Asie et Mélanésie. Elle vit dans des endroits ombragés et humides, près des cascades et des sources.
À Madagascar, les jeunes frondes (crosses) sont consommées comme légume cuit. En Asie du Sud-Est, les crosses ainsi que les bulbilles présentes sur le rachis sont consommées bouillies ou cuites à la vapeur comme légume, ou crues en salade (Van der Burg, 2015). Situées au niveau des nœuds du rachis, ces bulbilles donnent naissance à des jeunes plants.
Pacheco et Bautista (2001) font remarquer que les deux espèces voisines D. lonchophyllum et D. expansum sont une bonne source de vitamines A et C. Elles contiennent des substances antioxydantes pour la prévention de nombreuses maladies, une teneur élevée en calcium, des fibres et des lipides et glucides en faible quantité. Ces espèces sont comparables en qualité nutritionnelle avec de nombreux autres légumes verts (épinards, asperges, blettes, etc.) de consommation fréquente. Elles accompagnent les autres aliments riches en protéines et en vitamines.
73. Diplazium spectabile (Wall. ex Mett.) Ching (Athyriaceae)
Syn. : Diplazium multicaudatum (Wall.) Sledge.
Cette espèce a une vaste répartition qui s’étend de l’Himalaya (Bhoutan, Népal) au sud de la Chine et au Myanmar. Elle pousse principalement dans le biome subtropical à une altitude de 1 500-2 700 m On la rencontre sur le bord des ruisseaux et des fossés dans les forêts de feuillus sempervirents.
Au Népal, les pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021) ; elles sont consommées durant la saison des pluies (Toffin & Wiart, 1985).
74. Dryoathyrium boryanum (Willd.) Ching (Athyriaceae).
Syn. : Deparia boryana (Willd.) M. Kato (nom cité par Ojha & Devkotah, 2021, p. 3).
Son aire de distribution s’étend en Afrique tropicale et australe, aux Comores, à la Réunion, en Inde, au Népal, à Sri Lanka, en Asie du Sud-Est, aux Philippines, à Sumatra et jusqu’à Fiji. Vivant dans un climat variant du subtropical au tempéré-montagneux (alt.1 000 à 1 500 m), elle se développe le long des ravines humides et ombragées.
Au Népal, les jeunes feuilles et les pousses tendres sont utilisées comme nourriture (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
75. Dryopteris cochleata (D. Don) C. Chr. (Dryopteridaceae)
Cette espèce, qui vit en zone tropicale humide, se rencontre en Assam, au Bangladesh, dans le centre-sud de la Chine, en Inde, à Java, dans les petites îles de la Sonde, en Malaisie, au Myanmar, au Népal, au Pakistan, aux Philippines, en Thaïlande, au Viêt-nam et dans les parties occidentale et orientale de l’Himalaya.
Ses pousses tendres sont utilisées comme légume au Népal (Ojha & Devkotah, 2021).
76. Dryopteris lewalleana Pic. Serm. (Dryopteridaceae)
L’espèce est répandue dans l’ouest de l’Afrique tropicale centrale, orientale et méridionale et dans les régions orientales de l’Afrique australe. Elle vit à l’ombre claire ou profonde dans les forêts sempervirentes saisonnièrement humides, généralement dans la litière de feuilles sur le sol forestier.
Chez les peuples Shi et Tembo du Kivu, les jeunes pousses sont préparées comme légume (Maiden, 1889 ; Mangambu-Mokoso et al., 2012).
77. Dryopteris splendens (Desv.) Kuntze (Dryopteridaceae)
Syn : Nephrodium splendens (Willd.) Desv. (basionyme).
Cette espèce tropicale est distribuée en Asie (Yunnan, Bhoutan, Inde, Népal) où elle prospère dans les forêts mixtes.
Au Népal, ses pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021).
78. Dryopteris varia (L.) Kuntze (Polypodiaceae)
Syn. : Polypodium varium L.
Cette espèce, qui vit dans les forêts tempérées et subtropicales, se rencontre en Chine, Inde, Japon, Corée, Philippines et Viêt-nam.
Selon Chevalier (1951), on mange les jeunes pousses en Chine.
79. Gleichenella pectinata (Willd.) Ching (Gleicheniaceae)
Syn. : Dicranopteris pectinata (Willd.) Underw. (nom utilisé par Jimenez-Alvarez, 2011).
Ses rhizomes sont cuisinés en Colombie (Jimenez-Alvarez, 2011).
80. Goniophlebium manmeiense (Christ) Rödl-Linder (Polypodiaceae)
Syn : Metapolypodium manmeiense (Christ) Ching (nom utilisé par Yujing Liu et al., 2012).
C’est une espèce de fougère épiphyte ou lithophyte qui vit entre 1 000 et 2 500 m. Elle se trouve en Asie du Sud-Est : Chine (Guizhou, Sichuan, Yunnan), Cambodge, NE Inde, Laos, Myanmar, Thaïlande et Viêt-nam.
Elle est a été utilisée par les Jinuo (groupe ethnique du sud du Yunnan) comme exhausteur de goût pour cuisiner les légumes (Yujing Liu et al., 2012).
81. Gymnosphaera podophylla (Hook.) Copel. (Cyatheaceae; photo 16)
Syn. : Alsophila podophylla Hook. (nom utilisé par Tồng Cục Hậu Cần & Cục Quân Nhu, 2007).
Cette fougère arborescente est originaire du sud de la Chine, de Taiwan, du Viêt-nam, du Laos, de la Thaïlande, du Cambodge et des îles Ryukyu. Elle pousse dans les forêts sombres près des ruisseaux et dans les ravins, à une altitude de 600 à 2 000 m environ.
On utilise ses jeunes frondes et le cœur du stipe. Au Viêt-nam, on enlève l’enveloppe externe des jeunes frondes, on les coupe en fines lamelles qui sont lavées pour enlever tout ce qui est visqueux. On les blanchit, puis on les cuit dans de la graisse avec du mắm (pâte de crevette fermentée) ou des légumes fermentés. On en fait aussi un canh qui est une soupe traditionnelle aigre-douce qui peut être à la tomate (canh chua cà), au poisson (canh chua cá) (Tồng Cục Hậu Cần & Cục Quân Nhu, 2007).
82. Helminthostachys zeylanica (L.) Hook. (Ophioglossaceae)
On trouve cette espèce au Népal, à Sri Lanka, en Asie du Sud-Est et en Australie. Elle vit sur les sols alluviaux de ruisseaux, de rivières ou dans les sols riches organiques et noirs en bordure des marais (tourbe noire).
En Nouvelle-Calédonie, les jeunes feuilles (crosses) sont consommées comme des asperges au goût un peu aromatique (Chevalier, 1951 ; Vidal, 1959 ; Vieillard & Deplanche, 2005). Au Népal, c’est une espèce rare qui est surexploitée ; ses pousses tendres sont utilisées comme légume dans le Tarai, partie népalaise de la plaine indo-gangétique (Kandel, 2020 ; Ojha & Devkotah, 2021).
83. Lygodium flexuosum (L.) Sw. (Lygodiaceae)
C’est une fougère grimpante originaire des régions tropicales et subtropicales de l’Asie du Sud-Est et de l’Océanie. Cette espèce est une adventice des rizières et de diverses plantations (hévéas, palmiers à huile, thé).
Au Népal, ses pousses tendres sont utilisées comme légume (Ojha & Devkotah, 2021).
84. Lygodium japonicum (Thunb.) Sw. (Lygodiaceae ; photo 17)
Syn. : Lygodium microstachyum Desv.
Cette espèce de climat tropical se rencontre en Asie de l’Est et du Sud-Est, notamment à Taiwan, au Japon, en Corée, en Inde, au Népal et dans l’est de l’Australie. Elle vit en habitat humide (marécages) mais aussi dans les zones perturbées par l’action humaine.
Au Népal les jeunes feuilles sont utilisées comme légume (Ojha & Devkotah, 2021).
85. Lygodium salicifolium C. Presl (Lygodiaceae)
Cette fougère se rencontre en Asie orientale tropicale : Chine du Sud (Hainan, Yunnan), Taiwan, Inde, dans la zone himalayenne (Bhoutan, Népal), au Myanmar, en Thaïlande, au Viêt-nam et en Indonésie. Elle se cantonne dans des forêts mixtes, à des altitudes qui varient entre 800 et 1 200 m. Cette fougère sarmenteuse présente des tiges qui peuvent atteindre 3 à 4 m de long.
Au Laos, les parties jeunes sont consommées comme légume (Vidal, 1959).
86. Marattia alata Sw. (Marattiaceae)
Cette espèce américaine se trouve en Jamaïque et à Cuba. Elle habite les montagnes rocheuses ombragées.
Selon Crowe (2004), sa tige charnue a été mangée dans les îles Sandwich (Atlantique sud).
87. Marattia douglasii (C. Presl) Baker (Marattiaceae)
Syn. : Stibasia douglasii C. Presl.
Son aire de répartition naturelle est l’archipel hawaïen. Elle pousse principalement dans le biome tropical humide.
Crowe (2004) indique qu’elle est consommée par les Hawaïens.
88. Marsilea minuta L. (Marsileaceae)
Cette espèce se trouve partout en Afrique, à Madagascar et aux Comores. Elle se rencontre aussi largement en Asie tropicale, en Amérique du Sud et comme adventice dans le sud des États-Unis. Elle peut croître du niveau de la mer jusqu’à 1 900 m d’altitude, dans les étangs et eaux peu profondes, douces ou saumâtres, sur un sol argileux ou sableux.
Ses feuilles vertes, brillantes, sont tendres et sont consommées comme herbe potagère au Sénégal, en Gambie, en Inde, à Sri Lanka et au Bangladesh (Van der Burg, 2015).
89. Microsorum punctatum (L.) Copel. (Polypodiaceae)
Sa répartition géographique est vaste : Afrique, Asie tempérée (Chine, Taïwan), Asie tropicale (Philippines, Malaisie, Papouasie-Nouvelle-Guinée), Australie, Polynésie (Fidji, Vanuatu, Nouvelle-Calédonie). Elle se développe dans les forêts denses humides, équatoriales, où l’humidité est propice à son développement. Cette espèce est épiphyte, mais pousse aussi parmi les feuilles mortes, au niveau des mousses sur les rochers où elle forme un véritable tapis.Elle est considérée comme nourriture de base des anciens Mélanésiens. Les jeunes frondes constituent d’excellents légumes verts. Elle se mange facilement en soupe, en salade, ou cuite. Elle est également utilisée pour envelopper la nourriture afin de la faire cuire au four traditionnel (Baudoin, 2019).
90. Microsorum scolopendria (Burm. f.) (Polypodiaceae)
Syn. : Polypodium phymatodes L. (sous ce nom dans Chevalier, 1951, p. 42).
Cette espèce, qui vit en Afrique tropicale (Sierra Leone à Afrique du Sud, Seychelles, Comores, Mascareignes, Madagascar), mais aussi Sri Lanka, Indonésie, Malaisie, Australie et Polynésie, pousse dans les lieux humides et ombragés en pleine terre, mais plus souvent sur les arbres ou les rochers des forêts secondaires et frangeantes (troncs de cocotiers). Son rhizome long, glabre et peu ramifié, ondulant, est d’un vert émeraude écaillé de brun qui lui donne tout à fait l’aspect d’un lézard (Bourret, 1981).
D’après Chevalier (1951, p. 42), les jeunes crosses et les côtes tendres sont mangées comme des asperges à Tahiti, alors que ses rhizomes mal préparés sont toxiques.
91. Nephrolepis biserrata (Sw.) Schott (Nephrolepidaceae)
Cette fougère est distribuée dans de nombreuses régions tropicales du globe (Afrique, Amérique, Asie). Épiphyte ou terrestre, elle se développe dans les milieux forestiers tropicaux ou subtropicaux. Elle est parfois considérée comme invasive.
Martin (1971) indique que ses jeunes feuilles sont consommées au Cambodge.
92. Nephrolepis cordifolia (L.) Presl (Nephrolepidaceae ; photo 18)
Native du nord-est de l’Australie et de l’Asie (Hawaï, Népal, Sikkim), cette fougère vit dans les sous-bois. Les tubercules qui se développent sur les rhizomes se propagent à la manière des stolons. Ils peuvent donner de nouvelles plantules.
Ces tubercules contiennent une grande quantité de glucides et de calcium. Mangés crus frais, ils sont rafraîchissants et étanchent la soif (Toffin et al., 1985) ; l’un de nous (L. C.) a pu les apprécier lors d’un voyage au Sikkim.
Consommés mûrs et torréfiés, ils sont une riche source de nutriments (Gauchan et al., 2008 ; Oyeyemi et al., 2019). Au Népal, les tubercules et les jeunes pousses sont consommés (Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
93. Nephrolepis falcata (Cav.) C. Chr. (Nephrolepidaceae)
Syn. : Nephrolepis davallioides (Sw.) Kunze, Tectaria falcata Cav.
Originaire d’Asie du Sud Est (Philippines, Malaisie, Thaïlande et Viêt-nam), cette espèce vit dans l’ombre, dans la forêt humide. Elle pousse sur les troncs des arbres et sur des sols peu profonds.
En Nouvelle-Guinée, les rhizomes sont réduits en farine. Dans les îles Cham, situées au large de Hoi An (centre Viêt-nam), ses jeunes pousses et ses frondes sont bouillies et consommés comme légume (Pham et al., 2013).
94. Nephrolepis undulata (Afzel ex) J. Smith (Nephrolepidaceae)
Comme les Nephrolepis précédents, elle se caractérise par la présence de tubercules racinaires, charnus, qui sont consommés par le peuple africain Shi (Mangambu-Mokoso et al., 2012).
95. Ophioglossum nudicaule f. (Ophioglossaceae)
Syn. : Ophioglossum vulgatum var. nudicaule (L. f.) D.C. Eaton (basionyme).
Selon Tropicos, cette espèce vit en Afrique du Sud (province du Cap) ; selon Flora of China, de 1800 à 4300 m, elle serait aussi dans le sud-ouest du Sichuan, au Xizang, dans le centre et le nord-ouest du Yunnan, au nord de l’Inde et au Népal. Les données floristiques indiquant des origines très différentes, il est possible qu’il y ait une confusion dans la détermination de cet Ophioglosse.
Bajracharya et Bajracharya (2022, p. 4) signalent la consommation de cette fougère au Népal, ainsi que celle de O. petiolatum et de O. reticulatum.
96. Ophioglossum parvifolium Grev. & Hook. (Ophioglossaceae)
L’aire de répartition naturelle de cette espèce s’étend en Afrique tropicale et de l’Asie tropicale au Pacifique, d’Hispaniola et du Panama à l’ouest de la Bolivie et au Brésil. C’est une géophyte vivace ou rhizomateuse qui pousse principalement dans le biome tropical humide.
Ses frondes sont consommées au Népal (Poudel & Joshi, 2021).
97. Ophioglossum petiolatum Hook. (Ophioglossaceae)
Cette espèce tropicale se rencontre au Népal et dans certaines parties de l’Asie comme en Chine (Hainan, Hubei, Sichuan, Yunnan), au Tibet, en Indonésie, à Taiwan, au Japon, en Australie, en Nouvelle-Zélande, aux Fidji et en Amérique du Nord. Elle vit dans des zones herbeuses exposées humides.
Au Népal, les frondes sont utilisées comme légume (Kandel, 2020 ; Ojha & Devkotah, 2021 ; Bajracharya & Bajracharya, 2022).
98. Ophioglossum reticulatum L. (Ophioglossaceae)
Cette espèce a une distribution pantropicale et subtropicale : Amérique (du Mexique à l’Argentine), Caraïbes, Afrique subsaharienne, Madagascar, Yémen, sous-continent indien, Népal, Asie du Sud-Est, régions plus chaudes de Chine, Malaisie, Corée, Japon et de nombreuses îles tropicales.
Ses feuilles sont comestibles et sont régulièrement consommées en Afrique et en Asie. Au Népal, d’ailleurs, les frondes sont utilisées comme légume (Kandel, 2020 ; Ojha & Devkotah, 2021). Elles sont consommées en salade ou en légume cuit à Zanzibar (Tanzanie). En Indonésie, c’est une plante appréciée, cueillie assidûment partout où elle est commune. Les feuilles doivent être juste blanchies ; si elles sont trop cuites, elles se transforment en une masse gluante. À Madagascar, l’espèce proche O. ovatum Bory est mangée bouillie et est particulièrement recherchée par la tribu Antandroy (Van der Burg, 2015).
99. Pecluma pectinatiformis (Lindm.) M.G. Price (Polypodiaceae)
Cette espèce, qui se trouve au Brésil, en Argentine et au Paraguay, vit dans la forêt mixte ombrophile.
Ses frondes sont sucrées comme des bonbons et sont généralement mâchées par les enfants Guaranis d’Argentine (Keller et al., 2011 ; Martinez et al., 2016).
100. Platycerium alcicorne (P. Willemet) (Polypodiaceae ; photo 19)
Syn : Acrostichum alcicorne P. Willemet (nom utilisé par Chevalier, 1951).
Cette espèce est originaire de Madagascar, des Seychelles et des Comores, ainsi que du Mozambique et du Zimbabwe, C’est une épiphyte qui se trouve dans la haute forêt boisée et sèche.
Selon Chevalier (1951) le rhizome de cette espèce donne un amidon qui serait utilisé en Nouvelle-Zélande pour faire du pain. Étant donné le grand nombre de Platycerium, il est fort probable qu’il s’agisse pour ce pays d’une erreur d’identification.
101. Polystichum neozelandicum Fée (Dryopteridaceae)
Syn : Polystichum richardii J. Sm.
Endémique de Nouvelle-Zélande, cette espèce très variable a récemment fait l’objet d’une révision (Perrie & Brownsey, 2003). On la trouve dans les forêts côtières à montagnardes de toute la Nouvelle-Zélande.
On consomme les nouvelles pousses ou têtes de fougère récoltées au printemps et en été. Ces jeunes pousses sont cuites comme de la verdure et consommées par les Maoris. Selon Crowe (2004), Macdonald les recommande cuites comme des asperges et servies avec du beurre fondu sur du pain grillé ou simplement comme légume.
102. Pteridium esculentum (G. Forst.) Cockayne subsp. arachnoideum (Kaulf.) J.A. Thomson (Dennstaedtiaceae)
Syn. : Pteridium arachnoideum (Kaulf.) Maxon (cité par Teixeira et al., 2015, et Faccin et al., 2017).
Cette fougère présente une répartition qui s’étend du Mexique à l’Amérique tropicale. Elle vit dans des forêts de nuages à Pinus–Quercus, mais aussi dans des zones perturbées.
En Amazonie, les crosses de cette espèce sont considérées comme comestibles, mais leur utilisation nécessite une longue ébullition avant consommation pour éliminer les substances toxiques et cyanogènes (Teixeira et al., 2015). Faccin et al. (2017) insistent d’ailleurs sur ce danger puisqu’ils considèrent que la consommation de ces crosses est responsable de plusieurs « cancers à cellules squameuses de l’œsophage présentant des lésions tumorales sténosantes circulaires caractéristiques » (trad.).
103. Pteridium revolutum (Blume) Nakai (Dennstaedtiaceae)
Syn. : Pteridium aquilinum subsp. wightianum (J. Agardh) W.C. Shieh.
Cette espèce est largement distribué dans les régions tropicales et subtropicales d’Asie : au Népal, en Chine (Hunan, Jiangxi, Shaanxi, Sichuan, Xizang, Yunnan et Zhejiang), en Inde (Arunachal, Sikkim, Darjeeling, Uttarakhand, Himachal, Jammu-et-Cachemire), au Pakistan, au Bhoutan, à Taiwan et au nord de l’Australie. Elle se développe sur des pentes ensoleillées et dans des forêts ombragées ouvertes, entre 600 et 3 000 m.
On consomme ses pousses au Népal (Bajracharya & Bajracharya, 2022).
104. Pteris biaurita (Pteridaceae)
Largement distribuée dans le monde, elle vit notamment en Afrique, dans les Amériques et en Asie, dans des zones climatiques à sol humide, qui s’étagent du tempéré à subtropical.
Ses jeunes feuilles et ses pousses sont consommées comme légume sauvage par les tribus Raji dans l’ouest du Népal (Thapa et al., 2014), ainsi que les tribus Newar, Chetri, Tamang et Bankaria du district de Makawanpur (Ojha & Devkotah, 2021).
105. Pteris vittata L. (Pteridaceae)
Elle est présente en Europe méditerranéenne, en Afrique, en Asie et en Océanie. Elle a été introduite aux USA pour dépolluer les sols contaminés par des pesticides à base d’arsenic. Elle vit dans des zones humides et ombragées, dans des forêts tropicales semi-persistantes.
Au Népal, on consomme ses rhizomes et ses jeunes pousses (Bajracharya & Bajracharya, 2022).
106. Ptisana attenuata (Labill.) Murdock (Marattiaceae)
Syn. : Marattia attenuata Labill.
Cette fougère est endémique de Nouvelle-Calédonie. Elle vit en forêt humide sur substrat volcano-sédimentaire, entre 150 et 860 m d’altitude.
Les crosses et jeunes rhizomes sont comestibles. Les jeunes frondes servent à la préparation d’infusions (Jeanneney, 1894).
107. Ptisana fraxinea (Sm.) Murdock (Marattiaceae)
Syn : Marattia fraxinea Sm. (nom cité dans les travaux de Mangambu-Mokoso et al., (2012).
Cette espèce se trouve en Afrique de l’Ouest, centrale et du Sud, à Madagascar, aux îles Mascareignes, en Asie tropicale. Elle pousse dans les forêts sempervirentes humides ou marécageuses.
En Afrique, les rhizomes charnus de la plante sont consommés par les Pygmées (Mangambu-Mokoso et al., 2012).
108. Ptisana salicina (Sm.) Murdock (Marattiaceae)
Syn. : Marattia salicina Sm.
C’est une espèce originaire de l’île Norfolk (Australie), de la Nouvelle-Zélande et du Pacifique Sud (Jacq & Butaud, 2013). Autrefois commune en Nouvelle-Zélande, mais maintenant assez rare, elle pousse dans la forêt des basses terres de Kaitaia, près de Wanganui, le long de l’ouest de l’île du Nord, généralement dans des ravines à l’ombre épaisse.
Récoltée toute l’année, cette fougère porte une grosse racine tubéreuse, souvent en forme de sabot de cheval, couverte de grandes écailles rosées. Les Maoris consomment ces grandes écailles ressemblant à des bractées ; elles sont considérées comme un mets de choix après torréfaction. Colenso classe cette fougère comme la onzième plante alimentaire indigène la plus importante des Maoris. C’était aussi l’une des rares plantes connues pour avoir été cultivée par eux.
Les racines nécessitaient toutefois une longue cuisson pour être appétissantes. Potts les décrit comme « dures, sèches, solides, comme une pomme de terre au goût très indifférent, avec un goût légèrement acide » (trad.). Cependant, Taylor (1955) dit qu’elles sont sucrées et farineuses, et excellentes, ajoutant que, « si le Marattia salicina (Ptisana salicina) pouvait être cultivé en n’importe quelle quantité, il serait précieux comme aliment délicat » (trad.). Cependant, cette fougère a une racine à croissance notoirement lente qui, même dans des conditions favorables, ne pousse que de 2,5 cm de diamètre en un an, et une personne peut consommer en une journée la croissance de cinq ans ! (Crowe, 2004). En Océanie, dans les îles de la Société et aux Tuamotu, on consomme ses rhizomes cuits ou grillés (Henry, 1968 / 2004). Le rhizome rôti est considéré comme « une grande délicatesse » (Taylor, 1847). « Ce comestible était rosâtre ou violet pâle lorsqu’il était coupé, solide, dur, presque insipide, avec une saveur légèrement amère. » (Potts, 1879).
109. Salvinia auriculata (Salviniaceae)
Originaire des Amériques, du Mexique au sud de l’Argentine et du Chili, cette petite fougère aquatique est riche en protéines. En Colombie, elle est utilisée dans les élevages porcins (Leterme et al., 2009) et contribue ainsi, de façon indirecte mais efficace, à l’alimentation humaine.
110. Salvinia cucullata Roxb. (Salviniaceae ; photo 20)
Fougère aquatique originaire d’Asie (de l’Inde à la Thaïlande et devenue invasive au Viêt-nam et en Indonésie).
Selon Vidal (1959) : « Cette fougère flottante, à petites frondes en forme d’oreille de souris, libère des spores en quantité vers la fin de la saison des pluies. Au Laos, ces spores (sic ; cf. frondes ? plante entière ?) utilisées dans l’alimentation se trouvent par paniers entiers sur le marché en novembre ».
111. Salvinia nymphellula Desv. (Salviniaceae)
Fougère aquatique annuelle ou vivace à rhizome ramifié pouvant mesurer 30 cm de longueur. Elle est originaire d’Afrique tropicale, mais a été dispersée dans plusieurs pays chauds où elle vit sur les eaux stagnantes.
Hounkanli (1982), de Dakar, souligne la facilité et la rapidité de propagation de ces plantes, ainsi que leur pouvoir envahissant des surfaces des eaux sur lesquelles elles vivent. Il estime que « loin de constituer une flore nuisible elles peuvent être valorisées pour le bien de l’humanité » et propose, après expériences, d’utiliser la farine de cette fougère pour l’alimentation de la volaille ; de ce fait elle devient ainsi, de façon indirecte à l’instar de la précédente espèce, une précieuse matière alimentaire utile aux populations africaines se nourrissant de ces volatiles.
Elle a une répartition géographique qui comprend l’Amérique du Sud (Argentine et sud-est du Brésil), l’Australie (Queensland), la Nouvelle-Guinée, la Malaisie et la Nouvelle-Zélande. Cette espèce présente deux types de frondes, la fronde stérile est simple et mesure de 3 à 25 cm de long, la fronde fertile, plus longue et plus étroite, porte de nombreux sporanges ronds. En Nouvelle-Zélande, bien que rare, on la rencontre dans les forêts de plaine et de montagne, généralement le long des bords des clairières.
Ses jeunes pousses étaient récoltées au printemps et en été mais, en raison de sa rareté, elle ne doit être consommée qu’en situation de survie. Selon Crowe (2004), les ecclésiastiques Taylor (en 1855) et Colenso (en 1868) rapportent que les Maoris mangeaient les jeunes pousses succulentes non développées de cette fougère, qui devait donc être beaucoup plus commune à l’époque qu’aujourd’hui.
113. Sphaeropteris intermedia (Mett.) R.M. Tryon (Cyatheaeceae)
Syn : Alsophila intermedia Mett., Cyathea intermedia (Mett.) Copel.
Endémique de Nouvelle-Calédonie, cette fougère arborescente vit à la lisière des forêts. Mesurant jusqu’à 35 m, elle est probablement la plus grande du monde.
Les Canaques consomment l’amidon qu’ils extraient de son stipe (Chevalier, 1951, p. 42).
114. Sphaeropteris medullaris (G. Forst) Bernh. (Cyatheaceae)
Syn. : Polypodium medullare Forst., Cyathea medullaris (G. Forst.) Sw. (nom utilisé par Colenso, 1880, et Crowe, 2004).
Cette grande fougère arborescente (plus de 20 m de hauteur) se trouve en Océanie, au sud-ouest du Pacifique, des Fidji à l’île Pitcairn, ainsi qu’en Nouvelle-Zélande. Son biotope est constitué par les forêts humides et leurs lisières des basses terres, au sol souple. L’humidité de l’air est également très importante.
Chevalier (1951) et Crowe (2004) indiquent qu’on retire l’amidon de la moelle interne de la partie supérieure du stipe pour faire du pain. La moelle peut aussi être directement mangée rôtie. Crowe (2004) précise que l’on consomme également, toute l’année, la base des rachis des frondes et la partie non enroulée des nouvelles pousses.
La préparation culinaire des fougères étant très rarement indiquée, celle qui concerne cette espèce vaut la peine d’être décrite. La partie comestible des stipes et des frondes est coupée en petites longueurs. Ces morceaux sont cuits à la vapeur pendant 48 heures. Consommé froid, le produit fini a une saveur sucrée dont la consistance rappelle celle du navet. Une autre méthode de préparation consiste à enfiler les morceaux sur de longues ficelles et séchées en vue d’une utilisation future. Cuite ensuite, cette moelle constitue un substitut acceptable au sagou. Sa valeur nutritionnelle est importante : la moelle du stipe contient (en poids sec) 3,6 % de protéines, 3,1 % de lipides, 3,0 % de sucres réducteurs simples et 7,4 % d’amidon (Crowe, 2004). Cet auteur rapporte les observations que Heaphy a faites lors de son expédition sur la côte ouest en 1846. Cet explorateur néo-zélandais remarque que, lorsqu’ils sont mélangés avec du vin, du sucre et des épices, ces éléments de tiges cuits « peuvent être confondus avec de la pomme au four ». Pour les Maoris, son importance principale réside dans le fait qu’il s’agit d’une nourriture pour les voyageurs et comme dernier recours en période de pénurie.
Colenso (1880) présente ce Sphaeropteris (Cyathea m.) comme la sixième plante alimentaire indigène la plus importante des Maoris. Crowe (2004) cite Buck (1949) qui mentionne son importance, même à une époque relativement moderne, comme donnant « une couleur locale aux festins » (trad.).
115. Sphaeropteris novae-caledoniae (Mett.) R.M. Tryon (Cyatheaceae)
Syn. : Cyathea novae-caledoniae (Mett. ex Fourn.) Copel.
Mesurant plus de 20 m de hauteur, cette fougère endémique de Nouvelle-Calédonie se trouve sur toute l’île, aux lisières de la forêt dense humide et le long des rivières.
Les Canaques utilisent l’amidon de la moelle interne du stipe pour se nourrir (Chevalier, 1951, p. 42).
116. Stenochlaena palustris (Burm.) Bedd. (Blechnaceae ; photo 21)
On rencontre cette espèce en Asie de l’Est, Inde, Chine méridionale, Viêt-nam, Laos, Thaïlande, Malaisie, Philippines, Australie, jusqu’aux îles du Pacifique. Cette espèce lianescente peut mesurer plus de 20 m de longueur. Semi-forestière, elle est largement distribuée dans les fourrés, généralement dans les endroits marécageux près de la mer.
Les jeunes frondes (vraisemblablement celles qui sont stériles) sont généralement servies sautées avec de l’ail, des crevettes sèches, des sardines ou de la pâte de crevettes. En Malaisie, c’est un aliment populaire ; au Viêt-nam, ces jeunes frondes, appelées đọt choại, sont servies sous forme de soupe ou frites avec de l’ail. Les feuilles sont également consommées, mélangées à de la vinaigrette (Tanaka & Nguyen, 2007). Au Népal, les jeunes pousses sont utilisées comme légume (Ojha & Devkotah, 2021) ; elles sont consommées comme des épinards par les tribus Mechi de l’est du pays (Kandel, 2020).
117. Stenochlaena tenuifolia (Desv.) T. Moore (Blechnaceae)
Syn. : Lomaria tenuifolia Desv., Stenochlaena mildbraedii Brause.
Cette espèce tropicale africaine lianescente se rencontre au Cameroun, en Angola, en Ouganda, en Guinée équatoriale, en Tanzanie, en Afrique du Sud et à Madagascar. Elle prospère dans les forêts marécageuses et côtières.
À Madagascar, on consomme ses jeunes frondes Des recherches sur sa culture, sa valeur nutritionnelle et ses propriétés bactéricides semblent justifiées (Van der Burg, 2015).
118. Sticherus flabellatus (R. Br.) H. St. John (Gleicheniaceae)
Basionyme : Gleichenia flabellata R. Br. (nom cité par Coiffier, 2013).
Elle se trouve en Australie, en Nouvelle-Guinée, en Nouvelle-Calédonie et Nouvelle-Zélande ; elle vit généralement dans ou près des ruisseaux ou sur des berges humides en bordure de forêt tropicale.
En Nouvelle-Calédonie, ses rhizomes sont utilisés comme substances alimentaires dans les années de disette (Coiffier, 2013, p.138).
119. Sticherus furcatus (L.) Ching. (Gleicheniaceae)
Syn. : Acrostichum furcatum L. (cité sous ce nom par Mérat & De Lens, 1883).
La répartition géographique de cette fougère s’étend en Amérique : Mexique, Amérique centrale, Grandes Antilles (Cuba, Jamaïque), Petites Antilles (seulement en Guadeloupe), Amérique du Sud (seulement en Colombie). Elle vit dans les ravins forestiers humides, les pentes abritées et les abords rocheux des cours d’eau.
Le rhizome est utilisé, mais Mérat et De Lens (1833) estiment « qu’il faut être privé de toute autre ressource pour en user ». Lesson, dans son voyage autour du monde (1839), précise que les Néo-Zélandais recueillent les rhizomes de cette espèce et les font sécher au soleil pour les convertir en pain. Ils sont concassés dans un mortier et triturées jusqu’à obtention d’une pâte brun-jaune, visqueuse comme de la glu. Dans son quatrième tome, p. 28, il écrit « J’en vis occupés à piler dans un mortier la racine de fougère dont on pétrit une sorte de pain, et dont il se fait de grandes provisions pour les temps de disette. ».
Étant donné l’ancienneté de ces informations, il est fort possible que la détermination soit fausse et il pourrait s’agir de Sticherus flabellatus (R. Br.) H. St. John selon M. Baudrie (courriel du 16/07/2023).
120. Tectaria coadunata (J Sm.) C. Chr. (Tectariaceae)
Cette espèce se trouve en Chine, au Laos, en Malaisie, au Myanmar, au Népal, à Sri Lanka, en Thaïlande et au Viêt-nam. Les frondes produisent sur leurs parties supérieures des bulbilles plus ou moins sphériques qui naissent à la jonction des nervures axiales des pennes. Cette espèce vit sur les pentes des montagnes dans les forêts denses ou dans les crevasses rocheuses à proximité des cours d’eau, à des altitudes moyennes inférieure et supérieure situées entre 350 et 1 500 m.
Au Népal, les jeunes feuilles et les pousses de cette espèce très commune sont consommées en juin-juillet pour en faire des salades (Kandel, 2020 ; Ojha & Devkotah, 2021).
121. Tectaria zeilanica (Houtt.) Sledge (Tectariaceae)
Syn. : Ophioglossum zeilanicum Houtt.
Cette espèce s’étend du Népal à la Chine, au sud de l’Inde, à la péninsule indochinoise et en Malaisie. Elle se développe sur des roches boueuses dans les forêts, près des ruisseaux et sur les pentes abruptes.
Au Népal, on consomme ses frondes (Bajracharya & Bajracharya, 2022).
122. Telmatoblechnum indicum (Burm. f.) Perrie, D.J. Ohlsen & Brownsey (Blechnaceae)
Syn. Blechnum indicum Burm. f.
Cette espèce, qui se trouve en Inde, en Thaïlande, en Malaisie, en Nouvelle-Calédonie et en Australie, pousse souvent sur des sols sablonneux dans des zones marécageuses des forêts denses humides.
Ses rhizomes féculents étaient l’un des aliments les plus importants des aborigènes australiens du sud du Queensland (Crowe, 2004).
123. Trichomanes crispum (Hymenophyllaceae)
Espèce épiphyte et lithophyte, elle croît en Amérique tropicale et aux Grandes et Petites Antilles dans les forêts inondées.
Les Indiens Siona de la région amazonienne l’utilisent comme boisson rafraîchissante. Ils font macérer les feuilles dans l’eau, mais sans la faire bouillir, puis boivent cette décoction (Murillo-Pulido & Harker-Useche, 1990).
124. Trichomanes diversifrons (Bory) Mett. ex (Hymenophyllaceae)
Syn. : Hymenostachys diversifrons Bory.
Cette fougère tropicale américaine a une répartition qui s’étend du sud du Mexique jusqu’en Bolivie. Principalement terrestre, elle se trouve en milieux forestiers humides, dans des ravines et talus très ombragés et bords de rivières.
Les frondes macérées dans de l’eau sans les porter à ébullition fournissent une boisson rafraîchissante (Jimenez-Alvarez, 2011).
125. Woodwardia unigemmata (Makino) Nakai (Blechnaceae)
Fougère asiatique qui prospère au Népal, en Chine (Fujian, Gansu, Guangdong, Guangxi, Guizhou, Hubei, Hunan, Jiangxi, Shanxi, Sichuan, Xizang et Yunnan), en Inde (Arunachal, Sikkim, Darjeeling, Uttarakhand, Himachal, Jammu et Cachemire), au Pakistan, au Bhoutan, au Myanmar, au Viêt-nam, Philippines, à Java, en Nouvelle-Guinée, à Taiwan et au Japon. Elle produit des bulbilles constituées par des petites boules pelucheuses de 3 à 5 mm situées sur la face inférieure de ses frondes bipennées. Elle habite dans des ravins et des pentes humides, densément boisées sous les arbres dans des secteurs à fortes précipitations.
Au Népal, on consomme ses rachis (Bajracharya & Bajracharya, 2022).
5. Commentaires et conclusion
Cette approche confirme ce qu’on pouvait imaginer à partir de la luxuriance botanique des pays tropicaux. Le nombre de fougères consommées par les peuples répartis dans de nombreux pays chauds des hémisphères nord et sud est en effet très important. Notre aperçu, qui ne saurait les envisager toutes, est simplement destiné à mettre en lumière cette diversité et les usages qui en sont faits. On remarque toutefois que l’Asie (tempérée et tropicale) est largement dominante dans l’emploi des fougères alimentaires : est-ce le fait des traditions ancestrales ou plus prosaïquement dû aux enquêtes modernes des ethnobotanistes œuvrant dans cette partie du globe ? Les données concernant l’Afrique et l’Amérique tropicales paraissent actuellement partielles ou, simplement, plus difficilement accessibles. Dans cette présentation, les exemples choisis ont pour objectif de révéler le rôle de légumes joué par ces végétaux, la recherche de leurs saveurs délicates et leur importance comme indéniable complément alimentaire.
On peut également prendre en compte l’intérêt de certaines fougères cultivées pour l’alimentation animale qui permet à des populations vivant dans des zones à faible niveau de vie d’augmenter avantageusement leur quantité alimentaire. C’est en particulier le cas de la production locale de volaille de façon économique, comme l’indique Hounkanli (1982) à propos de Salvinia nymphellula utilisé par les populations sénégalaises, ou faire partie, dans nos régions, de la nourriture additionnelle des porcs faite avec Dryopteris filix-mas ainsi que l’ont noté plusieurs auteurs (Cazin, 1868, p. 439 ; Goubeau, 1950 ; Coquillat, 1950 ; Dumas, 2002).
Par ailleurs, on remarque que certaines fougères cultivées produisant une masse considérable de matière fraiche sont utilisées comme engrais verts pour l’amélioration des sols, ce qui permet de diminuer l’apport d’intrants chimiques coûteux. On connaît d’ailleurs l’emploi de purin de fougères comme fertilisant et comme pesticide. On sait aussi que certaines fougères aquatiques comme Azolla pinnata (Rai, 2008 ; Guittonny-Philippe et al., 2014) et Bolbitis sont capables de capter des métaux lourds toxiques (phytoremédiation).
On peut également évoquer d’autres utilisations, comme les matériaux de construction (stipes de Cyathea) tels que poutres et toitures pour les maisons et divers objets tels que pots à orchidée comme éléments décoratifs de la maison, mais aussi comme finition des chapeaux coniques en lataniers (nón là) au Viêt-nam. Dans le village de Chuông (Nord-Viêt-nam), le cerclage des bords de ces chapeaux est fait avec des tiges refendues de Dicranopteris linearis (Burm. f.) Underw. (Gleicheniaceae ; photo 22).
Il ne faut pas oublier l’intérêt non négligeable que représentent ces végétaux au niveau ornemental, que ce soit en situation domestique (Asplenium par exemple) et à l’extérieur (Platycerium), en situation sèche ou ensoleillée (Nephrolepis), humide ou ombragée (Cyrtomium).
Certaines fougères sont employées comme parure dans les danses et dans les cérémonies rituelles en Océanie et en Amérique du Sud. En Nouvelle-Calédonie par exemple, les Kanaks ligaturent des frondes de fougères (Pteridium esculentum, Gleichenia) sur le manche des casse-têtes (Coiffier, 2013). Vieillard et Deplanche (2005, p. 92) signalent que « Les frondes élégantes du Gleichenia dicarpa R. Br., du Lygodium reticulatum Schk., du Dicksonia thyrsopteroides Mett., du Stromatopteris moniliformis Mett., des Lycopodium cernuum et mirabile sont généralement employées pour la confection des couronnes, dont les indigènes se parent les jours de fête ». Kasarhérou (1993, p. 38) signale également que des racines de fougère étaient utilisées dans les régions centre et sud de la Nouvelle-Calédonie pour constituer la barbe de certains masques.
On a vu que des fougères ont fait partie de l’alimentation humaine paléolithique et que l’usage médicinal remontait également loin dans le temps. On peut citer le cas des analyses effectuées dans des résidus conservés dans un vase à offrande provenant d’une sépulture datant de l’âge du Bronze (Pyrénées). Celles-ci ont révélé de nombreuses spores de Dryopterix filix-mas associées à des œufs de douve (Fasciola hepatica), agent de la distomatose. Cette découverte suggère que les officiants ont offert de la viande reconnue parasitée qu’ils ont volontairement accompagnée de son « antidote » médicinal (Bui Thi Mai et al., 2011). On sait en effet que Dryopterix filix-mas possède des propriétés antihelminthiques reconnues depuis fort longtemps.
Dans l’avenir, on peut espérer que ce monde passionnant des fougères livrera des molécules intéressantes dans plusieurs domaines : agrochimie, pharmacologie, etc. (flavonoïdes : effet antioxydant, par exemple).
[1] L’apogamie ou apomixie est un « phénomène par lequel un embryon se développe sans fécondation à partir d’une cellule végétative, généralement diploïde » (Plantefol, 1931).
[2] Cette fougère, qui se trouve dans le sud-est de la Colombie-Britannique, est menacée par les activités récréatives et l’exploitation de propriétés de loisirs. Elle a été désignée « en voie de disparition » dès avril 1984.
[3] Dorvault (1928, p. 1322) indique la confection du sirop, mais utilise la fougère capillaire du Canada (Adiantum pedatum) : prendre 100 g de frondes, verser 1,5 l d’eau bouillante et laisser infuser pendant six heures. Presser à travers un linge et ajouter 180 g de sucre pour 100 g de colature, puis porter à ébullition.
[4] Pâte de crevettes salée et fermentée.
[5] C’est le principal élément cancérigène des fougères. Il est responsable des maladies hémorragiques, de la cécité lumineuse chez le bétail et du cancer de l’œsophage et de l’estomac chez l’homme (Bruneton, 2019).
[6] Les chémotypes (ou chimiotypes) sont présents dans les plantes sauvages et cultivées. Le mot désigne une entité chimique distincte au sein d’une même espèce (règlement Reach).
[7] Le bougna est un ragoût de viande locale qui comprend du taro, de la patate douce, de la banane poingo (= banane plantain), de l’igname, cuits dans du lait de coco dans des fours enterrés.-
Bibliographie
Anderson A. & White P., 2001. Approaching the Prehistory of Norfolk Island. Records of the Australian Museum, supplement 27 :
1-9.
Bajracharya G.B. & Bajracharya B., 2022. A comprehensive review on Nepalese wild vegetable food ferns. Heliyon 8 : 1-22.
Baudoin C., 2019. Asplenium nidus, autres fougères et compléments alimentaires de Nouvelle-Calédonie. Diplôme d’État de docteur en pharmacie, 108 p.
Biloso Moyene A., 2008. Valorisation des produits forestiers non ligneux des plateaux de Bateke en périphérie de Kinshasa (RD Congo). Thèse, Université libre de Bruxelles, 255 p.
Bois D., 1937. Les plantes alimentaires chez tous les peuples et à travers les âges. Histoire, utilisation, culture, IV – Les plantes à boissons. Encyclopédie biologique XVII. Réimpr. 1996, 600 p.
Bonet M.A. & Vallès J., 2002. Use of non-crop food vascular plants in Montseny biosphere reserve (Catalonia, Iberian Peninsula). International Journal of Food Sciences and Nutrition 53 (3) : 225-248.
Bourret D.,1981. Bonnes plantes de Nouvelle-Calédonie et des Loyauté. Les Éditions du Lagon, Nouméa, 110 p.
Bruneton J., 2020. Plantes toxiques 2008-2019. Actualisation bibliographique commenté. Fougère-aigle et autres fougères, version 03 – 05/04/20, Université Angers, https://phytomedia.univ-angers.fr.
Buck P.H., 1949. The Coming of the Maori by the Rangi Hiroa. Whitcombe and Tombs, Wellington, 551 p
Bui Thi Mai, Courtaud P., Dumontier P., Girard M., Mirabaud S. & Regert M., 2011. Analyses du contenu des vases déposés en contexte sépulcral au Bronze ancien et moyen dans les grottes de Droundak et Homme de Pouey (Pyrénées Atlantiques). 8es Rencontres méridionales de Préhistoire récente, Marseille 7 et 8 novembre 2008 : 449-456.
Cazin F.-J., 1868. Traité pratique et raisonné des plantes médicinales indigènes, 3e édition. Asselin, Paris, 1189 p.
Chevalier A., 1951. Les flores et spécialement les plantes utiles de l’hémisphère austral et notamment de l’Océanie. Revue internationale de botanique appliquée et d’agriculture tropicale 31, 339-340 : 38-50.
Christenhusz M.J.M. & Byng J.W., 2016. The number of known plants species in the world and its annual increase. Phytotaxa 261 (3) : 201-217.
Coiffier C., 2013. Fougères et autres éléments végétaux associés aux casse-têtes kanak ou l’art de communiquer sans parole. Journal de la Société des océanistes 136-137 : 133-147.
Colenso W., 1880. On the vegetable food of the ancient New Zealanders before Cook’s visit. Transactions of New Zealand Institute 13 : 3-38.
Copeland E.B., 1942. Edible Ferns. American Fern Journal 32 (4) : 121-126.
Coquillat M., 1950. Au sujet du « pain de fougère » en Mâconnais. Bulletin mensuel de la Société linnéenne de Lyon 19ᵉ année, septembre 1950, 7 : 173-176.
COSEPAC (Comité sur la situation des espèces en péril au Canada), 2000. Évaluation et rapport de situation sur l’adiante cheveux-de-Vénus au Canada. Ottawa, 6 p.
Couplan F., 2009. Le régal végétal : plantes sauvages comestibles. In Encyclopédie des plantes sauvages, comestibles et toxiques de l’Europe, Sang de la Terre, 527 p.
Cremers G. & Boudrie M., 2007. Les Ptéridophytes des Guyanes, les spécimens de référence depuis Aublet (1775) à nos jours. Journal de botanique de la Société botanique de France 40 : 3-111.
Crowe A., 2004. A field guide to the native edible plants of New Zealand. Penguin Books, 196 p,
De Wildeman E., 1934. Documents pour l’étude de l’alimentation végétale de l’indigène du Congo belge. Mémoire de l’Institut royal colonial belge, 269 p.
Dong Y.-H., Wang Q.-F. & Wahiti Gituru R., 2012. Effect of habitat modification on the distribution of the endangered aquatitc fern Ceratopteris pteridoides (Parkeriaceae) in China. American Fern Journal 102 : 136-146.
Dorvault F.-L.-M., 1928. L’officine ou répertoire général de pharmacie pratique, 17e édition revue par E. Defacqz & R. Weitz. Vigot frères, Paris, 2009 p.
Dournes J., 1973. Chi-Chê, la botanique des Srê. Journal d’agriculture tropicale et de botanique appliquée 20 (1-12) : 1-189.
Dumas Y., 2002. Que savons-nous de la Fougère aigle ? Revue forestière française LIV (4) : 357-374.
Dy Phon P., 2000. Dictionary of plants used in Cambodia, trilingue anglais, français, khmer. Phnom Penh, 915 p.
Ezavin O. & Basset C., 2013. Fougères rustiques pour le jardin. Ulmer, 223 p
E. A., 2018. Barbagia, il formaggio nelle felci, Su Casu in Filixi è una ricetta antica che oggi sopravvive soltanto nella zona di Seulo. La Stampa; il secolo XIX, 20-2-2018.
Faccin T.C., Masuda E.K., Piazer J.V.M, Melo S.M.P. & Kommers G.D., 2017. Annular stenotic oesophageal squamous cell carcinoma in cattle exposed naturally to bracken fern (Pteridium arachnoideum). Journal of Comparative Pathology 157 (2-3) :174-180.
FNA (Flora of North America, North of Mexico), s.d. 2 – Pteridophytes and Gymnosperms. R. Morin (ed), Flora of North America Editorial Committee Convening, www.efloras.org.
Fournier P.V., 1948. Le livre des plantes médicinales et vénéneuses de France. Paul Lechevalier, Paris, I (477 p), II (504 p.) et III (636 p).
Gallé J.-B., 2011. Les fougères, plantes médicinales, plantes utiles. Les multiples usages des ptéridophytes. In : Les Fougères d’Alsace, d’Europe et du Monde. Actes du Colloque en hommage à Claude Jérôme (1937-2008) Strasbourg les 3-4 octobre 2009. :163-174.
Gauchan D.P., Manandhar D., Shrestha S. & Suwal K., 2008. Nutritional analyses of Nephrolepis cordifolia (L.) C. Presl. Kathmanda University Journal Science, Engineering and Technology 1 (5) : 68-72.
Goubeau A., 1950. Le pain de fougère. Bulletin trimestriel de l’Union des sociétés françaises de sciences naturelles 2 : 47-50.
Grenand P., Moretti C., Jacquemin H. & Prévost M.-F. (dir.), 2004. Pharmacopées traditionnelles en Guyane. IRD, Marseille, 815 p.
Guittonny-Philippe A., Masotti V., Laffont-Schwob I., Delmail D.& Viglione J., 2014. Potentiels d’utilisation des macrophytes pour réduire l’impact des industries sur les milieux aquatiques européens. Sciences Eaux & Territoires 3 (15) : 74-77.
Henry T., 2004. Flore des îles de la société et des Tuamotus In Tahiti aux temps anciens [en ligne], Société des océanistes, Paris : 722 p., DOI : https://doi.org/10.4000/books.sdo.1410.
Herrick J. W., 1997. Iroquois Medical Botany. Dean R. Snow, 292 p.
Houghton P., 1978. Dental evidence for dietary variation in prehistoric New Zealand. Journal of the Polynesian Society 87 (3) : 257-263.
Hounkanli J.-Y., 1982. Utilisation d’une fougère d’eau douce (Salvinia nymphellula) en alimentation des volailles. Thèse doctorat vétérinaire, Université de Dakar, 90 p.
Italian-Traditions, s.d. 15 formaggi della Sardegna da non perdere, https://italian-traditions-com consulté le 10-3-2023.
Jacq F.& Butaud J.-F., 2013. Guide floristique. Plateau de Te Méhani, Raiatea, Polynésie française, 2e édition. Au Vent des Iles et direction de l’Environnement, 130 p.
Jahns H.M., 1989. Guide des fougères, mousses et lichens d’Europe. Delachaux & Niestlé, 258 p.
Jeanneney A., 1894, rééd. 1981. La Nouvelle-Calédonie agricole : nature minéralogique et géologique du sol ; renseignements pratiques pour les émigrants. Éditions du Pacifique, 344 p.
Jimenez-Alvarez S.E., 2011. Estado actual de conocimiento del uso de algunos de las helechos presentes en Colombia. Thèse de biologie, Bogota, 240 p.
Jones D.L., 1987. Encyclopedia of Ferns. An introduction to ferns, their structure, biology, economic importance, cultivation and propagation. Timber Press, Portland (U.S.A.), 433 p.
Johnson A., 1961. The genus Ceratopteris in Malaya. The Gardens’ bulletin 18 : 76-82.
Joshi P., 1997. Ethnobotany of Pteridophytes of hilly districts of Uttar Pradesh, India. Indian Fern Journal 14 : 14-18.
Kandel D.R., 2020. Pteridophytes of Nepal. Plant Diversity of Nepal 1 : 10-22.
Kandel D.R. & Fraser-Jenkins C.R., 2020. Ferns and Fern-allies of Nepal (3). National Herbarium and Plant Laboratories, Department of Plant Resources, Ministry of Forests and Soil Conservation, Nepal.
Kari P.R., 1987. Tanaina Plantlore. Dena’ina K’et’una. An ethnobotany of the Dena’ina Indians of Southcentral Alaska. National Park Service, Alaska Region, Anchorage.
Kasarheou E., 1993. Le masque kanak. Ed Parenthèses, Marseille, Arts témoins, 78 p.
Keller H.A., Meza Torres E.I. & Prance G.T. 2011. Ethnopteridology of Guarani communities in the Northeast of Argentina. American Fern Journal 101 (3) : 193-204.
Keller H.A. & Prance G.T., 2015. Review the ethnobotany of ferns and lycophytes. Fern Gazette 20 (1) : 1-13.
Kim J., Pezzuto J.M., Soejarto D.D., Lang F.A. & Kinghorn A.D., 1988. Polypodoside A, an Intensely Sweet Constituent of the Rhizomes of Polypodium glycyrrhiza. Journal of Natural Products 51 (6) : 1166-1172.
Krings M. & Schultka S., 2002. Cuticles of Karinopteris beneckei (Potonié ex Huth) Boersma emend., a mariopterid seed fern from the Upper Carboniferous of Lower Silesia (Poland). Fossil Record 5 : 319-333.
Kuhnlein H.V & Turner N.J., 1991. Traditional Plant Foods of Canadian Indigenous Peoples, Nutrition, Botany and Use. Foods and Nutrition in History and Anthropology 8, 525 p.
Large M.F. & Braggins J.E., 2004. Tree ferns. Timber Press, 360 p.
Le Hors M., 2009. Remarques générales sur la flore des îles Saint-Pierre & Miquelon. 53 p., http://www.grandcolombier.pm/wp-content/uploads/pdf/190109/flore_spm_le_hors_derniere_version.pdf.
Leclercq S., 1951. Étude morphologique et anatomique d’une fougère du Dévonien supérieur : le Rhacophyton zygopteroides nov. sp. Annales de la Société géologique de Belgique 9 : 3-58.
Lesson R.P., 1839. Voyage autour du monde entrepris par ordre du gouvernement sur la corvette. La Coquille 4, 201 p.
Leterme P., Londoño A.M., Muñoz J.E., Suarez J., Bedoya C.A. Souffrant W.B. & Buldgen A., 2009. Nutritional value of aquatic ferns (Azolla filiculoides Lam. and Salvinia molesta Mitchell) in pigs. Animal Feed Science and Technology 149 (1-2) : 135-148.
Lieutaghi P., 1966. Le livre des bonnes herbes. Actes Sud, Arles, 517 p.
Lindsay S. & Middleton D.J., 2012. Ferns of Thailand, Laos and Cambodia checklist, revised 17 November 2016, http://rbg-web2.rbge.org.uk/thaiferns/.
Lognay G, Haubruge E., Delcarte E., Wathelet B., Mathieu F., Marlier M. & Malaisse F., 2008. Ophioglossum polyphyllum A. Braun in Seub. (Ophioglossaceae, Pteridophyta), une herbe potagère rare du Tibet centro-méridional (Région autonome du Tibet, R.P. Chine). Revue internationale de géologie, de géographie et d’écologie tropicales 32 : 9-16.
Louis-Marie Père, 1931. Flore-manuel de la province de Québec. Presses de l’Institut agricole d’Oka, Montréal, 320 p.
Maiden J.H., 1889. The useful native plants of Australia, including Tasmania. Turner & Henderson, Sydney, 696 p.
Mangambu Mokoso J. de D., Van Diggelen R., Mwanga J.C., Ntahobavuka H., Malaisse F. & Robbrecht E., 2012. Étude ethnoptéridologique, évaluation des risques d’extinction et stratégies de conservation aux alentours du Parc national de Kahuzi Biega (RD Congo). Revue internationale de géologie, de géographie et d’écologie tropicales 36 : 137-158.
Marie-Victorin Frère, 1964. Flore laurentienne. Presses de l’Université de Montréal, 927 p.
Maroyi A., 2014. Not just minor wild edible forest products: consomptions of pteridophytes in sub-Saharan Africa. Journal of Ethnobiology and Ethnomedicine10 : 78-87.
Martin M.-A., 1969. Notes sur quelques végétaux utilisés au Cambodge. Journal d’agriculture tropicale et de botanique appliquée16 (2-5) : 112-157.
Martin M.-A., 1971. Introduction à l’ethnobotanique du Cambodge. CNRS, Paris, 257 p.
Martinez O.G., Assis F.C., Meza Torres E.I., Cacharani D.A. & Jaimez D.G., 2016. The genus Pecluma (Polypodiaceae) in Argentina. Darwiniana, n. s., 4 (2) : 234-251.
May L.W., 1978. The economic uses associated folklore of fern and fern allies. The Botanical Review 44 : 491-528.
Mérat F.V. & de Lens A.J., 1833. Dictionnaire universel de matière médicale. 5, O-Q, 656 p.
Murdock A.G. & Smith A.R., 2003, Pteridophytes of Moorea, French Polynesia, with a new species Tmesipteris gracilis (Psilotaceae). Pacific Science 57 : 253-265.
Murillo M., 1983. Usos de los helechos en Suramérica, con especial referencia a Colombia. Instituto de ciencias naturales, Museo de Historia Natural, Universidad Nacional de Colombia, Bogotá, D. C., 156 p.
Murillo-Pulido M.-T. & Harker-Useche M.-A.,1990. Helechos y plantas afines de Colombia. 169 p.
Nagai K. & Murai J., 1884. Descriptive catalogue of the exhibits sent by the Sanitary Bureau of the Japanese Home Department. International Health Exhibition, London, 136 p.
Norton H.H., 1981. Plant use in Kaigani Haida culture: correction of an ethnohistorical oversight. Economic Botany 35 : 434-449.
Ohwi J., 1965. Flora of Japan. F.G. Meyer & E.H Walker (eds), Smithsonian Institution, Washington, 1067 p.
Ojha R. & Devkota H.P., 2021. Edible and Medicinal Pteridophytes of Nepal: a review. Ethnobotany Research and Applications 22 (16) : 1-16.
Oyeyemi S.D., Adebiyi A.O. & Ojo V.I., 2019. Phytochemical and nutritional evaluation of Nephrolepis cordifolia (L.) C. Presl, a tropical edible fern. East African Scholars Journal of Biotechnology and Genetics 1 (4) : 91-98.
Pacheco L. & Bautista L., 2001. Son los helechos una alternativa en la alimentación? Contactos 42 : 5-10.
Perrie L. & Brownsey P.J., 2003. Evidence for an allopolyploid complex in New Zealand Polystichum (Dryopteridaceae). New Zealand Journal of Botany 41 (2) : 189-215.
Phạm Hoàng Hộ, 1999. Cây cỏ Việt Nam » (An illustrated flora of Vietnam), 1 : 1008 p., 2 :953 p., 3 : 1020 p.
Pham T.K.T., Lê P.C. & Nguyen T.K.Y., 2013. Biodiversity indices and utilization of edible wild plants: a case study of the Cham Island in Quang Nam Province, Vietnam. Journal of Research in Environmental Science and Toxicology 2 (9) : 167-174.
Plantefol L., 1931. Cours de botanique et de biologie végétale, 1. Librairie classique Eugène Belin, Paris, 596 p.
Popier A., 1988. La vie cachée des Fougères. Bulletin de la Société linnéenne de Lyon 57 (9) : 283-285.
Potts T.H., 1882 (1976). Out of the Open. Capper Press, Christchurch, 301 p.
Poudel R.C. & Joshi B.K., 2021. Vegetable genepools in Nepal: an update on semi-domesticated, wild and wild relatives awaiting conservation and sustainable uilization. In Comprehensive Insights in Vegetables of Nepal, S.L. Shyaula, G.B. Bajracharya, K.C. Gopal, S.M.Shakya & D.Subba (editors) : 75-121.
Prathibhani H.M. & Kumarihami C., 2022. Are Ferns edible? The Story of Two Diplazium Species in Sri Lanka. Biome 1, Agroecology Report : 102-105.
Prelli R. & Boudrie M., 2021. Les Fougères et plantes alliées d’Europe. Biotope, Mèze, 527 p.
Rai P.K., 2008. Phytoremediation of Hg and Cd from industrial effluents using an aquatic free floating macrophyte Azolla pinnata. International Journal of Phytoremediation 10 (5) : 430-439.
Revedin A., Aranguren B., Becattini R., Longo L., Mardoni E., Mariotti-Lippi M., Skakun N., Sinitsyn A., Spiridova E. & Svoboda J., 2010. Thirty thousand-year-old evidence of plant food processing. PNAS 107 (44) : 18815-18819.
Rollet B., 1975. Les utilisations de la mangrove. Journal d’agronomie tropicale et de botanique appliquée 22 (7-9) : 203-235.
Roy S. & Chaudhuri T.K., 2020. A comprehensive review on the pharmacological properties of Diplazium esculentum, an edible fern. Journal of Pharmaceutics and Pharmacology Research 3 (2) : 1-9.
Schofield J.J., 2003. Discovering Wild Plants, Alaska, W. Canada and the Northwest. Alaska Northwest Books, 358 p.
Tanaka Y. & Nguyen Van Ke, 2007 (2013). Edible Wild Plants of Vietnam: the Bountiful Garden. Orchid Press, Thaïlande, 175 p.
Taylor B.W., 1955. The flora, vegetation and soils of Macquarie Island. Australian National Antarctic Expeditions Report, B, 2 : botany, 192 p.
Taylor N., Taylor E. & Krings M., 2009. The Biology and Evolution of Fossil Plants. Academic Press, Elsevier,1230 p.
Teixeira G., Maciel S. & Pietrobom M.R., 2015. Potencial utilitário de licófitas e samambaias: aplicabilidade ao contexto amazônico. Biotaamazonia 5 (1) : 68-73.
Testard de Marans A., 2004. Souvenirs des îles Marquises 1887-1888. Étude sur le groupe Sud-Est de l’archipel. Société des océanistes, Paris, 212 p.
Thapa L.B, Dhakal T.M. & Chaudhary R., 2014. Wild edible plants used by endangered and indigenous Raji Tribe in Western Nepal. International Journal of Applied Sciences and Biotechnology 2 (3) : 243-252.
Thomson J.A, 2000. Morphological and genomic diversity in the genus Pteridium (Dennstaedtiaceae). Annals of Botany 85 (supp. B) : 77-99.
Toffin G. & Wiart J., 1985. Recherches sur l’ethnobotanique des Tamang du massif du Ganesh Himal (Népal central) : les plantes non cultivées. Journal d’agronomie tropicale et de botanique appliquée XXXII : 127-175.
Tổng Cục Hậu Cần & Cục Quân Nhu, 2007. Một số rau dại ăn được ở Việt Nam (Quelques végétaux sauvages comestibles au Viêtnam). 308 p.
Toupal S (dir.)., 2006. An ethnobotany of Indiana Dunes National Lakeshore: a baseline study emphasizing plant relationships of the Miami and Potawatomi peoples. Final Report 1.
Turner N.J., Johnson-Gottesfeld L.M., Kuhnlein H.V. & Ceska A., 1992. Edible Wood Fern Rootstocks of Western North America: Solving an Ethnobotanical Puzzle. Journal of Ethnobiology 12 (1) : 1-34.
Vaga E., 1975. Où, quand, comment cueillir les plantes médicinales. Éd. de Vecchi, 113 p.
Van Der Burg W.J., 2015. Pteridium aquilinum (L.) Kuhn, Fiche de Protobase, https://uses.plantnet-project.org/fr/Pteridium aquilinum (PROTA 2015) consulté le 22-5-2023.
Vidal J., 1959. Les plantes utiles du Laos. Journal d’agriculture tropicale et de botanique appliquée 6 (8-9) : 391-404.
Vidal J., 1967. Notes ethnobotaniques abrégées sur quelques plantes du Cambodge. Journal d’agriculture tropicale et de botanique appliquée 14 (1-3) : 21-66.
Vieillard E. & Deplanche É., 1862 et 1863 (2005). Essais sur la Nouvelle-Calédonie, Paris, Revue maritime et coloniale 6-7 (republié en fac-similé en 2005), L’Harmattan, Paris.
Violet E., 1946. En Mâconnais, les joies et les peines des gens de la terre. Buguet-Comptour, Mâcon, 132 p.
Võ Văn Chi, 1997.Từ điển cây thuốc Việt Nam (Dictionnaire des plantes médicinales vietnamiennes). Édition Nhà xuất bản Y học, Ho Chi Minh Ville, 1 468 p.Vol C.E. (de), 1957. The geographic distribution of Ceratopteris pteridoides. American Fern Journal 47 (2) : 67-72.
Yujing Liu, Wujisguleng Wujisguleng & Chunlin Long, 2012. Food uses of ferns in China: a review. Acta Societatis Botanicorum Poloniae 81 (4) : 263-270, https://www.academia.edu/11535666/Food_uses_of_ferns_in_China_a_review.
Zhang Y.M., 2007. A preliminary investigation of the history of pteridophyte eating in China. Journal of Southwest Agricultural University (Social Science Edition) 5 (4) : 103-106.
Remerciements
Nous remercions M. Michel Boudrie (ptéridologue) qui a bien voulu revoir la totalité du manuscrit ; son apport conséquent sur la taxonomie des fougères et sur l’exactitude botanique des illustrations ont grandement amélioré la qualité de ce travail. Nous remercions également M. Bruno de Foucault et les membres du comité de rédaction pour le suivi de cette étude et de sa production. Nous remercions nos collègues canadiens, thaïlandais, vietnamiens et français qui nous ont aidés dans la collecte des informations : Jacques Aubinel, ethnologue américaniste (Musée de l’Homme, Paris) ; Prasit Auetrakulvit, archéozoologie (Silpakorn University, Bangkok, Thaïlande) ; Aline Barbier, palynologue (lycée Jacques-Amyot, Auxerre) ; Marc Bottin, botaniste (Faculté des sciences, Nice) ; Laurent Bouby, carpologue (CNRS, Montpellier) ; Pierre Corbeil, préhistorien (recherches amérindiennes au Québec, Université de Montréal, Canada) ; Dinh Trong Hieu, ethnobotaniste (CNRS, Paris) ; Laure Emperaire, ethnobotaniste américaniste (IRD-MNHN, Paris) ; Cristina Gastaldi, mélissopalynologue (ANSES, Sophia-Antipolis) ; Brian Hayden, ethno-archéologue (Simon Fraser University, Vancouver, Colombie-Britannique, Canada) ; Le Cong Kiet, botaniste (Université des Sciences de Ho Chi Minh-ville, Viêt-nam) ; Roland Mourer, archéologue (conservateur du département d’Asie, Musée Guimet de Lyon) ; Cécile Mourer, zoologue paléo-avifaune (CNRS, Lyon) ; Nguyen Thi Mai Huong, palynologue (Institut d’archéologie, Ha Noi, Viêt-nam) ; Catie et Michel Orliac, préhistorien et ethnobotaniste océanistes (MNHN et CNRS, Paris) ; Maurice Reille, palynologue (Université Saint-Jérôme, Marseille).