Miscellanées phytosociologiques VII : syntaxons nouveaux, validés ou complétés
Title
Phytosociological miscellanées VII: new, validated or completed syntaxa
Résumé
Ce septième numéro de Miscellanées phytosociologiques apporte de nouvelles données sur des végétations forestières et arbustives héliophiles, des végétations thérophytiques diverses (Cardaminetea hirsutae, Polygono-Poetea annuae, Sisymbrietea officinalis), des murs suintants et des microphorbiaies.
Abstract
This seventh issue of Miscellanées phytosociologiques provides new data on heliophilous forest and shrub vegetation, various therophytic vegetation (Cardaminetea hirsutae, Polygono-Poetea annuae, Sisymbrietea officinalis), weeping walls and microphorbia.
1. Les associations arborescentes et arbustives
Le Pyro spinosae-Paliuretum spinae-christi est un fourré franco-méditerranéen décrit par Kuhnholtz-Lordat en 1954 et étudié ultérieurement plus en détail par Dieleman (1970) ; ce dernier auteur l’a surtout étudié dans la région de Montpellier. Le 22 avril 2024, il a été observé aussi sur les rives du lac de Salagou ; ainsi, aux environs du village de Celles (N 43° 39’ 48,3’’, E 3° 20’ 11,9’’, 159 m d’altitude), il était composé de Pyrus spinosa, Paliurus spina-christi, Buxus sempervirens, Prunus mahaleb, Pistacia terebinthus, Juniperus oxycedrus subsp. o., Genista scorpius, Clematis flammula, Rhamnus alaternus subsp. a., Rh. saxatilis subsp. s., Phillyrea latifolia, Quercus ilex j, Fraxinus angustifolia subsp. a. j.
Élément emblématique de la ville de Marseille, la colline Notre-Dame de la Garde qui culmine à 149 m d’altitude offre une large vue sur la ville et ses extensions. En contrebas de la basilique (photo 1), un fourré largement dominé par Rhus coriaria (photo 2) occupe la pente exposée à l’ouest, il a donné lieu au relevé suivant :
N 43° 17’ 03,9’’, E 5° 22’ 12,7’’, 119 m, 80 %, 200 m², 21 mai 2024, 10 taxons
- Rhamno-Quercion cocciferae: Rhus coriaria 4, Medicago arborea (photo 3) 2, Euphorbia characias *c. 1, Viburnum tinus 1,
- autres taxons : Glebionis coronaria 2, Quercus ilex j +, Malva olbia +, Pinus halepensis j 1, Ailanthus altissima j +, Celtis australis j + ;
cette combinaison d’espèces est absente du Catalogue de Noble & Baret (2019) ; on peut l’interpréter comme association nouvelle sous le nom de Medicagini arboreae-Rhoetum coriariae ass. nov. hoc loco, typus nominis hoc loco : le relevé ci-dessus. Comme l’association évoquée dans le paragraphe précédent, il est proposé de l’inclure dans le Rhamno lycioidis-Quercion cocciferae Rivas Goday ex Rivas Mart. 1975 (de Foucault, 2021b). Avec la présence de Medicago arborea, cette association pourrait aussi être rapprochée du Medicagini arboreae-Malvion arboreae O. Bolòs & Vigo 1984 nom. mut. hoc loco (de Foucault, 2015a, sub Medicagini citrinae-Lavaterion arboreae), mais ici les taxons halophiles manquent.
Dans le même ordre d’idées, on peut aussi préciser que le Fico caricae-Sambucetum nigrae B. Foucault 2016, initialement décrit de l’Aude et observé aussi en Grèce continentale (de Foucault, 2022a), manque dans le Catalogue de Noble & Baret (2019), alors que cette association est représentée dans les Bouches-du-Rhône en Arles (voir de Foucault, 2016, relevé 25 du tableau 3).
Le Sorbo mougeotii-Lonicerion alpigenae défini en 2012 est une alliance invalide (art. 8) car validée par le Lonicero-Sorbetum chamaemespili Géhu & Géhu-Franck 1985 lui-même invalide selon l’article 3f (de Foucault, 2012a). On propose ici de valider l’association jurassienne sous le nom de Lonicero alpigenae-Sorbetum chamaemespili Géhu & Géhu-Franck ex ass. nov. hoc loco, typus nominis hoc loco : le même que celui choisi par les auteurs initiaux, soit le relevé 5 du tableau 2 in Géhu & Géhu-Franck (1985, Lazaroa 7 : 29), de sorte que l’alliance peut être validée ici sous le nom de Sorbo mougeotii-Lonicerion alpigenae B. Foucault ex B. Foucault all. nov. hoc loco, rassemblant des fourrés de substrats acidiclines à basiques de l’étage montagnard supérieur, liés à des forêts caducifoliées (hêtraies, érablières) ou mixtes caducifoliées/résineuses (hêtraies-sapinières-pessières), notamment caractérisés par Lonicera alpigena, L. xylosteum, Ribes alpinum, Laburnum alpinum, Sorbus mougeotii, S. aria, Acer pseudoplatanus, Abies alba, Fagus sylvatica, typus nominis hoc loco : le Lonicero alpigenae-Sorbetum chamaemespili Géhu & Géhu-Franck ex hoc loco.
Le Searsio tripartitae-Oleetum laperrinei (Quézel 1965) B. Foucault ex B. Foucault 2020 est un fourré steppique saharien qui avait été reconnu antérieurement à 2020 mais de façon invalide par Boucheneb & Bouhouhou (2012).
Dans le même ordre d’idées, dans sa monographie sur le Tibesti, Quézel (1958) décrit une « association à Tamarix brachystylis et Desmostachya bipinnata » qui s’avère un complexe d’une prairie haute à Desmostachya bipinnata, pouvant être rattachée au Tripidio ravennae-Desmostachyetum bipinnatae (Quézel 1965) B. Foucault 2020, et d’une association arbustive à Tamarix gallica (6 relevés sur 7, incl. T. brachystylis) : Alhagi maurorum (6), Vachellia nilotica subsp. adstringens (3), soit l’Alhagi maurorum-Tamaricetum gallicae (Quézel 1958) ass. nov. hoc loco, typus nominis hoc loco : composante ligneuse du relevé 2 du tableau 5 in Quézel (1958, Mém. Inst. Rech. Sahariennes 4 : 215). Des mêmes régions, dans ses tableaux 6, 7, 14 et 17, le même auteur évoque des boisements steppiques que l’on peut ainsi synthétiser (sur 30 relevés) : Vachellia flava IV, V. tortilis subsp. raddiana III, Capparis decidua II, Maerua crassifolia I, Balanites aegyptiaca I, Boscia senegalensis I, soit le Vachellietum raddiano-flavae (Quézel 1958) ass. nov. hoc loco, typus nominis hoc loco : composante ligneuse du relevé 4 du tableau 7 in Quézel (1958, Mém. Inst. Rech. Sahariennes 4 : 230).
2. Les sous-bois herbacés méditerranéens
Dans une large synthèse de 2020 consacrée à la végétation forestière européenne, ouest-asiatique et nord-africaine (de Foucault, 2020), on a notamment été amené à opposer à la végétation des sous-bois herbacés tempérés, rattachée aux Anemono nemorosae-Caricetea sylvaticae Gillet ex Gillet & B. Foucault in B. Foucault 2020, celle des sous-bois herbacés méditerranéens rattachée aux Rubio peregrinae-Asplenietea onopteridis B. Foucault 2020. Cette dernière classe ne présente jusqu’à présent qu’un ordre, les Rubio peregrinae-Asplenietalia onopteridis B. Foucault 2020, et quatre alliances. Le tableau synthétique 1 reprend le tableau H26 de la synthèse de 2020, avec les syntaxons codés de CAo1 à CAo16, puis CyAo1a à CyAo3, CAa et CTs, en y ajoutant maintenant CAo17 (de Foucault, 2023, tableau 1, de Montagne Noire), puis CAo18 de Majorque (de Bolòs & Molinier, 1958, tableau 1), CAo19 de Minorque (de Bolòs et al., 1970, tableau 1) et CAo20 aussi de Minorque (de Bolòs et al., 1970, tableau 5).
Les associations bien définies sont l’Avenello flexuosae-Asplenietum onopteridis (Braun-Blanq. 1936) B. Foucault 2020 (colonne CAo1), l’Orchido provincialis-Asplenietum onopteridis (R.J. Loisel 1976) B. Foucault 2020 (CAo3), le Cephalanthero rubrae-Ruscetum aculeati (Barbero & R.J. Loisel 1983) B. Foucault 2020 (CAo6), le Carici olbiensis-Arisaretum vulgaris (Barbero & R.J. Loisel 1983) B. Foucault 2020 (CAo8), le Carici distachyae-Ruscetum aculeati (Braun-Blanq. 1936) B. Foucault 2020 (CAo10), le Cephalanthero rubrae-Rubietum peregrinae B. Foucault 2023 (CAo17). Le CAo15 peut être décrit sous le nom de Helianthemo origanifolii-Caricetum distachyae (Roselló 1994) ass. nov. hoc loco, typus nominis hoc loco : composante hémicryptophyto-géophytique du relevé 1 du tableau 91 in Roselló (1994, Catálogo florístico y vegetación… : 557-558), en remplaçant Helianthemum molle par H. origanifolium subsp. o. ; la colonne CAo16 peut alors se réduire à une variation de cette association d’Espagne orientale (nord-ouest de Valencia). Dans l’ensemble des trois syntaxons des Baléares, avec 23 relevés, on peut au moins distinguer la colonne CAo18 comme Rubio longifoliae-Ruscetum aculeati ass. nov. hoc loco, typus nominis hoc loco : composante hémicryptophyto-géophytique du relevé 17 du tableau 1 in de Bolòs & Molinier (1958, Collect. Bot. (Barcelona) V (III) hors texte).
Alors que les syntaxons CAo1 à CAo17, plutôt ibériques et franco-méditerranéens, sont rattachés au Carici distachyae-Asplenion onopteridis B. Foucault 2020 et aux Rubio peregrinae-Asplenietalia onopteridis, les syntaxons CyAo1a à CTs (plus l’extrême colonne à droite notée ? non encore interprétée) sont plutôt décrits de Corse et d’Italie, se répartissant entre
- le Cyclamini repandi-Asplenion onopteridis Foucault 2020 de Corse (CyAo1a à CyAo3), avec le Galio scabri-Asplenietum onopteridis B. Foucault 2020 et le Cyclamini repandi-Asplenietum onopteridis (Gamisans 1986) B. Foucault 2020,
- le Cyclamini repandi-Anemonion apenninae Foucault 2020 (CAa), avec le Klaseo cichoraceae-Ruscetum aculeati (Di Pietro, Azzella & Facioni 2010) B. Foucault 2020,
- le Carici olbiensis-Teucrion siculi Foucault 2020 (CTs), avec le Teucrio siculi-Caricetum olbiensis (Di Pietro, Azzella & Facioni 2010) B. Foucault 2020.
Les syntaxons CAo18 à CAo20, des Baléares, s’isolent assez bien, étant différenciés par Rubia peregrina subsp. longifolia, Arisarum vulgare, Asphodelus ramosus subsp. r., Asperula laevigata, Cyclamen balearicum, pour définir le Cyclamini balearici-Ruscion aculeati all. nov. hoc loco, typus nominis hoc loco : le Rubio longifoliae-Ruscetum aculeati nov.
Dans le tableau 1, une césure majeure passe entre les colonnes CAo20 et CyAo1a, ce qui permet de définir un ordre nouveau pour la partie droite, caractérisé ou différencié de l’ordre précédent essentiellement par Cyclamen repandum, Dioscorea communis et Potentilla micrantha, ainsi qu’un manque de certains taxons caractérisant les Rubio-Asplenietalia : Cyclamini repandi-Asplenietalia onopteridis ord. nov. hoc loco, typus nominis hoc loco : le Cyclamini repandi-Asplenion onopteridis B. Foucault 2020 (Evaxiana 7 : 101).
Ajoutons à toutes ces données que cette classe est reconnaissable dans les données de Braun-Blanquet & Maire (1924 : 119-120) provenant d’une chênaie verte marocaine vers 1 600 m d’altitude (C. distachya, A. onopteris, Rubia peregrina, Viola alba subsp. dehnhardtii, Cephalanthera rubra, Ruscus aculeatus) en lien avec un ourlet thérophytique (p. 121) à Rhagadiolus edulis, Geranium lucidum.
3. Un pré halophile montagnard
Le Spergulario mediae-Puccinellietum distantis est un pré de salines intérieures décrit de la Fontaine Salée dans les Corbières audoises, vers 640 m d’altitude (de Foucault, 2018c, sub Spergulo mediae-Puccinellietum distantis). Sous le nom de Spergulario salinae-Puccinellietum distantis (Feekes 1936) Vlieger 1937, Abdulhak et Sanz (2012 : 157) évoquent un pré halophile de la basse vallée du Guil, vers 1 000 m d’altitude ; la Spergulaire citée dans leur liste étant bien S. media, non S. salina (= S. marina), il est probable qu’il faille rattacher cette association à celle des Corbières.
4. Quelques végétations thérophytiques
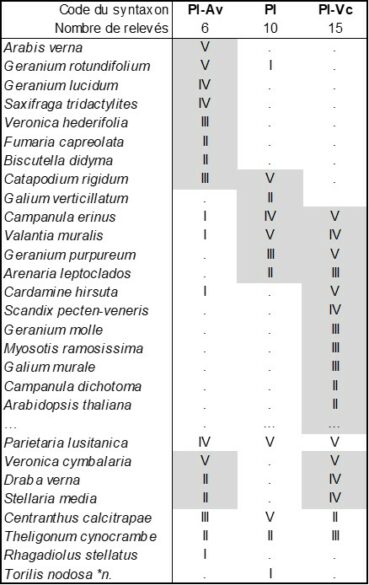
En considérant de près les données phytosociologiques apportées par de Litardière (1928), on reconnaît un ourlet thérophytique vernal dans la « sous-association à Ruta divaricata et Brassica oleracea subsp. insularis », les deux taxons éponymes étant actuellement nommés respectivement R. corsica et B. insularis, correspondant à la liste synsystématique de la colonne Pl-Av du tableau 2 (d’après la composante thérophytique des relevés 1 à 5 du tableau p. 124-126 et celle de la liste p. 128, soit sur six relevés-liste empruntés à de Litardière ; nomenclature actualisée). Cet ourlet étudié par l’auteur entre 290 et 450 m d’altitude relève clairement du Valantio muralis-Galion muralis Brullo in Brullo & Marcenò 1985 dans la classe des Cardaminetea hirsutae Géhu 2000 (de Foucault, 2009), Parietaria lusitanica apparaissant autant dans cette alliance que dans le Parietarion lusitanico-mauritanicae Rivas Mart. et al. 2001 ibérique. Deux associations peuvent en être rapprochées, le Parietarietum lusitanicae Sutter 1973 de France méditerranéenne continentale (Sutter, 1973, tableau 2 ; Pl dans le tableau 2 ; si l’auteur indique ass. nov. prov. dans le titre de l’article, rien dans le texte n’indique ce statut provisoire) et le Parietario lusitanicae-Veronicetum cymbalariae Brullo in Brullo & Marcenò 1985 de Sicile (Brullo & Marcenò, 1985 ; Pl-Vc). Ces trois syntaxons révèlent une forte parenté, mais ne semblent guère pouvoir se réduire les uns aux autres. En particulier le syntaxon corse Pl-Av est assez original et peut être décrit sous le nom de Parietario lusitanicae-Arabidetum vernae ass. nov. hoc loco, typus nominis hoc loco : composante thérophytique du relevé 2 du tableau in de Litardière (1928, Arch. Bot. II, mémoire 4 : 124-126).
Au sein des Polygono-Poetea annuae, le Trago racemosi-Euphorbietum prostratae a été décrit de l’Aude (de Foucault, 2018a, 2021a) ; on peut maintenant l’étendre à l’Hérault comme le montre le relevé suivant :
Montpellier (34), ballast du tram de la ligne 1 entre la station Malbosc – Domaine d’Ô et le rond-point de l’Appel-du-18-Juin-1944, N 43° 38’ 09’’, E 3° 49’ 54,7’’, 72 m, 05 septembre 2024, 30 %, 10 m², 6 taxons, photo 4
Tragus racemosus 3, Euphorbia prostrata 2, Portulaca oleracea 2, Eragrostis sp. 2, Setaria italica 1, Eleusine indica +, Plantago coronopus *c. + ;
il a aussi été observé à la station voisine Euromédecine, sans toutefois avoir fait l’objet d’un relevé.
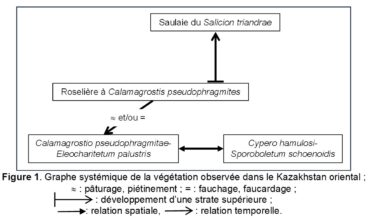
Dans une publication récente sur une végétation thérophytique hygrophile du Kazakhstan oriental, Taran (2024) a décrit le Marisco hamulosi-Crypsietum schoenoidis, qui devrait être muté en Cypero hamulosi-Sporoboletum schoenoides nom. mut. hoc loco. La composante vivace n’y est guère évoquée : il s’agit d’une communauté (nombre d’occurrences sur les relevés 1 à 12 du tableau 1 de l’auteur) à Alisma gramineum 9, Plantago major *intermedia 9, Eleocharis palustris 9, Calamagrostis pseudophragmites 8, Alisma plantago-aquatica 7, Bolboschoenus maritimus 6, Gratiola officinalis 5, Pentanema britannica 5, Veronica anagallis-aquatica 4, Typha angustifolia 3, Agrostis stolonifera 3, Sagittaria trifolia 3, Mentha arvensis 3, Marsilea minuta 2, Lythrum virgatum 2. Il s’agit manifestement d’une prairie vivace inondable eutrophile à affinités centre-asiatiques des Deschampsietalia cespitosae Horvatić 1958 semblant dériver d’une roselière à Calamagrostis pseudophragmites, Alisma plantago-aquatica, Bolboschoenus maritimus, Typha angustifolia, Sagittaria trifolia, en lien avec une saulaie arbustive alluviale du Salicion triandrae T. Müll. & Görs 1958, prairie que l’on retrouve au sein des relevés 13 et 14 du même tableau et que l’on peut décrire sous le nom de Calamagrostio pseudophragmitae-Eleocharitetum palustris Taran & B. Foucault ass. nov. hoc loco, typus nominis hoc loco : composante vivace du relevé 11 du tableau 1 in Taran (2024, Vestnik of Orenburg State Pedagogical University, Electronic Scientific Journal 3 (51) : 57-58). La figure 1 représente le graphe systémique (suivant Gillet et al., 1991) de la végétation de cette petite vallée, tout à fait isomorphe à ceux que l’on peut décrire dans d’autres régions (de Foucault, 1984, 2012 : figure 1).
L’alliance du Chenopodion muralis Braun-Blanq. 1936, muté en Chenopodiastrion muralis nom. mut. hoc loco, qui rassemble des communautés thérophytiques nitrophiles au sein des Sisymbrietea officinalis Korneck 1974 (de Foucault, 2012b), paraît représentée au Tibesti par une association à Zaleya pentandra [syn. : Trianthema pentandrum, Aizoaceae], dont Quézel (1958, tableau 22) rapporte deux relevés effectuées sur la chaîne de l’Emi Koussi, à 2 000-2 600 m d’altitude, au niveau des reposoirs de troupeaux, qui peut être validée en Amarantho graecizantis-Zaleyetum pentandrae Quézel & B. Foucault ass. nov. hoc loco, typus nominis hoc loco : relevé 2 du tableau 22 in Quézel (1958, Mém. Inst. Rech. Sahariennes 4 : 276).
5. La végétation de murs suintants ombragés
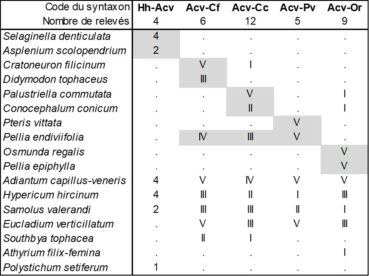
En considérant à nouveau de près les données phytosociologiques apportées par de Litardière (1928 : 135-136), on reconnaît aussi une végétation à Adiantum capillus-veneris et Hypericum hircinum décrite sur la base de quatre relevés réalisés en Corse orientale entre 380 et 640 m d’altitude synthétisés dans la colonne Hh-Acv du tableau 3 et comparés avec quatre autres associations à Adiantum capillus-veneris et Hypericum hircinum décrites par Brullo et al. (1989), les Adianto capilli-veneris-Cratoneuretum filicini, Adianto capilli-veneris-Cratoneuretum commutati, Adianto capilli-veneris-Pteridetum vittatae et Adianto capilli-veneris-Osmundetum regalis (respectivement colonnes Acv-Cf, Acv-Cc, Acv-Pv et Acv-Or du tableau 3 ; Brullo et al., 1989 ; de Foucault, 2015b, tableau 1 : colonnes 17 à 20). Si l’on considère que les bryophytes forment des communautés indépendantes des végétaux vasculaires (position défendue par de Foucault, 2015b), les Adianto capilli-veneris-Cratoneuretum filicini et Adianto capilli-veneris-Cratoneuretum commutati seraient à revoir et probablement à intégrer dans le Samolo valerandi-Adiantetum capilli-veneris Julve ex B. Foucault 2015. Quoi qu’il en soit, la colonne Hh-Acv du même tableau ne peut se réduire aux quatre déjà décrites. On peut la définir ici comme Hyperico hircini–Adiantetum capilli-veneris ass. nov. hoc loco, typus nominis hoc loco : relevé 4 du tableau in de Litardière (1928, Arch. Bot. II, mémoire 4 : 135-136). Cette association semble correspondre à celle évoquée par Royer (2014 : 209), avec en plus Solenopsis corsica. Ajoutons que, avec Polystichum setiferum et Asplenium scolopendrium, le relevé 1 de de Litardière montre aussi des liens avec le Polysticho setiferi-Asplenion scolopendrii Ubaldi ex Ubaldi & Biondi in Biondi et al. 2014 (de Foucault, 2015b).
Non loin de ce type de végétation, on peut encore évoquer celle, thérophytique, à Centaurium flexuosa (Gentianaceae), taxon non revu depuis sa découverte en 1940 par Th. Monod et sa description en 1943 par R. Maire sous le nom de Monodiella flexuosa (photo 5), récolté dans un suintement de l’Aïn Gongom au Tibesti septentrional (nord du Tchad), associé à Centaurium pulchellum, Blackstonia grandiflora, Schenkia spicata (Médail & Quézel, 2018 : annexe 4), bien que ces trois derniers taxons ne sont pas présents, ou du moins actuellement connus, dans cette partie de l’Afrique tropicale (https://africanplantdatabase.ch/ [01.09.2024]). Cette association de taxons montre des affinités avec l’alliance du Centaurio pulchelli-Blackstonion perfoliatae B. Foucault 1988.
6. Les mégaphorbiaies
Initialement décrit de la France méditerranéenne (de Foucault, 2011), le Senecioni doriae-Cirsietum monspessulani atteint aussi le Queyras, dans la vallée du Guil (Abdulhak & Sanz, 2012 : 111). Il en est de même de l’Epilobio hirsuti-Equisetetum telmateiae B. Foucault in Royer et al. 2006.
7. Une microphorbiaie cévenole
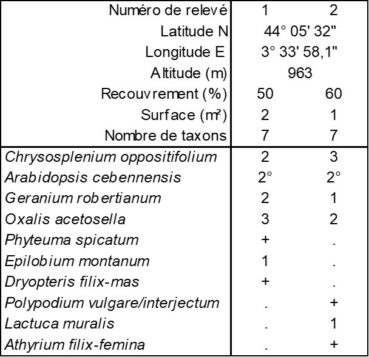
En présentant la synthèse des Filipendulo ulmariae-Convolvuletea sepium (de Foucault, 2011), à la suite d’une première note (de Foucault & Delpech, 1985), on a insisté sur la coexistence de ces mégaphorbiaies avec les microphorbiaies, les deux formations végétales possédant en commun des traits foliaires caractérisés par des limbes ou des divisions foliaires arrondis, ainsi que leur cantonnement dans des régions soumises à une hygrométrie plutôt moyenne à élevée et/ou sur des sols suffisamment humides, les deux ne se distinguant finalement que par la taille des végétaux et leur luxuriance. Sur le versant sud du mont Aigoual, à la source des Trois Fontaines (Val-d’Aigoual, route de l’Aigoual, D 986, vers 960 m d’altitude), au milieu d’un petit torrent, se développe effectivement une mégaphorbiaie caractérisée par Arabidopsis cebennensis dont le relevé a été remis à 2025, à une période phénologiquement plus optimale (il conviendra de la comparer à l’Arabidopsio cebennensis-Adenostyletum alliariae Braun-Blanq. ex Delpech & B. Foucault 1985, surtout développé au-dessus de 1 200 m ; Delpech & de Foucault, 1985 ; de Foucault & Corriol, 2013). Sur les deux berges de ce torrent, en situation moins inondée, on peut observer une microphorbiaie (photo 6) où Arabidopsis cebennensis existe mais sous une morphe plus réduite, moins luxuriante, dont le tableau 4 rapporte deux relevés très proches, mais distincts. Il s’agit sans doute d’un groupement du Caricion remotae, au sein des Montio fontanae-Cardaminetea amarae Braun-Blanq. & Tüxen ex Klika & Hadač 1944 (de Foucault, 2018b), probablement différent de celui décrit aussi sur la base de deux relevés par de Foucault & Delpech (1985, tableau 2), mais à une altitude supérieure (1 200-1 500 m) et avec Saxifraga rotundifolia, Chrysosplenium alternifolium, Micranthes stellaris…
Bibliographie
Abdulhak S. & Sanz Th., 2012. Guide des habitats humides du bassin du Guil. Conservatoire botanique national alpin, Gap, 171 p.
Bolòs O. (de) & Molinier R., 1958. Observations phytosociologiques dans l’île de Majorque. Collectanea Botanica (Barcelona) V (III) : 699-865.
Bolòs O. (de), Molinier R. & Montserrat P., 1970. Observations phytosociologiques dans l’île de Minorque. Acta Geobotanica Barcinonensia 5 : 1-150.
Boucheneb N. & Bouhouhou S.S., 2012. Plant communities in the Tamanrasset region, Ahaggar, Algeria. Ecologia Mediterranea 38 : 67-80.
Braun-Blanquet J. & Maire R., 1924. Études sur la végétation et la flore marocaines, 1re partie – Études sur la végétation du Maroc. Mémoires de la Société des sciences naturelles du Maroc 8 (1) : 5-152.
Brullo S. & Marcenò C., 1985. Contributo alla conoscenza della vegetazione nitrofila della Sicilia. Colloques phytosociologiques XII, Les végétations nitrophiles et anthropogènes : 23-146.
Brullo S., Lo Giudice R. & Privitera M., 1989. La classe Adiantetea in Sicilia. Archivio Botanico Italiano 65 (1-2) : 81-99.
Delpech R. & de Foucault B., 1985. Comparaisons entre quelques mégaphorbiaies des Alpes du Nord et du Massif central. Colloques phytosociologiques XII, séminaire Les mégaphorbiaies : 49-64.
Dieleman P., 1970. Le Pyreto-Paliuretum spinae-christi Kuhnholtz-Lordat 1954 aux environs de Montpellier. Proceedings Koninklijke Nederlandse Akademie van Wetenschappen, ser. C, 73 (3) : 254-270.
Foucault B. (de), 1984. Systémique, structuralisme et synsystématique des prairies hygrophiles des plaines atlantiques françaises. Thèse de doctorat d’État ès sciences naturelles, université de Rouen Haute-Normandie, 685 p. et annexes.
Foucault B. (de), 1988. Les végétations herbacées basses amphibies : systémique, structuralisme et synsystématique. Dissertationes Botanicae 121 : 1-150.
Foucault B. (de), 2009. Contribution au prodrome des végétations de France : les Cardaminetea hirsutae Géhu 1999. Journal de botanique de la Société botanique de France 48 : 49-70.
Foucault B. (de), 2011. Contribution au prodrome des végétations de France : les Filipendulo ulmariae – Convolvuletea sepium Géhu & Géhu-Franck 1987. Journal de botanique de la Société botanique de France 53 : 73-137.
Foucault B. (de), 2012a. Contribution au prodrome des végétations de France : les Betulo carpaticae – Alnetea viridis Rejmánek in Huml, Leps, Prach & Rejmánek 1979. Journal de botanique de la Société botanique de France 60 : 47-68.
Foucault B. (de), 2012b. Contribution au prodrome des végétations de France : les Sisymbrietea officinalis Korneck 1974. Journal de botanique de la Société botanique de France 58 : 55-116.
Foucault B. (de), 2015a. Contribution au prodrome des végétations de France : les Pegano harmalae – Salsoletea vermiculatae Braun‑Blanq. et O. Bolòs 1958. Journal de botanique de la Société botanique de France 72 : 41-60.
Foucault B. (de), 2015b. Contribution au prodrome des végétations de France : les Adiantetea capilli-veneris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952. Acta Botanica Gallica: Botany Letters 162 (4) : 375-403.
Foucault B. (de), 2016. Quelques associations arbustives nouvelles pour la Malepère (Aude centrale). Bulletin de la Société botanique du Centre-Ouest, n. s., 46 : 244-260.
Foucault B. (de), 2018a. Errata et compléments à propos du Prodrome des végétations de France, cinquième note. Journal de botanique de la Société botanique de France 81 : 39-42.
Foucault B. (de), 2018b. Contribution au prodrome des végétations de France : les Montio fontanae – Cardaminetea amarae Braun-Blanq. & Tüxen ex Klika & Hadač 1944. Documents phytosociologiques, 3e série, 7 : 5-86.
Foucault B. (de), 2018c. La sortie phytosociologique du 28 mai 2017 à la Fontaine Salée et ses environs en forêt domaniale de l’Eau Salée (commune de Sougraigne). Bulletin de la Société d’études scientifiques de l’Aude CXVII : 189-196.
Foucault B. (de), 2020. Éloge du paradigme synusial : alternative à la classification phytosociologique de la végétation forestière européenne, ouest-asiatique et nord-africaine. Evaxiana 7 : 5-248.
Foucault B. (de), 2021a. Miscellanées phytosociologiques : syntaxons nouveaux, validés, complétés ou corrigés. Carnets botaniques 44 : 1-23, https://doi.org/10.34971/AKGG-T733.
Foucault B. (de), 2021b. Essai de synthèse phytosociologique sur les fourrés sempervirents méditerranéens. Carnets botaniques 51 : 1-42, https://doi.org/10.34971/D6BN-RG49.
Foucault B. (de), 2022a. Nouvelles considérations phytosociologiques sur la végétation de la Grèce. Carnets botaniques 109 : 1-27, https://doi.org/10.34971/Q6KD-W822.
Foucault B. (de), 2022b. Miscellanées phytosociologiques III : syntaxons nouveaux, validés, corrigés ou complétés. Carnets botaniques 112 : 1-23, https://doi.org/10.34971/6AX1-0K40.
Foucault B. (de), 2023. Nouvelles données sur la végétation du versant audois de la Montagne Noire. Carnets botaniques 160 : 1-30, https://doi.org/10.34971/HTCT-WD37.
Foucault B. (de) & Delpech R., 1985. Quelques données sur les « microphorbiaies » à Viola biflora de Haute-Maurienne. Colloques phytosociologiques XII, séminaire Les mégaphorbiaies : 67-73.
Foucault B. (de) & Catteau E., 2012. Contribution au prodrome des végétations de France : les Agrostietea stoloniferae Oberd. 1983. Journal de botanique de la Société botanique de France 59 : 5-131.
Foucault B. (de) & Corriol G., 2013. Contribution au prodrome des végétations de France : les Mulgedio alpini – Aconitetea variegati Hadač & Klika ex Klika 1948. Journal de botanique de la Société botanique de France 61 : 49-87.
Géhu J.-M. & Géhu-Franck J., 1985. Groupements arbustifs et mégaphorbiaies du haut Jura français, quelques aspects particuliers. Lazaroa 7 : 25-35.
Gillet F., de Foucault B. & Julve Ph., 1991. La phytosociologie synusiale intégrée : objets et concepts. Candollea 46 : 315-340.
Litardière R. (de), 1928. Contributions à l’étude phytosociologique de la Corse : les montagnes de la Corse orientale entre le Golo et le Tavignano. Archives de botanique II, mémoire 4, 184 p. et 10 planches.
Maire R. & Monod Th., 1950. Études sur la flore et la végétation du Tibesti. Mémoires de l’Institut français d’Afrique Noire 8 : 1-140 + annexes.
Médail F. & Quézel P., 2018. Biogéographie de la flore du Sahara, une biodiversité en situation extrême. Conservatoire et Jardin botaniques de la Ville de Genève et IRD éditions, Marseille, 366 p.
Noble V. & Baret J., 2019. Catalogue des végétations du département des Bouches-du-Rhône. Conservatoire botanique national méditerranéen de Porquerolles, 282 p.
Quézel P., 1958. La végétation du Borkou et du revers méridional du Tibesti. In P. Quézel, Mission botanique au Tibesti, Mémoires de l’Institut de recherches sahariennes 4 : 195-350.
Royer J.-M., 2014. Introduction à la session Corse 2013. Bulletin de la Société botanique du Centre-Ouest, n. s., 45 : 209-211.
Sutter R., 1973. Über Vorkommen und Verbreitung von Asplenium petrarchae (Guérin) DC. und die Assoziationen Phagnalo-Asplenietum petrarchae Br.-Bl. und Parietarietum lusitanicae ass. nov. prov. Botanische Jahrbücher für Systematik, Pflanzengeschichte und Pflanzengeographie 93 (4) : 568-602.
Taran G.S., 2024. Association Marisco hamulosi-Crypsietum schoenoidis (Isoëto-Nanojuncetea): new interpretation and comparison with European analogues. Vestnik of Orenburg State Pedagogical University, Electronic Scientific Journal 3 (51) : 53-74 (en russe, avec abstract), https://doi.org/10.32516/2303-9922.2024.51.4.
Remerciements
Merci à la Bibliothèque botanique et phytosociologique de France hébergée au Conservatoire botanique national de Bailleul pour la transmission de bibliographie.