Miscellanées phytosociologiques VI : syntaxons nouveaux ou complétés
Title
Phytosociological miscellanes VI: new or completed syntaxa
Résumé
Ce sixième numéro de Miscellanées phytosociologiques apporte de nouvelles données sur des végétations forestières et arbustives héliophiles, des prés oligotrophiles hygrophiles, des ourlets vivaces, des végétations rudérales, des prés halophiles, des mégaphorbiaies, des landes et des mares temporaires.
Abstract
This sixth issue of Miscellanées phytosociologiques provides new data on forest and heliophilous shrub vegetation, oligotrophic hygrophilous and halophitic meadows, perennial hems, ruderal vegetation, tall herb communities, heaths and temporary pools.
En 2008, puis 2018a, je présentais deux ensembles de validations de syntaxons invalides ou inédits. À la suite de six autres contributions (de Foucault, 2021a, b, 2022a, b, 2023a, c), le présent article rapporte divers syntaxons omis, complétés ou nouveaux ; il s’agit le plus souvent d’associations, regroupées par grands types : forêts, fourrés, prairies oligotrophiles et halophiles, pelouses thérophytiques, pelouses et ourlets vivaces, mégaphorbiaies, végétation rudérale, landes, mares temporaires. La méthode phytosociologique suit le paradigme synusial (de Foucault, 2020a). La nomenclature taxonomique suit Flora Gallica (Tison & de Foucault, 2014) pour les taxons présents en France, Euro+Med PlantBase et Catalogue of life (www.catalogueoflife.org) pour les autres taxons selon les cas. On a là l’occasion de publier aussi des relevés restés jusqu’à présent inédits.
Avant de présenter les données qui suivent, on va faire une correction consécutive à la mise en ligne de mon article sur la Corée du Sud (de Foucault, 2023b) : la photo 45, prise dans un espace vert en France, ne représente pas Cornus kousa, mais plutôt C. capitata, taxon himalayen absent de Corée, mais susceptible d’être planté dans notre pays. La corydale indéterminée de la photo 59 serait Corydalis turtschaninovii ; un grand merci à Flavien Saboureau d’avoir ainsi réagi à cet article (courriel du 14 octobre 2023).
1. La végétation forestière
1.1. Une forêt de ravin de Franche-Comté
Sous les noms de « Polysticho setiferi-Ulmetum glabrae » et « Phyllitido scolopendrii-Aceretum pseudoplatani dryopteridetosum borreri », Collaud (2010) a décrit des forêts de ravins à affinités subatlantiques, notamment caractérisées localement par Polystichum setiferum. L’analyse synusiale (de Foucault, 2020a) révèle en fait une association arborescente à rattacher à l’Aceri pseudoplatani-Tilietum platyphylli Gillet ex Gillet & B. Foucault 2020, une association arbustive intraforestière à rattacher à l’Ulmo glabrae-Ribesetum alpini B. Foucault 1999 décrit initialement du Jura (de Foucault, 1999 : 29) et une association à rattacher à l’Actaeo spicatae-Mercurialion perennis Gillet ex Gillet & B. Foucault 2020 par la présence de Cardamine heptaphylla, Polystichum aculeatum, Leucojum vernum, Lathyrus vernus (photo 1), toutefois dans une association originale justement marquée par Polystichum setiferum : Lathyro verni-Polystichetum setiferi ass. nov. hoc loco, typus nominis hoc loco : composante herbacée du relevé 10 du tableau III in Collaud (2010, Les Nouvelles Archives de la flore jurassienne et du nord-est de la France 8 : 102-103).
1.2. Les sapinières d’altitude des Alpes maritimes
Barbero et Bono (1970) ont décrit des sapinières d’altitude dans les Alpes maritimes, ce travail n’ayant pas été pris en compte dans une synthèse antérieure (de Foucault, 2020a), on va le reprendre ici à la lumière du paradigme synusial.
Entre 950 et 1 150 (voire 1 400) m, ils décrivent une sapinière à Ostrya carpinifolia (tableau 1 des auteurs), dont la composante arborescente est ainsi constituée (sur 12 relevés) : Abies alba V, Ostrya carpinifolia III, Tilia platyphyllos III, Laburnum alpinum III, Fagus sylvatica II, Acer pseudoplatanus II, A. platanoides II, A. opalus *o. II, A. campestre II, Quercus pubescens II, Prunus avium I, Pinus sylvestris I, Sorbus aucuparia *a. + ; malgré la présence d’O. carpinifolia, cette combinaison floristique renvoie plus à l’Aceri opali-Quercion pubescentis qu’à l’Ostryo carpinifoliae-Fraxinion orni (de Foucault 2020a, tableaux A2 et A4), plus précisément au groupe de syntaxons à Fagus sylvatica et Tilia platyphyllos. Cette association est nouvelle : Laburno alpini-Abietetum albae ass. nov. hoc loco, typus nominis hoc loco : composante arborescente (taxons soulignés dans le tableau des auteurs) du relevé 11 du tableau 1 in Barbero & Bono (1970, Veröff. Geobot. Inst. der ETH, Stiftung Rübel, in Zürich 43 hors texte). La composante arbustive est une corylaie peu caractérisée. La composante herbacée vivace se rapporte clairement au Veronico urticifoliae-Trochiscanthion nodiflori, se rapprochant de l’Anemono trifoliae-Trochiscanthetum nodiflori B. Foucault 2020.
Entre 1 450 et 2 000 m (tableaux 2 et 3 des auteurs), c’est plutôt une sapinière à Sorbus aucuparia (sur 39 relevés) : Abies alba V, Sorbus aucuparia *a. IV, Picea abies *a. III, Larix decidua *d. III, Laburnum alpinum III, Acer pseudoplatanus II, A. platanoides I, Fagus sylvatica +. Celle-ci relève nettement des Pino cembrae-Piceetea abietis (de Foucault, 2018), mais ne coïncide avec aucun des syntaxons connus inclus : Laburno alpini-Abietetum albae ass. nov. hoc loco, typus nominis hoc loco : composante arborescente (taxons soulignés dans le tableau des auteurs) du relevé 12 du tableau 3 in Barbero & Bono (1970, Veröff. Geobot. Inst. der ETH, Stiftung Rübel, in Zürich 43 hors texte). Selon les mêmes sources, la composante arbustive est mieux caractérisée que dans le cas précédent : Rosa pendulina IV, Rubus idaeus *i. III, Lonicera nigra II, L. alpigena (photo 2) II, L. caerulea *c. (photo 3) II, Pinus uncinata *mugo II, Clematis alpina (photo 4) II, Daphne mezereum II, Alnus alnobetula *a. II, Sambucus racemosa *r. II, Sorbus chamaemespilus +, Ribes alpinum +, Salix caprea r, Amelanchier ovalis *o. r ; cette liste correspond à une association originale du Sorbo mougeotii-Lonicerion alpigenae (de Foucault, 2012a) : Lonicero alpigenae-Rosetum pendulinae ass. nov. hoc loco, typus nominis hoc loco : composante arbustive du relevé 9 du tableau 3 in Barbero & Bono (1970, Veröff. Geobot. Inst. der ETH, Stiftung Rübel, in Zürich 43 hors texte). On ne discutera pas ici les synusies herbacées, à l’exception d’une synusie thérophytique dans certains des relevés du tableau 2, à Impatiens noli-tangere, Cardamine impatiens, Moehringia trinervia à rapprocher du Geranio robertiani-Impatientetum noli-tangere B. Foucault 2023 (de Foucault, 2023c).
1.3. Un sous-bois herbacé vernal de Montagne Noire
En validant le Scillion bifoliae (de Foucault, 2020a : 81, 82), on a décrit du versant audois de la Montagne Noire le Tractemo lilio-hyacinthi-Erythronietum dentis-canis B. Foucault 2020 ; le relevé suivant en offre un nouvel exemple :
Lacombe (11), col de Fangas Haut, N 43° 24’ 56’’, E 2° 14’ 49’’, 820 m, 20 mars 2024, 70 %, 20 m², 16 taxons (photo 5)
- combinaison caractéristique : Scilla bifolia 2, Narcissus pseudonarcissus *ps. 2, Ficaria verna *ficariiformis 2, Anemone nemorosa 2, Arum maculatum 2, Hedera helix 2, Lamium galeobdolon *montanum 2, Erythronium dens-canis 1, Euphorbia hyberna 1, Melica uniflora 1, Lactuca plumieri 1, Viola riviniana +, Stellaria holostea +,
- autres taxons : Urtica dioica *d. 1, Ilex aquifolium j 1, Rubus +,
avec absence ici du premier taxon éponyme d’association.
1.4. Une laurisylve de Sicile
Marino et al. (2014) ont étudié une laurisylve de ravines fraîches du nord de la Sicile, dont l’analyse détaillée permet de séparer (tableau 1 des auteurs, 12 relevés) :
- une végétation arborescente à Laurus nobilis V, Hedera helix V, Quercus ilex IV, pubescens (sub Q. virgiliana) IV, Salix pedicellata III, Ficus carica II, Vitis vinifera *sylvestris II, Sorbus domestica I, Salix alba +, soit le Salici pedicellatae-Lauretum nobilis ass. nov. hoc loco, typus nominis hoc loco: composante arborescente du relevé 3 du tableau 1 in Marino et al. (2014, Acta Bot. Gallica: Bot. Lett. 161 (1) : 51-52) ;
- une végétation arbustive à Rubia peregrina *p. V, Rubus ulmifolius V, Clematis vitalba V, Asparagus acutifolius IV, Smilax aspera IV, Phillyrea latifolia IV, Erica arborea III, Dioscorea communis III, Rosa sempervirens III, Euonymus europaeus III, Crataegus monogyna III, Arbutus unedo II, Rhamnus alaternus *a. II, Hypericum hircinum *majus II, Prunus spinosa II, Corylus avellana II, Calicotome intermedia I, Euphorbia characias s. l. I, Rosa canina I, Coronilla valentina I, Rhamnus lojaconoi +, Sambucus nigra +, Solanum dulcamara +, où plusieurs taxons caractérisant les Rhamno catharticae-Prunetea spinosae ( vitalba, E. europaeus…) pénètrent dans des fourrés des Pistacio lentisci-Rhamnetea alaterni, soit le Clematido vitalbae-Phillyreetum latifoliae ass. nov. hoc loco, typus nominis hoc loco: composante arbustive du relevé 2 du tableau 1 in Marino et al. (2014, Acta Bot. Gallica: Bot. Lett. 161 (1) : 51-52), sans doute à rattacher aux Cytiso villosi-Genistetalia monspessulanae Rivas Mart. et al. in Rivas Mart. et al. 2002 (présence de E. arborea, A. unedo) au sein de la seconde classe citée ;
- une végétation hémicryptophyto-chaméphytique à Polystichum setiferum V, Ruscus aculeatus V, Asplenium adiantum-nigrum ( onopteris?) V, Selaginella denticulata IV, Pteridium aquilinum IV, Bituminaria bituminosa IV, Acanthus mollis III, Clinopodium nepeta *n. III, Polypodium cambricum III, Cistus salviifolius III, Asplenium trichomanes *quadrivalens III, Lamium flexuosum III, Cyclamen hederifolium III, Daphne laureola III, Brachypodium sylvaticum III, Arum italicum III, Prunella vulgaris II, Hyoseris radiata II, Agrimonia eupatoria I, Teucrium scorodonia s. l. I, Carex distachya I, Clinopodium vulgare *orientale I, à rapprocher des Rubio peregrinae-Asplenietea onopteridis plutôt que des Anemono nemorosae-Caricetea sylvaticae, soit le Selaginello denticulatae-Polystichetum setiferi ass. nov. hoc loco, typus nominis hoc loco : composante hémicryptophyto-chaméphytique du relevé 3 du tableau 1 in Marino et al. (2014, Acta Bot. Gallica: Bot. Lett. 161 (1) : 51-52).
1.5. Des hêtraies de Grèce
Tant dans ma synthèse de 2020a que dans le compte rendu d’un voyage en Grèce publié en 2022, l’article de Bergmeier & Dimopoulos (2001) sur des forêts de Grèce avait été ignoré, on va l’analyser ici.
Le tableau 1 en précise les strates arborescentes considérées. Ainsi les colonnes 1 à 8 se rapportent à l’Abieti borisii-regis-Fagetum sylvaticae B. Foucault 2022, alors que la colonne 11, bien caractérisée, se rapproche beaucoup de l’Aceri obtusati-Fagetum sylvaticae B. Foucault 2022 (de Foucault, 2022c). Les colonnes 14 à 16 décrivent une forêt originale à Fagus orientalis, Quercus petraea et Sorbus torminalis, qui ne peut toutefois être validée. Dans leur tableau 8, Gamisans et Hébrard (1981) évoquent aussi une chênaie à Quercus frainetto et Castanea sativa qui peut être rapportée au Castaneo sativae-Quercetum frainetto B. Foucault 2022. Dans leur tableau 7, ces mêmes auteurs décrivent en revanche une chênaie assez différente : Quercus frainetto V (sur 16 relevés), Carpinus orientalis V, Fraxinus ornus V, Sorbus domestica IV, Quercus dalechampii III, Ostrya carpinifolia II, Sorbus torminalis II, Acer campestre II et des taxons de présence +, soit le Carpino orientalis-Quercetum frainetto ass. nov. hoc loco, typus nominis hoc loco : composante arborescente du relevé 7 du tableau 7 in Gamisans & Hébrard (1981, Doc. Phytosoc., n. s., V hors texte), qui est distinct du Carpino orientalis-Quercetum dalechampii B. Foucault 2022.
Le tableau 2 en précise les strates arbustives intraforestières synthétisées par Bergmeier & Dimopoulos. Elles sont faiblement caractérisées en dehors des colonnes 5 et 6, la plus significative étant cette dernière : ce Frangulo rupestris-Buxetum sempervirentis ass. nov. hoc loco peut être typifié par la composante arbustive du relevé 20 (typus nominis hoc loco) du tableau 1 in Habeck & Reif (1994, Phytocoenologia 22 : 512-514).
Le tableau 3 synthétise les strates herbacées intraforestières et fait apparaître quatre syntaxons de niveau alliance numérotés de I à IV que l’on va tenter de placer au sein des Anemono-Caricetea sylvaticae en s’appuyant sur le tableau H2 de la synthèse de 2020a, classe à laquelle ils se rattachent assez bien.
Tout d’abord, avec Athyrium filix-femina, Oxalis acetosella, Dryopteris dilatata, Urtica dioica, Lamium galeobdolon s. l., Milium effusum, Anemone nemorosa, Epilobium montanum…, le syntaxon I semble pouvoir se rattacher aux Oxalidetalia acetosellae B. Foucault 2020, mais se différencie bien des alliances déjà connues par Potentilla micrantha, Aremonia agrimonioides, Pulmonaria rubra, Symphytum ottomanum. Parmi les quatre syntaxons subordonnés à cette unité, on peut distinguer la colonne 1 sous le nom de Geranio versicoloris-Galietum odorati ass. nov. hoco loco, typus nominis hoc loco : composante herbacée vivace du relevé 3 du tableau in Quézel & Contandriopoulos (1965, Bull. Soc. Bot. France 112, entre p. 316 et p. 317). Cette association peut alors être le typus nominis hoc loco du Pulmonario rubrae-Galion odorati all. nov. hoc loco, alliance caractérisée ou différenciée des alliances voisines par Pulmonaria rubra, Scrophularia scopolii, Symphytum ottomanum, Potentilla micrantha, Aremonia agrimonioides…
Avec Lathyrus venetus, Cyclamen hederifolium et Aremonia agrimonioides, la colonne II peut se rattacher aux Cyclamini hederifolii-Lathyretalia veneti B. Foucault 2020, mais là encore dans une alliance distincte des trois déjà reconnues. Parmi les cinq syntaxons rapprochés dans cette unité, on peut distinguer la colonne 13 comme Lathyro laxiflori-Doronicetum orientalis ass. nov. hoco loco, typus nominis hoc loco : composante herbacée vivace du quatrième relevé (non numéroté) du tableau 22 in Barbero & Quézel (1976, Ecol. Medit. 2 : 60, en remplaçant Lathyrus inermis par L. laxiflorus et Doronicum caucasicum par D. orientale). Cette association peut alors être le typus nominis hoc loco du Lathyro laxiflori-Doronicion orientalis all. nov. hoc loco, alliance caractérisée ou différenciée des alliances voisines par Primula vulgaris, Festuca drymeja, Lathyrus alpestris, L. laxiflorus, Geocaryum capillifolium, Rubus canescens, Cota tinctoria s. l., Helleborus cyclophyllus, Trifolium pignantii, Doronicum orientale, Physospermum cornubiense…
Si les syntaxons III et IV relèvent encore des Anemono-Caricetea sylvaticae, ils ne rattachent guère aux ordres déjà décrits. Parmi les syntaxons élémentaires de la catégorie III, se distingue au moins la colonne 13 qui peut être décrite comme Festuco drymejae-Prenanthetum purpureae ass. nov. hoco loco, typus nominis hoc loco : composante herbacée vivace du relevé 49 du tableau 1 in Habeck & Reif (1994, Phytocoenologia 22 : 512-514).
En définitive, ces nouvelles unités s’intègrent ainsi au sein des Anemono-Caricetea sylvaticae :
Anemono nemorosae-Caricetea sylvaticae Gillet ex Gillet & B. Foucault in B. Foucault 2020
Oxalidetalia acetosellae B. Foucault 2020
Pulmonario rubrae-Galion odorati nov.
Cyclamini hederifolii-Lathyretalia veneti B. Foucault 2020
Lathyro laxiflori-Doronicion orientalis nov.
1.6. Des forêts de ravin du Pays basque espagnol
À la suite de Fernández Prieto & Vásquez (1987), Biurrun et al. (2011) ont étudié des forêts de ravin cantabriques sous le nom de « Helleboro occidentalis-Tilietum cordatae » [syn. : « Mercuriali perennis-Fraxinetum excelsioris Fern. Prieto & Vásquez 1987 nom. illeg.], dont la végétation arborescente peut s’intégrer dans l’Aceri platanoidis-Tilion platyphylli Julve ex B. Foucault & Gillet in B. Foucault 2020, alors que la végétation herbacée vivace s’intègre au Dioscoreo communis-Asplenion scolopendrii B. Foucault 2020 sous une association originale à Astrantia major (IV sur 13 relevés), Ranunculus montanus (III), Laserpitium latifolium (III), Carex caudata (II), Cruciata glabra (II), Erica vagans (II), Luzula sylvatica subsp. henriquesii (II)…, Astrantio majoris-Polystichetum setiferi ass. nov. hoc loco, typus nominis hoc loco : composante herbacée vivace du relevé 7 du tableau 5 in Fernández Prieto & Vásquez (1987, Lazaroa 7 : 378-379). À la suite de Vanden Berghen (1968), les mêmes auteurs décrivent l’« Hyperico androsaemi-Ulmetum glabrae Vanden Berghen 1968 », dont la végétation arborescente relève aussi de l’Aceri platanoidis-Tilion platyphylli alors que la végétation herbacée vivace est distincte de la précédente et non décrite : Hyperico androsaemi-Polystichetum setiferi ass. nov. hoc loco, typus nominis hoc loco : composante herbacée vivace du relevé 17 du tableau 1 in Biurrun et al. (2011, Actes del IX Col-loqui internacional de Botànica pirenaico-cantàbrica a Ordino, Andorra : 70-72).
1.7. Une forêt savanicole du Zaïre
Mandango et Kayumba (1996) ont étudié une forêt savanicole dans la région de Kinshasa au Zaïre. À partir des quinze relevés de leur tableau II, on peut distinguer (avec indication des présences > I, nomenclature des taxons corrigée et actualisée)
- la végétation arborescente, à Hymenocardia acida (dominant, Phyllanthaceae) V, Markhamia lutea (Bignoniaceae) IV, Albizia adianthifolia (Fabaceae) IV, Anthocleista schweinfurthii (Gentianaceae) III, Caloncoba welwitschii (Achariaceae) III, Baphia dewevrei (Fabaceae) III, Sclerocroton cornutus (Euphorbiaceae) III, Millettia drastica (Fabaceae) III, laurentii II, Pentaclethra eetveldeana (Fabaceae) II, soit le Markhamio luteae-Hymenocardietum acidae ass. nov. hoc loco, typus nominis hoc loco: composante arborescente (MgPh + MsPh) du relevé 2 du tableau II in Mandango & Kayumba (1996, Doc., Phytosoc., n. s., XVI : 258-263) ;
- la végétation arbustive, à Annona senegalensis (Annonaceae) V, Crossopteryx febrifuga (Rubiaceae) V, Smilax anceps (Smilacaceae) V, Landolpia lanceolata (Apocynaceae) V, Bridelia ferruginea (Phyllanthaceae) IV, Tetracera poggei (Dilleniaceae) IV, Maprounea africana (Euphorbiaceae) IV, Campylospermum lecomtei (Ochnaceae) IV, Strychnos spinosa (Loganiaceae) IV, pungens III, Baccharoides guineensis (Asteraceae) III, Cassytha filiformis (Lauraceae) III, Millettia macroura (Fabaceae) III, Vitex ferruginea (Lamiaceae) III, V. madiensis II, Pauridiantha callicarpoides (Rubiaceae) II, Dracaena nitens (Asparagaceae) II, Landolpia jumellei (Apocynaceae) II, Alchornea cordifolia (Euphorbiaceae) II, Cogniauxia podolaena (Cucurbitaceae) II, Ochna membranacea (Ochnaceae) II, soit le Landolphio lanceolatae-Crossopterygetum febrifugae ass. nov. hoc loco, typus nominis hoc loco: composante arborescente (McPh + NPh…) du relevé 1 du tableau II in Mandango & Kayumba (1996, Doc., Phytosoc., n. s., XVI : 258-263) ;
- la végétation herbacée vivace haute, à Aframomum alboviolaceum (Zingiberaceae) V, Anisophyllea quangensis (Anisophylleaceae) V, Chromolaena odorata (Asteraceae, plutôt vivace qu’annuel comme annoncé dans le tableau) V, Dichaetanthera corymbosa (Melastomataceae) IV, Hyparrhenia diplandra (Poaceae) III, Murdannia simplex (Commelinaceae) III, Tephrosia lupinifolia (Fabaceae) III, Melinis repens (Poaceae) III, Parinari capensis (Chrysobalanaceae) II, Pteridium aquilinum (Dennstaedtiaceae) II, soit l’Anisophylleo quangensis-Aframometum alboviolacei nov. hoc loco, typus nominis hoc loco: composante herbacée vivace du relevé 1 du tableau II in Mandango & Kayumba (1996, Doc., Phytosoc., n. s., XVI : 258-263) ;
- la végétation herbacée thérophytique, à Bulbostylis hispidula (Cyperaceae) III, Schwenckia americana (Solanaceae) III, Crassocephalum montuosum (Asteraceae) II, Indigofera capitata (Fabaceae) II, Oldenlandia affinis (Rubiaceae) II (sauf « Kotsbya brachiari» IV sans doute erroné ; il s’agit peut-être de Brachiaria kotschyanum maintenant appelé Urochloa comata, Poaceae), soit le Schwenckio americanae-Bulbostylidetum hispidulae nov. hoc loco, typus nominis hoc loco : composante herbacée annuelle (Th) du relevé 13 du tableau II in Mandango & Kayumba (1996, Doc., Phytosoc., n. s., XVI : 258-263).
Malgré la présence du second taxon éponyme d’association, l’Anisophylleo quangensis-Aframometum alboviolacei mésoxérophile a peu à voir avec les Megaphrynio macrostachyi-Palisotetea hirsutae plus hygrophiles (de Foucault, 2022b), mais plutôt avec les savanes zambésiennes des plateaux batékés du Congo (Schnell, 1976 : figure 102 p. 260, où les trois taxons cités sont présents dans la liste précédente, mais sous des noms anciens).
2. La végétation arbustive héliophile (voir § 1 pour des végétations arbustives sciaphiles)
On a récemment décrit de l’Aude le Junipero communis-Phillyreetum angustifoliae (de Foucault, 2023d), dont le tableau 4 rapporte cinq nouveaux relevés.
Annexe du tableau 4 – rel. 1 et 2 : Saint-Martin-le-Vieil (11), ‘Ficelle’, bord de la D 64, 13/07/2023 ; rel. 3 : Saint-Martin-le-Vieil (11), ‘Borde Neuve’, 13/07/2023 ; rel. 4 : Montolieu (11), route de Saint-Martin-le-Vieil, 13/07/2023 ; rel. 5 : id. rel. 1 et 2, 07/10/2014.
Du sud-ouest de la péninsule Ibérique, Vila-Viçosa et al. (2012) ont décrit le « Lavandulo viridis-Ericetum lusitanicae », qui s’avère en fait être un complexe (présences sur 11 relevés)
- d’un fourré à Erica lusitanica V (photo 6), Rubus ulmifolius V, Arbutus unedo III, Daphne gnidium III, Salix salviifolia III, Erica scoparia *s. II, Genista triacanthos II, Lonicera periclymenum *hispanica II, implexa II, Rosa canina II, R. pouzinii II, Rubia peregrina *longifolia II, Cistus populifolius II, Nerium oleander II, Viburnum tinus II, Myrtus communis II et des taxons de présence au plus I, qui peut être défini comme Salici salviifoliae-Ericetum lusitanicae ass. nov. hoc loco, typus nominis hoc loco : composante arbustive du relevé 12 (ou ordinal 7) du tableau 1 in Vila-Viçosa et al. (2012, Acta Bot. Gallica: Bot. Letters 159 (2) : 278), à rattacher aux Cytiso villosi-Genistetalia monspessulanae Rivas Mart. et al. in Rivas Mart. et al. 2002 ;
- et d’une lande à Lavandula viridis IV, Cistus salviifolius III, Ulex minor II, Lavandula ×alportelensis (L. stoechas × viridis) II, Calluna vulgaris +, le Cisto salviifolii-Lavanduletum viridis ass. nov. hoc loco, typus nominis hoc loco : composante hémicryptophyto-chaméphytique du relevé 8 (ou ordinal 10) du tableau 1 in Vila-Viçosa et al. (2012, Acta Bot. Gallica: Bot. Letters 159 (2) : 278), à placer dans les Cisto-Lavanduletea stoechadis plutôt que dans les Calluno-Ulicetea minoris.
Le Rubo idaei-Cytisetum oromediterranei a initialement été décrit des Cévennes (de Foucault, 2017), puis revu dans la montagne ardéchoise (de Foucault, 2021a). Le relevé suivant provient de l’Auvergne des volcans :
Chambon-sur-Lac (63), vallée de Chaudefour, sous la Crête de Coq, N 45° 31’ 56,3’’, E 2° 50’ 21,9’’, 1 240 m, 27/06/2023, 100 %, 30 m², 8 taxons
- combinaison caractéristique : Cytisus oromediterraneus 4, scoparius *s. 2, Rubus idaeus *i. 2, Sambucus racemosa *r. 2, Orobanche rapum-genistae +,
- autres taxons : Fagus sylvatica j 2, Sorbus aria j 1, aucuparia *a. j 1.
3. La végétation des prés oligotrophiles plus ou moins hygrophiles
Récemment (de Foucault, 2023c), on a attiré l’attention sur deux bas-marais à bien distinguer, le Cirsio dissecti-Schoenetum nigricantis Braun-Blanq. & Tüxen 1952 et le Schoeno nigricantis-Juncetum subnodulosi P. Allorge 1922, en précisant que ce dernier présente une race subcontinentale à Carex davalliana en Champagne, Laonnois… (de Foucault, 1984 : 163). Il est intéressant de préciser ici qu’un tableau de dix relevés de S. Thévenin provenant du Grand Marais (ou Vivier de Chenay, communes de Chenay et Trigny, Marne) et publié par Arnal (1993 : 500) se rapporte clairement à cette race subcontinentale peu décrite.
Dans une synthèse récente du Molinion caeruleae, on a décrit de l’Aude le Cirsio tuberosi-Schoenetum nigricantis (de Foucault, 2023d). Le relevé suivant en propose un nouvel exemple, au contact du Junipero communis-Phillyreetum angustifoliae (cf. supra, § 2) :
Saint-Martin-le-Vieil (11), ‘Ficelle’, bord de la D 64, N 43° 18’ 42,6’’, E 2° 09’ 21,4’’, 213 m, 13/07/2023, 90 %, 40 m², 27 taxons
- Molinion caeruleae et unités supérieures : Schoenus nigricans 3, Prunella hyssopifolia 2, Molinia caerulea 2, Succisa pratensis 2, Carex flacca *f. 2, Cirsium tuberosum 1, Plantago maritima *serpentina 1, Scorzonera humilis +,
- autres taxons : Brachypodium rupestre *r. 2, Agrostis stolonifera *s. 2, Lotus dorycnium 1, hirsutus 2, Genista hispanica *h. 2, Centaurea jacea *j. 2, Aphyllanthes monspeliensis 2, Fraxinus angustifolia *a. j 1, Ligustrum vulgare j 1, Eupatorium cannabinum *c. +, Erica scoparia *s. j 1, Briza media *m. 1, Danthonia decumbens *d. 1, Catananche caerulea 1, Galatella linosyris/sedifolia 1, Ranunculus bulbosus +, Quercus ilex j +, Cervaria rivini +, Juniperus communis *c. j +.
D’ailleurs, dans cette synthèse de 2023, au sein du Serratulo tinctoriae-Molinienion caeruleae, il faut ajouter une quinzième association, le Serratulo tinctoriae-Schoenetum nigricantis Seytre in Seytre et al. 2015 du Cantal (Seytre et al., 2015).
Molinia caerulea est remplacé en Corée du Sud par Moliniopsis japonica. Dans un article récent, on a d’ailleurs défini une alliance originale pour ce pays, le Miscantho sinensis-Moliniopsion japonicae (de Foucault, 2023b). Ce même taxon existe aussi au Japon, mais il y caractérise une autre alliance, le Faurion cristae-galli Suzuki 1964 [syn. : Moliniopsion japonicae A. Miyaw. & Fujiwara 1970 nom. illeg.], à muter en Nephrophyllidion cristae-galli nom. mut. hoc loco, caractérisé par la Menyanthaeae Nephrophyllidium crista-galli (photos 7 et 8 ; syn. : Fauria crista-galli), Carex blepharicarpa, Gentiana thunbergii var. minor, Geum pentapetalum (photo 9), Shortia soldanelloides (photo 10), Narthecium asiaticum (photo 11), Drosera rotundifolia, la plupart de ces taxons non cités de Corée du Sud. Dans cette alliance, on peut citer le Faurio-Moliniopsietum japonicae Maeda 1952 ou Nephrophyllido cristae-galli–Moliniopsietum japonicae nom. mut. hoc loco évoqué notamment par Ohba (1973). D’autres associations sont citées par Ishida et al. (2016), les Carici middendorffii-Moliniopsietum japonicae, Inulo ciliaris-Moliniopsietum japonicae et Irido spontaneae-Moliniopsietum japonicae.
Non loin de cette catégorie, on peut aussi évoquer l’Achilleo ptarmicae-Juncetum inflexi décrit par Mayot (1977) du Jura central et ayant fait l’objet de la fiche F 03-57 dans une synthèse antérieure (de Foucault & Catteau, 2012). Cette association est restée jusqu’à présent inédite ; la colonne 136 du tableau 12 de la synthèse citée en donne la description synfloristique, il reste donc à désigner un holotype :
Achilleo ptarmicae-Juncetum inflexi Mayot & B. Foucault ass. nov. hoc loco [syn. : Junceto-Achilleetum ptarmicae Mayot 1977 (Essai d’interprétation de la végétation… : 67) nom. ined.], typus nominis hoc loco : relevé 9 du tableau VII in Mayot (1977) publié ci-après
Gray-et-Charnay (39320), « Murgatière », ~ N 46°28’ 11’’, E 5° 27’ 57,8’’, 370 m, 34 taxons
- Mentho longifolio-Juncion inflexi et unités supérieures : Juncus inflexus 1, Achillea ptarmica *p. 1, Centaurea jacea *j. +, Lychnis flos-cuculi *f. +, Equisetum palustre +, Sanguisorba officinalis +, Myosotis scorpioides +, Galium palustre +, Schedonorus arundinaceus *a. 1, Mentha aquatica +, Carex hirta +,
- taxons des mégaphorbiaies : Valeriana officinalis *o. 3, Caltha palustris *p. 2, Deschampsia cespitosa *c. 2, Cirsium palustre 1, Hypericum tetrapterum +, Angelica sylvestris *s. +, Filipendula ulmaria +, Eupatorium cannabinum +, Lythrum salicaria +, Epilobium hirsutum +,
- taxons oligotrophiles : Molinia caerulea 2, Succisa pratensis 1, Silaum silaus 1, Juncus conglomeratus 1, Carex hostiana 1, panicea +, Potentilla erecta +,
- autres taxons : Poa trivialis *t. +, Lathyrus pratensis +, Festuca rubra s. l. +, Ranunculus acris +, Gymnadenia conopsea +, Lotus corniculatus *c. + ;
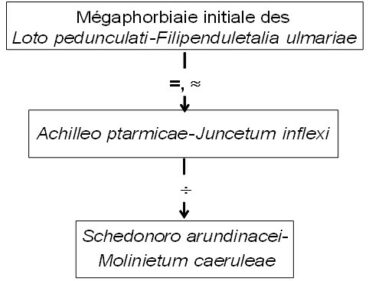
la décomposition en groupes sociologiques permet de poser l’hypothèse que cette prairie dérive d’une mégaphorbiaie initiale à tonalité continentale, à rattacher à une alliance des Loto pedunculati-Filipenduletalia ulmariae H. Passarge (1975) 1978, et peut dériver par oligotrophisation vers un pré oligotrophile affine du Molinion caeruleae (figure 1), décrit aussi par Mayot mais validé seulement en 2023 sous le nom de Schedonoro arundinacei-Molinietum caeruleae Mayot & B. Foucault in B. Foucault 2023 (de Foucault, 2023d).
4. La végétation des ourlets vivaces
La végétation des lisières herbacées, ou ourlets, continue de solliciter notre attention. Voici d’abord un nouvel exemple du Prunello hastifoliae-Lathyretum nigri, un ourlet décrit de l’Aude en 2020, puis validé correctement en 2022 (de Foucault, 2020b, 2022a) :
Arzens (11), chemin de Barthe et Pontils, N 43° 10’ 50,6’’, E 2° 12’ 27,7’’, 283 m, 18/06/2023, 85 %, 30 m², 28 taxons
- combinaison caractéristique : Lathyrus niger *n. 2, Prunella hastifolia 2, Dioscorea communis 2, Lonicera periclymenum *p. 2, Fragaria vesca 2, Pulmonaria longifolia *l. 1, Rubia peregrina *p. 1, Betonica officinalis *o. 1, Galium maritimum +, Euphorbia amygdaloides *a. +, Trifolium ochroleucon +, Brachypodium sylvaticum +, Luzula forsteri +, Ruscus aculeatus +, Oenanthe pimpinelloides +, Silene nutans *n. +, Ajuga reptans +,
- jeunes ligneux : Viburnum tinus j 1, Rosa sempervirens j 1, Ligustrum vulgare j 1, Erica arborea j 1, Sorbus domestica j 1, torminalis j +,
- autres taxons : Carex flacca *f. 2, Centaurea decipiens 1, Rubus sp. 1, Hedera helix 1, Geum urbanum +.
Les jeunes taxons ligneux annoncent le Roso sempervirentis-Viburnetum tini B. Foucault 2015 (de Foucault, 2015).
Les deux relevés qui suivent, au contraire, correspondent à des ourlets non décrits. Le premier possède des affinités orophiles :
Saint-Pierre-Colamine (63), bord de la D 633, N 45° 30’ 24,2’’, E 2° 57’ 23,3’’, 1 012 m, 30/06/2023, 100 %, 30 m², 60 taxons
- taxons des ourlets orophiles : Vicia sepium 2, Campanula persicifolia 2, Poa nemoralis *n. 2, Pimpinella major 2, Laserpitium latifolium *l. 2, Festuca heterophylla 2, Brachypodium rupestre *r. 2, Aquilegia vulgaris 2, Knautia arvernensis 2, Fragaria vesca 2, Galium album 2, odoratum 1, Trifolium medium *m. 1, Euphorbia dulcis *incompta 1, E. hyberna 1, E. cyparissias 1, Silene vulgaris *v. 1, Campanula trachelium *t. 1, Pulmonaria affinis 1, Epilobium angustifolium 1, Phyteuma spicatum 1, Linaria repens 1, Prenanthes purpurea 1, Viola riviniana 1, Lathyrus niger *n. +, L. latifolius +, Solidago virgaurea *v. 1, Epipactis helleborine *h. 1, Valeriana officinalis *tenuifolia +, Astrantia major *m. +, Ranunculus serpens +, Cirsium erisithales +, Astragalus glycyphyllos +, Heracleum sphondylium s. l. +, Scrophularia nodosa +, Rubus idaeus *i. +, Lactuca muralis +,
- taxons acidiphiles : Luzula nivea 2, Melampyrum pratense 2, Lathyrus linifolius 2, Hieracium umbellatum 2, Avenella flexuosa *f. 1,Convallaria majalis +, Luzula sylvatica *s. +,
- autres taxons : Genista pilosa *p. 2, sagittalis 1, Hedera helix 1, Briza media *m. 1, Populus tremula j 1, Quercus petraea *p. j 1, Fagus sylvatica j +, Polygala vulgaris *v. +, Corylus avellana j +, Sorbus aucuparia *a. j +, Fraxinus excelsior j +, Prunus avium j +, Hypericum perforatum *p. +, Viburnum lantana j +, Anthyllis vulneraria *v. +, Abies alba j + ;
ce riche mélange de flore neutrophile et de flore plus acidiphile, avec Lathyrus linifolius, Aquilegia vulgaris et Phyteuma spicatum, rappelle le Lathyro linifolii-Phyteumatetum spicati des plaines bas-normandes (de Foucault, 1998, sub Lathyro linifolii-Phyteumetum spicati), ici toutefois dans une tonalité bien plus montagnarde. Il serait intéressant de mieux comprendre les facteurs édaphiques qui expliquent cette combinaison floristique.
Le second relevé est caractérisé par Iris graminea (photo 12), un taxon qui apparaît assez rarement dans les publications :
Saint-Martin-le-Vieil (11), ‘Ficelle’, bord de la D 64, N 43° 18’ 32,4’’, E 2° 09’ 29’’, 210 m, 13/07/2023, 80 %, 30 m², 27 taxons
- combinaison caractéristique : Brachypodium rupestre *r. 3, Iris graminea 2, Molinia caerulea 2, Cirsium tuberosum 2, Campanula glomerata *g. 2, Catananche caerulea 2, Centaurea decipiens 2, Asphodelus cerasifer 1, Pulmonaria longifolia *l. 1, Filipendula vulgaris 1, Lotus hirsutus 1, Rubia peregrina *p. 1, Eryngium campestre 1, Euphorbia amygdaloides *a. 1, flavicoma *verrucosa 1, Vincetoxicum hirundinaria +, Seseli montanum +, Prunella hastifolia +, Silene italica +,
- autres taxons : Smilax aspera 2, Ligustrum vulgare j 1, Viburnum lantana j 1, Rubus 1, Genista hispanica *h. 1, Cornus sanguinea *s. j +, Pteridium aquilinum +, Briza media *m. +.
5. La végétation rudérale nitrophile
Du Massif central, on a décrit le Polygono avicularis-Scleranthetum uncinati B. Foucault & Terrisse in B. Foucault 1987 (photo 13) au niveau des chemins plus ou moins piétinés et sablonneux d’altitude (de Foucault, 1987, 2010). Le tableau 5 en rapporte deux nouveaux relevés [rel. 1 : Besse-et-Saint-Anastaise (63), nord du lac de Bourdouze, 26/06/2013 ; rel. 2 : Saint-Victor-la-Rivière (63), voie communale de Chacuze, 01/07/2023].
Le relevé suivant offre un nouvel exemple du Carduo pycnocephali-Sinapietum albae B. Foucault 2021, une friche thermophile thérophytique nitrophile souvent massivement dominée par Sinapis alba (de Foucault, 2021b) :
Arzens (11), chemin d’Arzens, N 43° 11’ 53,1’’, E 2° 12’ 44,5’’, 188 m, 18/06/2023, 40 %, 6 m², 9 taxons
- combinaison caractéristique : Sinapis alba 2, Carduus pycnocephalus 2, Avena barbata 2, Anisantha sterilis +, Hordeum murinum *leporinum 1,
- autres taxons : Geranium rotundifolium 2, Medicago polymorpha 1, Euphorbia peplus 1, Sonchus oleraceus 1,
au contact du Fico caricae-Sambucetum nigrae B. Foucault 2015, un fourré lui-même nitrophile
même localisation spatio-temporelle, 90 %, 15 m², 6 taxons
- combinaison caractéristique : Sambucus nigra 4, Rubus ulmifolius 3,Ficus carica 2, Bryonia dioica1,
- autres taxons : Juglans regia j 1, Laurus nobilis j +.
Le Carduo-Sinapietum albae est finalement très répandu autour d’Arzens comme le montrent des observations du début du printemps 2024.
Quant au relevé suivant, il montre un bel exemple de moisson sur sol basique :
Saint-Martin-le-Vieil (11), Villelongue, non loin de la Tuilerie, N 43° 18’ 19,6’’, E 2° 10’ 18,5’’, 187 m, 31/05/2023, 50 %, 50 m², 36 taxons
- combinaison caractéristique : Papaver rhoeas 2, Sherardia arvensis 2, Coronilla scorpioides 2, Scandix pecten-veneris *p. 2, Adonis annua 2, Kickxia spuria 2, Filago germanica 2, Anthemis cotula 2, Legousia speculum-veneris 2, Euphorbia falcata 2, Torilis nodosa *n. 1, Ervilia loiseleurii 1, Ajuga chamaepitys 1, Arenaria leptoclados 1, Galium parisiense 1, Gastridium ventricosum 1, Valerianella eriocarpa 1, Reseda phyteuma 1, Ranunculus arvensis 1, Rapistrum rugosum 1, Chaenorrhinum minus 1, Lysimachia arvensis *a. 2, foemina 2, Sonchus asper *a. 1, Aphanes arvensis 1, Catapodium rigidum 1, Mercurialis annua +, Thymelaea passerina *pubescens +, Agrostemma githago +, Clinopodium acinos +, Trifolium campestre +,
- autres taxons : Blackstonia perfoliata 1, Centaurium pulchellum 1, Helminthotheca echioides +, Anisantha sterilis +, Veronica arvensis +,
qui se rattache assez bien au Polycnemo arvensis-Linarietum spuriae Braun-Blanq. 1936, muté ici en Polycnemo arvensis-Kickxietum spuriae nom. mut. hoc loco (Braun-Blanquet et al., 1952), association vicariante du Linarietum spuriae Kruseman & Vlieger 1939 nord-atlantique, muté ici en Kickxietum spuriae nom. mut. hoc loco (Kruseman & Vlieger, 1939).
6. La végétation de prés salés
Dans la synthèse des Juncetea maritimi Tüxen & Oberd. 1958 (de Foucault, 2021d), au sein de la sous-alliance du Frankenio laevis-Armerienion maritimae Géhu & Géhu-Franck in Géhu 1976, manque le Suaedo maritimae-Limonietum bellidifoliae Bioret 2004 du littoral du nord-est de l’Angleterre (Bioret, 2004). En fait, il s’agit d’une mosaïque entre un pré halophile vivace à Limonium bellidifolium et L. binervosum et un pré halophile thérophytique à Suaeda maritima et Salicornia procumbens subsp. p. (sub S. ramosissima), ce dernier à rattacher au Salicornietum procumbentis Géhu & Géhu-Franck ex B. Foucault & Guitton 2021 (de Foucault & Guitton, 2021). L’association vivace devrait donc être renommée, aucune association décrite dans la sous-alliance ne semblant l’inclure.
Dans ma synthèse récente des Crithmo maritimi-Limonietea (de Foucault, 2023e), j’ai défini le Sileno reiseri-Allion commutati pour la végétation des côtes de Croatie, où se place le Plantagini holostei-Limonietum cancellati Horvatić (1934) 1939. Or cette association a été retenue antérieurement pour typifier le Limonion anfracto-cancellati par Mucina (in Mucina et al., 2016 : 135, ‘Limonion anfracti-cancellati’ art. 41 b). Ce nom est donc prioritaire sur celui de 2023.
Terzi et al. (2019) retiennent ce nom de Limonion anfracto-cancellati pour placer cinq associations d’un archipel adriatique, le problème est que, quand on synthétise ces associations dans une seule colonne à valeur d’alliance, leurs liens avec les deux ordres déjà définis, les Crithmo maritimi-Limonietalia Molin. 1934 et les Cichorietalia spinosi B. Foucault 2023, sont quasiment nuls en dehors de Matthiola incana et Capparis orientalis qui le relient faiblement au second ordre. Par ailleurs, sur la base de quatre associations, ils définissent un Capparo orientalis-Aurinion leucadeae qu’ils placent dans les Helichrysetalia italici, suivis par Jasprica & Terzi (2023), mais qui pourrait être mieux placé aussi dans les Crithmo-Limonietea, quoiqu’un peu en limite et ne se rattachant à aucun des deux ordres déjà définis (de Foucault, 2023e).
Dans la synthèse des Sarcocornietea fruticosae Braun-Blanq. & Tüxen ex A. Bolòs & O. Bolòs in A. Bolòs 1950 (de Foucault, 2021c), aux neuf alliances citées dans l’ordre des Limonietalia Braun-Blanq. & O. Bolòs 1957, il faut ajouter une alliance manquante, endémique de la Toscane italienne, le Limonion etrusci Viciani, Foggi & Ferretti 2012 réduite à son association type, le Limbardo crithmoidis-Limonietum etrusci Viciani, Foggi & Ferretti 2012 (Viciani et al., 2012).
Du Japon, a été précédemment défini au sein des Thero-Suaedetea splendentis l’Atriplici gmelinii–Suaedion japonicae B. Foucault & Guitton 2021, avec l’indication de son absence d’Hokkaidō (de Foucault & Guitton, 2021). Cependant, de l’est de cette île subboréale, Ito (1959) a étudié une végétation à Atriplex gmelinii, Spergularia marina et Salicornia europaea selon la méthode des sociations (fréquences à partir d’inventaires floristiques d’une cinquantaine de quadrats), donc non d’inspiration sigmatiste. Pourtant des données de cet auteur (ses tableaux 2 à 4), on peut déduire un véritable relevé sigmatiste à trois taxons, sur 45 à 50 m² : Salicornia europaea 3, Spergularia marina 1, Atriplex gmelinii +, typus nominis hoc loco de l’Atriplici gmelinii-Salicornietum europaeae ass. nov. hoc loco, à rattacher à la même alliance que celle citée plus haut, quoique Suaeda japonica manque sur le littoral d’Hokkaidō. On retrouve cette association dans les données de Ito & Leu (1962).
Cette végétation thérophytique forme une mosaïque avec un pré salé vivace pouvant donner lieu au relevé suivant de quatre taxons vivaces sur 45-50 m² : Juncus gracillimus 2 à 3, Lysimachia maritima + à 1, Argentina anserina subsp. groenlandica + à 1, Phragmites australis +, à rapprocher du Juncetum gracillimi A. Miyaw. & Ohba 1965, au sein du Puccinellion pumilae A. Miyaw. & Ohba 1965 et des Juncetea maritimi Tüxen & Oberd. 1958 (de Foucault, 2021d).
7. La végétation des mégaphorbiaies
Dans deux publications (de Foucault et al., 2011 ; de Foucault, 2022c), on a attiré l’attention des phytosociologues sur les mégaphorbiaies tropicales, surtout africaines. De Granville (1984, 1994) évoque des sous-bois hygrophiles guyanais (marsh forests, swamp woods) à hautes Monocotylédones à larges feuilles et zoogames relevant surtout des Cyclanthaceae (photo 14), Araceae (photos 15 et 16), Rapateaceae (photo 17), Musaceae (en fait Heliconiaceae en Guyane), Marantaceae, Zingiberaceae et Costaceae. Malheureusement fort peu d’études phytosociologiques sont consacrées à ce type de végétation.
8. Une lande algérienne
Décrivant des boisements nord-ouest-algériens à Tetraclinis articulata et Quercus rotundifolia développées entre 900 et 1 100 m d’altitude, Miara et al. (2012) étudient notamment des landes à Cistus salviifolius associées à des fourrés du Genisto tricuspidatae-Cytision spinosi B. Foucault & Dahmani ex B. Foucault & Dahmani in B. Foucault 2022. En compilant les tableaux 1, 2 (sauf relevé 80), 3 (sauf relevés 66, 77, 57, 69) et 4 (sauf relevés 7, 24, 45, 19, 20, 28, 29, 30, 48, 46, 17, 41, 65 et 21), soit sur 41 relevés, on peut déduire la liste synthétique suivante : Cistus salviifolius IV, Thymus munbyanus *ciliatus IV, Dactylis glomerata s. l. IV, Lavandula stoechas III, Teucrium pseudochamaepitys (photo 18) III, T. polium III, Fumana thymifolia II, Asphodelus ramosus II, Arrhenatherum album II, Linum tenue *munbyanum II, Sedum sediforme II, Atractylis caespitosa I, Catananche caerulea I, Eryngium tricuspidatum I, E. triquetrum I, Drimia maritima I, Lobularia maritima I, Halimium halimifolium I, Macrochloa tenacissima I, Ebenus pinnatus I, Helichrysum stoechas I, Cephalaria leucantha I, Paronychia argentea I et des taxons de présences + et r, soit le Thymo ciliati-Cistetum salviifolii ass. nov. hoc loco, typus nominis hoc loco : composante hémicryptophyto-géophyto-chaméphytique du relevé 25 du tableau 4 in Miara et al. (2012, Bull. Soc. Bot. Centre-Ouest, n. s., 43 : 306-310). Cette association semble devoir être rattachée aux Cisto-Lavanduletea stoechadis Braun-Blanq. in Braun-Blanq., Molin. & He. Wagner 1940, mais aucune unité de rangs ordre et alliance ne peut actuellement l’accueillir selon notre synthèse (de Foucault et al., 2012).
Comme c’est souvent le cas, au voisinage de cette lande, il existe des pelouses à thérophytes. La plus fréquente est celle qui correspond à la liste suivante (sur 72 relevés, d’après les tableaux 1, 3 à 5 et 7 des auteurs algériens) : Plantago lagopus V, Linum strictum IV, Lagurus ovatus IV, Bromus rubens IV, Briza maxima III, Aegilops triuncialis (photo 19) III, Anacyclus clavatus III, Trifolium tomentosum IV, T. campestre III, T. angustifolium III, T. stellatum II, Lomelosia stellata II, Atractylis cancellata (photo 20) II, Neatostema apulum II, Tuberaria guttata II, Lysimachia arvensis II, Torilis nodosa II, Medicago ciliaris II, M. tornata II, Ammi majus II, Plantago bellardii II, Bombycilaena discolor I, Hordeum murinum I, Lolium rigidum I, Echinaria capitata I, Trifolium cherleri I, Eudianthe coeli-rosa I et des taxons de présences + et r ; cette combinaison semble décrire une pelouse assez naturelle mais enrichie en taxons subnitrophiles (Bromus rubens, Aegilops triuncialis, Anacyclus clavatus, Lysimachia arvensis, Hordeum murinum) sans doute favorisés par le pâturage et évoquant la végétation du Taeniathero capitis-medusae-Aegilopion geniculatae Rivas Mart. & Izco 1977 d’optimum ibérique (de Foucault, 2012) ; elle peut être décrite sous le nom de Aegilopo triuncialis-Plantaginetum lagopodis ass. nov. hoc loco, typus nominis hoc loco : composante thérophytique du relevé 25 du tableau 4 in Miara et al. (2012, Bull. Soc. Bot. Centre-Ouest, n. s., 43 : 306-310). Cela signifie par ailleurs qu’il doit exister localement une pelouse thérophytique plus naturelle pouvant dériver vers la précédente sous l’influence de l’eutrophisation ; le tableau 2 des auteurs algériens en décrit une sur la base de six relevés : Bombycilaena discolor V, Tripodion tetraphyllum (photo 21) V, Plantago lagopus IV, Linum strictum III, Atractylis cancellata II, Bromus rubens II, Ammi majus II, Lolium rigidum II, Tuberaria guttata I, Aegilops triuncialis I, Tripodio tetraphylli–Bombycilaenetum discoloris ass. nov. hoc loco, typus nominis hoc loco : composante thérophytique du relevé 25 du tableau 4 in Miara et al. (2012, Bull. Soc. Bot. Centre-Ouest, n. s., 43 : 306-310), avec une probable sous-association de passage entre les deux associations reconnues ici, différenciée par Bromus rubens, Aegilops triuncialis et Ammi majus (relevés 80 et 58), selon le schéma systémique de la figure 2. Le Tripodio-Bombycilaenetum discoloris n’entre dans aucune des alliances synthétisées par de Foucault & Lazare (2020), ce qui est sans doute lié à la conjonction des altitude et latitude différentes.
9. Des mares temporaires californiennes
Par la méthode des transects, Kopecko et Lathrop (1975) ont décrit la zonation sur la bordure d’une mare temporaire du sud de la Californie (8 km à l’ouest de Murrieta, sud-est de Los Angeles) sur la base de cinq zones codées de A (niveau supérieur) à E (niveau inférieur), dont la liste floristique quantifiée par des coefficients dénommés relative dominance ou importance value a la valeur de relevé (art. 2 et 7 de l’ICPN) et donnant lieu à cinq tableaux biologiquement hétérogènes (mélange taxons vivaces/thérophytes) où les taxons sont en outre rangés par ordre alphabétique (ce qui n’a jamais été un ordre biologique). On se propose ici de reconsidérer cette zonation sur la base des tableaux 6 et 7 et de la méthodologie présentée dans des publications antérieures (de Foucault, 1988, 2013). Le type biologique des taxons cités est notamment basé sur les tableaux 6A à 6D de Zedler (1987). On a ajouté les familles d’appartenance de ces taxons.
Tout d’abord le tableau 6 rapporte la zonation de la végétation vivace à partir d’un niveau supérieur (A) caractérisé faiblement par la géophyte Muilla maritima. Ce sont surtout les niveaux inférieurs (C à E) qui retiennent l’attention et qui paraissent caractériser une unique association, le Marsileo vestitae-Isoetetum orcuttii ass. nov. hoc loco, typus nominis hoc loco : composante vivace de la colonne D du tableau 1 in Kopecko & Lathrop (1975, Aliso 8 (3) : 285) reprise dans la colonne D de notre tableau 6. On retrouve cette végétation aussi chez Thorne et Lathrop (1969, 1970, où Marsilea vestita est dénommé M. mucronata). La combinaison d’espèces des genres Marsilea, Pilularia, Isoetes et Eryngium évoque clairement la S(Marsileaceae-Isoetaceae) définie antérieurement à partir de données provenant d’autres continents (de Foucault, 1988). Zedler (1987) cite encore dans de telles végétations Ophioglossum californicum, mais sans plus de précisions.
Le tableau 7 rapporte ensuite la zonation de la végétation thérophytique menant de niveaux supérieurs (A et B), caractérisés par des thérophytes de pelouses plutôt xérophiles, accueillant notamment des taxons introduits d’Europe, à des niveaux moyens à inférieurs (C à E). Parmi ceux-ci se distinguent bien les colonnes C et D, décrivant l’Elatino californicae-Plagiobothryetum undulati ass. nov. hoc loco, typus nominis hoc loco : composante thérophytique de la colonne C du tableau 1 in Kopecko & Lathrop (1975, Aliso 8 (3) : 285) reprise dans la colonne C de notre tableau 7, qu’on retrouve aussi chez Thorne & Lathrop (1969) ; on trouvera une illustration d’Elatine triandra var. andina dans de Foucault (2024 : photo 115). Ce type de végétation est homologue pour la Californie de celle des Elatino triandrae-Cyperetalia fusci d’Europe, avec laquelle elle partage Juncus bufonius, Lythrum hyssopifolia, Lysimachia minima, et relève plus largement des S(Elatinaceae-Lythraceae) (de Foucault, 1988).
Bibliographie
Arnal G., 1993. Cinquième jour : jeudi 28 mai 1992, Châlons-sur-Vesle, le Vivier de Chenay, bois de la Fosse à Ville-Dommange, les Faux de Verzy et la Neuville-en-Challois. Bulletin de la Société botanique du Centre-Ouest, n. s., 24 : 497-506.
Barbero M. & Bono G., 1970. Les sapinières des Alpes maritimes, de l’Authion à la Ligurie et de la Stura au Tanaro. Veröffentlichungen des Geobotanischen Institutes der Eidg. Tech. Hochschule, Stiftung Rübel, in Zürich 43 : 140-168.
Barbero M. & Quézel P. 1976. Les groupements forestiers de Grèce centro-méridionale. Ecologia Mediterranea 2 : 3-86.
Bergmeier E. & Dimopoulos P., 2001. Fagus sylvatica forest vegetation in Greece: syntaxonomy and gradient analysis. Journal of Vegetation Science 12 : 101-126.
Bioret F., 2004. Sur une nouvelle association végétale des hauts schorres sableux du littoral nord-est de l’Angleterre. Journal de botanique de la Société botanique de France 25 : 43-47.
Biurrun I., Campos J.A., García Mijangos I., Herrera M. & Loidi J., 2011. Nuevos datos sobre los bosques de barrancos y pies de cantil (Tilio-Acerion) del País Vasco y regiones limítrofes. Actes del IX Col-loqui internacional de Botànica pirenaico-cantàbrica a Ordino, Andorra : 67-74.
Braun-Blanquet J., Roussine N. & Nègre R., 1952. Les groupements végétaux de la France méditerranéenne. CNRS, Paris, 297 p.
Collaud R., 2010. Contribution à l’étude des forêts hygrosciaphiles de ravins à affinités atlantiques en Franche-Comté. Les Nouvelles Archives de la flore jurassienne et du nord-est de la France 8 : 87-122.
Fernández Prieto J.A. & Vásquez V.M., 1987. Datos sobre los bosques asturianos orocantábricos occidentales. Lazaroa 7 : 363-382.
Foucault B. (de), 1984. Systémique, structuralisme et synsystématique des prairies hygrophiles des plaines atlantiques françaises. Thèse de doctorat d’État, université de Rouen, 675 p. et annexes.
Foucault B. (de), 1987. Données phytosociologiques sur la végétation observée lors de la treizième session de la S.B.C.O. en Aubrac et Margeride. Bulletin de la Société botanique du Centre-Ouest, n. s., 18 : 337-361.
Foucault B. (de), 1988. Les végétations herbacées basses amphibies : systémique, structuralisme, synsystématique. Dissertationes Botanicae 121 : 1-150.
Foucault B. (de), 1998. Contribution à une approche systémique des végétations forestières bas-normandes : les bois mésophiles du pays de Cinglais (Calvados). Journal de botanique de la Société botanique de France 6 : 39-56.
Foucault B. (de), 1999. Notes phytosociologiques sur la végétation observée dans le Jura français. Bulletin de la Société botanique du nord de la France 52 (4) : 23-48.
Foucault B. (de), 2010. Contribution au prodrome des végétations de France : les Polygono-Poetea annuae Rivas-Mart. 1975 corr. Rivas-Mart. et al. 1991. Journal de botanique de la Société botanique de France 49 : 55-72.
Foucault B. (de), 2012a. Contribution au prodrome des végétations de France : les Betulo carpaticae-Alnetea viridis Rejmánek in Huml, Lepš, Prach & Rejmánek 1979. Journal de botanique de la Société botanique de France 60 : 47-68.
Foucault B. (de), 2012b. Contribution au prodrome des végétations de France : les Sisymbrietea officinalis Korneck 1974. Journal de botanique de la Société botanique de France 58 : 55-116.
Foucault B. (de), 2013. Contribution au prodrome des végétations de France : les Isoëtetea velatae de Foucault 1988 et les Juncetea bufonii de Foucault 1988 (« Isoëto–Nanojuncetea bufonii »). Journal de botanique de la Société botanique de France 62 : 35-70, 63 : 63-109.
Foucault B. (de), 2015. Quelques associations arbustives nouvelles pour la Malepère (Aude centrale). Bulletin de la Société botanique du Centre-Ouest, n. s., 46 : 244-260.
Foucault B. (de), 2017. Données phytosociologiques nouvelles sur la végétation des Cévennes occidentales (département de la Lozère) et du Haut-Languedoc (département de l’Hérault). Bulletin de la Société botanique du Centre-Ouest, n. s., 48 : 334-359.
Foucault B. (de), 2018. Contributions à la flore des Alpes, compte rendu de la 151e session extraordinaire de la Société botanique de France en Maurienne (Savoie) : quelques données phytosociologiques sur la haute Maurienne. Journal de botanique de la Société botanique de France 81 : 54-61
Foucault B. (de), 2020a. Éloge du paradigme synusial : alternative à la classification phytosociologique de la végétation forestière européenne, ouest-asiatique et nord-africaine. Evaxiana 7 : 5-248
Foucault B. (de), 2020b. Données phytosociologiques sur les forêts de la Malepère (Aude, France) et leurs lisières. Carnets botaniques 9 : 1-15 +15 tableaux, https://doi.org/10.34971/5nt2-zy92.
Foucault B. (de), 2021a. Miscellanées phytosociologiques : quelques syntaxons nouveaux, validés, complétés ou corrigés. Carnets botaniques 44 : 1-23 + 28 tableaux, https://doi.org/10.34971/AKGG-T733.
Foucault B. (de), 2021b. Miscellanées phytosociologiques II : syntaxons nouveaux, validés, complétés ou corrigés. Carnets botaniques 70 : 1-22 + 13 tableaux, https://doi.org/10.34971/3t1m-6445.
Foucault B. (de), 2021c. Contribution à une synthèse des Sarcocornietea fruticosae. Carnets botaniques 59 : 1-19 + 17 tableaux, https://doi.org/10.34971/8h0c-0b94.
Foucault B. (de), 2021d. Contribution à une synthèse des Juncetea maritimi. Carnets botaniques 68 : 1-30 + 22 tableaux, https://doi.org/10.34971/nbat-mh09.
Foucault B. (de), 2022a. Validation de syntaxons invalidement publiés en 2021. Carnets botaniques 79 : 1-12, https://doi.org/10.34971/dxjk-t193.
Foucault B. (de), 2022b. Miscellanées phytosociologiques III : syntaxons nouveaux, validés ou complétés. Carnets botaniques 112 : 1-22 + 17 tableaux, https://doi.org/10.34971/6AX1-0K40.
Foucault B. (de), 2022c. Nouvelles considérations phytosociologiques sur la végétation de la Grèce. Carnets botaniques 109 : 1-27 + 7 tableaux, https://doi.org/10.34971/Q6KD-W822.
Foucault B. (de), 2023a. Miscellanées phytosociologiques IV : syntaxons nouveaux, validés ou complétés. Carnets botaniques 127 : 1-18 + 14 tableaux, https://doi.org/10.34971/1d8e-ky97.
Foucault B. (de), 2023b. Un printemps botanique et phytosociologique au pays du Matin calme (fin mars et avril 2023). Carnets botaniques 156 : 1-31 + 15 tableaux, https://doi.org/10.34971/spy7-vw87.
Foucault B. (de), 2023c. Miscellanées phytosociologiques V : syntaxons nouveaux, validés ou complétés. Carnets botaniques 154 : 1-15 + 6 tableaux, https://doi.org/10.34971/M5RZ-7B62.
Foucault B. (de), 2023d. Retour sur la structuration synsystématique des alliances du Molinion caeruleae et du Juncion acutiflori. Carnets botaniques 146 : 1-26 + tableaux 1 à 18d, https://doi.org/10.34971/86S0-XR84.
Foucault B. (de), 2023e. Sur la végétation aérohalophile à Crithmum maritimum, essai de synthèse. Carnets botaniques 144 : 1-23 + 17 tableaux, https://doi.org/10.34971/4XBV-3673.
Foucault B. (de), 2024. Nouveaux regards sur la végétation des forêts chiliennes et formations associées. Carnets botaniques 178 : 1-36, https://doi.org/10.34971/W983-T852.
Foucault B. (de), Batawila K., Wala K. & Akpagana K., 2011. Une formation végétale méconnue pour l’Afrique tropicale, la mégaphorbiaie ; le cas du Marantochloo – Anubiadetum giganteae du Togo. Acta Botanica Gallica, 158 (3) : 409-424.
Foucault B. (de), Argagnon O. & Paradis G., 2012. Contribution au prodrome des végétations de France : les Cisto ladaniferi-Lavanduletea stoechadis Braun-Blanq. in Braun-Blanq., Molin. & Wagner 1940. Journal de botanique de la Société botanique de France 57 : 59-82.
Foucault B. (de) & Catteau E., 2012. Contribution au prodrome des végétations de France : les Agrostietea stoloniferae Oberd. 1983. Journal de botanique de la Société botanique de France 59 : 5-131.
Foucault B. (de) & Lazare J.-J., 2020. Contribution à une synthèse phytosociologique des steppes d’Afrique du Nord (hors Lygeo sparti-Stipetea tenacissimae). Botanique 6 : 53-116.
Foucault B. (de) & Guitton H., 2021. Une déclinaison moderne des Thero-Suaedetea splendentis. Carnets botaniques 76 : 1-9 + 2 tableaux, https://doi.org/10.34971/3XK3-N640.
Gamisans J. & Hébrard J.-P., 1981. À propos de la végétation des forêts en Grèce du nord-est (Macédoine orientale et Thrace occidentale). Documents phytosociologiques, n. s., V : 243-289.
Granville J.-J. (de), 1984. Monocotyledons and pteridophytes indicators of environmental constraints in the tropical vegetation. Candollea 39 : 265-269.
Granville J.-J. (de), 1994. Les formations végétales primaires de la zone intérieure de Guyane. In Forêt guyanaise, gestion de l’écosystème forestier et aménagement de l’espace régional (congrès Sepanguy, Cayenne, 1990), Nature guyanaise : 21-40.
Habeck F. & Reif A. 1994. Die Waldgesellschaften der montanen und subalpinen Stufe des Ostabfalls des Olymp, Griechenland. Phytocoenologia 22 : 501-536.
Ishida Y., Matsue D., Takyu M. & Nakamura Y., 2016. Species composition and distribution o the snow-patch meadows on the northern part of the Ushiro-tatemaya mountain range, Central Japan. Eco-Habitat 23 (1) : 23-40.
Ito K., 1959. Salicornia europaea community on the Okhotsk side in Hokkaido, Japan: ecological studies on the salt marsh vegetation in Hokkaido, Japan (3). Japanese Journal of Ecology 9 (1) : 21-27 (en grande partie en japonais).
Ito K. & Leu T., 1962. The salt marsh communities in the northern part of Lake Notoro near Abashiriin in the north-eastern part of Hokkaido, Japan: ecological studies on the salt marsh vegetation in Hokkaido, Japan (5). Japanese Journal of Ecology 12 (1) : 17-20 (en grande partie en japonais).
Jasprica N. & Terzi M., 2023. The new association Pimpinello lithophilae-Centaureetum lovricii (Crithmo-Staticetea) from the island of Vis (southern Croatia). Acta Botanica Croatica 82 (2) : 144-146.
Kopecko K.J.P. & Lathrop E.W., 1975. Vegetation zonation in a vernal marsh on the Santa Rosa Plateau of Riverside County, California. Aliso 8 (3) : 281-288.
Kruseman G. & Vlieger J., 1939. Akkerassociaties in Nederland. Nederlandsch kruidkundig archief, série 3, 49 (1) : 327-386.
Mandango M.A. & Kayumba L., 1996. Étude écologique et phytosociologique de la savane à Hymenocardia acida Tul. dans la région de Kinshasa (Zaïre). Documents phytosociologiques, n. s., XVI : 251-263.
Marino P., Castiglia G., Bazan G., Domina G. & Guarino R., 2014. Tertiary relict laurophyll vegetation in the Madonie mountains (Sicily). Acta Botanica Gallica: Botany Letters 161 (1) : 47-61.
Mayot J., 1977. Essai d’interprétation de la végétation de la partie inférieure du Jura central (feuille 1/50 000e d’Orgelet). Thèse de doctorat d’État, université de Franche-Comté, 248 p.
Miara M.D., Hadjadj Aoul S. & Ait Hammou M., 2012. Analyse phytoécologique et syntaxonomique des groupements végétaux dans le massif de Guezoul, Tiaret (N-O Algérie). Bulletin de la Société botanique du Centre-Ouest, n. s., 43 : 279-316.
Mucina L., Bültmann H. et al., 2016. Vegetation of Europe: hierarchical floristic classification system of vascular plant, bryophyte, lichen, and algal communities. Applied Vegetation Science 19, suppl. 1 : 3-264.
Ohba T., 1973. Die Vegetation des oberen Kiyotsu-Tales, Mittel-Japan. [Nom de la revue en japonais] (3) : 57-128.
Quézel P. & Contandriopoulos J., 1965. À propos de la végétation des forêts de hêtres dans le massif du Pinde. Bulletin de la Société botanique de France 112 : 312-319.
Schnell R., 1976. Flore et végétation de l’Afrique tropicale, I. Gaulthier-Villars, Paris, 468 p.
Seytre L., de Foucault B. & Hugonnot V., 2015. Approche phyto-écologique des groupements à Schoenus nigricans de l’îlot de Saint-Paul-des-Landes (Cantal, France). Journal de botanique de la Société botanique de France 72 : 19-40.
Terzi M., Bogdanović S., Saverio D’Amico F. & Jasprica N., 2019. Rare plant communities of the Vis Archipelago (Croatia). Botany Letters 167 (2) : 241-254.
Thorne R.F. & Lathrop E.W., 1969. A vernal marsh on the Santa Rosa Plateau of Riverside County, California. Aliso 7 (1) : 85-95.
Thorne R.F. & Lathrop E.W., 1970. Pilularia americana on the Santa Rosa Plateau, Riverside County, California. Aliso 7 (2) : 149-155.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1 196 p.
Vanden Berghen C., 1968. Les forêts de la Haute Soule (Basses-Pyrénées). Bulletin de la Société royale de botanique de Belgique 102 : 107-132.
Viciani D., Foggi B. & Ferretti G., 2012. The Mediterranean salt steppes (order Limonietalia Br.-Bl. & O. Bolòs 1958) in Toscany (Central Italy). Acta Botanica Gallica: Botany Letters 159 (1) : 85-96.
Vila-Viçosa C., Quinto-Canas R., Mendes P., Cano-Ortiz A., Rosa-Pinto J. & Pinto-Gomes C., 2012. A new Erica lusitanica Rudolphi heathland association to the Iberian south-west. Acta Bot. Gallica: Botany Letters 159 (2) : 277-280.
Zedler P.H., 1987. The ecology of southern California vernal pools: a community profile. U.S. Fish and Wildlife Service, Biological Report 85 (7.11) : 1-136.
Remerciements
Un grand merci à V. Gaudillat (MNHN, UMS PatriNat, cellule Habitats naturels et cartographie) pour son aide à la recherche bibliographique.