Sur le concept de familles végétales isomorphes selon un gradient
Title
On the concept of isomorphic vegetal families according to a gradient
Résumé
En analysant la structure interne de diverses familles végétales (selon APG IV ; parfois de genres ou d’ordres) par la considération de gradients, on met en évidence la notion d’isomorphisme de familles pour un gradient donné, c’est-à-dire de familles ayant la même structure interne.
Abstract
By analyzing the internal structure of various plant families (according to APG IV; sometimes of genera or of orders) by the consideration of gradients, we highlight the notion of isomorphism of families for a given gradient, i.e. of families having the same internal structure.
1. Introduction
La systématique végétale, c’est-à-dire la hiérarchisation des catégories taxonomiques (espèces, genres, familles, ordres, classes…), a beaucoup évolué depuis l’émergence de la botanique en tant que science. Très récemment, l’utilisation de caractères intra-organites par l’étude des séquences des bases azotées des ARN et ADN (chloroplastique, avec les gènes atpB et rbcL codant une enzyme, la RuBisCo, le gène nucléaire 18S) permise par les techniques d’amplification des acides nucléiques doit être la voie finale devant décider des affinités réelles définitives entre taxons. C’est là une révolution systématique qui a confirmé bien des résultats antérieurs, mais a surtout remis en cause certains classements ; la convergence initialement limitée à l’appareil végétatif s’étend maintenant à l’appareil reproducteur ; on s’aperçoit que des caractéristiques florales communes ne sont pas forcément l’indice d’une parenté phylétique, mais qu’elles ont pu apparaître indépendamment dans des lignées sans rapports phylogénétiques ; on parle de « convergence évolutive ».
Le résultat concret de toutes ces investigations est l’état actuel de la systématique des Angiospermes telle qu’elle est exposée dans le récent APG IV (Angiosperm Phylogeny Group, 2016), avec des perspectives qui peuvent gêner les utilisateurs de la systématique antérieure. Dans la suite de ces considérations, nous voudrions surtout montrer que la nouvelle systématique n’est pas toujours aussi surprenante que celle-ci en explorant des gradients variés à l’intérieur de familles, parfois de genres ou d’ordres. Sera ainsi révélée une hétérogénéité interne à ces catégories, mais de telles hétérogénéités existaient déjà au sein des taxons classiques. Ces gradients seront illustrés par la suite logique de quelques attributs de variables très diverses empruntées à la biologie, la morphologie et l’écologie végétales. Ils permettent de décrire la structure interne des familles selon un certain point de vue.
Pour démontrer notre propos, il nous faut clairement distinguer les familles classiques dont le contenu est conservé par APG IV (indiquées par *), les familles modernes dont le contenu a été revu (signe +), les anciennes familles dont une partie au moins du contenu est incluse dans les précédentes (-).
Cet exposé a été illustré par une trentaine de photos de taxons souvent peu ou pas connus des botanistes de l’hémisphère nord. Les photos réalisées en milieu naturel seront identifiées par une localisation géographique ; celle-ci est absente pour les photos réalisées en jardin botanique.
2. Analyses de gradients
2.1 Gradients biologiques
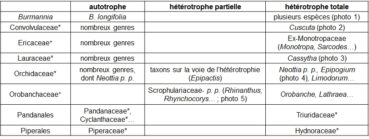
En premier lieu, le gradient ‘autotrophie – hétérotrophie partielle – hétérotrophie totale’ peut être illustré par le tableau 1.
Pour le gradient ‘autotrophie – carnivorie’, on peut observer que les diverses familles dicotylédones de plantes carnivores sont dispersées dans plusieurs ordres, où elles côtoient de nombreuses familles strictement autotrophes :
- Caryophyllales (Dioncophyllaceae*, Droseraceae+, Drosophyllaceae+, Nepenthaceae*),
- Oxalidales (Cephalotaceae*),
- Ericales (Sarraceniaceae*),
- Lamiales (Byblidaceae*, Lentibulariaceae* ; photo 6),
qui présentent ainsi des gradients trophiques. Chez les Monocotylédones, seules les Bromeliaceae* (Brocchinia reducta, B. hechtioides, Catopsis berteroniana) et Eriocaulaceae* (Paepalanthus bromelioides) incluent quelques genres carnivores à côté d’un vaste ensemble autotrophe. La carnivorie végétale est donc un excellent exemple de convergence évolutive, notamment chez les Monocotylédones.
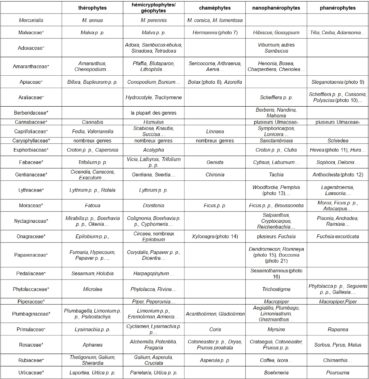
Le gradient biologique selon Raunkiær
‘thérophyte – hémicryptophyte/géophyte – chaméphyte – nanophanérophyte – phanérophyte’
relie des herbes annuelles (thérophytes) puis vivaces (hémicryptophytes/géophytes) à des sous-arbrisseaux (chaméphytes), des arbustes (nanophanérophytes) et des arbres (phanérophytes). Il est perceptible déjà dans de vastes genres comme Euphorbia, Senecio, Triumfetta. Il l’est bien aussi dans des familles cosmopolites ou récemment élargies pour inclure un plus grand nombre de genres, ce qui contribue à diversifier ces types biologiques. Le tableau 2 présente quelques exemples de genres ou d’espèces pour les familles classiques.
2.2 Gradients morphologiques reproducteurs
Le gradient ‘inflorescence bombée – inflorescence plane – inflorescence refermée (urcéolée)’, lié à la forme de l’inflorescence, est rarement réalisé (tableau 3).
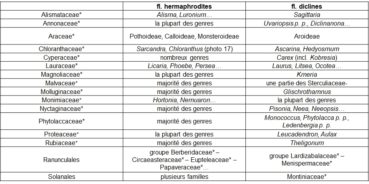
Si on entend par « diclinie » le caractère de fleurs unisexuées (dioïques ou monoïques), le gradient ‘hermaphrodisme – diclinie’ peut être observé dans des taxons rassemblés dans le tableau 4.
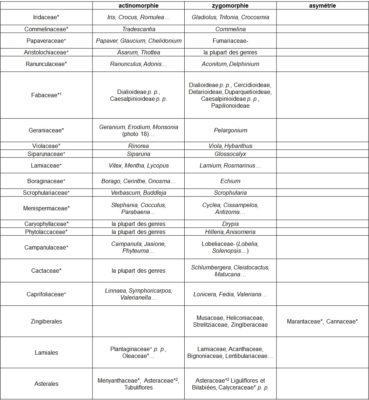
Le gradient ‘actinomorphie – zygomorphie – asymétrie’, ayant trait au degré de symétrie florale, est illustré par le tableau 5.
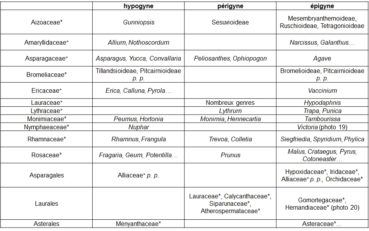
Le gradient ‘hypogyne – périgyne – épigyne’ concerne la position du gynécée par rapport aux autres pièces florales (au-dessus : hypogyne ; entouré : périgyne ; en partie en dessous : épigyne). C’était un caractère important pour la délimitation des familles classiques, notamment chez les Monocotylédones ; la nouvelle systématique en atténue la valeur (tableau 6).
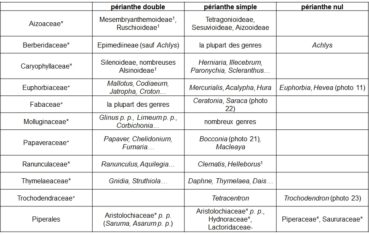
Le gradient ‘périanthe double – périanthe simple – périanthe nul’ est lié à la complexité de l’ensemble ‘calice plus corolle’ ou périanthe (tableau 7).
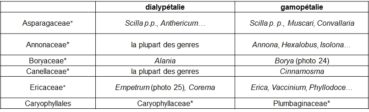
Le gradient ‘dialypétalie – gamopétalie’ a trait au caractère libre (dialypétalie) ou soudé (gamopétalie) des pétales et est illustré par le tableau 8.
La réduction progressive du nombre d’étamines fertiles est notamment marquée chez les
- Annonaceae*, la plupart des genres à étamines toutes fertiles, certains à fleurs pourvues de staminodes (Xylopia, Atopostema, Anaxagorea, Fusaea…) ;
- Geraniaceae* : Geranium à dix étamines fertiles, Erodium à cinq fertiles et cinq stériles ;
- Gesneriaceae* : rarement à cinq étamines fertiles (Ramonda, Sinninga p.), plus souvent à quatre seulement ;
- Pontederiaceae*, avec des genres à six étamines – Eichhornia, Monochoria, Pontederia – et d’autres à trois – Eurystemon, Heteranthera (photo 26), Zosterella… – ou une fertile et deux stériles (Hydrothrix) ;
- Asparagales : la plupart des familles ont deux verticilles fertiles, mais les Iridaceae* ont trois étamines fertiles ; chez les Orchidaceae*, les plus primitives (Apostasioideae et Cypripedioideae) en ont deux ou trois, les autres une seule ;
- Ericales : les Ericaceae+ p. ont deux verticilles staminaux fertiles, les Primulaceae+ ont un verticille fertile et un de staminodes (Theophrastaceae-, dont Samolus), ou un seul verticille fertile (Primulaceae-, Myrsinaceae-) ;
- Zingiberales : le groupe Musaceae* – Heliconiaceae* – Strelitziaceae* est caractérisé par cinq étamines fertiles, le groupe Zingiberaceae* – Costaceae* n’en ayant qu’une, le groupe Marantaceae* – Cannaceae* une demi-étamine.
Le gradient ‘style terminal – style gynobasique’ est lié à la naissance du style par rapport à l’ovaire d’un carpelle (tableau 9 ; pour les Boraginales, cf. Luebert et al., 2016).
Ce gradient illustré par le tableau 10 est lié à la disposition des ovules dans les ovaires, la placentation.
La réduction du nombre de carpelles fertiles est notamment marquée chez
- les Papaveraceae+, avec n carpelles chez les Papaveroideae et deux chez les Chelidonioidae et les Fumarioideae (Fumariaceae-) ;
- les Caprifoliaceae+, avec quatre à cinq carpelles chez les Caprifoliaceae- (Lonicera, Symphoricarpos…) et deux à trois carpelles dont un seul fertile chez les Dipsacaceae-, Valerianaceae-.
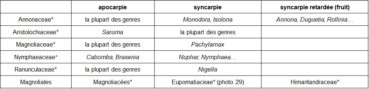
Le caractère libre (apocarpie) ou soudé (syncarpie) des carpelles offre aussi un court gradient, qui peut même être prolongé par la syncarpie retardée où les fruits, dérivés de carpelles libres, se soudent en une masse unique (tableau 11).
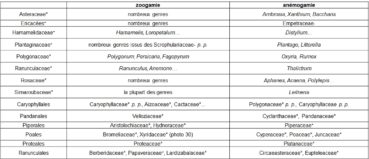
La pollinisation par le vent (anémogamie) ou par les animaux (insectes, oiseaux… ; zoogamie) constitue encore un important gradient (tableau 12).
Au sein d’une même famille, l’évolution du fruit, à partir du type modal déhiscent, peut se faire vers l’indéhiscence, de sorte que le fruit dérivé converge vers le type akène ou affine (samare…). C’est le cas notamment chez
- les Brassicaceae*, où le type modal est la silique (ou silicule par dérivation) qui peut converger vers un akène chez Clypeola, Isatis, Cakile, Rapistrum, Raphanus, Crambe… ;
- les Fabaceae*, où le type modal est la gousse qui peut converger vers un akène chez Onobrychis…, un ensemble de segments akénoïdes (gousse lomentacée de Coronilla, Hippocrepis), voire une samare chez Myroxylon et surtout Tipuana (photo 31).
2.3 Gradients écologiques
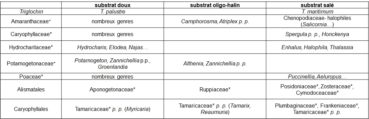
Le degré de minéralisation du substrat (eau, vase, rochers) est un facteur écologique important pour la végétation (tableau 13).
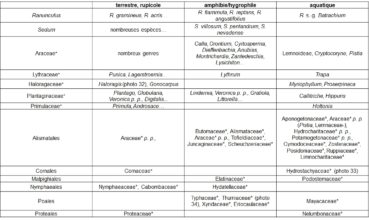
Il en est de même pour la position par rapport au niveau de l’eau (tableau 14).
3. Discussion et conclusion
La première observation qui ressort de ces multiples analyses de gradients au sein des unités systématiques est que tous nos tableaux (à part le 3 très pauvre ; peut-on l’enrichir ?) accueillent à la fois des familles classiques (notées *) et des familles au contenu actualisé (+). Cela signifie que, en définitive, les familles classiques ne sont pas moins hétérogènes que les modernes ; c’est un résultat intéressant qui pourrait faire accepter plus facilement la nouvelle systématique. S’il est des familles modernes qui gagnent en hétérogénéité, d’autres gagnent en homogénéité ; par exemple, le contenu nouveau des Orobanchaceae* devient très cohérent en rapprochant les genres holoparasites (Orobanchaceae classiques) et hémiparasites (Scrophulariaceae- p. p.). S’agit-il d’ailleurs vraiment d’hétérogénéité des taxons ? On préfèrerait plutôt parler de gradient adaptatif au sein des familles. Cela complique toutefois la définition simple et pédagogique d’une famille donnée et, par là même, l’élaboration d’une clé systématique non empirique de reconnaissance.
La seconde remarque qui émerge est que ces gradients n’existent pas seulement au rang de famille, mais aussi, à plusieurs reprises, au niveau des ordres. Si cette observation devrait se généraliser, il faudrait qu’elle se retrouve aussi dans d’autres rangs, supérieurs, comme les classes, ou inférieurs, comme les genres. C’est là que les quelques genres placés dans certains de nos tableaux (Triglochin, Burmannia, Mercurialis, Ranunculus…) prennent tout leur intérêt en confirmant cette symétrie entre taxons de rangs différents ; notamment les gradients biologiques illustrés par le tableau 2 pourraient être considérablement enrichis à ce niveau systématique.
La systématique classique utilise des traits de nature très diverse (morphologique, biochimique, écologique…) pour décrire la structure des familles végétales. Ici, on propose plutôt une description selon un ordonnancement de quelques traits reliés à des gradients choisis a priori. Il s’ensuit que, entre des familles rapprochées dans un même tableau tels que ceux élaborés ici (toujours en dehors du tableau 3), il existe une symétrie, autrement dit un isomorphisme selon ce gradient. Une de ces familles isomorphes pour un gradient donné pourrait être retenue comme modèle (ou encore de paradigme) pour toutes les autres du même tableau. De ce point de vue, les familles monospécifiques sont par définition toutes isomorphes, quel que soit le gradient considéré ; ce sont notamment les suivantes : Aextoxicaceae, Agdestidaceae, Alzateaceae, Amborellaceae, Aphloiaceae, Austrobaileyaceae, Barbeuiaceae, Barbeyaceae, Butomaceae, Centroplacaceae, Cephalotaceae, Curtisiaceae, Cynomoriaceae, Drosophyllaceae, Emblingiaceae, Eucommiaceae, Geissolomataceae, Gomortegaceae, Guamatelaceae, Halophytaceae, Koeberliniaceae, Lanariaceae, Lophopyxidaceae, Maundiaceae, Pentadiplandraceae, Penthoraceae, Petenaeaceae, Petermanniaceae, Plocospermataceae, Rhynchocalycaceae, Scheuchzeriaceae, Setchellanthaceae, Simmondsiaceae, Strasburgeriaceae, Tetracarpaeaceae, Ticodendraceae.
Bibliographie
Angiosperm Phylogeny Group, 2016. An update of the Angiosperm Phylogeny Group classification for the ordres and families of flowering plant: APG IV. Botanical Journal of the Linnean Society 111 : 1-20.
Luebert F. et 19 autres contributeurs (Boraginales Working Group), 2016. Familial classification of the Boraginales. Taxon 65 (3) : 502-522.
The Legume Phylogeny Group, 2017. A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny. Taxon 66 (1) : 44-77.
Remerciements
Ils s’adressent à Pierre Coulot dont la relecture a permis une bonne finalisation de cet article.