Quelques aspects de la végétation observée en Nouvelle-Zélande et en Tasmanie
Title
Some aspects of the vegetation observed in New Zealand and Tasmania
Résumé
La végétation observée lors de deux voyages en Nouvelle-Zélande et Tasmanie est illustrée à travers le littoral, les zones humides et les forêts et leurs lisières. Sept associations végétales nouvelles y sont définies et illustrées, ainsi qu’une alliance et une structure systématique nouvelles.
Abstract
The vegetation observed during two trips to New Zealand and Tasmania is illustrated across the coast, wetlands and forests and their edges. Seven new plant associations are defined and illustrated, as well as one new alliance and one systematic structure.
Suite à un voyage effectué en décembre 2017 dans l’île du Nord (North Island), en Nouvelle-Zélande, je définissais une végétation dunaire originale et une végétation halophile australe (de Foucault, 2019). Un nouveau voyage, cette fois-ci consacré à l’île du Sud (South Island), en janvier 2020, a aussi été l’occasion de nouvelles observations sur la végétation locale dans plusieurs types de formations végétales. Il a été suivi, en février de la même année, d’un voyage en Tasmanie. Le présent article synthétise et illustre les résultats phytosociologiques obtenus dans ces deux îles australes.
La détermination des taxons a été facilitée par divers ouvrages (Dawson & Lucas, 2015 ; Manning et al., 2019), ainsi que par les sites internet suivants : www.nzflora.info et www.nzpcn.org.nz pour la Nouvelle-Zélande, www.flora.tmag.tas..gov.au et www.utas.edu.au pour la Tasmanie. La nomenclature des taxons cités suit Catalogue of Life (www.catalogueoflife.org), sauf pour celle des Nothofagaceae qui suit la révision de Heenan & Smissen (2013). Pour alléger le texte, le nom des sous-espèces autonymes a été abrégé à la lettre initiale (exemple Richea pandanifolia subsp. p.) ; dans les tableaux, le signe * remplace ‘subsp.’ ou ‘var.’. Les taxons arbustifs et arborescents représentés par des formes juvéniles dans les végétations basses sont identifiés par la lettre j à la suite de leur nom. Dans les localisations, National Park a été abrégé en N. P. Les considérations synfloristiques et écologiques feront aussi l’objet de commentaires taxonomiques et phytogéographiques. Pour ne pas éclater l’ensemble du texte, les photos ont été rassemblées dans une « galerie » en fin d’article ; la mise en page n’y respecte pas toujours l’ordre des photos.
1. La végétation littorale
1.1 Les falaises soumises aux embruns
Tout d’abord, en ce qui concerne la végétation littorale, le Selliero radicantis-Samoletum repentis B. Foucault 2019, initialement décrit de l’île du Nord, a été revu dans l’île du Sud, par exemple au niveau des Pancake Rocks de Punakaiki, sur la côte nord-occidentale, entre Greymouth et Westport (photo 1).
1.2 Une sansouire australe
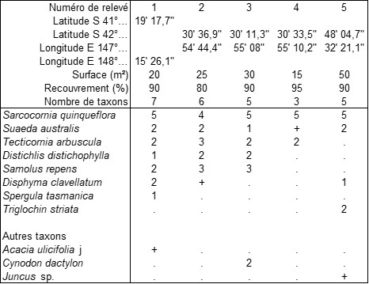
Si on peut étendre le terme de sansouire à la végétation australe chaméphytique riche en Amaranthaceae halophiles, on peut en décrire une des côtes de Tasmanie (photo 2) à partir des cinq relevés du tableau 1, sous le nom de Suaedo australis-Sarcocornietum quinqueflorae ass. nov. hoc loco, typus nominis hoc loco : relevé 1 du tableau 1 hoc loco (photo 3). Combinant Suaeda australis, Tecticornia arbuscula, Sarcocornia quinqueflora, Distichlis distichophylla, Samolus repens, Disphyma clavellatum, les relevés accueillent en moyenne 7 taxons. On reconnaît cette association, avec en outre Sporobolus virginicus et Zoysia macrantha, taxons présents aussi en Tasmanie, au sein de l’Estuarine complex décrit par Keith et Sanders (1990) du sud-est de l’Australie. Cette végétation est homologue de celle des Salicornietea fruticosae boréaux.
1.3 La végétation dunaire de Nouvelle-Zélande
Le Desmoschoeno spiralis-Spinificetum sericei B. Foucault 2019 n’a pas été identifié sur la côte occidentale de l’île du Sud. Il semble se cantonner sur l’île du Nord et peut-être au nord de l’île du Sud. Il est d’ailleurs intéressant de noter que la coupure entre la partie centro-méridionale de l’île du Sud et l’ensemble partie centro-méridionale de l’île du Nord et nord de l’île du Sud a aussi été remarquée sur un plan plus largement phytogéographique par Takhtajan (1986 : 300-301) dans sa distinction entre la Southern Neozeylandic Province et la Central Neozeylandic Province.
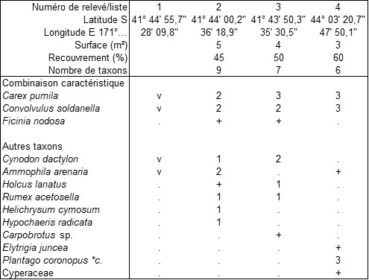
Il faut préciser que les plages parcourues sont souvent dégradées et infiltrées d’une riche flore exotique. Aux environs de Westport et sur la côte centro-orientale, on a cependant pu observer une végétation spontanée caractérisée par Carex pumila, Ficinia nodosa et le taxon subcosmopolite Convolvulus soldanella (tableau 2, trois relevés et une liste), associés à divers xénophytes, dont Ammophila arenaria. On peut définir ici le Convolvulo soldanellae-Caricetum pumilae ass. nov. hoc loco, caractérisé par la combinaison de Carex pumila, Convolvulus soldanella et Ficinia nodosa, typus nominis hoc loco : relevé 2 du tableau 2 hoc loco (photo 4). On remarquera la présence caractéristique de deux Cyperaceae, famille dont le rôle a déjà été noté largement dans les systèmes dunaires tant tropicaux que tempérés ; d’autre part Ficinia nodosa permet de rapprocher cette association du Desmoschoeno spiralis-Spinificetum sericei. Étudiant une dune au nord-est de Haast (île du Sud), Sykes et Wilson (1991) observent Convolvulus soldanella et Desmoschoenus spiralis, mais précisent que Carex pumila manque dans cette station ; Spinifex sericeus y est aussi absent.
1.4 La végétation dunaire de Tasmanie
En Tasmanie, nous avons surtout étudié les dunes des côtes septentrionales (de Wynyard à Devonport) puis orientales (de St Helens à Triabunna). Comme le montre le tableau 3, elles combinent diversement Spinifex sericeus, Ficinia nodosa, Carpobrotus rossii, Poa triodioides (plutôt sur la côte est), Chenopodium candolleanum subsp. c., plus rarement Lepidosperma concavum. Ammophila arenaria y est densément naturalisé, avec parfois de forts coefficients d’abondance-dominance, bien que manquant sur certaines plages ; Euphorbia paralias est irrégulièrement représenté à l’est, alors que Convolvulus soldanella est rare sur l’ensemble des côtes de cette île (de Salas & Baker, 2005). On peut définir ici le Carpobroto rossii-Spinificetum sericei ass. nov. hoc loco, typus nominis hoc loco : relevé 2 du tableau 3 hoc loco, caractérisé par la combinaison de Spinifex sericeus, Carpobrotus rossii, Ficinia nodosa, Euphorbia paralias, Chenopodium candolleanum subsp. c. (photo 5) ; un autre taxon assez fidèle pourrait y être associé, malheureusement il s’agit d’une Poaceae indéterminée un peu à port de Distichlis distichophylla, ce dernier étant plutôt un taxon halophile. Cette association présente deux variations :
- typicum, incluant le type, différencié par Poa triodioides, Lepidosperma concavum, plus rarement une Cyperaceae restée indéterminée, accueillant en moyenne 7,2 taxons par relevé, correspondant aux situations les plus naturelles ;
- une variation encore provisoire différenciée par Mesembryanthemum cordifolium, Elytrigia juncea, Osteospermum fruticosum, des taxons naturalisés liés à des situations plus perturbées, accueillant en moyenne près de 8 taxons par relevé.
Tant en Nouvelle-Zélande qu’en Tasmanie, un contact thérophytique est marqué par Cakile maritima et Atriplex prostrata, un groupement basal relevant des Cakiletea maritimae ici synnaturalisés (de Foucault, 2018 ; photo 6). À Four Mile Creek (Scamander, non loin du relevé 2), il semble se produire une acidification du sable, facilitant l’arrivée de Pteridium esculentum et Lomandra longifolia, taxons fréquents en sous-bois des eucalyptaies sur sol oligotrophe.
1.5. Une nouvelle alliance
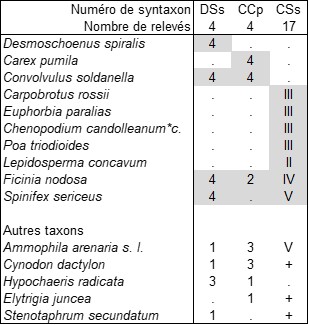
En rapprochant dans un même tableau synthétique le Desmoschoeno-Spinificetum sericei (tableau 4 : syntaxon DSs ; de Foucault, 2019, tableau 1), le Convolvulo-Caricetum pumilae (tableau 4 : syntaxon CCp ; cet article, tableau 2) et le Carpobroto-Spinificetum sericei (tableau 4 : syntaxon CSs ; cet article, tableau 3), il apparaît possible de définir une nouvelle alliance, le Spinifici sericei-Ficinion nodosae all. nov. hoc loco, typus nominis hoc loco : Desmoschoeno spiralis-Spinificetum sericei B. Foucault 2019 (J. Bot. Soc. Bot. France 86 : 13) rassemblant la végétation psammophile australe des côtes néo-zélandaises et tasmaniennes, caractérisée par Ficinia nodosa, Spinifex sericeus, Convolvulus soldanella, vicariante des unités boréales des Euphorbio paraliae-Ammophiletea australis, dont quelques taxons se naturalisent ici. Des investigations plus poussées révèleront si cette alliance pourra englober aussi la végétation dunaire d’Australie continentale, au moins méridionale ; Spinifex sericeus existe dans l’État de Victoria, paraît rarissime dans l’État de Western Australia et manque dans celui de South Australia ; Ficinia nodosa est présent dans les trois États. Mais il est probable que des taxons plus thermophiles apparaissent sur ces côtes.
1.6. Un fourré arrière-dunaire de Tasmanie
En Nouvelle-Zélande, les fourrés localisés en arrière des dunes proprement dites sont souvent structurés par des xénophytes tels que Cytisus scoparius, Ulex europeus, Rubus ulmifolius, Prunus serrulata j, ainsi qu’un Coprosma. Signalons cependant de beaux fourrés plus naturels développés sur falaise à l’ouest de Westport (cap Foulwind, S 41° 44’ 55,7’’, E 171° 28’ 09,8’’), avec Freycinetia banksii, Rhopalostylis sapida (le seul palmier néo-zélandais, ici en limite d’aire vers le sud), Cordyline australis (photo 7) ; on le retrouve aussi un peu plus au sud-ouest, à Punakaiki, avec en outre Griselinia littoralis et un Coprosma (photo 8).
Plus intéressant est celui qui s’étend en arrière du Carpobroto-Spinificetum sericei tasmanien, quasiment dépourvu de xénophytes ; il accueille en effet Acacia longifolia subsp. sophorae, Myoporum insulare (apparemment plus rare sur la côte orientale), Chenopodium candolleanum subsp. c., Correa alba var. rotundifolia, Leptecophylla juniperina subsp. parvifolia, parfois Banksia serrata (au Rocky Cape N. P.), B. marginata, Muehlenbeckia adpressa, moins souvent Alyxia buxifolia, Bursaria spinosa subsp. s., Zieria littoralis, Lycium ferocissimum, Delairea odorata, ces deux derniers naturalisés ; les deux relevés suivants l’illustrent assez bien :
- relevé du 21/02/2020, St Helens, The Gardens, S 41° 10’ 07,7’’, E 148° 16’ 57,9’’, 90 %, 10 m², 7 taxons : Acacia longifolia *sophorae 4, Muehlenbeckia adpressa 2, Correa alba *rotundifolia 2, Alyxia buxifolia 2, Leptecophylla juniperina *parvifolia 2, Chenopodium candolleanum *c. 1, Coprosma repens + ;
- relevé du 21/02/20, St Helens, sur C 848, vers Sloop Lagoon, S 41° 12’ 09,2’’, E 148° 16’ 20,3’’, 100 %, 50 m², 5 taxons : Acacia longifolia *sophorae 3, Leptecophylla juniperina *parvifolia 2, Muehlenbeckia adpressa 2, Banksia marginata 1, Allocasuarina litttoralis j 1.
Le premier de ces deux relevés est retenu ici comme typus nominis hoc loco du Leptecophyllo parvifoliae-Acacietum sophorae ass. nov. hoc loco, fourré arrière-littoral caractérisé par Acacia longifolia subsp. sophorae, Myoporum insulare, Chenopodium candolleanum subsp. c., Correa alba var. rotundifolia, Leptecophylla juniperina subsp. parvifolia, Banksia marginata, Muehlenbeckia adpressa, Alyxia buxifolia, Bursaria spinosa subsp. s., Zieria littoralis (photo 9). Ce fourré est aussi le manteau d’une forêt arrière-littorale à Allocasuarina littoralis, Exocarpos cupressiformis et des Eucalyptus, et est homologue de ceux des Rhamno catharticae-Prunetea spinosae européens.
2. La végétation des zones humides
2.1. Les zones humides de l’île du Sud
Au niveau des zones humides néo-zélandaises, on peut d’abord évoquer la mégaphorbiaie à Convolvulus sepium et Phormium tenax, déjà perçue en 2017 dans l’île du Nord (photo 10). On retrouve ici la place caractéristique d’une monocotylédone zoogame dans des mégaphorbiaies, milieux habituels de dicotylédones zoogames (de Foucault, 2011 ; de Foucault & Corriol, 2013), ces monocotylédones étant surtout représentées par des Zingiberaceae, Costaceae, Commelinaceae et Marantaceae (de Foucault et al., 2011) ; Ph. tenax étant rattaché aux Asphodelaceae (incluant les Hemerocallidaceae), cette famille vient donc s’ajouter aux quatre déjà citées ; rappelons que des Hemerocallis se naturalisent aussi dans des mégaphorbiaies boréales (Tison & de Foucault, 2014 : 301). Il semble d’autre part que les perturbations des milieux de niveau topographique supérieur induisent le développement de Ph. tenax par apophytisation (Kopecký, 1985 ; de Foucault et al., 2011). Une autre station primaire de Ph. tenax est constituée par la végétation herbacée de sous-bois hygrophiles comparable à celle des aulnaies marécageuses à Carex elongata (photo 11).
La végétation amphibie des bordures de lacs glaciaires néo-zélandais est souvent peu développée et donc très décevante : sans doute est-elle banalisée par la fréquentation humaine, les bases de loisirs, la végétation xénophytique… Il n’y a guère que sur les rives du Te Anau Lake que l’on a pu observer une grève colonisée par :
- une végétation amphibie vivace à Lilaeopsis novae-zelandiae et Fonkia uliginosa (= Gratiola sexdentata; photos 12 et 13) ; le second taxon évoque la végétation de prairies inondables des Deschampsietalia cespitosae où Gratiola officinalis joue un rôle important (de Foucault & Catteau, 2012) ; quant au premier taxon, endémique néo-zélandais, il est représentatif d’un genre d’optimum américain incluant quatorze espèces ;
- une végétation amphibie thérophytique à Glossostigma, dont trois espèces sont représentées en Nouvelle-Zélande selon de Lange & Rolfe (2010), cleistanthum, G. diandrum et G. elatinoides; en 2017, au lac Taupo (île du Nord) avait été observé le dernier de ces trois taxons (photo 14) ; c’est à ce niveau que l’on doit aussi y rencontrer Centrolepis glabra selon Ford (2014) et Elatine gratioloides (rencontré dans le sud-est de l’Australie en 2008 ; photo 15) ; cette végétation est clairement homologue de celle des Elatino-Cyperetalia fusci, au sein des Juncetea bufonii.
À propos de cette végétation à Lilaeopsis, on peut rappeler l’étude de Géhu (1975) sur L. attenuata, taxon tempéré est-américain naturalisé au Portugal et dans le nord-ouest de l’Espagne ; ce taxon y est observé au sein de gazons amphibies à Eleocharis acicularis, Littorella uniflora, Triglochin striata naturalisé, un peu comparables à ceux de Te Anau.
On peut maintenant évoquer les tourbières d’altitude, qui ont surtout été parcourues à Arthur’s Pass, entre Christchurch et Greymouth, entre 760 et 889 m d’altitude (photo 16), notamment sur le Bealey Valley Track (S 42° 55’ 09,1’’, E 171° 33’ 30’’), puis Dobson (S 42° 54’ 45,1’’, E 171° 33’ 33,1’’) et Otira Valley (S 42° 53’ 55,5’’, E 171° 33’ 31,6’’). Elles sont caractérisées par Donatia novae-zelandiae, Drosera arcturi, D. spathulata, Gaimardia setacea, Aporostylis bifolia, de petites Epacridaceae (photo 17) ; dans ce cortège manque notamment Phyllachne colensoi, plus rare que Donatia novae-zelandiae ; par ailleurs, on n’y observe guère de sphaignes. Elles rappellent les tourbières de la Tierra del Fuego (Argentine et Chili), caractérisées par Donatia fascicularis, Drosera uniflora, Nanodea muscoides, Tetroncium magellanicum (photo 18), Gaimardia australis…, certaines décrites sous le nom de Donatio fascicularis-Oreoboletum obtusangulae et Drosero uniflorae-Donatietum fascicularis dans le Donation fascicularis (Ramírez et al., 2014). Les Donatia et Phyllachne sont actuellement rattachés à la famille des Stylidiaceae, à dispersion gondwanienne.
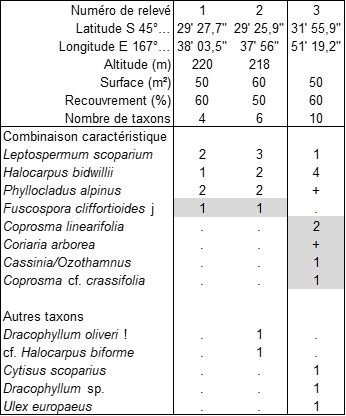
Une tourbière bien différente fut parcourue à Te Anau, sur la partie occidentale du Kepler Track, vers le lieu-dit « Kepler marshes » (S 45° 29’ 27,7’’, E 167° 38’ 03,5’’, 220 m), où l’on observe la mosaïque d’unités suivantes dans un contexte riverain de hêtraie australe à Fuscospora cliffortioides (photo 19) :
- des bombements turfigènes à sphaignes (dont Sphagnum cristatum), Drosera arcturi, spathulata, D. binata, Centrolepis ciliata, une herbe non fleurie au feuillage glauque (Oreobolus pectinatus?) (photo 20) ;
- une lande paraissant liée à un épaississement de la tourbe et à l’affranchissement de la végétation vis-à-vis de la nappe, caractérisée par Dracophyllum oliveri, Thelymitra venosa, Empodisma minus (photos 21 et 22) ;
- un fourré hygrophile oligotrophile à Halocarpus bidwillii dont deux relevés sont rapprochés dans le tableau 5 (nos 1 et 2 ; photo 23).
Manifestement la première unité est homologue de la végétation des Oxycocco-Sphagnetea, qui, on le sait, tend à évoluer vers une lande turficole à Ericaceae (famille représentée ici par les Styphelioideae) par élévation du bombement et assèchement de la tourbe. Quant au fourré à Halocarpus bidwillii, il évoque clairement les fourrés oligotrophiles hygrophiles à Frangula alnus. On sait aussi que ce dernier arbuste caractérise aussi des fourrés oligotrophiles plus mésophiles (de Foucault & Royer, 2014) ; il est donc remarquable de retrouver une végétation arbustive oligotrophile mésoxérophile dans la Wilderness Scientific Reserve localisée entre sur la route 94 entre Te Anau et Mossburn, dont un relevé est aussi placé dans le tableau 5 (n° 3) ; logiquement, à côté d’un fond arbustif oligotrophile commun, quelques arbustes de niveau topographique supérieur différencient cette végétation de celle de la tourbière, dont deux xénophytes d’origine boréale (photo 24). Pour le syntaxon de tourbière, on peut définir l’Halocarpo bidwillii-Phyllocladetum alpini ass. nov. hoc loco, typus nominis hoc loco : relevé 2 du tableau 5 hoc loco, caractérisé par la combinaison de Halocarpus bidwillii, Phyllocladus alpinus, Leptospermum scoparium, Fuscospora cliffortioides juvénile.
Cette végétation appelle les commentaires suivants. On note d’abord l’importance des Centrolepidaceae vivaces, avec deux genres sur les trois connus dans cette famille, Centrolepis et Gaimardia (le troisième, Aphelia, rassemble des espèces annuelles), se rattachant aux Poales, famille toutefois incluse dans les Restionaceae par APG IV (2016). Halocarpus et Phyllocladus sont deux genres de Podocarpaceae (incluant Phyllocladaceae), famille d’optimum austral, le premier genre étant endémique de Nouvelle-Zélande.
Signalons encore pour achever cette partie l’existence d’une végétation vivace très ouverte colonisant lâchement les terrasses alluviales soumises à des inondations intermittentes, à substrat formé d’un mélange de galets roulés et de sable, surtout caractérisée par Raoulia tenuicaulis et Epilobium pycnostachys (photos 25 et 26) ; cette végétation rappelle beaucoup celle de l’Epilobion fleischeri d’Europe. Le genre Raoulia, de la famille des Asteraceae (tribu des Gnaphalieae), est endémique de Nouvelle-Zélande et rassemble vingt-trois espèces, surtout orophiles.
2.2. Les zones humides de Tasmanie
Les tourbières à Donatia novae-zelandiae et Phyllachne colensoi existent aussi en Tasmanie, mais n’ont pas été parcourues lors du séjour. En revanche, au niveau de dépressions mal drainées, Drosera arcturi, Dracophyllum minimum, un Centrolepis, Gaimardia setacea caractérisent certaines d’entre elles à Hartz Mountain N. P. (photos 27 et 28), taxons auxquels on peut ajouter Gunnera cordifolia. En comparant les tourbières de Nouvelle-Zélande à celles de Tasmanie, on reconnaît l’invariance d’un type biologique particulier, les chaméphytes à coussinets denses, tant chez Donatia, Phyllachne, Dracophyllum que chez Centrolepis et Gaimardia.
Dans cet État australien, à côté des tourbières, on peut évoquer une mare du Tasmanian Bushland Garden (commune de Buckland) peuplée par une végétation hydrophytique à Ornduffia reniformis et Myriophyllum variifolium (photo 29 ; Ornduffia est un genre récemment séparé de Villarsia par Tippery & Les, en 2009, au sein des Menyanthaceae), bordée par une parvoroselière à Baloskion tetraphyllum et Carex fascicularis (morphologiquement très ressemblant à C. pseudocyperus) et une ceinture amphibie vivace à Mazus pumilio, Ranunculus prasinus et Lobelia pedunculata. Sur la côte orientale, à St Helens (lieu-dit « Eloura », S 41° 23’ 43,3’’, E 148° 16’ 48,3’’), une mare sur sable acide au sein d’une eucalyptaie oligotrophile présentait une ceinture amphibie vivace à Goodenia humilis et Drosera pygmaea (photo 30), associée à une ceinture thérophytique à Centrolepis strigosa, Lachnagrostis filiformis, Isolepis setacea, évoquant à nouveau les Juncetea bufonii boréaux. Lachnagrostis est un genre de Poaceae à infrutescence souvent dispersée en entier, qui évoque morphologiquement des Aira à longs pédicelles (type elegantissima ou provincialis ; photo 31), mais les épillets sont le plus souvent uniflores, de sorte qu’il est plus proche des Agrostis ; toutefois c’est un genre polyphylétique, certaines espèces étant proches des Polypogon, d’autres des Agrostis (Saarela et al., 2010).
Il existe aussi des chemins inondables, comme par exemple à Rocky Cape N. P. où l’on peut rencontrer Selaginella uliginosa (photo 32), Utricularia dichotoma, Xyris operculata ; ce dernier genre est représenté par trois autres espèces en Tasmanie, alors que les Eriocaulaceae, famille qui accompagne souvent les Xyridaceae en région tropicale, y sont absentes.
Vers l’aéroport d’Hobart, entre le Travel Lodge et le Tasmanian Gourmet Seafoods (S 42° 49’ 55,6’’, E 147° 29’ 51,1’’), une pelouse thérophytique à Parapholis incurva, Cotula coronopifolia, Oxybasis glauca, Plantago coronopus se développe en conditions édaphiques plus ou moins salées (photo 33), évoquant les Saginetea maritimae européens. Non loin, en conditions bien moins salées, Cotula coronopifolia abondant s’associe à Lythrum hyssopifolia et Lachnagrostis cf. filiformis, donc évoquant à nouveau plutôt les Juncetea bufonii.
3. La végétation forestière
3.1. La végétation forestière de la Nouvelle-Zélande
Globalement, les associations arborescentes des forêts néo-zélandaises combinent diversement des Gymnospermes (Dacrycarpus dacrydioides, Dacrydium cupressinum, Phyllocladus trichomanoides var. t. et var. alpinus, Podocarpus totara, Prumnopitys ferruginea, P. taxifolia), des Nothofagaceae (Fuscospora cliffortioides, F. fusca, Lophozonia menziesii), des fougères « arborescentes » (Alsophila dealbata, Cyathea medullaris, Dicksonia fibrosa, D. antarctica, D. squarrosa), ainsi que Alectryon excelsus, Elaeocarpus hookerianus, Fuchsia excorticata, Plagianthus regius subsp. r., Freycinetia banksii, Carpodetus serratus, Metrosideros umbellata, Hedycarya arborea, Sophora microphylla, Weinmannia racemosa. Les essences suivantes caractérisent plutôt l’île du Nord et le nord de l’île du Sud : Agathis australis, Libocedrus plumosa, Fuscospora solandri, Knightia excelsa, Metrosideros excelsa, Cordyline indivisa, Beilschmiedia tawa, Corynocarpus laevigatus, Rhopalostylis sapida, Syzygium maire, Vitex lucens, Sophora tetraptera ; on trouvera plusieurs photographies de ces taxons dans de Foucault (2020 : partie A, IV).
Dans l’île du Sud, à plusieurs reprises, au niveau de cours d’eau, nous avons observé une ripisylve à Salix fragilis et S. alba (photo 34) ; il s’agit clairement d’un nouveau cas de synnaturalisation, celui du Salicetum albo-fragilis européen, parfois en relation avec un fourré lui-même hygrophile à Salix purpurea, S. elaeagnos (Salicetea purpureae synnaturalisés). Ainsi, ce sont onze Salix, dont sept d’Europe, qui sont naturalisés en Nouvelle-Zélande, aucun n’y étant spontané (Howell & Sawyer, 2006).
Les associations arbustives et arbrisselées, tant en sous-bois qu’en lisière, sont le domaine des Coprosma (Rubiaceae ; C. grandifolia, C. spathulata, C. virescens, C. cf. pseudocuneata), des Pittosporum (P. eugenioides, P. ralphii, P. colensoi, P. cf. cornifolium), des Pseudopanax (Araliaceae ; Ps. crassifolius, Ps. discolor, Ps. ferox, Ps. colensoi, Ps. arboreus, Ps. laetus, Ps. lessonii), des lianes (Ripogonum scandens, Rubus cissoides, R. squarrosus, Parsonsia capsularis, Clematis foetida, C. paniculata), ainsi que Aristotelia serrata, Ascarina lucida, Corokia cotoneaster, C. buddlejoides, Geniostoma rupestre var. ligustrifolium, Melicytus lanceolatus, M. ramiflorus, Myrsine australis, Brachyglottis repanda, Pomaderris oraria subsp. novaezelandiae, P. phylicifolia, Pseudowintera colorata, Rhabdothamnus solandri, Rhopalostylis sapida (surtout île du Nord et nord de l’île du Sud ; photo 35). Les lisières sont plutôt l’habitat de Dodonaea viscosa, Lophomyrtus bullata, Macropiper excelsum, Melicope ternata, Olearia ilicifolia, Plagianthus divaricatus, Entelea arborescens, Griselinia lucida, G. littoralis, Cordyline australis, Coriaria arborea.
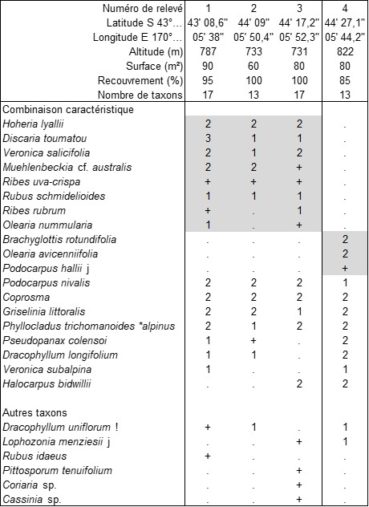
Parmi les lisières arbustives les mieux caractérisées, évoquons le fourré montagnard étudié au pied du mont Cook (île du Sud, point culminant de l’archipel à 3 724 m) décrit par les trois relevés du tableau 6 (relevés 1 à 3), correspondant à une association originale, le Discario toumatou-Hoherietum lyallii ass. nov. hoc loco, typus nominis hoc loco : relevé 2 du tableau 6 hoc loco, caractérisée par la combinaison de Discaria toumatou, Hoheria lyallii, Veronica salicifolia, Rubus schmidelioides, Olearia nummularia, Phyllocladus trichomanoides var. alpinus, Pseudopanax colensoi, Dracophyllum longifolium (photo 36) ; accueillant près de 16 taxons en moyenne par relevé, il se développe surtout autour de 750 m d’altitude. Le relevé 4 est assez différent : c’est la lisière interne de la forêt à Lophozonia menziesii (photo 37) s’étendant au-dessus de 800 m. ce fourré quelque peu alticole paraît homologue de ceux des Betulo-Alnetea viridis.
Dans les collines autour de Twizel, Discaria toumatou caractérise un fourré de plus basse altitude, associé à Carmichaelia petriei et de nombreux pieds de Rosa du groupe micrantha-rubiginosa naturalisé. Le genre aphylle Carmichaelia est quasiment endémique de Nouvelle-Zélande, avec vingt-trois espèces (une seule en Australie, à l’île Lord Howe).
Pour clore cette partie consacrée aux lisières arbustives, il faut encore citer des clairières intraforestières à Schefflera digitata (photo 38), où l’Araliaceae éponyme est accompagnée de Sambucus nigra, Leycesteria formosa, Ulex europaeus, Convolvulus tuguriorum, Solanum dulcamara, S. laciniatum, Cytisus scoparius, Aristotelia serrata, Salix caprea, Fuchsia cf. boliviana, Pittosporum tenuifolium, un Coprosma, Muehlenbeckia australis, Acer pseudoplatanus j. On notera l’importance des taxons naturalisés, la parenté systémique et synfloristique avec les fourrés européens du Sambuco-Salicion capreae (de Foucault & Royer, 2016) et la confirmation de la place de certaines Araliaceae dans cette situation (de Foucault, 2020 : Partie A, I.1).
La végétation des sous-bois herbacés est souvent caractérisée par diverses fougères (Asplenium bulbiferum, A. oblongifolium, Cranfilia fluviatilis, Parablechnum novae-zelandiae, P. procerum, Parapolystichum microsorum subsp. pentangularis, Marattia salicina, Histiopteris incisa, Pneumatolepis pennigera, Polystichum vestitum, Lomaria discolor, Cardiomanes reniformis, Pellaea rotundifolia, Phymatosorus pustulatus, Hypolepis millefolium, Rumohra adiantiformis, Sticherus cunninghamii), des Orchidaceae sciaphiles (Pterostylis banksii et d’autres du même genre, Gastrodia cunninghamii mycotrophe non chlorophyllien), trois Urticaceae (Australina pusilla, Urtica incisa, Elatostema rugosum), ainsi que Astelia nervosa, Chasmanthe latifolium, Dianella nigra, Jovellana sinclairii, Lagenophora pumila, Libertia pulchella, Mazus radicans, Ourisia macrophylla, Viola cunninghamii… Tout particulièrement, les fougères forment de belles banquettes sur les ruptures de pente (photo 39) ; on retrouve ici ces « talus à fougères » déjà évoqués ailleurs dans le monde (de Foucault, 2020 : partie C, III, alliance AM).
La végétation bryophytique est bien représentée aussi sous ces ambiances hautement humides. On peut observer de beaux bryochaméphytes dendroïdes qui forment les bryoclimax locaux, dont l’acrocarpe Dawsonia superba (une des plus « grandes » acrocarpes du monde ; photo 40), Dendroligotrichum dendroides (photo 41), Hypnodendron kerrii, des Trichocolea.
Dans les zones de suintements plus ou moins ombragées, on peut observer des microphorbiaies crénicoles à petits végétaux à feuilles arrondies, des Epilobium (photo 42) et des Nertera (photo 43). Le premier genre est représenté par plus de quarante-cinq taxons dans cet archipel (dont E. nerteroides à la morphologie végétative convergeant vers celle d’un Nertera), le second par six espèces ; on retrouve ici les feuilles arrondies et le rôle des Epilobium dans ce type de végétation comme dans les Montio-Cardaminetea amarae qui en sont les homologues boréaux (de Foucault, 2018b).
Les épiphytes ne sont pas rares au sein de ces forêts, notamment sur les troncs de fougères arborescentes, surtout des ptéridophytes : Asplenium flaccidum, Pseudodiphasium volubile, Notogrammitis heterophylla, Huperzia varia, Pyrrosia elaeagnifolia, Tmesipteris elongata (cinq à six taxons connus en Nouvelle-Zélande dans ce genre de Psilotaceae ; Brownsey & Perrie, 2015 ; photo 44), de nombreuses Hymenophyllaceae, mais aussi Collospermum hastatum, Earina mucronata, Luzuriaga parviflora, Metrosideros perforata…
Dans les lisières basses, à valeur d’ourlet, s’étendent plus ou moins largement des landes à Ericaceae et lycopodes ; ainsi sur la route R 73 vers Arthur’s Pass, cette lande à Austroblechnum penna-marina et Ericaceae (photo 45), une autre encore à la Wilderness Scientific Reserve entre Mossburn et Te Anau avec un lycopode et une Ericaceae (photo 46). Plus précisément, l’une d’elles a fait l’objet d’un relevé :
lisière chaméphytique de la forêt à Lophozia menziesii (Governors Bush Walk, Mount Cook Village, S 43° 44’ 27,1’’, E 170° 05’ 44,2’’, 822 m, 6 m², 100 %, 6 taxons, photo 47) : Podocarpus nivalis 4, Diphasium scariosum 3, Gaultheria antipoda 2, Dracophyllum sp. +, Austroblechnum penna-marina +, Phormium colensoi +.
Une lande très affine existe aussi à une altitude comparable (vers 800 m) à Arthur’s Pass. On peut définir ici une association originale de lande alticole, le Diphasio scariosi-Podocarpetum nivalis ass. nov. hoc loco, typus nominis hoc loco : relevé de Governors Bush Walk ci-dessus, caractérisé par la combinaison de Podocarpus nivalis, Diphasium scariosum, Gaultheria antipoda, Austroblechnum penna-marina, Leucopogon fraseri. À noter encore, toujours au mont Cook, mais à plus basse altitude (vers 730 m), une lande où une Ericaceae et Podocarpus nivalis accompagnent un Aciphylla (photo 48). Bardés d’épines vulnérantes (feuilles, bractées…) et donc difficiles d’étude, les Aciphylla (photo 49) constituent un remarquable genre d’Apiaceae d’optimum néo-zélandais (environ trente-sept taxons dans cet archipel, surtout dans l’île du Sud, deux autres en Australie ; voir une revue et une clé une peu anciennes in Oliver, 1956), caractérisant surtout les pelouses, souvent associés à des Chionochloa (photo 50).
3.2. La végétation forestière de Tasmanie
De nombreuses forêts ont été parcourues en Tasmanie ; pour les plaines et collines, les sites sont localisés à St Helens, Douglas Apsley N. P., Launceston (Cataracte Gorge Reserve), Buckland (Tasmanian Bushland Reserve), Hobart (Mount Wellington), Coles Bay (Freycinet N. P.) ; à plus haute altitude, ce sont les Hartz Montain N. P., Mount Field N. P. et Cradle Moutain – Lake Saint Clair N. P. Plusieurs d’entre elles ont été étudiées par Jarman et al. (1994), dont la figure 1 montre que leur optimum se situe dans le tiers occidental de l’île.
À basse altitude d’abord, la végétation forestière arborescente est surtout caractérisée par la combinaison de taxons des genres suivants : Eucalyptus (E. globulus subsp. g., E. amygdalina…), Allocasuarina (A. littoralis, A. verticillata…), Acacia (A. mearnsii, A. dealbata…), ainsi que Callitris rhomboidea, Exocarpos cupressiformis… Le sous-bois arbustif et arbrisellé est assez riche : Pimelea drupacea, Pomaderris apetala, Coprosma hirtella, C. nitida, Micrantheum hexandrum, Notelaea ligustrina, Asteraceae (Olearia argophylla, O. phlogopappa, O. viscosa, Ozothamnus rosmarinifolius, O. scutellifolius), Lamiaceae (Prostanthera lasianthos, Westringia brevifolia), Zieria arborescens subsp. a., Clematis clitorioides, Melaleuca gibbosa… Les fougères arborescentes, dont Dicksonia antarctica, caractérisent des forêts à l’ambiance mésoclimatique assez humide ou possédant des terrasses alluviales inondables (photo 51). Le sous-bois chaméphytique et herbacé vivace accueille surtout Astroloma humifusum, Lomandra longifolia, Pteridium esculentum, Xanthorrhoea australis… (photo 52), parfois Carpobrotus rossii qui quitte les dunes (photo 53), et, quand l’ambiance mésoclimatique est assez humide, Drymophila cyanocarpa, Gonocarpus tetragynus, Carex cheesemanniana, Dipodium roseum (une orchidée mycotrophe), Hydrocotyle hirta, Libertia pulchella, Urtica incisa et des fougères plus exigeantes (Histiopteris incisa, Parablechnum wattsii).
Les lisières ligneuses sont caractérisées par des Fabaceae (Bossiaea cordigera, Goodia lotifolia, Platylobium triangulare, Acacia terminalis, A. genistifolia), Pittosporaceae (Bursaria spinosa subsp. s., Billardiera longifolia), Proteaceae (Hakea cf megadenia, H. lissosperma, Banksia marginata, Lomatia tinctoria, Persoonia juniperina), Ericaceae (Gaultheria hispida, Monotoca glauca, Epacris impressa, Pentachondra involucrata), Goodenia ovata, Cucumis myriocarpus, Dodonaea viscosa subsp. spatulata, Boronia anemonifolia, B. pilosa, Calytrix tetragona au Rocky Cape N. P., Thryptomene micrantha au Freycinet N. P.
À Maria Island, au large de Triabunna, Ludeke (2005) confirme la structure de cette végétation de basse altitude en rapportant la végétation forestière suivante :
- association arborescente à Eucalyptus globulus g., E. obliqua, E. viminalis, E. pulchella, E. amygdalina, E. ovata, Allocasuarina monilifera, A. verticillata, A. littoralis, Acacia verticillata subsp. v., A. melanoxylon, A. dealbata subsp. d., Exocarpos cupressiformis;
- association arbustive intraforestière à Banksia marginata, Pomaderris apetala, Bedfordia salicina, Olearia argophylla, phlogopappa, Bursaria spinosa subsp. s., Zieria arborescens subsp. a., Dicksonia antarctica, Alsophila australis subsp. a.
Certains taxons appellent des commentaires : Drymophila cyanocarpa est une monocotylédone proche des Luzuriaga épiphytes de Patagonie et Nouvelle-Zélande, les deux genres étant anciennement rattachés aux Luzuriagaceae, famille aujourd’hui incluse dans les Alstroemeriaceae. Le genre Gonocarpus est proche des Haloragis, dans la famille des Haloragaceae.
À plus haute altitude, dans la végétation arborescente, les acacias paraissent régresser ou disparaissent au profit des Nothofagaceae et de Gymnospermes autres que les Callitris, alors que les Eucalyptus sont représentés par des essences particulières : Eucalyptus coccifera, E. subcrenulata, Lophozonia cunninghamii, Atherosperma moschatum subsp. m., Athrotaxis cupressoides, A. selaginoides, Lagarostrobos franklinii, Phyllocladus aspleniifolius, Eucryphia lucida. La végétation arbustive et arbrisellée est diversifiée, et d’ailleurs ne se distingue guère de celle des fourrés extra-forestiers car la végétation arborescente est plutôt dispersée : Allocasuarina zephyrea, Anopterus glandulosus, Muehlenbeckia gunnii, Fuscospora gunnii, Pherosphaera hookeri, Pimelea linifolia, P. sericea, Pomaderris argophylla, Tetracarpaea tasmanica, Coprosma nitida, Diselma archeri, Drimys aromatica, Eucryphia milliganii, Proteaceae (Banksia marginata, Cenarrhenes nitida, Lomatia polymorpha, Persoonia gunnii, Telopea truncata, Orites acicularis, Hakea epiglottis, H. lissosperma), Ericaceae surtout Styphelioideae (Richea gunnii, R. scoparia, R. sprengelioides, R. pandanifolia subsp. p., Gaultheria hispida, Sprengelia incarnata), Myrtaceae (Leptospermum lanigerum, Melaleuca squamea), Asteraceae (Olearia pinifolia, Ozothamnus argophyllus, O. hookeri). La photo 54 montre un exemple de fourré d’altitude à Richea pandanifolia dans des ravines (les taxons associés n’ont pu être précisés car la circulation hors des sentiers balisés est interdite dans ce parc national). De même la végétation du sous-bois chaméphytique et herbacé ne se distingue guère de celle des landes extra-forestières (photos 55 et 56) : Asteraceae (Xerochrysum milliganii, X. subundulatum, Abrotanella forsterioides, Senecio pectinatus, Craspedia glauca), Ericaceae Styphelioideae (Epacris serpyllifolia, Pentachondra pumila, Trochocarpa thymifolia), Cyperaceae (Carpha alpina, Gymnoschoenus sphaerocephalus, Gahnia grandis), Restionaceae (Eurychorda complanata, Empodisma minus, Winifredia sola), Astelia alpina, Baeckea gunniana, Bauera rubioides, Exocarpos humifusus, Diphasium scariosum, Hibbertia procumbens, Microcachrys tetragona, Milligania densiflora, Oxalis magellanica, Pterostylis sp., Stylidium graminifolium, Euphrasia gibbsiae, Gentianella diemensis, Geranium potentilloides, Gleichenia alpina, Gonocarpus montanus, Bellendena montana, Mitrasacme serpyllifolia, Boronia citriodora, B. rhomboidea.
Là encore, plusieurs de ces taxons méritent des commentaires : Athrotaxis et Diselma (Cupressaceae) sont deux genres endémiques tasmaniens de respectivement deux et une espèces. Les Podocarpaceae sont représentés par les genres Phyllocladus, Lagarostrobos (genre monospécifique endémique, au bois précieux connu sous le nom de Huon pine, du nom du petit fleuve qui coule à l’ouest de Hobart), Pherosphaera, Microcachrys (deux genres monospécifiques endémiques). Plusieurs familles gondwaniennes sont représentées ici : Winteraceae (avec Drimys aromatica longtemps appelé Tasmannia lanceolata), Atherospermataceae (famille séparée des Monimiaceae, avec Atherosperma monospécifique), Cunoniaceae (avec Eucryphia, genre de sept espèces du Chili et d’Australie, et Bauera), Escalloniaceae (avec Anopterus). Le beau Tetracarpaea tasmanica (photo 57) est le seul représentant de la famille endémique des Tetracarpaeaceae, proche des Haloragaceae, et Oxalis magellanica représente une espèce commune à la Patagonie, l’Australie et la Nouvelle-Zélande. Plusieurs espèces de Restionaceae ont été citées comme participant aux landes tasmaniennes ; l’importance du sclérenchyme dans les tiges, leur caractère scléromorphe… conduisent en effet à considérer beaucoup de leurs représentants comme des chaméphytes, voire des nanophanérophytes qui s’associent aux Ericaceae et aux Proteaceae ; ces observations confirment le constat que j’avais fait en découvrant le fynbosh sud-africain où l’on observe la même situation avec d’autres familles locales (Bruniaceae, Penaeaceae, Scrophulariaceae au sens APG IV… ; de Foucault, 2000).
3.3. Une nouvelle structure systématique
En comparant la flore forestière tempérée australe de la Patagonie (P), de l’Afrique du Sud (AS), de Madagascar (M), de la Tasmanie (T) et de la Nouvelle-Zélande (NZ), et même de Nouvelle-Calédonie (NC), on est amené à définir une nouvelle structure systématique de rang familial (de Foucault, 1987) caractérisée par la combinaison des familles principales suivantes :
- les Araucariaceae : Agathis (NZ, NC), Araucaria (P, NC) ;
- les Podocarpaceae : Acmopyle (NC), Afrocarpus (AS), Dacrycarpus (NZ, NC), Dacrydium (NZ, NC), Falcatifolium (NC), Halocarpus (NZ), Lagarostrobos (T), Lepidothamnus (NZ), Manoao (NZ), Phyllocladus (NZ, T ; fossile en P), Podocarpus (largement distribué), Prumnopitys (P, NZ, NC), Retrophyllum (NC), Saxegothaea (P) ;
- les Cupressaceae : Athrotaxis (T), Austrocedrus (P), Callitris (T, NC), Fitzroya (P), Widdringtonia (AS), Libocedrus (NZ, NC), Neocallitris (NC) ;
- les Monimiaceae : Hedycarya (NZ), Tambourissa (M) ;
- les Winteraceae : Drimys (P, T, NZ), Takhtajania (M) ; fossiles en AS (Vink, 1993, figure 140) ;
- les Proteacae : plusieurs genres ;
- les Atherospermataceae : Atherosperma (T), Laurelia (P, NZ), Laureliopsis (P), Nemuaron (NC) ;
- les Cunoniaceae : Ackama (NZ), Acsmithia (NC), Anodopetalum (T), Caldcluvia (P), Codia (NC), Cunonia (AS, NC), Eucryphia (P, T), Geissois (NC), Pancheria (NC), Platylophus (AS), Weinmannia (largement distribué) ;
- les Myrtaceae : plusieurs genres ;
- les Nothofagaceae : Lophozonia (P, NZ, T), Fuscospora (P, NZ, T), Nothofagus (P), Trisyngyne (NC).
Cette nouvelle F-structure peut être dénommée S(Cunoniaceae-Podocarpaceae), d’optimum gondwanien, et est la vicariante australe de la S(Rosaceae-Pinaceae) boréale (de Foucault, 2020). Les Corynocarpaceae (NZ, NC), les Casuarinaceae (T, NC), les Paracryphiaceae (T, NC, NZ) et les Rousseaceae (NZ) en différencient une aile plutôt est-gondwanienne. Elle doit atteindre la Nouvelle-Guinée et le sud-est de l’Australie continentale, avec Araucariaceae (Wollemia), Casuarinaceae, Cunoniaceae (Callicoma), Nothofagaceae (Lophozonia), Winteraceae fossiles (Vink, 1993, figure 140).
4. La végétation rupicole
Sur quelques corniches rocheuses éclairées à semi-ombragées (environs de Fairlie, Ben Lomond à Queenstown, île du Sud ; Cataracte Gorge Reserve à Launceston et Douglas Apsley N. P., Tasmanie), on peut observer une végétation chasmophytique évoquant celle des Asplenietea trichomanis, avec Asplenium flabellifolium, A. richardii, Cheilanthes sieberi, Pelargonium australe (en Tasmanie), parfois Sophora prostrata, Geranium sessilifolium (photo 58).
5. Conclusion
Au-delà d’une moisson photographique conséquente de plantes australes, sur le plan phytosociologique, ces deux voyages ont donc permis de décrire sept associations végétales, une alliance et une structure formelle systématique nouvelles. Celui dans l’île du Sud a permis aussi de remarquer de nouveaux exemples de végétation synnaturalisée, les Cakiletea maritimae et le Salicetum albo-fragilis. Diverses composantes de cette végétation australe peuvent être comparées à leurs homologues boréales. De ce point de vue, il vient l’idée que le synsystème européen pourrait servir de paradigme (ou modèle) pour les futures études phytosociologiques hors Europe, moyennant des homologies floristico-écologiques et des invariants de tous ordres. Devant cette magnifique végétation est-gondwanienne, les phytosociologues européens ne peuvent que regretter que les botanistes australiens, néo-zélandais… n’aient pas plus cette fibre phytosociologique, alors qu’ils mènent divers travaux phyto-écologiques de qualité.
Bibliographie
Angiosperm Phylogeny Group, 2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society 181 : 1-20.
Brownsey P.J. & Perrie L.R., 2015. Psilotaceae. In I. Breitwieser, P.B. Heenan & A.D. Wilton, Flora of New Zealand, Ferns and lycophytes 9 : 1-22.
Dawson J. & Lucas R., 2015. Nature guide to the New Zealand forest. Random House New Zealand, Auckland, 312 p.
Ford K.A., 2014. Centrolepidaceae. In I. Breitwieser, P.J. Brownsey, P.B. Heenan & A.D. Wilton (coord.), Flora of New Zealand 2 : 1-24.
Foucault B. (de), 1987. Nouvelles recherches sur les structures systématiques végétales : caractérisation, ordination, signification. Phytocoenologia 15 (2) : 159-199.
Foucault B. (de), 2000. Notes sur la végétation observée dans les régions du Cap et du Karoo (Afrique du Sud). Bulletin de la Société de botanique du nord de la France 53 (2-3) : 9-16.
Foucault B. (de), 2011. Contribution au prodrome des végétations de France : les Filipendulo ulmariae-Convolvuletea sepium Géhu & Géhu-Franck 1987. Journal de botanique de la Société botanique de France 53 : 73-137.
Foucault B. (de), 2018a. Errata et compléments à propos du Prodrome des végétations de France, cinquième note. Journal de botanique de la Société botanique de France 81 : 39-52.
Foucault B. (de), 2018b. Contribution au prodrome des végétations de France : les Montio-Cardaminetea amarae Braun-Blanq. & Tüxen ex Klika & Hadač 1944. Documents phytosociologiques, 3e série, 7 : 1-86.
Foucault B. (de), 2019. Notes phytosociologiques sur la végétation littorale de Nouvelle-Zélande (île du Nord) et d’Australie sud-occidentale. Journal de botanique de la Société botanique de France 86 : 11-16.
Foucault B. (de), 2020. Éloge du paradigme synusial : alternative à la classification phytosociologique de la végétation forestière européenne, ouest-asiatique et nord-africaine. Evaxiana 7, à paraître.
Foucault B. (de), Batawila K., Wala K. & Akpagana K., 2011. Une formation végétale méconnue pour l’Afrique tropicale, la mégaphorbiaie ; le cas du Marantochloo – Anubiadetum giganteae du Togo. Acta Botanica Gallica 158 (3) : 409-424.
Foucault B. (de) & Catteau E., 2012. Contribution au prodrome des végétations de France : les Agrostietea stoloniferae Oberd. 1983. Journal de botanique de la Société botanique de France 59 : 5-131.
Foucault B. (de) & Corriol G., 2013. Contribution au prodrome des végétations de France : les Mulgedio alpini-Aconitetea variegati Hadač & Klika ex Klika 1948. Journal de botanique de la Société botanique de France 61 : 49-87.
Foucault B. (de) & Royer J.-M., 2014. Contribution au prodrome des végétations de France : les Franguletea alni Doing ex V. Westh. in V. Westh. & den Held 1969. Journal de botanique de la Société botanique de France 66 : 83-106.
Foucault B. (de) & Royer J.-M., 2016. Contribution au prodrome des végétations de France : les Rhamno catharticae-Prunetea spinosae Tüxen 1962. Documents phytosociologiques, 3e série, 2 : 150-343.
Géhu J.-M., 1975. Synécologie de Lilaeopsis attenuata (Hooker et Arnott.) Fernald dans l’extrême nord-ouest de l’Espagne. Anales del Instituto Botánico A.J. Cavanilles 32 (2) : 993-1004.
Heenan P.B. & Smissen R.D., 2013. Revised circumscription of Nothofagus and recognition of the segregate genera Fuscospora, Lophozonia, and Trisyngyne (Nothofagaceae). Phytotaxa 146 (1) : 1-31.
Howell C. & Sawyer J.W.D., 2006. New Zealand naturalised vascular plant checklist. New Zealand Plant Conservation Network, Wellington, 60 p.
Jarman S.J., Kantvilas G. & Brown M.J., 1994. Phytosociological studies in Tasmanian cool temperate rainforest. Phytocoenologia 22 (3) : 355-390.
Keith D.A. & Sanders J.M., 1990. Vegetation of the Eden Region, south-eastern Australia: species composition, diversity and structure. Journal of Vegetation Science 1 (2) : 203-232.
Kopecký K., 1985. Der Apophytisierungsprozeß am Beispiel der Saumgesellschaften mit Chaerophyllum aromaticum L. in der Tschechoslowakei. Tuexenia 5 : 127-130.
Lange P.J. (de) & Rolfe J.R., 2010. New Zealand indigenous vascular plant checklist. New Zealand Plant Conservation Network, Wellington, 131 p.
Ludeke M., 2005. Tasmania’s Maria Island, a comprehensive history and visitor’s guide, 2nd edition. Hobart, édité par l’auteur, 128 p.
Manning K., Simmons M., Skabo R., Wapstra M. & Wright P., 2019. A guide to flowers & plants of Tasmania, 5th edition. Launceston Field Naturalists Club, 192 p.
Oliver W.R.B., 1956. The genus Aciphylla. Transactions of the Royal Sociey of New Zealand 84 (1) : 1-18.
Ramírez C., San Martín C., Vidal O., Pérez Y., Valenzuela J., Solís J.-L. & Toledo G., 2014. Tundra subantártica en la Isla Grande de Chiloé, Chile: flora y vegetación turbosa de campañas. Anales del Instituto de Patagonia 42 (2) : 17-37.
Saarela J.M., Liu Q., Peterson P.M., Soreng R.J. & Paszko B., 2010. Phylogenetics of the grass ‘Aveneae-type plastid DNA clade’ (Poaceae: Pooideae, Poeae) based on plastid and nuclear ribosomal DNA sequence data. In: O. Seberg, G. Petersen, Barfod A.S. & J.I. Davis (eds.), Diversity, phylogeny, and evolution in the Monocotyledons, Aarhus University Press, Aarhus : 557-587.
Salas M.F. (de) & Baker M.L., 2015. A census of the vascular plants of Tasmania, including Macquarie Island. Tasmanian Herbarium, Tasmanian Museum and Art Gallery, Hobart, 148 p.
Sykes M.T. & Wilson J.B., 1991. Vegetation of a coastal sand dune system in southern New Zealand. Journal of Vegetation Science 2 (4) : 531-538.
Takhtajan A., 1986. Floristic regions of the world. University of California Press, 522 p.
Tippery N.P. & Les D.H., 2009. A new genus and new combinations in Australian Villarsia (Menyanthaceae). Novon 19 : 404-411.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1196 p.
Vink W., 1993. Winteracae. In K. Kubitzki, The families and genera of vascular plants, II, Springer : 630-638.