Miscellanées phytosociologiques V : syntaxons nouveaux, validés ou complétés
Title
Phytosociological miscellanes V: new, validated or completed syntaxa
Résumé
Cet article présente diverses associations végétales nouvelles, validées ou complétées : boisements, fourrés, pelouses vivaces et à thérophytes, mégaphorbiaies, bas-marais, végétation chasmophile.
Abstract
This article presents various new, validated or supplemented plant associations: woodlands, shrubs, perennial and annual lawns, tall herb communities, fens, wall communities.
En 2008, puis 2018a, je présentais deux ensembles de validations de syntaxons invalides ou inédits. À la suite de quatre autres contributions (de Foucault, 2021a, b, 2022a, 2023), le présent article rapporte divers syntaxons omis, complétés ou nouveaux ; il s’agit le plus souvent d’associations, regroupées par grands types : forêts, fourrés, pelouses vivaces et thérophytiques, mégaphorbiaies, bas-marais, végétation chasmophile. La nomenclature taxonomique suit Flora Gallica (Tison & de Foucault, 2014) pour les taxons présents en France, Euro+Med PlantBase et Catalogue of life (www.catalogueoflife.org) pour les autres taxons selon les cas. On a là l’occasion de publier aussi des relevés restés jusqu’à présent inédits ; toutefois, dans ce cas, le plus souvent, les indications géodésiques sont approximatives (signe ~) en l’absence de GPS à l’époque de leur réalisation.
1. Les boisements
1.1. Des boisements ripicoles de Corse
Les Pinetum sylvestri-laricionis et Alnetum cordato-glutinosae ont été définis par de Foucault respectivement en 2021d et en 2020 ; on les reconnaît aussi dans la publication de Gamisans (1989, respectivement tableaux 3 et 17).
Par ailleurs, Gauberville et al. (2022) viennent de décrire une érablière ripicole montagnarde à subalpine de Corse. Sur la base d’un tableau de dix-sept relevés, ils définissent l’Alno suaveolentis-Aceretum pseudoplatani, qui peut s’analyser ainsi en phytosociologie moderne :
- une association arborescente : Acer pseudoplatanus V, Sorbus aucuparia *praemorsa III, Fagus sylvatica II, Abies alba I, Betula pendula +, Pinus nigra *laricio +, Sorbo praemorsae-Aceretum pseudoplatani ass. nov. hoc loco, typus nominis hoc loco: composante arborescente (A) du relevé 6 du tableau 1 in Gauberville et al. (2022, Phytosoc., 4e série, 2 : 9-10) ; dans le synsystème arborescent, on peut rapprocher cette association des Aceri platanoidis-Fraxinetalia excelsioris B. Foucault & Gillet in B. Foucault 2020 (de Foucault, 2020), mais dans une alliance qui reste encore indéterminée ou non décrite ;
- une association arbustive : Alnus alnobetula *suaveolens V, Acer pseudoplatanus j V, Fagus sylvatica j II, Rhamnus alpina *a. II, Ilex aquifolium +, Abies alba j +, Sorbus aria j +, qui s’avère n’être qu’une forme de l’Alnetum suaveolentis & Malcuit 1926 (de Litardière & Malcuit, 1926 ; Gamisans, 1977 ; de Foucault, 2012).
La végétation herbacée semble assez complexe ; on peut y reconnaître des éléments de mégaphorbiaies (Doronicion corsici : Athyrium filix-femina, Doronicum corsicum, Adenostyles alpina subsp. briquetii, Imperatoria ostruthium, Ranunculus platanifolius), de microphorbiaies (Viola biflora, Saxifraga rotundifolia, Cymbalaria hepaticifolia) et de sous-bois forestiers herbacés.
Ajoutons à cela une donnée un peu fragmentaire du Cynosuro effusi-Geranietum robertiani (Gamisans 1977) B. Foucault 2020 dans le relevé 6.7.3 du tableau 3 in Gamisans (1989).
1.2. Des boisements du Jura souabe
La monographie de Kuhn (1937) avait pour terrain d’étude le Jura souabe, au sud de Stuttgart (sud-ouest de l’Allemagne), dont les données ont été ultérieurement reprises par Oberdorfer (1957).
Dans sa description du « Querco-Lithospermetum » (tableau 29), on reconnaît d’abord le Sorbo ariae-Quercetum petraeae Gillet & B. Foucault in B. Foucault 2020 arborescent et une végétation arbustive du Berberidion vulgaris Braun-Blanq. ex Tüxen 1952. La végétation herbacée intraforestière paraît plus relever des Trifolio-Geranietea sanguinei T. Müll. 1962 que des Anemono-Caricetea sylvaticae Gillet ex Gillet & B. Foucault in B. Foucault 2020, étant proche du Geranio sanguinei-Coronilletum coronatae Rameau 1971 (Royer, 2015).
Le « Bupleuro longifolii-Fagetum sylvaticae » (tableau 33) peut être subdivisé en
- une association arborescente relevant du Querco petraeae-Fagetum sylvaticae (Tüxen 1955) B. Foucault & Julve in Foucault 2020 ;
- une association arbustive à Daphne mezereum, Abies alba j, Viburnum lantana… ; en compilant les données comparables des tableaux 34 à 37, soit sur 47 relevés, on peut la décrire par la liste synthétique suivante : Lonicera xylosteum V, Daphne mezereum IV, Fagus sylvatica j IV, Crataegus laevigata IV, Fraxinus excelsior j IV, Viburnum lantana III, Acer campestre j III, Rosa arvensis III, Acer pseudoplatanus j III, platanoides j III, Sorbus aucuparia *a. j III, Cornus sanguinea *s. II, Abies alba j II, Sorbus aria j II, Prunus avium j II, Crataegus monogyna II, Ribes alpinum II, Ulmus glabra j II, Rubus idaeus *i. II, plus des taxons de présence inférieure ou égale à I, qui peut être interprétée comme décrivant le Crataego laevigatae-Loniceretum xylostei ass. nov. hoc loco, typus nominis hoc loco: composante arbustive du relevé 6 du tableau 33 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 269-270), lequel peut être rapproché du Corylo avellanae-Populion tremulae Braun-Blanq. ex Rivas Mart. & M.J. Costa 1998 ;
- une association herbacée originale qui hésite entre Prenantho purpureae-Galion sylvatici Foucault 2020, Seslerio caeruleae-Mercurialion perennis Gillet ex Gillet & B. Foucault in B. Foucault 2020 et Dioscoreo communis-Buglossoidion purpureocaeruleae B. Foucault 2020 ; on peut la décrire sous le nom de Bupleuro longifolii-Phyteumatetum spicati ass. nov. hoc loco, typus nominis hoc loco: composante herbacée du relevé 1 du tableau 33 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 269-271).
L’« Helleboro foetidi-Fagetum », le « Festuco sylvaticae-Fagetum » et l’« Elymo europaei-Fagetum » (tableaux 34 à 36) peuvent être subdivisés en
- une association arborescente se rapprochant de l’Aceri pseudoplatani-Fraxinetum excelsioris Gillet ex Gillet & B. Foucault in Foucault 2020 ;
- une association arbustive évoquée supra;
- une association herbacée originale qui hésite là aussi entre Prenantho purpureae-Galion sylvatici, Seslerio caeruleae-Mercurialion perennis et Dioscoreo communis-Buglossoidion purpureocaeruleae; on peut la décrire sous le nom de Lilio martagon-Lathyretum verni ass. nov. hoc loco, typus nominis hoc loco : composante herbacée du relevé 5 du tableau 34 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 274-278).
Le « Corydalis-Wald » (tableau 38) peut être subdivisé en
- une association arborescente se rapportant à l’Ulmo glabrae-Fraxinetum excelsioris Foucault 1995 ;
- une association arbustive affine de l’Ulmo glabrae-Ribesetum alpini décrit du Jura français (de Foucault, 1999) ;
- une association herbacée vivace originale qui paraît relever du Scillion bifoliae et définie comme Anemono ranunculoidis-Corydalidetum cavae ass. nov. hoc loco, typus nominis hoc loco: composante herbacée vivace du relevé 3 du tableau 38 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 304-306) ;
- une association herbacée thérophytique (surtout relevés 3 à 10, auxquels on peut ajouter les relevés 2 et 4 à 7 du tableau 39) à Impatiens noli-tangere (présence V sur 13 relevés), Geranium robertianum (IV), Alliaria petiolata (III), Galium aparine (II), Aethusa cynapium (II), Galeopsis tetrahit (I), Veronica hederifolia (I), Moehringia trinervia (I), Lapsana communis *c. (+), Impatiens parviflora (+), Lamium purpureum (+), distincte des associations à noli-tangere déjà connues (de Foucault, 2011, 2020) : Geranio robertiani-Impatientetum noli-tangere ass. nov. hoc loco, typus nominis hoc loco: composante herbacée thérophytique du relevé 6 du tableau 38 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 304-306), qui relève du Lapsano communis-Geranion robertiani Tüxen & Brun-Hool 1975 (classe des Galeopsio tetrahit-Senecionetea sylvatici H. Passarge ex B. Foucault 2011).
Enfin l’« Ulmeto-Aceretum lunarietosum » (tableau 39) peut être subdivisé en
- une association arborescente se rapportant encore à l’Ulmo glabrae-Fraxinetum excelsioris;
- une association arbustive affine elle aussi de l’Ulmo glabrae-Ribesetum alpini;
- une association herbacée vivace originale à Lunaria rediviva (photo 1) qui paraît relever de l’Actaeo spicatae-Mercurialion perennis Gillet ex Gillet & B. Foucault in Foucault 2020 ; dans cette alliance, seules deux associations sont réellement décrites et validées, mais elles ne correspondent pas à celle qui est considérée ici, laquelle peut être dénommée Lunario redivivae-Lamietum montani ass. nov. hoc loco, typus nominis hoc loco: composante herbacée vivace du relevé 5 du tableau 39 in Kuhn (1937, Die Pflanzengesellschaften im Neckargebiet… : 314-315) ;
- une association herbacée thérophytique rattachée au Geranio robertiani–Impatientetum noli-tangere (cf. supra).
1.3. Des forêts du nord de l’Italie
Dans leur apport à la connaissance des forêts du voisinage du lac de Garde, Brullo et Guarino (1998, tableau 5) ont notamment décrit le « Phyllitido-Taxetum baccatae », sur pentes marquées, avec une association arborescente à Taxus baccata (V sur 14 relevés), Ostrya carpinifolia (V), Quercus ilex (V), Acer campestre (IV), Fraxinus ornus subsp. o. (III), Tilia platyphyllos (I) rappelant beaucoup le Fraxino orni-Taxetum baccatae (Gamisans 1977) B. Foucault 2020. Le plus original dans cette forêt est la synusie herbacée intraforestière qui se rattache clairement au Dioscoreo communis-Asplenion scolopendrii B. Foucault 2020 et qui accueille Cyclamen purpurascens (V), Polystichum aculeatum (IV), Helleborus foetidus (IV), Mercurialis ovata (III), Festuca heterophylla (III), Primula vulgaris subsp. v. (III), Paeonia officinalis subsp. o. (II)… : Cyclamini purpurascentis-Asplenietum scolopendrii ass. nov. hoc loco, typus nominis hoc loco : composante herbacée du relevé 10 du tableau 5 in Brullo & Guarino (1998, Phytocoenologia 28 (3) : 339).
L’« Ilici aquifolii-Ostryetum carpinifoliae » (Brullo & Guarino, 1998, tableau 8) présente une végétation arbustive intra-forestière nettement orientée vers le Cytision sessilifolii Biondi in Biondi, Allegrezza & Guitian 1988, mais les cinq relevés proviennent d’un unique site, de sorte qu’il est difficile de poser dès à present une interprétation.
La végétation arborescente du « Lauro nobilis-Alnetum glutinosae » (Brullo & Guarino, 1998, tableau 9) appartient nettement au Fraxino angustifoliae-Populion neapolitanae B. Foucault 2020 malgré l’absence du premier taxon éponyme d’alliance remplacé par Fraxinus excelsior.
1.4. Des boisements de Sibérie orientale
On doit à Anenkhonov & Chytrý (1998) une étude phytosociologique de forêts localisées sur la bordure orientale du lac Baïkal (Sibérie orientale) sur la base de soixante-huit relevés.
Pour la végétation arborescente (E3), selon l’approche moderne de la phytosociologie, on peut au moins distinguer
- le Pino sylvestris-Laricetum sibiricae ass. nov. hoc loco, basé sur les relevés 5 à 24 du tableau 1 des auteurs (soit vingt relevés) : Larix sibirica V, Pinus sylvestris IV, Betula pendula III, Pinus sibirica II, Populus tremula II, Abies sibirica I, recouvrant les « Carici cinereae-Pinetum sylvestris», « Calamagrostio obtusatae-Laricetum sibiricae » et « Maianthemo bifolii-Pinetum sibiricae » des auteurs, typus nominis hoc loco : composante arborescente (E3) du relevé 22 du tableau 1 in Anenkhonov & Chytrý (1998, Folia Geobot. 33 : 52-55) ; on retrouve plus ou moins cette association un peu fragmentaire in Brianskaia et al. (2019, tableau 1 : colonne 4), ainsi que chez Guinochet (1982, tableau I et bas p. 299) ;
- le Pinetum sylvestri-sibiricae ass. nov. hoc loco, basé sur les relevés 63 à 68 du tableau 1 des auteurs (soit six relevés) : Pinus sibirica V, sylvestris II, Betula pendula I, recouvrant la « Padus asiatica-Pinus sibirica comm. » des auteurs, typus nominis hoc loco: composante arborescente (E3) du relevé 66 du tableau 1 in Anenkhonov & Chytrý (1998, Folia Geobot. 33 : 52-55).
Pour la végétation arbustive (E2), on peut de même au moins distinguer
- l’Alno fruticosae-Pinetum pumilae ass. nov. hoc loco, basé sur les relevés 25 à 42 du tableau 1 des auteurs (soit dix-huit relevés) : Pinus pumila V, Alnus alnobetula *fruticosa II, Betula pendula j II, fruticosa I, Populus tremula j I, Sorbus aucuparia *glabrata j +, recouvrant les « Festuco ovinae-Pinetum pumilae» et « Pleurozio schreberi-Pinetum pumilae » des auteurs, typus nominis hoc loco : composante arbustive (E2) du relevé 25 du tableau 1 in Anenkhonov & Chytrý (1998, Folia Geobot. 33 : 52-55) ; cette association est notamment caractérisée par un pin arbustif rappelant Pinus mugo subsp. m., P. pumila (lequel atteint des montagnes japonaises et le Kamchatka ; Wilmanns et al., 1985 ; Krestov et al., 2008 ; Paal et al., 2021 ; de Foucault, 2021b°: 7 et photo 7) ; de Hokkaidō, Kobayashi (1967) a décrit des associations à P. pumila distinctes de celle-ci (Sorbo sambucifoliae-Pinetum pumilae, Rubo pedati-Pinetum pumilae, Rhododendro diversipilosi-Pinetum pumilae, ce dernier initialement sub Ledo diversipilosi-Pinetum pumilae) ;
- le Rhododendro daurici-Alnetum fruticosae ass. nov. hoc loco, basé sur les relevés 9 à 22 et 44 à 62 du tableau 1 des auteurs (soit trente-trois relevés) : Alnus alnobetula *fruticosa IV, Rhododendron dauricum IV, Pinus pumila III, Betula pendula j III, Pinus sibirica j II, sylvestris j II, Sorbus aucuparia *glabrata j II, Populus tremula j II, Salix caprea I, Spiraea media I, Lonicera caerulea *pallasii +, Spiraea salicifolia +, Rubus sachalinensis +, Abies sibirica j +, Clematis sibirica +, Larix sibirica j r, Cotoneaster tjuliniae r, C. melanocarpus r, Rosa acicularis r, Sambucus siberica r, recouvrant les « Calamagrostio obtusatae-Laricetum sibiricae», « Calamagrostio epigeji-Pinetum sylvestris » et « Vicio nervatae-Pinetum sylvestris » des auteurs, typus nominis hoc loco : composante arbustive (E3) du relevé 17 du tableau 1 in Anenkhonov & Chytrý (1998, Folia Geobot. 33 : 52-55) ; on reconnaît aussi cette association chez Guinochet (1982, tableau II : relevé 1).
On ne définira que peu de syntaxons nouveaux pour la végétation chaméphyto-cryptophytique intraforestière de ces boisements. Avec Aconitum septentrionale subsp. rubicundum, Cardamine macrophylla, Angelica decurrens, Veratrum lobelianum, Trollius asiaticus, Anthriscus sylvestris…, celle du « Cardamino macrophyllae-Abietetum sibiricae » évoque une mégaphorbaie : Veratro lobeliani-Cardaminetum macrophyllae ass. nov. hoc loco, typus nominis hoc loco : composante herbacée (E1) du relevé 2 du tableau 1 in Anenkhonov & Chytrý (1998, Folia Geobot. 33 : 52-55) ; il n’est pas certain que cette mégaphorbiaie soit identique au Rubo arctici-Cardaminetum macrophyllae décrit de la face sud-occidentale du lac Baïkal par Guinochet (1982 : 298 et tableau II : relevé 4). Chez Branskaia et al. (2019, tableau 1 : colonnes 5 et 6), on retrouve la mégaphorbiaie à Cardamine macrophylla, avec en plus Thalictrum baicalense, Dryopteris carthusiana…, mais aussi une seconde mégaphorbiaie, avec Matteuccia struthiopteris, Cirsium heterophyllum, Athyrium filix-femina, Urtica dioica subsp. sondenii, Parasenecio hastatus, Poa palustris… (voir aussi photos i et j de la planche 2 de ces auteurs). Les relevés 4 et 5 du tableau 5 in Chytrý et al. (1998) décrivent aussi une telle mégaphorbiaie : Parasenecioni hastati-Matteuccietum struthiopteridis ass. nov. hoc loco, typus nominis hoc loco : composante herbacée (E1) du relevé 4 du tableau 5 in Chytrý et al. (1995, Phytocoenologia 25 (3) : 423-426). Une autre mégaphorbiaie des mêmes régions est reconnaissable parmi les données de Chytrý et al. (1995, tableau 2 : relevés 1 à 6), avec Veronica longifolia, Filipendula palmata, Lactuca sibirica, Cirsium heterophyllum, Veratrum lobelianum, Pleurospermum uralense… Plusieurs de ces associations semblent appartenir aux Trollio asiatici-Crepidetalia sibiricae Guin. 1982. Cardamine macrophylla est un taxon remarquable qui confirme les liens entre microphorbiaies (à petites herbes, dont des Cardamine du type amara, asarifolia, raphanifolia, acris, flexuosa…) et mégaphorbiaies (à phorbes, dont ici C. macrophylla) déjà évoqués dans des travaux antérieurs (de Foucault, 1984, 2018b) ; d’ailleurs un taxon eurasiatique caractéristique des microphorbiaies tempérées, Chrysosplenium alternifolium, coexiste avec les phorbes caractéristiques du Veratro lobeliani-Cardaminetum macrophyllae.
La plupart des autres végétations de ces forêts évoquent des landes sciaphiles oligotrophiles à Ericaceae du type de celles que l’on trouve au sein des « Vaccinio-Piceetea abietis » européens.
Ajoutons encore qu’une donnée de Guinochet (1982 : 298-299) montre un ourlet thérophytique à Galeopsis tetrahit, Fallopia convolvulus et Persicaria hydropiper du type de ceux que l’on peut observer en Europe occidentale.
1.5. Les boisements du pog de Montségur
L’ascension du pog de Montségur (Ariège ; photo 2) pour atteindre le château en ruine du sommet s’effectue d’abord à travers une hêtraie développée sur substrat peu épais et quelque peu rocailleux. L’association arborescente correspond au Sorbo ariae-Fagetum sylvaticae (Braun-Blanq. & Susplugas 1937) B. Foucault 2018 décrit des Corbières à la suite de Braun-Blanquet & Susplugas (1937) et revu aussi dans les Pyrénées audoises (de Foucault, 2018d, 2019) :
Montségur (09), est de « Plancat », bord de la D 9, N 42° 52’ 39’’, E 1° 49’ 08,4’’, 1 004 m, 3 juin 2023, 100 %, 100 m², 6 taxons
Fagus sylvatica 4, Sorbus aria 3, Quercus robur 2, Fraxinus excelsior 2, Acer campestre 1, Prunus avium +.
L’association arbustive subordonnée à l’association précédente relève de l’Ilici aquifolii-Buxetum sempervirentis B. Foucault 2019 :
Montségur (09), montée au pog, N 42° 52’ 31,6’’, E 1° 49’ 47,7’’, 1 075 m, 3 juin 2023, 60 %, 100 m², 8 taxons
- Rhamno-Prunetea spinosae: Buxus sempervirens 3, Crataegus monogyna 2, Corylus avellana 2, Ilex aquifolium 1, Cornus sanguinea *s. 1,
- autres taxons : Fagus sylvatica j 3, Abies alba j 2, Sorbus aria j 1.
L’association herbacée intraforestière est plus originale :
même localisation spatio-temporelle que le précédent, 50 %, 100 m², 27 taxons
- Anemono-Caricetea sylvaticae et Mercurialietalia perennis: Geranium nodosum 2, Hedera helix 2, Daphne laureola *philippi 2, Carex sylvatica *s. 2, Phyteuma spicatum 1, Carex flacca *f. 1, Anemone hepatica 1, Rosa arvensis 1, Viola riviniana/reichenbachiana 1, Brachypodium sylvaticum 1, Cephalanthera damasonium 1, C. longifolia +, Euphorbia dulcis *incompta +, E. amygdaloides *a. +, Helleborus viridis +, Neottia ovata +, Hieracium gr. murorum +, Cruciata glabra +, Betonica officinalis *o. +,
- autres taxons : Fagus sylvatica j 2, Abies alba j 1, Prunus avium j 1, Rubus +, Crataegus monogyna j +, Cornus sanguinea *s. j +, Fraxinus excelsior j +, Ilex aquifolium j +.
Le Daphne laureola cité semble bien correspondre à la subsp. philippi (photo 3), mais l’absence de fleurs en cette période un peu tardive pour ce taxon ne permet pas une détermination définitive. Au sein des classe et ordre cités, aucune des trois alliances actuellement définies ne peut inclure ce type de végétation pyrénéenne (de Foucault, 2020). On peut au moins reconnaître une association originale dont ce relevé constitue le typus nominis hoc loco : Cephalanthero damasonii-Phyteumatetum spicati ass. nov. hoc loco.
Une fois sorti de cette hêtraie en poursuivant l’ascension, on débouche sur une végétation plus basse sur rocaille nettement dominante. On peut y observer des ourlets (à Polygonatum odoratum, Tanacetum corymbosum, Bupleurum falcatum, Campanula glomerata…) et des pelouses xérophiles qui n’ont pu être relevés faute de temps ; seul le fourré a pu l’être :
Montségur (09), au-dessus de la hêtraie et sous le sommet du pog, N 42° 52’ 30,5’’, E 1° 49’ 53,9’’, 1 130 m, 3 juin 2023, 60 %, 100 m², 17 taxons
- Rhamno-Prunetea spinosae et Prunetalia spinosae: Buxus sempervirens 4, Rhamnus alpina *a. 2, Hippocrepis emerus *e. 2, Corylus avellana 2, Lonicera xylosteum 1, Cornus sanguinea *s. 1, Prunus spinosa 1, Clematis vitalba 1, Ribes alpinum 1, Rhamnus cathartica +, Hedera helix +, Crataegus monogyna +,
- autres taxons : Sorbus aria j 1, Fraxinus excelsior j +, Prunus avium j +, Quercus robur j +, Acer campestre j + ;
au sein de l’ordre cité, avec Buxus sempervirens, Hippocrepis emerus et malgré l’absence apparente d’Amelanchier ovalis subsp. o., ce fourré semble devoir se rattacher à l’Amelanchiero ovalis-Buxion sempervirentis O. Bolòs & Romo 1989 et l’Eu–Amelanchiero ovalis-Buxenion sempervirentis. Certainement présent aussi sur d’autres pogs voisins, on peut le définir comme Hippocrepido emeri-Rhamnetum alpinae ass. nov. hoc loco, typus nominis hoc loco : le relevé ci-dessus.
Au nord-ouest du pog, sur substrats plus profonds, le sous-bois d’une frênaie est différent de celui de la hêtraie :
Montségur (09), « Plancat », au bord du GR 107, N 42° 52’ 31,3’’, E 1° 49’ 36,8’’, 1 035 m, le 3 juin 2023, 80 %, 50 m², 34 taxons
- Anemono-Caricetea sylvaticae et Oxalidetalia acetosellae: Tractema lilio-hyacinthus 3, Geranium nodosum 2, robertianum 2, Lilium pyrenaicum 2, Heracleum pyrenaicum 2, Phyteuma spicatum 2, Orchis mascula 1, Vicia sepium 1, Conopodium majus *m. 1, Rosa arvensis 1, Bistorta officinalis 1, Knautia arvernensis 1, Ranunculus serpens 1, Carex sylvatica *s. 1, Astrantia major +, Brachypodium sylvaticum +, Galium odoratum +, Helleborus viridis +, Dryopteris filix-mas +, Polystichum setiferum +, Sanicula europaea +, Scrophularia alpestris +,
- autres taxons : Fraxinus excelsior j 3, Rubus 1, Prunus avium j 1, Galium aparine 1, Clinopodium vulgare +, Lonicera xylosteum j +, Ajuga reptans +, Anthriscus sylvestris +, Veronica chamaedrys *ch. +, Cardamine pratensis 1, Ribes alpinum j +, Lamium maculatum +, Ranunculus acris + ;
cette association est bien distincte du Cephalanthero damasonii-Phyteumatetum spicati, étant notamment caractérisée par Tractema lilio-hyacinthus, taxon participant à deux alliances au sein du synsystème de la classe citée (de Foucault, 2020) ; c’est du Prenantho purpureae-Tractemion lilio-hyacinthi qu’elle se rapproche le plus. De nouveaux relevés sont nécessaires pour préciser son statut définitif.
2. Les fourrés (voir aussi § 1.4 et 1.5)
Assez bien pourvu en arbustes caractérisant les Rhamno-Prunetea spinosae et avec une présence de 2 sur quatre relevés d’Hippophae rhamnoidis (subsp. fluviatilis ?), le Salicetum capreo-nigricantis décrit par Brullo & Guarino (1998, tableau 10) se place bien dans l’Hippophaion fluviatilis Rübel ex B. Foucault & J.-M. Royer 2016.
Le Coriario myrtifoliae-Spartietum juncei B. Foucault 2017 est un fourré ouvert pionnier colonisant souvent des parcelles en déprise pastorale décrit initialement de l’Aude (de Foucault, 2017) et retrouvé un peu après sa description dans le Lot-et-Garonne (Henry, 2019). En voici un nouveau relevé de l’Aude (photo 4) :
Greffeil (11), rive gauche du Lauquet, N 43° 05’ 02,4’’, E 2° 22’ 29,9’’, 241 m, 11/06/2023, 50 %, 60 m², 9 taxons
Spartium junceum 3, Coriaria myrtifolia 3, Quercus ilex j 3, Rubus ulmifolius 1, Rosa sempervirens 1, Crataegus monogyna +, Viburnum lantana +, Osyris alba +, Juniperus communis *c. +.
Dans la même commune, le lit mineur du Lauquet encombré de galets est colonisé par un fourré alluvial se rapportant à l’Alno glutinosae-Salicetum elaeagni B. Foucault 1991 ex 2017, associé au Loto recti-Lythretum salicariae (cf. infra § 5)
Greffeil (11), rive gauche du Lauquet, N 43° 04’ 57,5’’, E 2° 22’ 29,8’’, 228 m, 11/06/2023, 60 %, 40 m², 6 taxons
- combinaison caractéristique : Salix elaeagnos 3, Populus nigra *neapolitana j 2, Salix purpurea 1,
- autres taxons : Coriaria myrtifolia 2, Salix alba j 1, Rubus ulmifolius
Le Senecioni fuchsii-Sambucetum racemosae Noirfalise ex Oberd. 1957 est un fourré de recolonisation de coupes forestières ; pour une définition plus moderne et biologiquement plus homogène, on propose de remplacer ce nom par celui de Fago sylvaticae-Sambucetum racemosae Dumont & Lebrun 1983 (Colloq. Phytosoc. VIII : 391), nom. inval. (art. 2b, 3o, 5) validé ici sous le nom de Fago sylvaticae-Sambucetum racemosae Dumont & Lebrun ex ass. nov. hoc loco, typus nominis hoc loco : composante arbustive du relevé 6 du tableau 7 in Dumont & Lebrun (1983, Colloq. Phytosoc. VIII hors texte). Le relevé suivant en offre un nouvel exemple du massif du Sancy :
Saint-Pierre-Colamine (63), ‘Lissert’, bord de la voie communale de Lissert, N 45° 30’ 42,2’’, E 2° 57’ 36,8’’, 1 029 m, 26/06/2023, 40 %, 10 m², 6 taxons
Salix caprea 2, Sambucus racemosa *r. 1, Rubus idaeus *i. 1, Fagus sylvatica j 1, Populus tremula j 2, Ulmus glabra j +.
En Auvergne et régions naturelles voisines, le manteau de la hêtraie potentielle est souvent caractérisé par Lonicera nigra et a été décrit sous le nom de Sorbo aucupariae-Loniceretum nigrae B. Foucault 1987 (de Foucault, 1987 ; Thébaud et al., 2014 ; de Foucault & Royer, 2016 ; photo 5). Le tableau 1 en rapporte deux nouveaux relevés [rel. 1 : Chambon-sur-Lac (63), réserve naturelle de la vallée de Chaudefour, 29/06/2023 ; rel. 2 : Saint-Victor-la-Rivière (63), voie communale de Brugères, 01/07/2023].
3. Les pelouses vivaces à Crassulaceae
Allium schoenoprasum subsp. s. est un taxon circumboréal surtout orophile en France (Jura, Alpes, Massif central, Pyrénées, Corse), beaucoup plus rare en plaine. À cet étage, il colonise par exemple des fissures suintantes de falaises granitiques à Lathus-Saint-Rémy (86), aux Portes d’Enfer, dans la vallée de la Gartempe (observations en date du 23 mai 1987). Le tableau 2 en rapporte trois relevés qui confirment l’écologie plutôt mésophile de cette végétation que l’on peut décrire sous le nom de Sedo albi-Allietum schoenoprasi ass. nov. hoc loco, typus nominis hoc loco : relevé 2 du tableau 2 hoc loco publié ci-après
Lathus-Saint-Rémy (86), les Portes d’Enfer, N 46° 19’ 20,7’’, E 0° 55’ 38,9’’, 141 m, 60 %, 1 m², 10 taxons
- combinaison caractéristique et unités supérieures : Allium schoenoprasum 3, Sedum album +, Peucedanum gallicum +, Plantago lanceolata +, Pilosella officinarum 1, Hylotelephium telephium 1,
- autres taxons : Centaurea decipiens 2, Thymus pulegioides +, Phalaris arundinacea *a. +°, Agrostis capillaris +.
Malgré une écologie chasmophile, une telle végétation semble plus à rattacher aux Sedo albi-Scleranthetea biennis Braun-Blanq. 1955 qu’aux Asplenietea trichomanis, mais on n’en trouve pas d’équivalent dans la synthèse de Royer & Ferrez (2018).
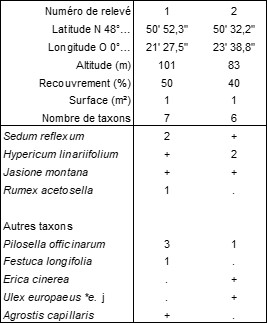
Le tableau 3 [rel. 1 : Les Isles-Bardel (61), vallée de l’Orne, bord de la D 245, au-dessus du barrage de Saint-Philibert, 10/08/1988 ; rel. 2 : Saint-Philibert-sur-Orne (61), limite de Rouvrou, sous le GR 36, 10/08/1988] rapproche deux relevés inédits de l’Hyperico linariifolii-Sedetum reflexi B. Foucault 1979 (de Foucault, 1979, 1981).
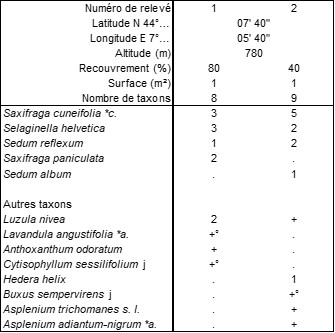
On peut rapprocher de ce type de végétation celle qui colonise les replats rocheux ombragés calcaires mais recouverts d’un humus acide à Selaginella helvetica en Tinée, dont le tableau 4 rapporte deux relevés [tous à Roure (06), bord de la M 2205, vers l’usine hydroélectrique de Valabre, le 17/07/1988]. À la sélaginelle, sont associés Saxifraga cuneifolia, S. paniculata et Sedum reflexum pour former le Selaginello helveticae-Saxifragetum cuneifoliae ass. nov. hoc loco, accueillant en moyenne environ 8,5 taxons par relevé, typus nominis hoc loco : relevé 1 du tableau 4 hoc loco.
4. Les pelouses vivaces oligotrophiles
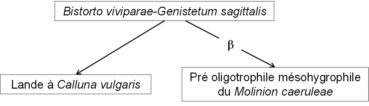
Kuhn (1937, tableau 24) a publié un tableau de dix relevés d’un Arnico montanae-Nardetum strictae, mais ce nom est un homonyme illégitime de l’Arnico montanae-Nardetum strictae Jouanne 1926 (Bull. Soc. Bot. France 73 : 937). L’association du Jura souabe se distingue en effet de la pelouse ardennaise par de nombreux taxons (Poa chaixii, Carex umbrosa subsp. u., Salix starkeana, Dianthus seguieri, Bistorta vivipara, Trollius europaeus, Luzula luzuloides, Helictochloa pratensis, Gentiana germanica…). En injectant ces dix relevés dans le tableau synthétique 1 d’une publication antérieure sur les Nardetea strictae Rivas Goday in Rivas Goday & Rivas Mart. 1963 (de Foucault, 2012), on voit clairement que cette pelouse souabe relève des Nardetalia strictae Oberd. ex Preising 1950 et du Violion caninae Schwick. 1944. Il s’agit en fait du Polygono vivipari-Genistetum sagittalis (Kuhn 1937) T. Müll. in Oberd. 1978 qu’on peut moderniser en Bistorto viviparae-Genistetum sagittalis nom. mut. hoc loco.
Dans le cortège floristique global, on reconnaît quelques taxons caractérisant les landes (Calluna vulgaris, Genista sagittalis, G. tinctoria) ou le Molinion caeruleae (Scorzonera humilis, Sanguisorba officinalis, Genista tinctoria, Serratula tinctoria, Galium boreale, Succisa pratensis, Betonica officinalis, peut-être Carex umbrosa et Trifolium spadiceum), de sorte que ce Bistorto-Genistetum sagittalis est le noyau d’un petit système représenté sur le graphe suivant avec deux flèches dynamiques (l’une avec b représentant une humidification édaphique, l’autre une dynamique progressive). La lande à Calluna vulgaris est concrètement évoquée par Kuhn (1937) en p. 207.
5. Les mégaphorbiaies (voir aussi 1.4)
Le Loto recti-Eupatorietum cannabini a été récemment décrit de l’Aude (de Foucault, 2018c, 2022a), mais c’est un homonyme illégitime du Dorycnio recti-Eupatorietum cannabini Géhu & Biondi 1988 (Géhu & Biondi, 1988, tableau 8), ce dernier s’en distinguant significativement (du moins sur la base des trois relevés publiés par ces auteurs) par la présence de Cirsium creticum et l’absence de plusieurs taxons hygrophiles (Lythrum salicaria, Equisetum telmateia…). On propose donc de renommer la mégaphorbiaie audoise en Loto recti-Lythretum salicariae (B. Foucault 2018) nom. nov. hoc loco, typus nominis hoc loco : le même que le type du Loto recti-Eupatorietum cannabini audois, soit le relevé 5 du tableau 3 in de Foucault (2018, Bull. Soc. Bot. Centre-Ouest, n. s., 49 : 466). De même le molinietosum caeruleae B. Foucault 2018 de l’association audoise est transféré au Loto-Lythretum salicariae et revalidé sous le nom de molinietosum caeruleae (B. Foucault 2018) nom. nov. hoc loco, typus nominis hoc loco : le même que le type du Loto recti-Eupatorietum cannabini molinietosum caeruleae audois, soit le relevé 13 du tableau 3 in de Foucault (2018, Bull. Soc. Bot. Centre-Ouest, n. s., 49 : 466). Le relevé suivant offre un nouvel exemple de cette association :
Greffeil (11), rive gauche du Lauquet, N 43° 04’ 57,5’’, E 2° 22’ 29,8’’, 228 m, 11/06/2023, 60 %, 40 m², 26 taxons
- combinaison caractéristique : Lythrum salicaria 2, Mentha suaveolens *s. 2, Eupatorium cannabinum *c. 2, Scirpoides holoschoenus 2, Scrophularia auriculata 2, Dittrichia viscosa *v. 1 (station primaire), Lotus rectus +, Hypericum tetrapterum +, Solanum dulcamara +,
- autres taxons : Populus nigra *neapolitana j 2, Dipsacus fullonum 1, Pulicaria dysenterica 1, Brachypodium sylvaticum 1, Verbena officinalis +, Inula conyzae +, Salix elaeagnos j +, alba j +, Dactylis glomerata *g. +, Juncus articulatus *a. +, Lycopus europaeus +, Origanum vulgare *v. +, Saponaria officinalis +, Cornus sanguinea *s. j +, Equisetum arvense +, Plantago lanceolata +, Rubus ulmifolius +.
On profite de cette opportunité pour corriger les coordonées des quatorze relevés du tableau 3 de la publication de 2018 qui sont défectueuses comme me l’a fait remarquer B. Offerhaus (courriel du 23 janvier 2023) :
| Relevés | Latitude N 43°… | Longitude E 2°… | Altitude (m) |
| 1 | 12’ 26,8’’ | 21’ 20,9’’ | 97 |
| 2 | 05’ 27,1’’ | 37’ 06,1’’ | 118 |
| 3 | 12’ 44,1’’ | 21’ 38,1’’ | 102 |
| 4 | 02’ 31,8’’ | 32’ 59,9’’ | 212 |
| 5 et 6 | 10’ 47,6’’ | 25’ 34,3’’ | 149 |
| 7 | 59’ 50,1’’ | 15’ 14,6’’ | 196 |
| 8, 10, 11 | 12’ 35,8’’ | 33’ 42,5’’ | 53 |
| 9 | 12’ 36,9’’ | 33” 32,1’’ | 53 |
| 12 | 05’ 23,1’’ | 37’ 06,1’’ | 117 |
| 13 | 10’ 25,5’’ | 17’ 21,2’’ | 140 |
| 14 | 12’ 45,1’’ | 21’ 35,4’’ | 99 |
Dans le tableau 30 de sa thèse inédite de 1983, sur la base de quatre relevés, Julve décrit à titre provisoire le Ligulario sibiricae-Polygonetum bistortae, validé ultérieurement par Thébaud et al. (2014 : 207) au travers de la publication effective du relevé type en p. 260. Le tableau 5 rapporte deux relevés inédits de ce Ligulario sibiricae-Bistortetum officinalis Julve ex Thébaud et al. 2014 nom. mut. hoc loco (photo 6) du pourtour du lac de Bourdouze [commune de Besse-et-Saint-Anastaise (63), côté nord pour le rel. 1, côté nord-est pour le rel. 2, le 30 juin 2023]. Au voisinage de cette mégaphorbiaie, on note aussi le fourré du Salicetum cinereo-pentandrae Almquist ex H. Passarge 1961 : Salix cinerea 2, S. pentandra 1, Betula pendula j 1.
6. Les pelouses à thérophytes hygrophiles
Pour ce type de végétation qui a été pour une grande part rattaché aux Juncetea bufonii, il faut bien reconnaître que les noms créés en 1988 Elatino-Cyperetalia fusci, Elatino-Damasonion alismatis et Centaurio-Blackstonion perfoliatae sont invalides car dans chaque cas le premier taxon éponyme reste ambigu (art. 3g) ; il n’en est pas de même dans le cas du Crassulo-Lythrion borysthenici car le premier terme ne souffre pas de cette ambiguïté, ne concernant que Crassula vaillantii. On valide donc ici définitivement les Elatino triandrae-Cyperetalia fusci B. Foucault ex ord. nov. hoc loco [typus nominis hoc loco : Eleocharition soloniensis G. Phil. 1968 (Veröff. Naturschutz Landschaftspflege Baden-Württemberg 36 : 72), muté ultérieurement en Eleocharition ovatae], l’Elatino triandrae-Damasonion alismatis B. Foucault ex all. nov. hoc loco [typus nominis hoc loco : Elatinetum macropodae Braun-Blanq. 1936 (Bull. Soc. Étude Sci. Nat. Nîmes XLVII : 14)] et le Centaurio pulchelli-Blackstonion perfoliatae (Müller-Stohl & Pietsch 1965) B. Foucault ex all. nov. hoc loco [typus nominis hoc loco : Erythraeo-Blackstonietum serotinae Oberd. 1957 (Pflanzensoziologie 10 : 109)].
Au sein des Juncetea bufonii, Chytrý et al. (1995 : 420) ont rapporté deux relevés d’un « groupement à Juncus bufonius et Ranunculus reptans » de la rive nord-orientale du lac Baïkal (Sibérie orientale), qu’on peut séparer en
- un groupement vivace à Ranunculus reptans (présence 2 sur deux relevés), Eleocharis acicularis (2), Alopecurus aequalis (2), Poa supina (1), Juncus filiformis (1), à rattacher au Littorellion uniflorae Koch 1926 ;
- un groupement thérophytique à Juncus bufonius (2), Androsace filiformis (2), Myosotis laxa caespitosa (2), Persicaria lapathifolia (2), Rorippa palustris (2), Limosella aquatica (1), Matricaria discoidea (1), Stellaria media (1) ; il s’agit là d’une association originale à caractère boréal (Androsace filiformis est un taxon subholarctique) qu’on peut décrire sous le nom de Androsaco filiformis-Juncetum bufonii ass. nov. hoc loco, typus nominis hoc loco: composante thérophytique du relevé « Settlement in the mouth of the Bol’Soj eivyrkuj River » in Chytrý et al. (1995, Phytocoenologia 25 (3) : 420), à placer dans les Elatino triandrae-Cyperetalia fusci (de Foucault, 2013).
De son côté, Benito Alonso (2010) décrit des végétations amphibies de mares temporaires méditerranéennes souvent biologiquement complexes. Notamment le tableau 2 décrivant l’« Elatino macropodae-Eleocharitetum acicularis Cirujano, Pascual & Velayos 1986 » peut s’interpréter comme une mosaïque
- d’une végétation vivace à Eleocharis acicularis (V sur 10 relevés), Littorella uniflora V, Baldellia repens *cavanillesii IV, Alopecurus geniculatus II, Mentha pulegium I, cervina I, Juncus articulatus *a. I, Marsilea strigosa +, Trocdaris verticillatum +, Eryngium corniculatum +, Potentilla reptans +, une association originale à caractère oro-ibéro-méditerranéen de l’Eleocharition acicularis Pietsch 1965 (autour de 1 000 m d’altitude), le Baldellio cavanillesii-Eleocharitetum acicularis ass. nov. hoc loco, typus nominis hoc loco: composante vivace du relevé 4 du tableau 2 in Benito Alonso (2010, Flora Montiberica 45 : 60) ; ce n’est sans doute pas la même association qui est rapportée par Cirujano et al. (1986 : 109) à laquelle renvoie Benito Alonso et d’altitude moyenne non précisée ;
- d’une végétation thérophytique à Juncus pygmaeus (V sur 18 relevés, en ajoutant aux dix du tableau 2 les huit du tableau 3 du même auteur qui se rattachent à la même végétation), Damasonium polyspermum (IV), Elatine brochonii IV, hexandra (II), Lythrum thymifolia (II), Juncus bufonius (II), J. tenageia (I), Lythrum borysthenicum (I), Schoenoplectus supinus (I), Polygonum aviculare (I), Isolepis setacea (+), l’Elatino brochonii-Damasonietum polyspermi ass. nov. hoc loco, typus nominis hoc loco: composante thérophytique du relevé 3 du tableau 2 in Benito Alonso (2010, Flora Montiberica 45 : 60) ; cette association ne correspond pas non plus à celle de Cirujano et al. (1986 : 109) à laquelle renvoie Benito Alonso et qui s’avère plutôt une association originale de l’Agrostion pourretii Rivas Goday 1958, l’Agrostio pourretii-Elatinetum macropodae ass. nov. hoc loco, typus nominis hoc loco : composante thérophytique du relevé 1 du tableau in Cirujano et al. (1986, Trab. Dept. Bot. Univ. Complut. Madrid : 109).
Alors que le tableau 3 du même auteur espagnol décrit une végétation vivace amphibie à Marsilea strigosa liée à l’Elatino brochonii-Damasonietum polyspermi précédent, dans le tableau 4, il s’agit d’une végétation à Eryngium corniculatum reliée à une végétation à Damasonium polyspermum et Myosotis sicula. Le tableau 5 décrit une végétation à Ranunculus nodiflorus, Myosotis sicula, Juncus capitatus, Isolepis setacea, Hypericum humifusum, Cicendia filiformis… qui évoque plus nettement le Myosotido siculae-Ranunculetum nodiflori B. Foucault, Argagnon & Givord in B. Foucault 2021 des Pyrénées-Orientales (de Foucault, 2021c) que l’Hyperico australis-Cicendietum filiformis Rivas Goday (1964) 1970 auquel la rattache l’auteur de la publication de 2010 ; elle pourrait représenter une variation originale plus méridionale de ce Myosotido-Ranunculetum, cicendietosum filiformis subass. nov. hoc loco, typus nominis hoc loco : composante thérophytique du relevé 2 du tableau 5 in Benito Alonso (2010, Flora Montiberica 45 : 65).
Dans une publication précédente (de Foucault, 2022b), on a analysé la contribution de Brullo et al. (2022) sur de telles végétations en Sicile. On peut maintenant aborder celles qu’ont étudiées Tomaselli et al. (2020) en Apulie (les Pouilles). Tout d’abord, l’Isolepido cernuae-Ranunculetum saniculifolii (tableau 2 des auteurs) et le Ranunculo saniculifolii-Elatinetum macropodae (tableau 3) sont des associations subaquatiques ou de bas niveau topographique qui entrent bien dans le Crassulo vaillantii-Lythrion borysthenici B. Foucault 1988. Le Pilulario minutae-Isoetetum longissimae (tableau 4) peut se placer dans l’Antinorio agrostideae-Isoetion velatae B. Foucault 1988 ; la composante thérophytique associée correspond à la liste suivante : Ranunculus saniculifolius (V sur cinq relevés), R. sardous V, Isolepis cernua V, Lythrum thymifolia V, Juncus pygmaeus V, J. capitatus IV, Lotus parviflorus II, Crassula vaillantii II, Polypogon subspathaceus II, qui correspond à une variation de l’Isolepido cernuae-Ranunculetum saniculifolii. Le Coronopodo squamati-Damasonietum polyspermi (tableau 4, ‘Coronopo…’ art. 41b) paraît se rattacher au Lythrion tribracteati Rivas Goday & Rivas Mart. ex Rivas Goday 1970. Le Solenopsietum caespitosae et la composante thérophytique du Poo jubatae-Isoetetum histricis (tableau 6), ainsi que les associations du tableau 7 et le Chamaemelo mixti-Agrostietum pourretii (tableau 9) vont bien dans le Cicendio filiformis-Solenopsion laurentiae Brullo & Minisalle 1998. Le Phalarido minoris-Agrostietum pourretii (tableau 8) va bien dans l’Agrostion pourretii, sa composante vivace se réduisant essentiellement à Eryngium pusillum, Carex divisa et Eleocharis multicaulis. Le Moenchio erectae-Isoetetum siculae (tableau 9) est biologiquement hétérogène, avec une composante vivace à Isoetes sicula, Carex divisa, Serapias lingua, Oenanthe lachenalii… associée à une association thérophytique de l’Agrostion pourretii. Le Damasonio alismatis-Verbenetum supinae (tableau 10, ‘…alismae-…’) est une association de l’Elatino triandrae-Damasonion alismatis (rappelons que le Verbenion supinae Slavnić 1951 est une alliance des Bidentetea tripartitae).
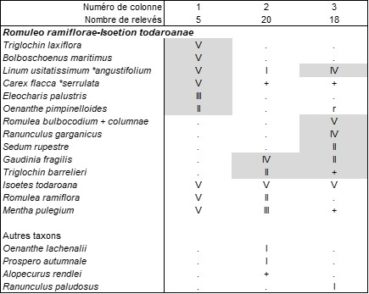
Le Solenopsio laurentiae-Isoetetum todaroanae (tableau 5 des auteurs) est biologiquement hétérogène, avec une composante thérophytique se rattachant au Cicendio filiformis-Solenopsion laurentiae et surtout une composante vivace à Isoetes todaroana, affine de l’Isoetetum todaroanae décrit de Sicile (Brullo et al., 2022), qui devrait s’intégrer écologiquement mais guère floristiquement à l’Ophioglosso lusitanici-Isoetion histricis B. Foucault 1988. On peut redéfinir la composante vivace sous le nom de Triglochino barrelieri-Isoetetum todaroanae ass. nov. hoc loco, typus nominis hoc loco : composante vivace du relevé 4 du tableau 5 in Tomaselli et al. (2020, Mediterranean Botany, https://dx.doi.org/10.5209/mbot.63617 : 28). Ces deux associations de l’Italie méridionale de niveau topographique moyen, synthétisées ici dans le tableau 6 [colonne 1 d’après Brullo et al., 2022, tableau A5, de Sicile ; colonne 2 d’après Tomaselli et al., 2020, tableau 5, des Pouilles ; en plus colonne 3 d’après Ernandes et al., 2017, tableau 5, où les Romulea sont sans doute à revoir, sub Pleurochaeto squarrosae-Isoetetum todaroanae, hétérogène mais proche du Triglochino barrelieri-Isoetetum todaroanae], doivent s’intègrer dans une alliance originale vicariante de l’Ophioglosso lusitanici-Isoetion histricis plus septentrional, peut-être liée aussi à des substrats plus basiques (cas du syntaxon sicilien), le Romuleo ramiflorae-Isoetion todaroanae all. nov. hoc loco, caractérisée par la combinaison d’Isoetes todaroana, Romulea ramiflora (photo 7), Mentha pulegium, typus nominis hoc loco : l’Isoetetum todaroanae Brullo & Ilardi in Brullo, C. Brullo, Sciandrello, Tavilla, Cambria, Tomaselli, Ilardi, Giusso del Galdo & Minissale 2022 (Plants, 2022 (11), 1214, https://doi.org/10.3390/plants11091214 : 20), alliance pouvant entrer dans les Isoetetalia velatae B. Foucault 1988 et Isoetetea velatae B. Foucault 1988.
On peut rapprocher de ces végétations thérophytiques celle colonisant des vases salées. Ainsi Bioret et al. (2022) viennent de décrire le Suaedo maritimae-Sodetum inermis (‘… inermi’, art. 41b) qu’ils placent dans le Thero-Suaedion splendentis Braun-Blanq. ex Braun-Blanq. in Braun-Blanq., Roussine & Nègre 1952 ; l’injection des données de leur tableau 1 dans le tableau 1 de notre synthèse (de Foucault & Guitton, 2021) ne confirme pas le rattachement à cette alliance méditerranéenne, mais bien plutôt au Salicornion disarticulato-europaeae (Géhu & Géhu-Franck 1984) B. Foucault & Guitton 2021.
7. Les bas-marais oligotrophiles
Parmi les bas-marais basiphiles atlantiques, Allorge (1922, tableau VIII) a décrit le Schoeno nigricantis-Juncetum subnodulosi, alors que Braun-Blanquet et Tüxen (1952, tableau 37) ont défini le Cirsio dissecti-Schoenetum nigricantis, sur lequel on a ultérieurement attiré l’attention (de Foucault, 1980). Il ne semble pas que ces deux associations aient été suffisamment comparées pour confronter leur statut, ce que permet maintenant le tableau 7 qui synthétise les données extraites du tableau 50 in de Foucault (1984, colonnes A à E ; la colonne F n’est pas reprise ici par suite de données trop partielles). Une césure significative passe entre les colonnes C et D, séparant le Schoeno-Juncetum subnodulosi (A à C, les données d’Allorge étant en B) et le Cirsio-Schoenetum nigricantis (D et E, les données de Braun-Blanquet & Tüxen étant en D). Les deux associations sont donc bien à distinguer, la seconde paraissant plus qu’une race boréo-atlantique de la première, position retenue en 1984. La colonne F non reprise ici correspond à une race subcontinentale (Champagne, Laonnois…) à Carex davalliana, Anacampis palustris… du Schoeno-Juncetum subnodulosi assurant le passage de celui-ci à l’Orchido palustris-Schoenetum nigricantis Oberd. 1957, qui peut être muté en Anacamptido palustris-Schoenetum nigricantis nom. mut. hoc loco. Le relevé suivant offre une nouvelle illustration du Schoeno-Juncetum subnodulosi P. Allorge 1922 :
Montmorillon (86), tourbière de la Mauvie, ‘les Régeasses’, N 49° 26’ 44,9’’, E 0° 54’ 21,3”, 112 m, 23/05/1987, 90 %, 26 taxons
- combinaison floristique caractéristique : Juncus subnodulosus 4, Schoenus nigricans 2, Valeriana dioica *d. 2, Hydrocotyle vulgaris 2, Succisa pratensis 2, Molinia caerulea 2, Lysimachia tenella 2, Eriophorum latifolium 2, Carex panicea 2, hostiana 1, Cirsium dissectum 1, Potentilla erecta 1, Parnassia palustris +, Pinguicula vulgaris +, Scorzonera humilis +, Dactylorhiza incarnata +, Oenanthe lachenalii +,
- autres taxons : Ranunculus repens 2, Mentha aquatica 1, Carex flacca *f. 1, Agrostis stolonifera *s. 1, Holcus lanatus *l. +, Gymnadenia conopsea +, Briza media *m. +, Poa trivialis *t. +, Phragmites australis +,
au contact d’un Anagallido tenellae-Eleocharitetum quinqueflorae B. Foucault in J.-M. Royer et al. 2008, muté ici en Lysimacho tenellae-Eleocharitetum quinqueflorae nom. mut. hoc loco (8 taxons ; photo 8) :
- combinaison floristique caractéristique : Eleocharis quinqueflora 3, Juncus subnodulosus 2, Carex panicea 1, lepidocarpa +, Lysimachia tenella +, Schoenus nigricans +,
- autres taxons : Chara vulgaris 5, Equisetum palustre +.
On déduit de cette comparaison que le « Cirsio dissecti-Schoenetum nigricantis » évoqué d’un site du Pas-de-Calais par de Foucault & Matysiak (1999 : 46 et tableau 1) est finalement à rattacher plutôt au Schoeno nigricantis-Juncetum subnodulosi.
8. La végétation des parois et des murs
La végétation des Adiantetea capilli-veneris Braun-Blanq. ex Braun-Banq. et al. 1952, liée à des parois fraîches à suintantes en ambiance plutôt chaude, a fait l’objet d’une synthèse antérieure (de Foucault, 2015) ; le relevé suivant offre une nouvelle illustration du Samolo valerandi-Adiantetum capilli-veneris Julve ex B. Foucault 2015 :
sortie sud de Saint-Paul-de-Fenouillet (66) près du carrefour D 7 ´ D 619, N 42° 47’ 54,7’’, E 2° 29’ 48,1’’, 239 m, 21/05/2021, non loin d’un Loto recti-Lythretum salicariae B. Foucault (cf. supra), 8 taxons
- combinaison caractéristique : Adiantum capillus-veneris 5, Sonchus aquatilis 1, Samolus valerandi +,
- autres taxons : Schoenus nigricans 1, Cirsium monspessulanum *m. 1°, Rubia peregrina *p. +, Eupatorium cannabinum *c. +°, Mentha suaveolens *s. +.
La rudéralisation de telles parois favorise l’apparition de Parietaria judaica et le passage de végétations assez naturelles à l’Adianto capilli-veneris-Parietarietum judaicae Segal 1969 au sein des Parietarietea judaicae Rivas Mart. in Rivas Goday 1964 (de Foucault, 2014) ; la photo 9 en illustre un exemple provenant de Caunes-Minervois (Notre-Dame-du-Cros, N 43° 20’ 6,5’’, E 2° 32’ 41,2’’, 215 m).
Du 14 février au 1er mars 2002, la Société botanique de France proposa un voyage d’études dans l’archipel Juan Fernández, au Chili, sous la direction de Ph. Danton. À côté de comptes rendus floristiques, un aperçu phytosociologique fut publié (de Foucault, 2003), sans toutefois proposer de nouveaux syntaxons. En revenant sur les données citées, il est cependant possible de valider deux associations originales :
- le Carici fernandesianae-Asplenietum stellati ass. nov. hoc loco, association de rochers plus ou moins moussus, à parois subverticales, ombragés sous forêt, à Asplenium stellatum, Carex fernandesiana (= Uncinia douglasii), Polyphlebium exsectum (= Trichomanes exsectum; photo 10), typus nominis hoc loco : relevé 7 du tableau 1 in de Foucault (2003, Bot. Soc. Bot. France 24 : 53) ;
- l’Ochagavio elegantis-Wahlenbergietum fernandezianae ass. nov. hoc loco, association héliophile de parois rocheuses xériques à Libertia chilensis (photos 11 et 12), Wahlenbergia fernandeziana (photo 13), Ochagavia elegans (photo 14), typus nominis hoc loco: relevé 14 du tableau 1 in de Foucault (2003, Bot. Soc. Bot. France 24 : 53).
Bibliographie
Allorge P., 1922. Les associations végétales du Vexin français. Nemours, 336 p.
Anenkhonov O.A. & Chytrý M., 1998. Syntaxonomy of vegetation of the Svyatoi Nos Peninsula, Lake Baikal; 2 – Forests and krummholz in comparison with other regions of northern Buryatia. Folia Geobotanica 33 : 31-75.
Benito Alonso J.L., 2010. Aproximación a la flora, la vegetación y la conservación de las lagunas temporales mediterráneas de la provincia de Soria. Flora Montiberica 45 : 54-86.
Bioret F., Gauberville Ch. & Sénotier J.-L., 2022 (publié 2023). Données écologiques et phytosociologiques sur la première localité finistérienne de Soda inermis Fourr. Bulletin de la Société botanique du Centre-Ouest, n. s., 53 : 236-240.
Braun Blanquet J., 1936. Un joyau floristique et phytosociologique : l’Isoetion méditerranéen. Bulletin de la Société d’étude des sciences naturelles de Nîmes XLVII : 1-23 (Communications de la SIGMA 42).
Braun Blanquet J. & Susplugas J., 1937. Reconnaissance phytogéographique dans les Corbières. Bulletin de la Société botanique de France 84 ; 669-685).
Braun Blanquet J. & Tüxen R., 1952. Irische Pflanzengesellschaften. Veröffentlichungen des Geobotanischen Institutes der Eidg. Techn. Hochschule, Stiftung Rübel, in Zürich 25 : 223-421.
Brianskaia E., Schmieder K., Boecker R., Gyninova A. & Balsanova L., 2019. Syntaxonomy of forest vegetation of the central zone of the Lake Baikal eastern coast. Tuexenia 39 : 139-160.
Brullo S. & Guarino R., 1998. The forest vegetation of the Garda lake (N Italy). Phytocoenologia 28 (3) : 319-355.
Brullo S., Brullo C., Sciandrello S., Tavilla G., Cambria S., Tomaselli V., Ilardi V., Giusso del Galdo G. & Minissale P., 2022. The plant communities of the class Isoëto-Nanojuncetea in Sicily. Plants, 2022 (11), 1214, https://doi.org/10.3390/plants11091214.
Chytrý M., Anenchonov O.A. & Danihelka J., 1995. Plant communities of the Bol’šolj Čivyrkuj River Valley, Barguzinskij Range, East Siberia. Phytocoenologia 25 (3) : 399-434.
Cirujano S., Pascual P. & Velayos M., 1986. Aportación al conocimiento de Ranunculus peltatus Schrank subsp. saniculifolius (Viv.) C.D.K. Cook, y su comportamiento fitosociológico. Trabajos del Departamento de Botánica, Universidad Complutense de Madrid 13 : 99-110.
Ernandes P., Gigante D., Beccarisi L., Marchiori S., Venanzoni R. & Zuccarello V., 2017. Isoëto-Nanojuncetea in Puglia (S-Italy): first phytosociological survey. Plant Sociology 54 (2) : 23-36.
Foucault B. (de), 1979. Observations sur la végétation des rochers arides de la Basse-Normandie armoricaine. Documents phytosociologiques, n. s., IV : 267-277.
Foucault B. (de), 1980. Deux associations de bas-marais méconnues pour la France occidentale : le Deschampsio setaceae-Agrostietum et le Cirsio dissecti-Schoenetum. Phytocoenologia 7 : 356-363.
Foucault B. (de), 1981. Cartographie chorologique et étude complémentaire de quelques associations végétales des pointements de roches précambriennes et primaires de Basse-Normandie continentale. Bulletin de la Société linnéenne de Normandie 108 : 61-70.
Foucault B. (de), 1984. Systémique, structuralisme et synsystématique des prairies hygrophiles des plaines atlantiques françaises. Thèse de doctorat d’État, université de Rouen, 675 p. et annexes.
Foucault B. (de), 1987. Données phytosociologiques sur la végétation observée lors de la treizième session de la SBCO en Aubrac et Margeride. Bulletin de la Société botanique du Centre-Ouest, n. s., 18 : 337-361.
Foucault B. (de), 1999. Notes phytosociologiques sur la végétation observée dans le Jura français. Bulletin de la Société de botanique du nord de la France 52 (4) : 23-48.
Foucault B. (de), 2003. Notes phytosociologiques sur la végétation de l’île Robinson Crusoé (archipel de Juan Fernández, Chili). Journal de botanique de la Société botanique de France 24 : 49-54.
Foucault B. (de), 2008. Validation nomenclaturale de syntaxons inédits ou invalides. Journal de botanique de la Société botanique de France 43 : 43-61.
Foucault B. (de), 2011. Synthèse phytosociologique sur la végétation observée lors de la 146e session de la SBF dans les Ardennes. Bulletin de la Société d’histoire naturelle des Ardennes 101 : 33-50.
Foucault B. (de), 2012. Contribution au prodrome des végétations de France : les Betulo carpaticae-Alnetea viridis Rejmánek in Huml, Lepš, Prach & Rejmánek 1979. Journal de botanique de la Société botanique de France 60 : 47-68.
Foucault B. (de), 2013. Contribution au prodrome des végétations de France : les Isoëtetea velatae de Foucault 1988 et les Juncetea bufonii de Foucault 1988 (« Isoëto–Nanojuncetea bufonii »). Journal de botanique de la Société botanique de France 62 : 35-70, 63 : 63-109.
Foucault B. (de), 2014. Contribution au prodrome des végétations de France : les Parietarietea judaicae Rivas-Mart. in Rivas Goday 1964. Acta Bot. Gallica: Botany Letters 161 (4) : 403-427.
Foucault B. (de), 2015. Contribution au prodrome des végétations de France : les Adiantetea capilli-veneris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952. Acta Bot. Gallica: Botany Letters 162 (4) : 375-403.
Foucault B. (de), 2017. Un nouveau syntaxon arbustif pour la Malepère (Aude) : le Coriario myrtifoliae-Spartietum juncei. Bulletin de la Société botanique du Centre-Ouest, n. s., 48 : 360-365.
Foucault B. (de), 2018a. Nouvelles validations de syntaxons invalides ou inédits. Journal de botanique de la Société botanique de France 81 : 35-38.
Foucault B. (de), 2018b. Contribution au prodrome des végétations de France : les Montio-Cardaminetea amarae Braun-Blanq. & Tüxen ex Klika & Hadač 1944. Documents phytosociologiques, 3e série, 7 : 1-86.
Foucault B. (de), 2018c. Quelques éléments de la végétation de l’étang asséché de Marseillette (Aude, France). Bulletin de la Société botanique du Centre-Ouest, n. s., 49 : 459-468.
Foucault B. (de), 2018d. La sortie phytosociologique du 28 mai 2017 à la Fontaine salée et ses environs en forêt domaniale de l’Eau salée (commune de Sougraigne). Bulletin de la Société d’études scientifiques de l’Aude CXVII : 189-196.
Foucault B. (de), 2019. Contribution à la connaissance phytosociologique de la végétation du pays de Sault (Aude, France). Evaxiana 6 : 29-129.
Foucault B. (de), 2020. Éloge du paradigme synusial : alternative à la classification phytosociologique de la végétation forestière européenne, ouest-asiatique et nord-africaine. Evaxiana 7 : 5-248.
Foucault B. (de), 2021a. Miscellanées phytosociologiques : quelques syntaxons nouveaux, validés, complétés ou corrigés. Carnets botaniques 44 : 1-23 + 28 tableaux, https://doi.org/10.34971/AKGG-T733.
Foucault B. (de), 2021b. Miscellanées II : syntaxons nouveaux, validés, complétés ou corrigés. Carnets botaniques 70 : 1-22 + 13 tableaux, https://doi.org/10.34971/3t1m-6445.
Foucault B. (de), 2021c. Quelques aspects de la végétation du plateau granitique de Rodès-Montalba (Pyrénées-Orientales). Carnets botaniques 72 : 1-13 + 8 tableaux, https://doi.org/10.34971/x3qj-h404.
Foucault B. (de), 2021d. Essai de synthèse phytosociologique sur les fourrés sempervirents méditerranéens. Carnets botaniques 51 : 1-42 + 37 tableaux, https://doi.org/10.34971/D6BN-RG49.
Foucault B. (de), 2022a. Miscellanées phytosociologiques III : syntaxons nouveaux, validés ou complétés. Carnets botaniques 112 : 1-22, https://doi.org/10.34971/6AX1-0K40.
Foucault B. (de), 2022b. Compléments aux synthèses des Juncetea bufonii et Crypsietea aculeatae ; essai sur les Oryzetea sativae. Carnets botaniques 107 : 1-10, https://doi.org/10.34971/vgyx-k502.
Foucault B. (de), 2023. Miscellanées phytosociologiques IV : syntaxons nouveaux, validés ou complétés. Carnets botaniques 127 : 1-18 + 14 tableaux,
Foucault B. (de) & Matysiak J.-P., 1999. Contribution à une étude floristique et phytosociologique de la glaisière de Nesles (Pas-de-Calais). Bulletin de la Société de botanique du nord de la France 52 (2-3) : 39-48.
Foucault B. (de) & Royer J.-M., 2016. Contribution au prodrome des végétations de France : les Rhamno catharticae-Prunetea spinosae Tüxen 1962. Documents phytosociologiques, 3e série, 2 : 150-343.
Foucault B. (de) & Guitton H., 2021. Une déclinaison moderne des Thero-Suaedetea splendentis. Carnets botaniques 76 : 1-9 + 2 tableaux, https://doi.org/10.34971/3XK3-N640.
Gamisans J., 1977. La végétation des montagnes corses, III. Phytocoenologia 4 (2) : 133-179.
Gamisans J., 1989. La végétation de la vallée du Verghellu (Corse centrale), son état actuel, son évolution probable et les particularités de sa flore. Travaux scientifiques du Parc naturel régional et des réserves naturelles de Corse 25 : 53-104.
Gauberville Ch., Panaïotis Ch., Reymann J., O’Deye-Guizien K. & Delbosc P., 2022. Caractérisation des végétations ripicoles forestières à Acer pseudoplatanus L. dans les étages montagnard et subalpin et limite de la végétation forestière en Corse. Documents phytosociologiques, 4e série, 2 : 1-12.
Géhu J.-M. & Biondi E., 1988. Données sur la végétation des ceintures d’atterrissement des lacs Alimini (Salento, Italie). Documents phytosociologiques, n. s., XI : 353-380.
Guinochet M., 1982. Notes de phytosociologie sigmatiste prises en Sibérie méridionale. Documents phytosociologiques, n. s., VI : 295-301.
Henry E., 2019. Caractérisation phytosociologique des coteaux marneux du Pays de Serres (Lot-et-Garonne). Evaxiana 5 : 241-262.
Jouanne P., 1926. Essai de géographie botanique sur les forêts de l’Aisne (suite). Bulletin de la Société botanique de France 73 (5) : 924-946.
Julve Ph., 1983. Les grouements de prairies humides et de bas-marais : étude régionale et essai de synthèse à l’échelle de l’Europe occidentale. Thèse de doctorat de 3e cycle, université de Paris-Sud-Orsay, 224 p.
Kobayashi K., 1967. Phytosociological studies on Pinus pumila scrubs of the Daisetsu and the Hidaka ranges in Hokkaido, Japan. Japanese Journal of Ecology 17 (5) : 189-198, https://doi.org/10.18960/seitai.17.5_189.
Krestov P.V., Omelko A.M. & Nakamura Y., 2008. Vegetation and natural habitats of Kamchatka. Berichte der Rheinhold-Tüxen-Gesellschaft 20 : 195-218.
Kuhn K., 1937. Die Pflanzengesellschaften im Neckargebiet der Schwäbischen Alb. Ferdinand Rau, Öhringen, 340 p.
Litardière R. (de) & Malcuit G., 1926. Contribution à l’étude phytosociologique de la Corse, le massif du Renoso. Paris, 143 p.
Oberdorfer E., 1957. Süddeutsche Pflanzengesellschaften. Pflanzensoziologie 10 : 1-564.
Paal J., Pesterov A. & Neshataeva, V. 2021. Diversity of Pinus pumila-dominated communities on the Kamchatka Peninsula. Forestry Studies | Metsanduslikud Uurimused 74 : 26-57.
Philippi G., 1968. Zur Kenntnis der Zwergbinsengesellschaften (Ordnung der Cyperetalia fusci) des Oberrheingebietes. Veröffentlichungen der Landesstelle für Naturschutz und Landschaftspflege Baden-Württemberg 36 : 65-130.
Royer J.-M., 2015. Contribution au Prodrome des végétations de France : les Trifolio medii-Geranietea sanguinei T. Müll. 1962. Documents phytosociologiques, 3e série, 2 : 4-150.
Royer J.-M. & Ferrez Y., 2018. Contribution au Prodrome des végétations de France : les Sedo albi-Scleranthetea biennis Braun-Blanq. 1955. Documents phytosociologiques, 3e série, 7 : 180-281.
Thébaud G., Roux C., Bernard C.-E. & Delcoigne A., 2014. Guide d’identification des végétations du nord du Massif central, associations végétales et habitats naturels. Presses universitaires Blaise-Pascal, Clermont-Ferrand, 274 p.
Tison J.-M. & de Foucault B., 2014. Flora Gallica, Flore de France. Biotope, Mèze, xx + 1 196 p.
Tomaselli V., Beccarisi L., Brullo S., Cambria S., Forte L., Minissale P. & Veronico G., 2020. Phytosociological research on temporary ponds in Apulia (southern Italy). Mediterranean Botany, https://dx.doi.org/10.5209/mbot.63617.
Wilmanns O., Bogenrieder A. & Nakamura Y., 1985. Vergleichende Studien des Pinus-Krummholzes in der japanischen und europaïschen Alpen. Tuexenia 5 : 335-358.