La flore de l’île Amsterdam, état des lieux des connaissances
Title
Amsterdam island flora, knowledge inventory
Résumé
Éloignée de plus de 3 000 km de tout continent, l’île française Amsterdam fait partie des îles les plus isolées du globe. Avec une superficie de 55 km² et une apparition assez récente (690 000 ans), la diversité floristique y est assez pauvre, mais l’endémisme et le sub-endémisme y sont tout de même importants. Cet état des lieux des connaissances floristiques, avec de nombreuses illustrations originales, est le premier à traiter à la fois des plantes vasculaires, des Bryophytes, des Lichens, des Algues et, dans une moindre mesure, des Champignons lichénicoles non lichénisés et Cyanobactéries. Il prend en compte les résultats des recherches menées depuis trois décennies et le travail de terrain réalisé ces dernières années, et en particulier en 2022. Sept nouveaux taxons sont cités pour l’île (Rhacocarpus purpurascens, Schistochila cf. splachnophylla, Metzgeria sp., Lejeunea sp., Trentepohliaceae (non lichénisé), Andreaea cf. alpina, Nostoc cf. flagelliforme) et plusieurs espèces sont illustrées pour la première fois in situ (Sphagnum cavernulosum, S. complanatum, Gyalecta amsterdamensis, etc.).
Abstract
Far more than 3,000 km from any continent, the French island of Amsterdam is one of the most isolated islands in the world. With a surface area of 55 km² and a fairly recent appearance (690,000 years), the flora diversity is quite poor but endemism and sub-endemism are significant. This inventory of floristic knowledge, with numerous original illustrations, is the first to deal with vascular plants, Bryophytes, Lichens, Algae and, to a lesser extent, Fungi and Cyanobacteria. It takes into account the results of research carried out over three decades and the fieldwork carried out in recent years, and in particular in 2022. Seven new taxa are cited for the island (Rhacocarpus purpurascens, Schistochila cf. splachnophylla, Metzgeria sp., Lejeunea sp., Trentepohliaceae (no photobionts), Andreaea cf. alpina, Nostoc cf. flagelliforme) and several species are illustrated for the first time in situ (Sphagnum cavernulosum, S. complanatum, Gyalecta amsterdamensis, etc.).
Notes introductives
-
Les mots suivis du signe * sont définis dans un glossaire annexe.
-
Les tableaux systématiques sont reportés en fin de texte.
1. Contexte naturel
1.1. Contexte géographique
L’île Amsterdam fait partie des îles les plus isolées du globe, d’une surface de 55 km² (10 km × 7 km dans ses plus grandes dimensions), cet ancien volcan perdu au milieu de l’océan Indien est éloigné de 3 000 km des continents les plus proches (3 400 km de l’Australie, 3 200 km de Madagascar et 3 100 km de l’Antarctique ; carte 1 ; photos 1 et 2). Elle forme un cône presque parfait qui culmine à 881 m d’altitude (la Dives ; carte 2 ; photos 3 et 4). Avec l’île Saint-Paul (8 km²), située à 90 km plus au sud, elle constitue, au sein de la collectivité territoriale des Terres australes et antarctiques françaises (TAAF), le district de Saint-Paul et Amsterdam. Avec les deux autres districts austraux des TAAF, l’archipel Crozet et les îles Kerguelen, le district de Saint-Paul et Amsterdam est intégré dans une réserve naturelle nationale créée en 2006 et inscrite en 2019 sur la liste du patrimoine mondial de l’humanité par l’Unesco.
1.2. Contexte géologique
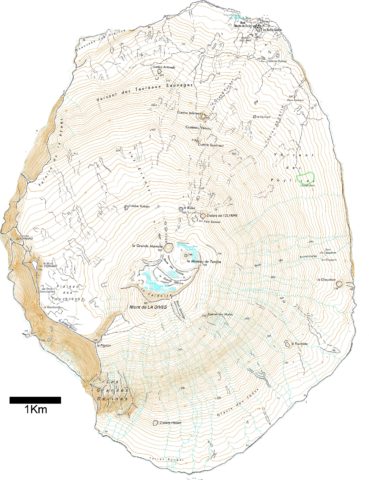
L’île volcanique, principalement composée de basaltes tholéiitiques (Doucet et al., 2004), est située sur l’un des points chauds de la dorsale sud-est indienne (Janin, 2010). Elle s’est formée en deux phases (Giret, 1987). Une première éruption l’a fait émerger de l’eau il y a 690 000 ans. Sa période d’activité la plus intense a eu lieu entre 400 000 et 200 000 ans. Aujourd’hui, seuls 3 km², représentés par le mont Fernand, le Grand Balcon, la Rambarde, le Pignon, la Chaussée de Kerguelen (photo 5) et les Grandes Ravines, sont encore visibles. La deuxième phase est survenue il y a quelques dizaines de milliers d’années et lui a donné la forme qu’on lui connaît. Cette éruption a créé la Dives (photos 3 et 4) et un lac de lave, qui s’est vidé en plusieurs phases, a formé la caldeira (TAAF, 2017 ; photo 6). Depuis, douze cratères adventifs sont apparus (photos 7 et 8). Les plus récents sont les cratères Dumas, au nord-est de l’île, que l’on peut estimer à moins de 120 ans d’après ses caractères morphologiques et pétrographiques (Doucet et al., 2003). Seules trois « plages » permettent de débarquer sur l’île, le reste étant inaccessible compte-tenu des hautes falaises qui la cernent (photos 2 et 9). Alors que les falaises du nord et de l’est dépassent rarement 50 m de hauteur, celles du sud et de l’ouest peuvent s’élever jusqu’à 730 m.
1.3. Contexte climatique
En lien avec la géomorphologie, la pédologie et les conditions climatiques, les plantes de l’île Amsterdam sont réparties en ceintures concentriques avec un fort étagement selon l’altitude (Tréhen et al., 1990). Le climat des différents étages est très hétérogène et varie selon l’altitude. Alors que le climat des milieux de basse altitude est subtropical (14 °C de moyenne), les milieux situés plus haut sont soumis à un climat d’affinité subantarctique (7 °C de moyenne au-dessus de 700 m d’altitude). Les précipitations moyennes annuelles s’élèvent à 1 103 mm à basse altitude et sont doublées non loin du sommet (Frenot & Valleix, 1990), où des points d’eau et ruisseaux temporaires peuvent alors être observés (photo 10). Le mois de février est le mois le plus chaud, alors que le mois d’août est le plus froid. Le vent y souffle sans cesse toute l’année, mais plus particulièrement en hiver où il dépasse couramment 100 km/h en altitude.
1.4. Contexte floristique
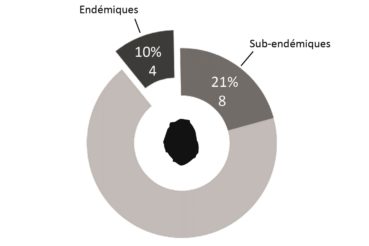
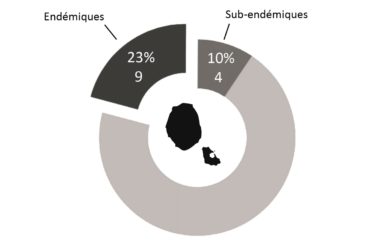
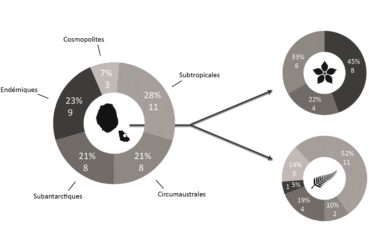
L’éloignement des masses continentales et la relative jeunesse géologique de l’île, d’un point de vue géologique, conditionnent fortement la flore présente : la diversité spécifique est faible, mais l’endémisme y est relativement important (23 % chez la flore vasculaire du district ; figures 1 et 2). Bien que cela ne relève pas de la botanique, il est à noter que le groupe des Thécamibiens, ou amibes* à thèques*, est le seul groupe taxonomique étudié de l’île (les macroalgues n’étant pas clairement étudiées) à ne pas montrer d’endémisme, et cela malgré les 43 taxons recensés en milieux terrestres et dulcicoles (Heger et al., 2009). Le rapprochement des deux îles est tel qu’il est difficile de traiter la flore de l’île Amsterdam sans aborder celle de Saint-Paul, ainsi elles sont traitées ensemble dans certains paragraphes comme ceux consacrés à l’histoire et la phytogéographie.
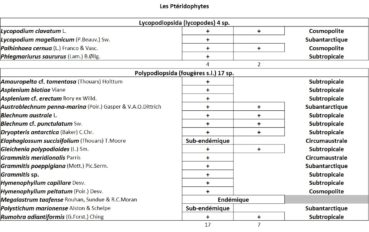
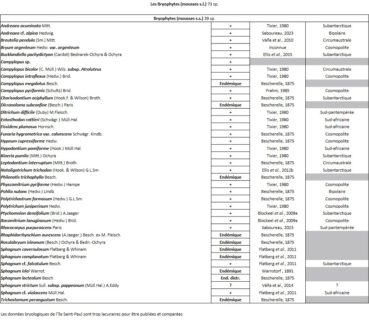
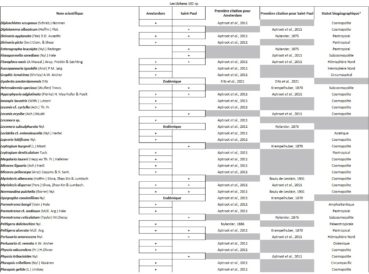
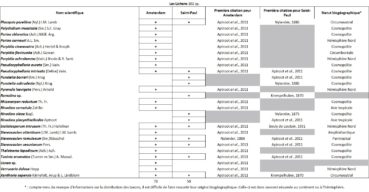
Quelques chiffres sur la flore d’Amsterdam (TAAF, IPEV, non publié)Plantes vasculaires : 38 espèces [17 Spermatophytes, dont 4 endémiques / 21 ptéridophytes] ; Bryophytes : 72 espèces [31 mousses, dont 3 endémiques / 33 hépatiques, dont 2 endémiques / 1 anthocérote / 7 sphaignes dont 3 endémiques] ; Lichens : 79 espèces ; Diatomées : 199 espèces, dont 29 endémiques (voir tableaux annexes). |
2. La flore
2.1. Le milieu marin
La flore de l’île commence en mer où le kelp cerne l’île entre 15 et 65 m de profondeur. Il est représenté par une algue brune (Ochrophyta), et plus particulièrement une laminaire, Macrocystis pyrifera (L.) C. Agardh (photo 11), la plus grande algue du monde. Cette algue a la particularité de posséder des pneumatocystes* en forme de poire qui lui permettent de flotter. Cette « barrière » semble bien plus imposante en hiver. Les thalles servent de support à de minuscules (2 mm Ø) vers annélides polychètes (Paralaeospira levinseni), des vers tubicoles calcifiants (Duhamel, 2023). Au plus près de la côte, dès 2 à 3 m de profondeur, une autre laminaire peut être observée. Connue d’Afrique du Sud et de l’archipel Tristan da Cunha, Laminaria pallida Greville (photo 12) se reconnaît à ses thalles palmés. Lors des plongées, on peut trouver de nombreuses autres espèces, comme une autre algue brune, Desmarestia rossii, ou encore des algues rouges (Rhodophyta) comme Callophyllis variegata, Plocamium hookeri, Polysiphonia anisogona, P. atricapilla (Féral et al., 2021) et bien d’autres encore (Reichardt, 1871) dont beaucoup ne sont pas encore inventoriées.
Lorsque l’on se rapproche encore un peu plus de la côte, les rochers qui subissent le battement de marées (dits intertidaux) servent de support à de nombreuses espèces d’algues comme l’étonnant Splachnidium rugosum (Linnaeus) Greville (photo 13), genre monospécifique aux faux airs de salicorne. Pouvant être observée en Nouvelle-Zélande, en Australie (et Tasmanie), en Afrique du Sud, sur les îles Juan Fernandez et sur l’archipel Tristan da Cunha (Anderson et al., 2016), cette espèce, comme de nombreux autres organismes présents sur l’île, a une répartition typiquement circumaustrale*. D’autres espèces comme les algues coralines (Corallinaceae spp. ; photo 14), les laitues de mer (Ulva spp.), les caulacanthes (Caulacanthus ustulatus (Mertens ex Turner) Kütz. ; photo 13) ou encore Bostrychia intricata (Féral & Saucède, 2023) tapissent le fond des mares intertidales. C’est au fond de ces mêmes mares que Bovichtus veneris, poisson endémique du district, peut être observé bien caché dans le décor composé d’algues (mimétisme) (Morel & Bourbon-Denis, 2021 ; d’Orchymont & Saboureau, 2022b), en compagnie d’autres organismes comme des ophiures (O’Hara & Thuy, 2022) (Amphipholis squamata, Ophiactis savignyi), des étoiles de mer (Parvulastra exigua) (Marc Eléaume, comm. pers.), des anémones de mer (Bunodactis cf. fallax, Actinia spp.), des patelles (Cymbula depsta), des amphipodes (Apohyale spp.) ou encore des isopodes (Cirolana rugicauda ; Duhamel, 2023). Comme en métropole, les draperies formées par des algues du genre Porphyra (P. capensis complex) peuplent les rochers les moins battus par les vagues. Pour plus d’informations sur les connaissances du milieu marin, se référer à Duhamel (coord., 2023).
2.2. Milieux terrestres de basse altitude
Au-dessus de la zone intertidale, en compagnie de Myriolecis dispersa (Pers.) Sliwa, Zhao Xin & Lumbsch. (syn. Lecanora dispersa), les premiers rochers sont parfois recouverts d’un lichen crustacé jaune, Xanthoria capensis Kärnefelt, Arup & L. Lindblom (photo 15). Cette espèce, que l’on trouve exclusivement sur le littoral, est principalement connue d’Afrique du Sud. Pour rappel, les Lichens sont des organismes naissant principalement de la symbiose entre un champignon (mycobionte) et une algue ou parfois une cyanobactérie (phytobionte). Cette année, une algue terrestre, qui s’apparente à un Chaetomorpha, a été trouvée dans des situations similaires sur substrat plus ou moins sableux à la pointe de la Recherche et à BMG.
Accroché aux falaises du sud de l’île, le céleri prostré, Apium prostratum Labill. ex Vent. (syn. A. australe Thouars ; photo 16) se développe dès le mois de mai et fleurit assez tôt avant de sécher et de passer l’été sous forme de semences. C’est sur les falaises suintantes ou près des cascades se jetant dans la mer que l’on retrouve les plus belles populations, toujours en situation très fortement exposée aux embruns. Exclusivement connue du sud de l’île, elle a été observée pour la première fois dans le nord près de la pointe de la Recherche (obs. pers., 2022). Sur les falaises de l’ouest de l’île, on peut très facilement observer une mousse emblématique, l’azorelle amstellodamoise (Hypodontium pomiforme (Hook.) Müll.Hal. ; photo 17). À la manière des plantes alpines, cette mousse adopte une morphologie en coussin lui conférant isolation thermique, résistance aux vents, source nutritive et humidité. Connue d’Afrique du Sud, elle a sûrement atteint l’île Amsterdam grâce aux masses d’air venant de l’ouest. Facilitatrice, elle sert souvent de support à diverses plantes vasculaires comme Poa novarae et Pentameris insularis, toutes les deux endémiques du district, mais aussi à quelques Bryophytes comme Syzygiella colorata.
Deux espèces sont dominantes en bord de mer. La première, le pâturin de la Novara Poa novarae Reichardt (photo 18), est endémique de Saint-Paul et Amsterdam. Elle a été nommée en l’honneur de la SMS Novara, une frégate autrichienne qui, lors de son expédition autour du monde, de 1857 à 1859, accosta sur Saint-Paul du 19 novembre au 6 décembre 1857 avec de nombreux naturalistes à son bord (Charton, 1860). P. novarae paraît avoir une affinité avec d’autres espèces de pâturins de l’hémisphère sud comme P. flabellata, de Patagonie, des Falklands, de Géorgie-du-Sud et de Tristan da Cunha, ou encore de P. astonii, originaire de Nouvelle-Zélande (obs. pers.). C’est l’espèce qui a le plus d’interactions positives avec la faune car, grâce aux touradons qu’elle forme, elle sert de support aux nids de la plus grande colonie mondiale d’albatros à bec jaune de l’océan Indien (Thalassarche carteri ; d’Orchymont, 2022 ; photo 19) et permet aux gorfous sauteurs du nord (Eudyptes moseleyi), espèce sub-endémique*, de construire leurs nids. La spartine faux-roseau, Sporobolus mobberleyanus P.M. Peterson & Saarela (syn. Spartina arundinacea (Thouars) Carmich. ; Peterson et al., 2014 ; photo 20), est la deuxième. Cette poacée est sub-endémique car, ailleurs, elle est exclusivement connue de l’archipel Tristan da Cunha. Cespiteuse, elle peut former des communautés monospécifiques, rarement très denses, proches du front de mer, comme sur les « Terres rouges ». Cependant, certains récits évoquaient des étendues de roseaux coupants et impénétrables (Lutwyche, 1853). Contrairement à Poa novarae, elle est surtout littorale et peu présente à l’intérieur de l’île, bien qu’on puisse en de rares occasions la rencontrer en altitude sur substrat tourbeux. Les fleurs, rassemblées en panicules spiciformes (~ 20 cm), ont des étamines à anthères violettes.
C’est aussi au plus près du front de mer que l’on peut observer l’une des espèces emblématiques de l’île, la sagine de Hooker (Sagina hookeri Timaná ; photo 21). Décrite en 2019 (Timaná et al., 2019), elle a été nommée en hommage à Sir Joseph Dalton Hooker (1817-1911) explorateur et botaniste britannique, grand compagnon de Charles Darwin. Elle était auparavant confondue avec Colobanthus diffusus Hook. f. (= Sagina diffusa (Hook. f.) Timaná), endémique de Saint-Paul (Timaná, 2018), un genre apétale, contrairement à la plante amstellodamoise qui arbore des pétales, mais à floraison sporadique. Les dizaines de graines noires, enfermées dans une capsule aux sépales persistants, ont une texture écailleuse. Les capsules apparaissent à l’extrémité d’un pédicelle qui ne se recourbe pas à maturité. Sur l’île, elle est presque exclusivement connue de deux populations distinctes. Une première est localisée au sud, entre la pointe Vlaming (point le plus méridional de l’île) et la pointe del Cano (« Terres rouges ») (photo 22), où la majorité des individus connus de l’espèce côtoient les restes du campement des naufragés du Méridian (Lutwyche, 1853). L’autre, située entre la pointe de la Recherche et la Chaussée des Otaries, a été récemment découverte et côtoie quant à elle les restes du naufrage du Vellore (Didier, 1866). Dans les deux cas elle se développe sur des coulées basaltiques ou sur des sols fortement érodés. Elle a aussi la particularité de partager ses deux uniques populations avec celles de Plantago stauntonii situées à basse altitude : un cas de phytogéographie, sûrement dû à la pédologie, remarquable sur un si petit territoire (photo 23). En 2021, quelques pieds ont été trouvés au pied des falaises d’Entrecasteaux et au bord de la falaise de la Pearl (Damien Morel & Mathieu Reveillas, comm. pers.). Bien qu’elle n’ait jamais été observée pour le moment, la seule inquiétude provient de la potentielle hybridation avec l’invasive S. procumbens, non cespiteuse, avec qui elle partage certaines stations, dont celle récemment découverte au-dessus de la Pearl.
Le contexte pédologique face à l’introduction des bovins et les incendies
La répartition actuelle des espèces végétales natives, qui dépend entre autres de la pédologie, est loin d’être celle connue par les premiers explorateurs. L’une des principales causes a été l’érosion induite par le surpâturage des bovins, particulièrement en-dessous de 200 m d’altitude (Frenot & Valleix, 1990). Introduites en 1871, lors d’une tentative de colonisation par un Réunionnais (Heurtin), les vaches ont profondément modifié les sols de l’île, avant qu’elles ne soient éradiquées en 2010. Jusqu’en 1988, où elles ont été cantonnées à la moitié nord de l’île, elles ont compté jusqu’à deux mille têtes et occupé 60 % de l’île (Berteaux & Micol, 1992). L’autre facteur important de modification des sols et de la végétation est le feu. Depuis sa découverte en 1522 par les compagnons de Magellan, six incendies ont pu être recensés (1792, 1853, 1857, 1899, 1974, 2021), celui de 1974, un des plus importants, ayant fait le tour de l’île. Ainsi, pour exemple, de nombreuses zones tourbeuses (ou paratourbeuses) de basse altitude, habitat préférentiel de Phylica arborea, ont été particulièrement impactées et se cantonnent désormais à quelques hectares disséminés sur le versant est.
Lorsque l’on s’éloigne des communautés mixtes côtières à Poa novarae et Sporobolus mobberleyanus apparaissent les grandes étendues de scirpes noueux, Ficinia nodosa (Rottb.) Goetgh., Muasya & D.A. Simpson (photo 24). Ce scirpe, également connue d’Afrique du Sud, d’Australie et de Nouvelle-Zélande, est la plante qui couvre le plus de surface sur l’île. Omniprésent entre 50 et 250 m d’altitude, il forme un milieu difficilement pénétrable.
C’est au milieu de ces scirpaies que l’on observe encore des milieux paratourbeux relictuels. Ces milieux hébergent le seul arbre indigène de l’île et par extension des Terres australes françaises : le Phylica (Phylica arborea Thouars ; photo 25). L’espèce serait arrivée de Gough Island il y a environ 500 000 ans (Richardson, 2003). C’est l’une des 148 espèces d’un genre qui s’est diversifié en Afrique du Sud, et plus particulièrement dans la région du Cap il y a huit millions d’années, où il offre l’un des nombreux exemples de radiation (Linder, 2005). Formant au xviie siècle une ceinture autour de l’île d’une surface de 1 500 ha, située entre 100 et 250 m d’altitude (De Vlaming, 1697), l’introduction des bovins, les incendies et les prélèvements de bois ont, jusqu’en 1988, réduit la surface occupée par le Phylica à quelques hectares, pour l’essentiel dans un boisement appelé « Grand-Bois » (Saboureau, 2021 ; photo 26). Depuis, l’éradication des bovins a été menée à bien et les premiers efforts de renforcement des populations ont été initiés par le Muséum national d’histoire naturelle (MNHN) de 1986 à 1993. Ce programme de restauration écologique a été relancé en 2012 par les TAAF dans le cadre de la gestion de la réserve naturelle nationale des Terres australes françaises (RNN TAF). Les plus vieux arbres ont la particularité d’avoir les branches recouvertes par un grand lichen foliacé, Pseudocyphellaria aurata (Ach.) Vain. (photo 27), parfois accompagné de P. intricata (Delise) Vain. (photo 28), que l’on peut rencontrer au sol, et de nombreuses autres espèces comme Fuscopannaria ignobilis, Polychidium muscicola et Pyrenula laevigata. Cependant ces milieux n’hébergent pas que le Phylica, de nombreuses espèces de fougères peuplent ces tourbes relictuelles, à commencer par la doradille de Blot, très récemment décrite, Asplenium blotiae Viane (Viane, 2021 ; photo 29). Sub-endémique, elle est également connue de l’île de la Réunion. Elle a été décrite en l’honneur de Marie-Laure Tardieu-Blot (1902-1998), ancienne botaniste du MNHN, spécialiste des fougères des flores tropicales d’Afrique, de Madagascar et d’Indochine, qui avait d’ailleurs publié un papier sur les fougères de l’île (Tardieu-Blot, 1954). Le dryoptère de l’Antarctique (Dryopteris antarctica (Baker) C. Chr. ; photo 30), aux indusies* réniformes et aux pinnules* aristées, y est également abondant. Comme son nom ne l’indique pas, il est principalement connu du continent africain. Cette affinité se retrouve chez la plupart des fougères des îles Saint-Paul et Amsterdam. Cette répartition s’explique par le régime de vents d’ouest, dominant sous ces latitudes, qui favorise la dissémination des spores (Muñoz et al., 2004). Les Bryophytes ne sont pas en reste. On peut citer Symphyogyna podophylla (Thunb.) Mont. & Nees (photo 31), une hépatique à thalle de l’hémisphère sud facilement reconnaissable, et Kurzia capillaris subsp. stephanii, une autre hépatique, minuscule, exclusivement rencontrée dans ce milieu pour le moment. C’est aussi dans ces conditions que l’on rencontre le plus fréquemment Peltigera dolichorhiza (photo 32), un lichen foliacé terrestre qui, comme les Pseudocyphellaria, appartient à la famille des Peltigeraceae. Sur les individus de Phylica arborea du nord de l’île, on rencontre parfois le lichen crustacé emblématique de l’île Caloplaca amsterdamensis Aptroot & Ertz (photo 33). Endémique du district et récemment décrit (Aptroot et al., 2011), il s’observe aussi bien sur les vieux troncs de Phylica que sur les anciens os de vache et les roches basaltiques. Il se reconnaît très facilement grâce à ses apothécies* rouge vif (le seul à arborer ces couleurs) et ses thalles rosés. Dirinaria aplanata (Fée) D.D. Awasthi (photo 34) est une autre espèce facilement reconnaissable, qui croît sur quelques Phylicas du nord de l’île. Bien souvent, les vieux rameaux, dépourvus de feuilles, sont recouverts d’une algue verte filamenteuse, bien connue comme phytobionte chez les Lichens, une Trentepohliaceae (photo 34). Sur l’île, jusqu’à maintenant, la famille était exclusivement connue des symbioses lichéniques.
L’île est constellée de nombreuses cavités aux conditions ombragées et humides qui hébergent des espèces vasculaires que l’on retrouve rarement ailleurs. C’est le cas de la seule fougère endémique du district, Megalastrum taafense Rouhan, Sundue & R.C. Moran (Sundue et al., 2010 ; photo 35), qui est aussi la plus grande avec des frondes pouvant dépasser 1,5 m de longueur. Sur l’île, elle se reconnaît grâce à ses pennes ayant des pinnules d’apparence « bombée ». Sous le microscope, les spores révèlent une périspore* ornementée de nombreuses excroissances (obs. pers.). On y observe aussi très souvent le blechnum austral (Blechnum australe L. ; photo 36), qui tolère des atmosphères plus sèches. C’est aussi dans ces cavités et l’entrée des grottes que l’on peut observer la plus rare des plantes vasculaires de l’île, la doradille érigée (Asplenium cf. erectum Bory ex Willd. ; photo 37). Discrète, elle n’est connue que de cinq stations à ce jour et s’observe au plus profond des cavités, là où la lumière se fait rare. Découverte par Alicia Lourteig (1913-2003) et P. Cour en 1963, puis observée par Jolinon en 1987, elle n’a été redécouverte qu’en 2019 (Hugo Berteloot, comm. pers.). La plus grande des stations a d’ailleurs pu être découverte en 2022 à l’entrée d’une grotte près de « Petit-Bois » (photo 38). D’origine subtropicale, elle est connue d’Afrique de l’Est, d’Inde, d’Indonésie, de Madagascar et de la Réunion. C’est dans des conditions similaires que l’on observe Lepraria lobificans, un lichen d’apparence presque fluorescente, bien connu en métropole. Dans les flaques qui se forment à l’entrée des nombreuses grottes, les Diatomées ont récemment été étudiées et ont révélé un taux d’endémisme important. Elle font partie des groupes taxonomiques les mieux étudiés sur l’île (Chattová, 2017). Pour rappel, aussi appelées Bacillariophycées, les Diatomées sont des algues brunes unicellulaires microscopiques caractérisées par un exosquelette siliceux appelé frustule. Dans les eaux douces de l’île, où les Rotifères* ont également pu être succinctement étudiés (De Smet, 2001), six taxons sont principalement représentés : Pinnularia spp., Frustulia lebouvieri, Kobayasiella subantarctica, Eunota paludosa, E. muscicola et Planothidium subantarcticum. Plusieurs espèces sont endémiques [Sellaphora barae, Orthoseira verleyenii (photo 39), etc.], elles représentent 17% des 104 espèces aujourd’hui recensées dans les eaux douces de l’île (Chattová et al., 2014). Les études menées ont mis en exergue une étonnante similitude avec la flore diatomique des tunnels de lave hawaïen (Mayamaea cavernicola par exemple ; Van de Vijver & Cox, 2013). Dans ces cavités, les Bryophytes sont légion, on peut citer Calypogeia fissa (L.) Raddi, Fissidens plumosus Hornsch. (photo 40), Lophocolea werthii (J.J. Engel & R.M. Schust.) Váňa & L. Söderstr., Lepidozia laevifolia (Hook. f. & Taylor) Gottsche (photo 40) et un Riccardia (photo 47) semblant très variable. C’est aussi dans deux de ces cavités qu’a été trouvé en 2021 un nouveau genre pour l’île, un Metzgeria (photo 41) dont l’espèce est encore indéterminée. Récemment, à partir d’un échantillon récolté dans les anfractuosités de parois de l’une des nombreuses coulées de laves effondrées de l’île (jardin météo), a été décrite une nouvelle espèce de lichen saxicole, endémique du district, Gyalecta amsterdamensis Ertz (Ertz et al., 2021 ; photo 42). Ce taxon, toujours observé stérile jusqu’ici, est caractérisé par ses nombreuses soralies* de couleur saumon et ses thalles blanchâtres lisses et fissurés.
Les îles Saint-Paul et Amsterdam, une flore à la croisée des origines
La flore vasculaire des îles Saint-Paul et Amsterdam est issue de nombreuses influences climatiques (figure 3). La particularité réside dans le fait que les onze espèces classées dans la catégorie des plantes issues des territoires subtropicaux soient exclusivement des ptéridophytes, la plupart venant peut-être du continent africain. Les trois espèces cosmopolites sont elles aussi des ptéridophytes, dont deux sont des Lycopodes. Cela est sûrement dû à leur mode de dispersion par spores, bien plus mobiles que les semences des Angiospermes. Sur les huit espèces recensées issues des territoires subantarctiques, on recense autant de ptéridophytes que d’Angiospermes. Les huit espèces issues des contrées circumaustrales, c’est-à-dire de latitudes similaires, sont majoritairement représentées par des plantes sub-endémiques provenant du complexe d’îles de Tristan da Cunha. On remarque que parmi celles-ci six sont des Angiospermes. Cette répartition est liée aux déplacements des oiseaux marins, en particulier les albatros dont l’aire de répartition relie Amsterdam et Tristan da Cunha, favorisant ainsi la dispersion des semences entre les deux groupes d’îles.
Les thalwegs de l’est de l’île hébergent la grande majorité des populations d’une espèce du genre Amauropelta (photo 43) qui s’apparente à A. tomentosa, présente dans les Mascareignes*. Sur l’île, elle se reconnaît grâce à ses pinnules souvent d’allure triangulaire et son rachis à poils courts, sans écaille. Elle forme bien souvent une communauté en compagnie d’un Philonotis (photo 44) qui pourrait correspondre à Ph. tenuis (Gilles Mignon, comm. pers.). C’est aussi dans l’est, à des altitudes proches de 100 m, que l’on observe les plus belles populations du lycopode penché, Palhinhaea cernua (L.) Franco & Vasc. (syn. Lycopodiella cernua (L.) Pic.Serm. ; photo 45). En forme de « sapin », cette espèce cosmopolite apparaît très variable selon les régions et donne du fil à retordre aux taxonomistes et ptéridologues. Cette espèce marcotte très facilement et forme ainsi des patchs de plusieurs dizaines de mètres carrés à l’allure de miniforêt. Ses strobiles* sessiles sont pendants.
Au sud, près de la pointe del Cano, les Grandes Ravines renferment un grand nombre de cryptogames, c’est là-bas que l’on peut observer l’hyménophylle chevelu (Hymenophyllum capillare Desv. ; photo 46), une espèce rare sur l’île, dont les poils dorés lui donnent une teinte ocre remarquable. Ce genre a la particularité de produire des sores à indusies divisées en deux valves, difficilement visibles chez cette espèce qui arbore des indusies de très petite taille. Les hépatiques, principalement représentées par Dumortiera hirsuta (Sw.) Nees (photo 47) et Marchantia berteroana Lehm. & Lindenb., y occupent de grandes surfaces, bien souvent en compagnie d’Anthoceros punctatus L., une anthocérote très courante dans les milieux ombragés pionniers et sur les sentiers piétinés. D’autres espèces comme Plagiochila heterodonta (Hook. f. & Taylor) Gottsche, Lindenb. & Nees (photo 48), que l’on trouve souvent sous des rochers, et Cephalozia bicuspidata y sont régulièrement observées. Une hépatique à feuilles très graphique y a été découverte en 2015 sur le « Mur végétal » (photo 49), un cassé de plus de 30 m de hauteur. Elle pourrait appartenir à l’ancien genre Pachyschistochila (Hugo Berteloot, comm. pers.), et plus particulièrement à P. splachnophylla (Hook. f. & Tayl.) R.M. Schust. & J.J. Engel devenu Schistochila splachnophylla (Hook. f. & Tayl.) Steph. (Sun et al., 2014 ; photo 50). Cette espèce, nouvelle pour le territoire français et typiquement circumaustrale, était jusque-là connue de Nouvelle-Zélande, de Gough Island, des Falklands et d’Amérique du Sud (dont les îles Juan Fernandez) (Müller, 2017). En 2022, une espèce du genre Lejeunea (photo 51), une autre hépatique à feuilles, a également pu être trouvée à quelques mètres de la précédente. Cependant, compte-tenu de la complexité du genre, nous ne sommes pas allé plus loin dans son identification. C’est aussi dans ces ravines, aux conditions ombragées, à l’hygrométrie élevée et aux nombreux suintements, que l’on rencontre la callitriche de l’Antarctique (Callitriche antarctica Engelm. ex Hegelm. ; photo 52), très rare sur l’île, et la renoncule subantarctique (Ranunculus biternatus Sm. ; photo 53). Toutes les deux d’origine subantarctique, leurs populations d’Amsterdam sont les plus septentrionales connues à ce jour. La première a étonnamment pu être trouvée cette année en compagnie d’Apium prostratum sur des suintements littoraux fortement exposés aux embruns. La renoncule est très proche de R. caroli Christoph. et la callitriche est très proche de C. christensenii Christoph., deux espèces endémiques de l’archipel Tristan da Cunha.
La flore introduite
Un inventaire des plantes introduites sur l’île Amsterdam, réalisé en 1985 (Jolinon, 1987), listait un total de 110 taxons, incluant 28 arbres et arbustes plantés et 41 fleurs et plantes potagères cultivées dans les serres et jardins. Pour les espèces non cultivées ou plantées, cette liste a été actualisée à la fin des années 1990 (Frenot et al., 2001) avec 56 espèces présentes. Ces espèces appartiennent principalement à la flore des régions tempérées de l’hémisphère nord, en particulier à la flore européenne. Depuis la création de la réserve naturelle en 2006, le nombre d’espèces dont la culture est autorisée a été drastiquement réduit (sept variétés potagères).
Actuellement 103 espèces exotiques végétales (EEV) sont répertoriées sur l’île Amsterdam (TAAF, non publié). Elles appartiennent principalement à la flore des régions tempérées de l’hémisphère nord, en particulier à la flore européenne. Parmi ces EEV, seules certaines d’entre elles sont considérées envahissantes et impactent les milieux et espèces indigènes. Holcus lanatus, Juncus effusus et Leontodon saxatilis sont de loin les trois EEV les plus répandues. Elles ont colonisé presque tous les milieux de l’île. Seuls quelques secteurs du Plateau des Tourbières et des tourbes relictuelles de basse altitude restent épargnés. Non loin derrière, Agrostis stolonifera, Cirsium vulgare, Pilosella aurantiaca, Plantago lanceolata, Prunella vulgaris, Sonchus oleraceus et Vulpia bromoides ont conquis tous les milieux de basse et moyenne altitude. Anthoxanthum odoratum, Leucanthemum vulgare, Senecio vulgaris et Trifolium dubium sont en pleine expansion sur le versant est. Cerastium fontanum, Convolvulus sepium, Juncus bufonius, Lepidium didymum, Poa annua, P. pratensis, Rumex acetosella, R. obtusifolius, Sagina procumbens, Solanum nigrum, Sonchus asper, Trifolium glomeratum et Vicia sativa sont moins dispersées mais n’en restent pas moins préoccupantes par leur dynamique. D’autres sont pour le moment plus ou moins circonscrites aux alentours de la base scientifique (photo 54) et certaines d’entre elles font l’objet d’actions de gestion menées par les TAAF dans le cadre de la gestion de la réserve naturelle depuis 2014 (+) : Agave americana+, Agrostis capillaris, Atriplex halimus+, Barbarea verna, Cardamine hirsuta, Cerastium glomeratum, Chenopodium album+, Conium maculatum+, Cynodon dactylon, Cynosurus cristatus, Dactylis glomerata, Digitaria sanguinalis, Erigeron canadenis, Ervilia hirsuta, Festuca rubra, Ficus carica+, Foeniculum vulgare+, Galium aparine+, Geranium molle, Hypochaeris radicata, Lathyrus aphaca, Lolium multiflorum, L. perenne, Malva multiflora+, Mentha pulegium, Nasturtium officinale+, Oxalis latifolia, Parietaria judaica+, Polypogon monspeliensis, Portulaca oleracea, Schedonorus arundinaceus, Sisymbrium officinale, Stellaria media, Taraxacum sp., Trifolium repens, Tropaeolum majus+, Verbena officinalis+ et Vicia angustifolia.
Du côté des bryophytes, Bryum argenteum var. argenteum est supposée exotique. Bien que cosmopolite, son abondance sur la base scientifique et sa dynamique de colonisation des chemins plaident en faveur d’une espèce introduite venue de métropole, où elle abonde. Si son expansion se confirme, ce serait alors le premier cas avéré d’une mousse invasive sur le district, comme l’incertain Campylopus introflexus. Remarque intéressante : sur la base scientifique, comme en métropole, elle colonise les fissures de dalles bétonnées en compagnie de Sagina procumbens. Cette association semble donc s’apparenter au Bryo argentei-Saginetum procumbentis, syntaxon bien connu de l’hémisphère nord (nouvel exemple de « synnaturalisation » ; de Foucault, 2018).
Les coulées de lave les plus récentes sont colonisées par une fougère très abondante sur l’île, Rumohra adiantiformis (G. Forst.) Ching. (photo 55). Issue d’Afrique du Sud (Bauret et al., 2017), elle se distingue des autres espèces présentes sur l’île par ses frondes aux cuticules* cireuses lui donnant un aspect de plante en plastique. Cette dernière est bien souvent indicatrice de trous de lave et les naturalistes qui se succèdent ici ont appris à la reconnaître. C’est aussi sur ces coulées que l’on peut retrouver une graminée endémique du district, Pentameris insularis (Hemsl.) Galley & H.P. Linder (syn. Pentaschistis insularis (Hemsl.) H.P. Linder ; photo 56), désormais membre du sous-genre Pentaschistis (Linder et al., 2010). Les lemmes, aux reflets dorés et aux grandes arêtes coudées, sont typiques. Parmi les 83 espèces connues, cette espèce est la seule insulaire. Genre africain, également connu de Madagascar, il fait partie de la sous famille des Danthonioideae. Sous-famille principalement dispersée dans l’hémisphère sud, seul le genre Danthonia est naturellement connu en Europe. Rencontrée sur l’ensemble de l’île, elle a tendance à former des colonies lâches à basse altitude, tandis qu’en altitude elle forme majoritairement des peuplements denses, parfois sous forme de grands coussins. C’est l’espèce indigène la plus répandue sur l’île. Dans ces milieux particulièrement secs en été austral (décembre-mars), on retrouve bien souvent, à la faveur de l’ombre d’un scirpe noueux, un blechnum dont l’identification reste encore incertaine, mais qui est pour le moment rapporté à l’espèce africaine B. cf. punctulatum Sw. (photo 57). Contrairement à B. australe, les pennes fertiles sont étroites alors que les pennes stériles sont larges, généralement ondulées et embrassantes sur le rachis.
À l’est ou au nord (« Versant des Taureaux Sauvages »), jusqu’à 300-400 m d’altitude, entre les affleurements basaltiques à Stereocaulon vesuvianum Pers., généralement accompagné d’Acarospora fuscata et de quelques Lecanora, ainsi que de Pentameris insularis, on retrouve souvent une communauté typique à Hypnum cupressiforme Hedw. et Austroblechnum penna-marina (Poir.) Gasper & V.A.O. Dittrich (photo 58), parfois accompagnée de Dicranoloma subconfine, qui sèche très facilement en été. Ubiquiste, l’Austroblechnum est présent en mélange au sein des communautés des différents étages altitudinaux.
Entre 300-400 et 500-600 m d’altitude, Gleichenia polypodioides (L.) Sm. (photo 59) forme de très grandes communautés monospécifiques. Cette fougère aux nombreux caractères ancestraux produit des frondes à la croissance dichotomique. Les sores, d’environ 7 mm de diamètre, divisés trois fois, ont la particularité d’être inclus au revers de la pinnule, sur laquelle ils ne sont jamais centrés. Alors qu’elle ne dépasse pas 25 cm de hauteur sur les stations d’altitude (cf. cratère de l’Olympe, Grande Marmite), elle atteint facilement 2 m de hauteur à l’intérieur des boisements de Phylica, sur lesquels elle peut s’élever. Après Ficinia nodosa, c’est la deuxième espèce en terme de surface d’occupation sur l’île. Parfois, surtout sur le secteur est, des patchs de sphaignes parsèment les pentes de gleichenia. Celles qui se développent dans la partie basse (S. lacteolum) blanchissent en été et sont sûrement impactées par le réchauffement climatique et la remontée des étages de végétation (Whinam & Copson, 2006).
2.3. Milieux terrestres d’altitude
Passée la ceinture de gleichenia, apparaissent les milieux d’altitude. Le climat, plus frais et plus humide, se rapproche de celui des îles subantarctiques Crozet et Kerguelen et quelques plantes sont communes à ces trois groupes d’îles. Un autre point commun est la perte de la fonction de vol chez plusieurs espèces d’insectes endémiques, par exemple le papillon Brachypteragrotis patricei (Viette, 1959) [Lepidoptera : Noctuidae : Noctuinae] ou encore la tipule Trimicra pauliani (Séguy, 1959) [Diptera : Tipuloidea : Limoniidae] (photo 60), tous les deux découverts par Patrice Paulian (1926-2001) en 1956, dont nous avons publié les premières photographies (Saboureau, 2022a,b). La grande différence provient de la présence de tourbières « vraies », issues de la dégradation des mousses du genre Sphagnum, absent de Crozet et Kerguelen. À l’heure actuelle, trois espèces de sphaignes sont considérées endémiques de l’île Amsterdam [S. cavernulosum Flatberg & Whinam (photo 61), S. complanatum (photo 62) et S. islei (sub.gen. Subsecunda) (Flatberg et al., 2011)] sur les sept déjà citées : S. cf. violascens (sub.gen. Acutifolia ; photo 63), S. cf. falcatulum (sub.gen. Cuspidata), S. lacteolum (sub.gen. Rigida ; photo 64) et S. strictum subsp. pappeanum. Une autre espèce de la section Acutifolia, S. cordemoyi, proche de S. violascens, serait aussi présente sur l’île (Kjell Flatberg, comm. pers.). Les observations de l’année 2022 ont montré que S. cavernulosum, à la couleur saumon plus orangé que S. complanatum, se rencontre très régulièrement au bord des ravines ou sur une micro-topographie de pente (Saboureau, 2022d). Sur ces tourbières (photo 65), où niche l’albatros d’Amsterdam (Diomedea amsterdamensis ; Chaigne, 2019), le seul oiseau strictement endémique de l’île, on retrouve un grand recouvrement de poacées. Elles sont principalement représentées par l’agrostide de de l’Isle (Agrostis delislei Hemsl. ; photo 66), une graminée nommée en l’honneur de Georges de l’Isle, naturaliste qui a pu herboriser sur l’île en 1874, et par le pâturin de la Terre de Feu, Poa alopecurus (Gaudich. ex Mirb.) Kunth (syn. Poa fuegiana (Hook. f.) Hack. ; photo 67). Sur ce dernier, on observe fréquemment des pseudo-viviparités*, cependant des interrogations demeurent quant à sa détermination car les critères morphologiques sont proches de ceux de Poa novarae. Ces poacées sont sûrement les plantes hôtes de Crambus viettellus Błeszyński & Collins (Viette, 1959) (syn. C. reductus Viette) [Lepidoptera : Crambidae : Crambinae] (photo 60), une noctuelle endémique des hauteurs d’Amsterdam, où elle est très courante, dont la famille est connue pour avoir les graminées comme plantes hôtes (Saboureau, 2022c). D’autres espèces tyrphobiontes*, que l’on peut également rencontrer sur les tourbes relictuelles de basse altitude, y sont abondantes ; c’est le cas de l’isolepis d’Auckland (Isolepis aucklandica Hook. f. ; photo 68) et de la fameuse langue de cerf (Elaphoglossum succisifolium (Thouars) T. Moore ; photo 69). Cette dernière est une fougère sub-endémique, également connue de l’archipel Tristan da Cunha, qui a la particularité d’avoir des frondes simples et entières, revêtues d’écailles brunes, blanchissant avec le temps. À la manière d’Austroblechnum penna-marina, qui est également abondante sur ces tourbes, elle forme des frondes stériles plus ou moins dressées, moins écailleuses à l’ombre, et des frondes fertiles érigées. Elle s’apparente à quelques espèces plus ou moins proches : E. campylolepium, de Tristan da Cunha (Roux, 1991), E. randii, connue des îles du Prince-Édouard et des îles Kerguelen, E. mathewsii d’Amérique du Sud ou encore E. stipitatum de l’étage altimontain réunionnais.
L’autre espèce qui abonde sur ces tourbières est une plante cosmopolite, la seule vasculaire commune à la métropole, le lycopode en massue (Lycopodium clavatum L. ; photo 70). C’est la population la plus méridionale connue à ce jour. Non loin, on observe souvent la laîche à col court, Carex brevicaulis Thouars (photo 71), dont les utricules crochus lui permettent d’être transportées par les oiseaux, et tout particulièrement les albatros, qui nichent sur ces milieux (photo 72). C’est d’ailleurs cette particularité qui lui avait valu son ancien nom : Uncinia (= crochet) brevicaulis (Thouars) Kunth. Ses pédoncules accrescents* sont plus courts à la floraison. Aujourd’hui, elle serait connue d’Amsterdam et de Saint-Paul, où elle a récemment été retrouvée (Chambrin et al., 2018), et de l’archipel Tristan da Cunha, et était auparavant appelée Uncinia brevicaulis var. rigida (Boeckeler) Kük. sur ces îles (Richardson, 2003). Cependant, de nombreuses confusions avec des taxons d’Hawaii (Henrickson & Herbst, 1988) et d’Amérique du Sud, donc ceux de l’archipel de Juan Fernandez (Wheeler, 2007), ne permettent pas de l’affirmer. Connue des îles subantarctiques, la laîche compacte, Carex austrocompacta K.L. Wilson (syn. Uncinia compacta R. Br.) (Global Carex Group, 2015 ; (photo 73), est l’autre espèce de laîche présente sur l’île. De taille plus modeste et aux feuilles recourbées, elle se rencontre aussi bien sur tourbières qu’à la limite des fellfields*. Elle est parfois citée sous le nom de Uncinia compacta subsp. elongata pour Amsterdam et l’archipel Tristan da Cunha (Ryan, 2007).
L’archipel Tristan da Cunha, les îles jumelles
Situé dans l’Atlantique sud, l’archipel Tristan da Cunha est composé de quatre îles volcaniques : Tristan da Cunha, Inaccessible Island, Nightingale Island et Gough Island. Tous les naturalistes qui ont pu passer par le district de Saint-Paul et Amsterdam ont été marqués par la parenté faunistique et floristique de ces deux complexes d’îles, pourtant éloignés de plus de 7 500 km. Ce rapprochement était déjà constaté à la fin du xixe siècle (Fournier, 1875). La similitude des climats ainsi que la très grande densité d’oiseaux marins sur ces terres ont favorisé la dispersion de nombreuses espèces végétales. Ainsi, Elaphoglossum succisifolium (syn. Acrostichum succisifolium), Phylica arborea et Sporobolus mobberleyanus (syn. Ponceletia arundinacea) et peut-être Carex brevicaulis (ex var. rigida) sont exclusivement partagées entre ces îles et inconnues du reste du monde. D’ailleurs, ces quatre espèces ont la particularité d’avoir été décrites pour la première fois par Louis Marie Aubert du Petit-Thouars (1758-1831), un botaniste français d’origine saumuroise, sous les noms actuels ou synonymes entre parenthèses (Petit-Thouars, 1808). Il avait pu les récolter lors de son escale à Tristan da Cunha au début du mois de janvier 1793 (Petit-Thouars, 1811). On retrouve aussi des espèces vicariantes qui ont récemment divergé, c’est le cas de Megalastrum taafense, qui partage de grandes affinités avec M. peregrinum (Gough Island) et M. aquilinum (Tristan da Cunha et Gough Island). Acaena insularis paraît quant à elle proche de A. sarmentosa et A. stangii (Walton, 1980), cette dernière semblant se différencier par ses pédoncules rougeâtres (voir Ryan, 2007), sans pour autant que sa vicariance n’ait été affirmée. On observe cependant deux grandes variantes dans les communautés floristiques. Les deux espèces qui couvrent le plus de surface sur Amsterdam, Ficinia nodosa et Gleichenia polypodioides, sont absentes de Tristan da Cunha, où deux autres espèces, inconnues d’Amsterdam, semblent abonder : Histiopteris incisa et Blechnum palmiforme. La flore n’est pas le seul groupe taxonomique où s’observe cette parenté. Le gorfou sauteur du nord (Eudyptes moseleyi), le bleu (Nemadactylus monodactylus), le suezichtys (Suezichtys ornatus) ou encore la langouste de Saint-Paul (Jasus paulensis), sont des animaux se rencontrant exclusivement sur ces terres (émergées).
Une autre plante se disperse par zoochorie, il s’agit de l’acaena d’Amsterdam (Acaena insularis Citerne ; photo 74) (Citerne, 1897), strictement endémique d’Amsterdam. Souvent mélangée aux patchs d’Austroblechnum penna-marina, elle produit dès le mois de décembre une inflorescence globuleuse érigée et forme par la suite des réceptacles floraux à quatre excroissances en forme de harpons lui permettant de s’accrocher aux plumes d’albatros. Genre typique des terres australes (Nouvelle-Zélande, Patagonie, etc.), il est comparable à nos sanguisorbes (Sanguisorba spp.) et aigremoines métropolitaines (Agrimonia spp.). Compte-tenu de la remontée des étages de végétation, conséquence du changement climatique, elle a récemment été classée CR sur la liste rouge de l’UICN (UICN Comité français, OFB & MNHN, 2022).
Autre particularité de ces tourbières, déjà remarquée en 2015 (Rhumeur, 2015), certains morphotypes observés sont bien différents de ceux de basse altitude. C’est la cas pour deux espèces de fougères : Asplenium blotiae et Megalastrum taafense (photo 75). Les raisons en restent encore énigmatiques et demandent à ce que l’on se penche sur le sujet, des échantillonnages ont récemment pu être effectués et envoyés au MNHN. Pour terminer, le cortège muscinal y est impressionnant (photo 76) mais restait encore mal connu il y a quelques années.
Racomitrium lanuginosum (Hedw.) Brid. (photo 77) et Dicranoloma subconfine (Besch.) Paris (photo 78), accompagnées de quelques Campylopus spp., sont de loin les mousses les plus abondantes.
En leur compagnie, on retrouve souvent Chorisodontium aciphyllum Brotherus (photo 79), taxon également présent sur la péninsule Antarctique (Ochyra et al., 2008), Anastrophyllopsis involutifolia (R.M. Schust.) Váňa & L. Söderstr. (Váña et al., 2010 ; photo 80), Herbertus dicranus, Syzygiella colorata, Rhaphidorrhynchium aurescens (A. Jaeger.) Besch. ex M. Fleisch. (photo 81) ou encore Bazzania decrescens (Lehm. & Lindenb.) Trevis (photo 82). Ptychomnion densifolium (Brid.) A. Jaeger (photo 79), facilement visible entre la Dives et le Pignon, Adelanthus lindenbergianus (Lehm.) Mitt. (photo 83) et un Anastrophyllum (photo 84) encore non identifié sont quant à eux moins courants. Ce dernier pourrait s’apparenter à l’espèce andine A. intermedium (Halina Bednarek-Ochyra, comm. pers.).
Quand on y regarde d’encore plus près il n’est pas rare de trouver Riccardia insularis Schiffn., très souvent accompagnée de Kurzia setiformis (De Not.) Grolle (photo 85). Cephaloziella varians (Gottsche) Steph. (photo 86), qui a la particularité d’être l’hépatique la plus répandue et la plus abondante en Antarctique (Newsham, 2010), est sûrement la plus discrète espèce du cortège.
On remarque régulièrement que la base des touffes de Poa alopecurus est colonisée par plusieurs cryptogames (Hymenophyllum peltatum, Herbertus dicranus, Riccardia insularis, etc.), et particulièrement souvent par une minuscule hépatique, Clasmatocolea humilis (Hook. f. & Taylor) Grolle (photo 86). Lors de la dernière campagne de terrain de 2022, Cladonia confusa R. Sant. (photo 87) y a été observé pour la première fois depuis sa découverte en 2007. Ce lichen qui apparaît très rare sur l’île semble inféodé aux plus hautes tourbières.
Récemment, c’est dans cette strate muscinale que les communautés diatomiques épiphytiques ont en partie pu être étudiées. L’analyse a mis en exergue la présence de 125 taxons, révélant un endémisme un peu plus important que dans les eaux douces avec 22 %. Elle a démontré qu’en dehors de l’altitude la conductivité électrique, le pH et l’humidité sont les principaux facteurs déterminant la structure des communautés diatomiques (Chattová et al., 2021).
À cette altitude, les cavités renferment bien souvent des fougères épilithes* de petite taille. Parmi les plus petites d’entre elles, on retrouve un Grammitis (ex-Stenogrammitis ; photo 88) dont l’espèce n’a pas encore été décrite. Elle a la particularité de produire les sores à l’apex inférieur de la fronde, là où elle est devenue entière. Sur la face supérieure des pinnules, alternes, on observe un organe circulaire. La plante d’Amsterdam apparaît être la même que celle de l’étage altimontain réunionnais. La deuxième est un autre Grammitis (ex-Notogrammitis), dont la taxonomie semble compliquée. Certaines plantes de l’île à frondes larges et courtes se rapprochent de G. poeppigiana (Mett.) Pic.Serm. (syn. N. crassior (Kirk) Parris ; photo 89) et d’autres à frondes fines et longues de G. meridionalis Parris (syn. N. angustifolia (Jacq.) Parris ; photo 90). Les travaux en cours permettront de trancher (Germinal Rouhan, comm. pers.) ou peut-être d’affirmer la présence des deux espèces. Plus ubiquiste, l’hymenophylle pelté (Hymenophyllum peltatum (Poir.) Desv. ; photo 91) est une espèce que l’on retrouve aussi bien dans les cavités, les ravins humides qu’à même les tourbes où elle se mélange aux mousses et autres hépatiques. C’est un taxon cosmopolite, présent des îles subantarctiques au continent africain. Chez cette espèce, contrairement à H. capillare, les indusies des sores sont bien plus grandes et il est facile d’observer les sporanges avec une simple loupe de terrain. Plagiochila heterodonta est aussi souvent représentée dans ce milieu.
Au-dessus de 700 m d’altitude, apparaissent les fellfields* (photo 92). Ces terres nues, très minérales, sont constamment battues par les vents. Une flore pauvre mais très spécifique s’y développe. Deux espèces de lycopodes y sont présentes. Le premier, Phlegmariurus saururus (Lam.) B. Øllg. (syn. Huperzia saururus (Lam.) Trevis. ; photo 93), forme des bâtonnets érigés, parfois en petites colonies mais bien souvent isolés. À la base des sporophylles* on observe facilement les sporanges en forme de macarons (Berteloot, 2019b). La partie fertile, à l’extrémité des rameaux, a la particularité de se détacher à maturité. Le lycopode de Magellan, Austrolycopodium magellanicum (P. Beauv.) Holub (syn. Lycopodium magellanicum (P. Beauv.) Sw. ; photo 94), est l’autre espèce rare de l’île et celle qui a le plus d’affinité subantarctique. Elle a été observée pour la première fois en 2007 (B. Van de Vijver, mission IPEV 136). Aujourd’hui elle n’a jamais été observée en-dessous de 675 m d’altitude et les stations se comptent sur les doigts des deux mains, cependant sa discrétion laisse espérer la présence d’autres stations à découvrir. Il est de loin le plus petit des quatre lycopodes présents sur l’île et fait partie des espèces vasculaires ayant colonisé le sommet de l’île, avec Acaena insularis end, Agrostis delislei end, Austroblechnum penna-marina, Carex austrocompacta, Phlegmariurus saururus, Pentameris insularis end, Plantago stauntonii end et Poa alopecurus (photo 95).
La plante emblématique de ce milieu, où elle abonde, est sans aucun doute le plantain de Staunton (Plantago stauntonii Reichardt). Ayant servi pour les études phylogénétiques au sein des Plantaginacées (Rønsted et al., 2002), son caryotype* a pu être examiné : 2n = 24 (Hassemer et al., 2019). Ce plantain endémique d’Amsterdam et de Saint-Paul, où il est connu de quelques crêtes érodées, a la particularité d’avoir des feuilles très velues (photo 96). Cependant, il est également présent à plus basse altitude, où il se raréfie et peut, comme dans les Grandes Ravines, prendre une forme bien différente et apparaître gras et glabre (bien qu’il reste poilu à la loupe) (photo 97). Plantago pentasperma Hemsl. (photo 98) est l’autre espèce du genre naturellement présente sur l’île et tout particulièrement sur les fellfields*. Cette espèce est globalement glabre, les feuilles sont rétrécies à la base et peuvent être violacées, et elle est de taille bien inférieure. Elle est strictement endémique des hauteurs de l’île Amsterdam, où elle est inconnue en-dessous de 500 m d’altitude. Certaines formes qui apparaissent intermédiaires entre les deux espèces sont parfois observées. Une retypification serait également nécessaire. Au sein du sous-genre Plantago, les deux espèces font partie de la section Mesembrynia, connue pour avoir une origine australasienne (Iwanycki Ahlstrand et al., 2019). Agrostis delislei est également bien présent dans ce milieu. Les rochers qui recouvrent les fellfields* sont colonisés par des lichens crustacés difficilement discernables entre eux, il s’agit de Placopsis (photo 99) parellina, P. gelida et P. cribellans. Les échantillons de ce dernier, récoltés en 2007, ont révélé qu’il était parasité par des champignons lichénicoles non lichénisés (photo 99) (Aptroot et al., 2011). Le premier, Taeniolella diederichiana, récemment décrit des Andes et des Canaries, semble exclusivement parasiter les espèces du genre Placopsis. Le deuxième, un Stigmidium à l’espèce indéterminée, semble surtout parasiter les apothécies.
Les îles Saint-Paul et Amsterdam, une histoire botanique qui débuta au xixe siècle
Sir Joseph Dalton Hooker (1817-1911), explorateur et botaniste britannique, grand compagnon de Charles Darwin, est l’un des premiers à avoir travaillé sur la flore de Saint-Paul et Amsterdam (Hooker, 1844-1847, 1875). Il sera le premier à établir une liste des espèces présentes sur l’île, initiant ainsi les études floristiques sur le district. Comme dans de nombreux récits de l’époque, les deux îles du district y sont régulièrement confondues (Timaná, 2018).
L’autre botaniste important à cette époque fut Sir Heinrich Wilhelm Reichardt (1835-1885) qui, en 1871, décrivit plusieurs espèces à partir d’échantillons récoltés à Saint-Paul par Sir George Leonard Staunton (1737-1801) en 1793, lors de l’expédition de George Macartney vers la Chine. Reichardt lui dédiera notamment un plantain, Plantago stauntonii. Dans sa publication de 1871, Reichardt, qui était à bord de la frégate autrichienne SMS Novara passée fin 1857 à Saint-Paul et Amsterdam, décrira également à partir de ses propres récoltes sur Saint-Paul deux autres endémiques, Poa novarae, en l’honneur de la frégate, et Sagina hochstetteri (= S. diffusa), en l’hommage au géologue Ferdinand von Hochstetter (1829-1884) qui était avec lui à bord.
Sir William Botting Hemsley (1843-1924), bien qu’il ne soit jamais venu sur ces îles, a été un botaniste important pour la flore de Saint-Paul et Amsterdam au xixe siècle (Hemsley, 1885). Il a principalement travaillé sur des échantillons, aussi bien de phanérogames que de cryptogames, récoltés par Georges de l’Isle, qui est sans aucun doute le botaniste de terrain le plus important dans la connaissance de la flore des deux îles. Il fut le botaniste de la mission astronomique française à Saint-Paul pour l’observation du passage de Vénus devant le Soleil fin 1874 début 1875 dirigée par le commandant Mouchez et comprenant Charles Vélain (1845-1925) qui fera aussi des prélèvements de plantes sur l’île Amsterdam (Vélain, 1877). Il lui dédiera notamment l’agrostis endémique d’Amsterdam, Agrostis delislei. Par ailleurs, Wilhelm Nylander (1822-1899), grand lichénologue finlandais, Émile Bescherelle (1828-1903), bryologue français, et Carl Friedrich Warnstorf (1837-1921), bryologue allemand, ont également examiné les récoltes de de l’Isle. Le premier a décrit deux des espèces de lichens endémiques (Lecanora subsulphurata et Opegrapha consimillima ; Nylander, 1875), le deuxième Rosulabryum isleanum, aussi endémique (Bescherelle, 1875) et le troisième l’endémique Sphagnum islei (Warnstorf, 1891), qui lui sont une nouvelle fois dédiées. Hemsley a également analysé les échantillons de Sir George Leonard Staunton, les observations de John MacGillivray (1821-1867) et de William Grant Milne (1829-1866) qui passèrent en 1853, celles de Charles Vélain, celles du lieutenant A.J. Smith et celles de Anton Jelinek qui faisait partie de l’expédition à bord de la frégate autrichienne. Il décrira deux autres espèces endémiques de l’île que sont Trisetum insulare (= Pentameris insularis) et Plantago pentasperma. Par la suite, Edgar Aubert de La Rüe (1901-1991) aura récolté plusieurs taxons (de La Rüe, 1932), dont les lichens qui auront été étudiés par Maurice Bouly de Lesdain (1869-1965) (Bouly de Lesdain, 1931).
Bien souvent, Stereocaulon atlanticum (I.M. Lamb) I.M. Lamb (photo 100), qui se reconnaît à ses rameaux érigés, Arthrorhaphis citrinella (Ach.) Poelt (photo 100), qui se reconnaît à sa couleur vert fluo, et des Porpidia spp., qui se reconnaissent généralement à leurs thalles orangés, les accompagnent. Les rochers proches de l’eau hébergent quant à eux Ionaspis lacustris (With.) Lutzoni, un lichen semi-aquatique. Du côté des Bryophytes, Racomitrium lanuginosum reste une nouvelle fois la mousse (sensu stricto) la mieux représentée avec le polytric (Polytrichum juniperinum Hedw. ; photo 101). D’autres espèces comme Notoligotrichum trichodon (Hook. & Wilson) G.L. Sm. (photo 102), Bucklandiella pachydictyon (Cardot) Bednarek-Ochyra & Ochyra (photo 103) et Andreaea cf. alpina Hedw. (Gilles Mignon, comm. pers. ; photo 104), bien que cette dernière soit plus rare, tirent leur épingle du jeu sur ces terres écorchées. Cette année, une mousse qui y avait déjà été observée et récoltée en 2019 (Hugo Berteloot, herb. district), aux feuilles longuement acuminées, a été identifiée pour la première fois, Rhacocarpus purpurascens (Brid.) Paris (photo 105). Du côté des hépatiques, l’espèce la plus courante est sans doute Jensenia difformis (Nees) Grolle (photos 106 et 115). Avec Symphyogyna podophylla, c’est l’unique autre Pallaviciniacée de la flore de l’île. Ces deux espèces ont d’ailleurs été citées pour la première fois en 2002 (Grolle, 2002). En situation exposée elle a la particularité de s’apparenter à un Fossombromia, alors qu’elle s’apparente à Trichomanes saxifragoides en situation abritée. Gymnomitrion subintegrum (S.W. Arnell) Váňa (photo 107), observée en situation saxicole, et Anastrophyllum auritum (Lehm.) Steph. (photo 108), principalement observée sur Bucklandiella pachydictyon, citées en 2014 d’une seule récolte de 2007, ont été trouvées sur les pentes du sommet en 2022. Cette même année, un nostoc, Nostoc cf. flagelliforme Harvey ex Molinari (photo 109), a été trouvé en abondance sur les fellfields de la caldeira. D’autres passages ont depuis été réalisés et ont montré que l’on observe plus facilement cet organisme sous une très forte hygrométrie. C’est une particularité typique de ces Cyanobactéries, vivant en colonies. Un autre organisme observé depuis plusieurs années, par les différents naturalistes, sur les coulées basaltiques d’altitude n’est toujours pas identifié. Il se remarque très bien grâce à ses couleurs orangées et pourrait s’apparenter, une nouvelle fois, à une algue du genre Trentepohlia (photo 110). Cependant, il ne semble pas avoir la même dynamique de colonisation des rochers que pourraient avoir certaines espèces comme T. iolitus, connue de Nouvelle-Zélande.
C’est également à ces altitudes, mais exclusivement sur les falaises (photo 111), que l’on peut avoir la chance d’observer le polystiche de Marion (Polystichum marionense Alston & Schelpe ; photo 113). Cette rare fougère, qui dépasse rarement 30 cm de hauteur, possède des frondes coriaces et érigées aux pinnules révolutées* et dentées. Connue des îles de Crozet et du Prince-Édouard, où elle se rencontre depuis le niveau de la mer, ou presque, elle est quasi exclusivement connue au-dessus de 700 m d’altitude sur Amsterdam. Elle se rapproche de plusieurs espèces comme P. mohrioides, connue de la Géorgie du Sud, des Falklands, de Patagonie, et P. andinum, des Andes et de Patagonie. Ici, comme sur de nombreux autres milieux d’altitude (photo 112), Herbertus dicranus (Taylor ex Gottsche, Lindenb. & Nees) Trevis. (photo 114), aux feuilles bidentées, et Syzygiella colorata (Lehm.) K. Feldberg, Váňa, Hentschel & Heinrichs (photo 115), aux couleurs rougeâtres, sont deux des nombreuses autres Jungermanniales de l’île (Andrewsianthus marionensis, Syzygiella sonderi, Heterogemma patagonica, etc.). Par ailleurs, S. colorata est connue pour être une composante importante des communautés muscinales des zones humides sur l’archipel Tristan da Cunha (Ryan, 2007). Colura calyptrifolia (Hook.) Dumort. (photo 104), une étonnante et minuscule hépatique (la plus petite des espèces végétales connues de l’île), avait pu être observée à deux occasions en épiphyte sur un Polytrichastrum (Váña et al., 2014) et un Syzygiella (Hugo Berteloot, 2019, comm. pers.) avant d’être trouvée à plusieurs reprises lors de la dernière campagne de terrain de 2022 (photo 116) sur Andreaea cf. alpina, non loin du sommet. Piégeant des Ciliés*, le genre est suspecté carnivore (Barthlott et al., 2000).
En conclusion, si les plantes vasculaires de l’île Amsterdam sont en majorité bien connues depuis les expéditions scientifiques des xixe et xxe siècles, les recherches menées plus récemment avec le soutien de l’Institut polaire français Paul-Émile-Victor (IPEV) ont permis de grandement améliorer la connaissance des Diatomées, des Bryophytes (22 espèces citées pour la première fois d’Amsterdam depuis 2009) et des Lichens (76 espèces citées pour la première fois d’Amsterdam depuis 2011). Il ne fait aucun doute que de nouvelles observations sur ces groupes auront encore lieu grâce à la présence sur le terrain d’agents Environnement des TAAF. Pour d’autres, Champignons, Macro-Algues, les connaissances sont encore très partielles. L’île Amsterdam est loin de nous avoir révélé tous ses secrets…
La réserve naturelle nationale des Terres australes françaises face aux enjeux de conservation
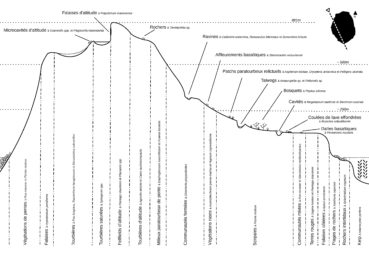
La réserve naturelle nationale des Terres australes françaises a été créée en 2006, puis étendue sur sa partie marine en 2016 et 2022. Couvrant une superficie d’environ 1 662 000 km², soit la totalité de terres émergées (archipel Crozet, îles Kerguelen, îles Saint-Paul et Amsterdam) et des espaces maritimes sous juridiction française (eaux territoriales et zone économique exclusive – ZEE), elle est à ce jour la plus grande réserve naturelle de France et la deuxième plus grande aire marine protégée au monde. Sur Amsterdam, des zones sensibles à la présence humaine ont ainsi été classées en zones dédiées à la recherche scientifique, c’est le cas des falaises d’Entrecasteaux (photo 9) et du Plateau des Tourbières, pour lesquelles un nombre maximal de passages est autorisé chaque année. Dans le cadre de la mise en œuvre du deuxième plan de gestion (2018-2027) de la réserve naturelle, différentes missions sont menées pour étudier la flore de l’île [protocole atlas, observatoire habitat (photos 92 et 117), cartographie des habitats, suivis post-éradication des bovins, etc.]. Un travail est également mené pour préciser la typologie des habitats de l’île via des relevés phytosociologiques. Le transect proposé (figure 4) est représentatif des différents habitats de l’île, mais avec une typologie encore incertaine issue des observations de l’année et des différents agents flore qui ont précédé (Berteloot, 2019a). D’autres missions sont menées pour la protéger (biosécurité, protocole de veille et d’arrachage des espèces exotiques, port de raquettes en zones tourbeuses, etc.). Une éradication des rongeurs est également prévue en 2024, dans le cadre du projet RECI (Restauration des écosystèmes insulaires de l’océan Indien) financé par l’Union européenne sur le onzième Fond européen de développement (FED – PTOM). Cette opération d’envergure doit favoriser la conservation des milieux et des espèces face aux menaces que représentent les mammifères introduits en milieu insulaire. Pour la flore, cette action pourrait favoriser la régénération naturelle de Phylica arborea et la dynamique de certaines espèces, comme la spartine (Sporobolus mobberleyanus), qui sont très régulièrement rongées par les rats et souris. Pour renforcer la dynamique naturelle de Phylica arborea un programme de restauration des populations a été repris en 2012 par les TAAF, suite aux premiers efforts menés par le Muséum national d’histoire naturelle entre 1986 et 1993. Ainsi, ce sont généralement mille phylicas qui sont produits dans la pépinière et plantés chaque année sur l’île Amsterdam.
Glossaire
Accrescent : qualifie un organe floral qui continue de croître après la fécondation.
Amibes : groupe polyphylétique de micro-organismes unicellulaires eucaryotes.
Apothécie : chez les Lichens, partie fertile en forme de disque ou de coupe issue de la « fructification » d’un champignon ascomycète.
Caryotype : analyse morphologique (nombre et structure) des chromosomes.
Ciliés : les ciliés, ou Ciliaphora, sont des protozoaires aquatiques eucaryotes unicellulaires.
Circumaustrale : qualifie la répartition d’un organisme qui suit des latitudes similaires dans la partie australe de l’hémisphère sud.
Conspécifiques : deux ou plusieurs organismes sont dits conspécifiques s’ils appartiennent à la même espèce.
Cuticule : couche externe qui recouvre et protège les organes aériens des plantes.
Épilithe : qualifie une espèce vivant à la surface d’une roche ou d’un substrat dur.
Fellfield : terme anglophone désignant un environnement ouvert et minéral, spécifiquement pauvre, où la dynamique du vent et du gel donne naissance à des formes végétales caractéristiques.
Indusie : fine membrane protégeant les sores chez les fougères.
Mascareignes : archipel de l’océan Indien formé de trois îles principales, La Réunion (France), l’île Maurice et Rodrigues (Maurice).
Périspore : membrane qui enveloppe les corpuscules reproducteurs des fougères.
Pinnule : division ultime d’une fronde de fougère.
Pneumatocyste : structure en forme de poire, remplie de gaz, permettant aux Algues brunes de flotter.
Pseudo-viviparité : reproduction végétative où la plante mère développe des bourgeons adventifs ou des bulbilles destinés à la dissémination de l’espèce.
Révolutée : qualifie une marge enroulée en dehors et en dessous du limbe.
Rotifères : organismes microscopiques caractérisés par deux couronnes de cils autour de leur bouche. Ils sont l’une des composantes majeures du zooplancton d’eau douce.
Soralie : déchirure du cortex supérieur du thalle chez certains lichens, renfermant les sorédies et servant à la reproduction asexuée.
Sporophylle : feuille ou fronde fertile portant les sporanges.
Strobile : inflorescence ou infrutescence, formée par un ensemble d’écailles imbriquées, principalement connu des Gymnospermes et Lycopodes.
Sub-aptère : en zoologie, qualifie une absence partielle d’ailes, rendant l’organisme inapte au vol.
Sub-endémique : qualifie une espèce qui se rencontre sur un territoire restreint, mais aussi et exclusivement sur un autre territoire assimilé ou limitrophe.
Thèque : enveloppe dure et minéralisée, présente chez beaucoup d’organismes, dont certaines amibes.
Tyrphobionte : qualifie un organisme qui est strictement inféodé aux milieux tourbeux.
Vicariantes : qualifie deux taxons se substituant l’un à l’autre dans des aires géographiques distinctes.
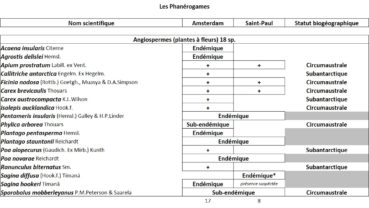
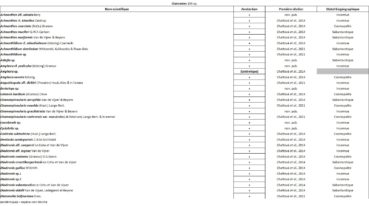
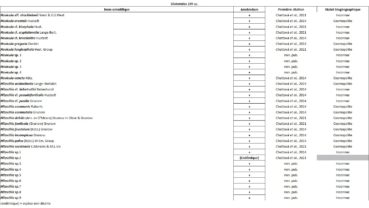
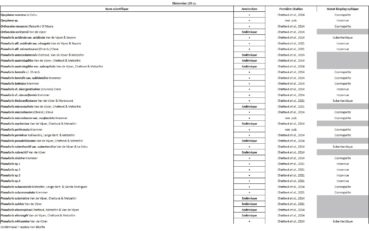
Tableau 1 (1a et 1b). Liste des Phanérogames et des Ptéridophytes de l’île Amsterdam.
Tableau 2 (2a et 2b). Liste des Bryophytes de l’île Amsterdam.
Tableau 3 (3a, 3b et 3c). Liste des Lichens de l’île Amsterdam.
Tableau 4 (4a, 4b, 4c, 4d, 4e et 4f). Liste des Diatomées de l’île Amsterdam
Bibliographie
Aptroot A., Van de Vijver B., Lebouvier M. & Ertz D., 2011. Lichens of Ile Amsterdam and Ile Saint-Paul (TAAF, southern Indian Ocean). Nova Hedwigia 92 : 343-367.
Barthlott W., Fischer E., Frahm J.-P. & Seine R., 2000. First experimental evidence for zoophagy in the hepatic Colura. Plant Biology 2 (1) : 93-97.
Bauret L., Rouhan G., Hirai R.Y., Perrie L., Prado J., Salino A., Senterre B., Shepherd L., Sundue M., Selosse M.-A. & Gaudeul M., 2017. Molecular data, based on an exhaustive species sampling of the fern genus Rumohra (Dryopteridaceae), reveal a biogeographical history mostly shaped by dispersal and several cryptic species in the widely distributed Rumohra adiantiformis. Botanical Journal of the Linnean Society 185 (4) : 463-481.
Berteaux D. & Micol T., 1992. Population studies and reproduction of the feral cattle (Bos taurus) of Amsterdam Island, Indian Ocean. Journal of Zoology 228 : 265-276.
Berteloot H., 2019a. Atlas de la flore de l’île Amsterdam. TAAF.DE. (n. pub.).
Berteloot H., 2019b. Guide de la flore de l’île Amsterdam. TAAF.DE. (n. pub.).
Bescherelle E., 1875. Note sur les mousses des îles Saint-Paul et d’Amsterdam. Comptes rendus hebdomadaires des séances de l’Académie des sciences 81 : 720-725.
Bischler-Causse H., 1993. Marchantia L., the European and African taxa. Bryophytorum Bibliotheca 45 : 1-129.
Blockeel T., Bakalin V., Bednarek-Ochyra H., Ochyra R., Buck W., Choi S., Cykowska-Marzencka B., Erdag A., Erzberger P., Kırmacı M., Kirschner H., Lebouvier M., Papp B., Sabovljevic M., Sabovljevic A., Schrder W., Singh S., Sun B.-Y., Townsend C. & Yayintas O., 2009a. New national and regional bryophyte records, 20. Journal of Bryology 31 (1) : 54-62.
Blockeel T., Bednarek-Ochyra H., Ochyra R., Cykowska-Marzencka B., Esquivel M., Lebouvier M., Lus L., Martins S., Müller F., Németh C., Papp B., Plasek V., Pcs T., Sabovljevic M., Sérgio C., Sim-Sim M., Stech M., Vňa J. & Yayintas O., 2009b. New national and regional bryophyte records, 21. Journal of Bryology 31 (2) : 132-139
Bouly de Lesdain M., 1931. Lichens recueillis en 1930 dans les îles Kerguelen, Saint-Paul et Amsterdam par M. Aubert de la Rüe. Annales de cryptogamie exotique 4 : 98-103.
Chaigne A., 2019. Plan national d’actions pour l’albatros d’Amsterdam 2018-2027. Ministère de la Transition écologique et solidaire, 135 p.
Chambrin L., Rhumeur A., Delord K., Barbraud C., Lebouard F. & Harivel R., 2018. Rapport de mission, campagne Saint-Paul. TAAF.DE. / IPEV (n. pub.).
Charton E., 1860. Voyage de circumnavigation de la frégate autrichienne La Novara (1857-1859). Le Tour du monde, nouveau journal des voyages (1) : 33-48.
Chattová B., 2017. Ecology, taxonomy and biogeography of diatoms (Bacillariophyta) of Ile Amsterdam and Ile Saint-Paul (TAAF, Southern Indian Ocean). Faculty of Science, Masaryk University, 224 p.
Chattová B., Lebouvier M. & Van de Vijver B., 2014. Freshwater diatom communities from Ile Amsterdam (TAAF, southern Indian Ocean). Fottea, Olomouc 14 (1) : 101-119.
Chattová B., Lebouvier M., Syrovatka V. & Van de Vijver B., 2021. Moss-inhabiting diatom communities from Ile Amsterdam (TAAF, southern Indian Ocean). Plant Ecology and Evolution 154 (1) : 63-79.
Citerne P. E., 1897. Du genre « Acaena« . Revue des sciences naturelles de l’Ouest 7 : 43.
De Smet W., 2001. Some Rotifera from Ile Amsterdam (Terres australes et antarctiques françaises), with description of Brachionus amsterdamensis sp. nov. (Monogononta: Brachionidae). International Journal of Limnology 37 (1) : 9-20.
De Vlaming W., 1697. Voyage to the Great South Land.
Didier S., 1866. Récit du naufrage du Vellore. La Gironde, 8 mai 1866.
Doucet S., Giret A., Weis D. & Scoates J., 2003. Géologie des îles Amsterdam et Saint-Paul. Géologues 137 : 10-14.
Doucet S., Weis D., Scoates J.S., Debaille V. & Giret A., 2004. Geochemical and Hf–Pb–Sr–Nd isotopic constraints on the origin of the Amsterdam-St. Paul (Indian Ocean) hotspot basalts. Earth and Planetary Science Letters 218 (1-2) : 179-195.
Duhamel G. (coord.), 2023. Les îles Saint-Paul et Amsterdam (océan Indien sud). Environnement marin et pêcheries. Muséum national d’histoire naturelle, Paris, 384 p.
Ellis L.T. et al., 2012a. New national and regional bryophyte records, 32. Journal of Bryology 34 (3) : 231-246.
Ellis L.T. et al., 2012b. New national and regional bryophyte records, 33. Journal of Bryology 34 (4) : 281-291.
Ellis L.T. et al., 2015. New national and regional bryophyte records, 42. Journal of Bryology 37 (1) : 68-79.
Ertz D., Sanderson N. & Lebouvier M., 2021. Thelopsis challenges the generic circumscription in the Gyalectaceae and brings new insights to the taxonomy of Ramonia. The Lichenologist 53 : 45-61.
Féral J.-P., Verlaque M., Rosenfeld S., Poulin E., Chenuil A. & Saucède T., 2021. The marine vegetation of the Kerguelen Islands: history of scientific campaigns, inventory of the flora and first analysis of its biogeographical affinities. Cryptogamie, Algologie 42 (12) : 173-216.
Féral J.-P. & Saucède Th., 2023. Les îles Saint-Paul et Amsterdam, une aire maritime protégée « pilote » ? Espèces 47 : 24-31.
Flatberg I., Whinam J. & Lebouvier M., 2011. Three species of Sphagnum endemic to Île Amsterdam, Terres australes et antarctiques françaises: S. cavernulosum sp. nov., S. complanatum sp. nov. and S. islei. Journal of Bryology 33 (2) : 105-121.
Foucault B. (de), 2018. Errata et compléments à propos du Prodrome des végétations de France, cinquième note. Journal de botanique de la Société botanique de France 81 : 39-52.
Fournier E., 1875. Sur les Fougères et les Lycopodiacées des îles Saint-Paul et Amsterdam. Comptes-rendus de l’Académie des sciences de Paris 81 : 1139-1142.
Frenot Y. & Valleix T., 1990. Carte des sols de l’île Amsterdam (Terres australes et antarctiques françaises). Bulletin du Comité national français des recherches antarctiques 59 : 1-48.
Frenot Y., Gloaguen J.-C., Massé L. & Lebouvier M., 2001. Human activities, ecosystem disturbance and plant invasions in subantarctic Crozet, Kerguelen and Amsterdam Islands. Biological Conservation 101 : 33-50.
Gargominy O., Tercerie S., Régnier C., Ramage T., Dupont P., Daszkiewicz P. & Poncet L., 2021. TAXREF v. 15, référentiel taxonomique pour la France : méthodologie, mise en œuvre et diffusion. Muséum national d’Histoire naturelle, Paris, rapport UMS PatriNat (OFB-CNRS-MNHN), 63 p.
Giret A., 1987. Géologie des Terres australes françaises. Comité national français de recherches antarctiques 58 : 17-41.
Global Carex Group, 2015. Making Carex monophyletic (Cyperaceae, tribe Cariceae): a new broader circumscription. Botanical Journal of the Linnean Society 179 (1) : 1-42.
Grolle R., 2002. The Hepaticae and Anthocerotae of the subantarctic and temperate islands in the eastern Southern Hemisphere (90° E to 0°): an annotated catalogue. Journal of Bryology 24 (1) : 57-80.
Hassemer G., Bruun-Lund S., Shipunov A.B., Briggs B.G., Meudt H.M. & Rønsted N., 2019. The application of high-throughput sequencing for taxonomy: the case of Plantago subg. Plantago (Plantaginaceae). Molecular Phylogenetics and Evolution 138 : 156-173.
Heger T.J., Mitchell E.A.D., Ledeganck P., Vincke S., Van de Vijver B. & Beyens L., 2009. The curse of taxonomic uncertainty in biogeographical studies of freeliving terrestrial protists: a case study of testate Amoebae from Amsterdam Island. Journal of Biogeography 36 : 1551-1560.
Hemsley W.B., 1885. Botany of the Challenger expedition: botany of the Bermudas and Various other Islands. 1 (2) : 259-281.
Henrickson J. & Herbst D., 1988. Uncinia Pers. (Cyperaceae) in the Hawaiian Islands. Pacific Science 42 (3- 4) : 230-236.
Hooker J.D., 1844-1847. The botany of the Antarctic voyage of H.M. Discovery Ships Erebus and Terror in the years 1839-1843, under the command of captain Sir James Clark Ross, 1 – Flora Antarctica. Reeve Brothers, London, 312 p.
Hooker J.D., 1875. On the discovery of Phylica arborea Thouars, a tree of Tristan da Cunha, in Amsterdam Island…, with an enumeration of the phanerogams and vascular cryptogams… Botanical Journal of the Linnean Society 14 : 474-480.
Iwanycki Ahlstrand N., Verstraete B., Hassemer G., Dunbar-Co S., Hoggard R., Meudt H. M. & Rønsted N., 2019. Ancestral range reconstruction of remote oceanic island species of Plantago (Plantaginaceae) reveals differing scales and modes of dispersal. Journal of Biogeography 46 (4) : 706-722.
Janin M., 2010. Le plateau d’Amsterdam-St Paul : caractérisation du point chaud éponyme et évolution de son interaction avec la dorsale sud-est indienne. Géologie appliquée, université de Bretagne occidentale – Brest, université européenne de Bretagne.
Jolinon J.-C., 1987. Les Phanérogames adventices sur l’île Amsterdam. Comité national français pour les recherches antarctiques 58 : 183-188.
Krempelhuber A. (von), 1870. Flechten. Reise Seiner Majestäts Fregatte Novara um die Erde. Botanischer Theil 1 : 105-129.
La Rüe E.A. (de), 1932. La flore et la faune des îles Saint-Paul et Amsterdam. Revue d’écologie, Terre et Vie : 642-662.
Linder P., 2005. Evolution of diversity: the Cape flora. Trends in Plant Science 10 (11) : 536-541.
Linder P., Baeza M., Barker N., Galley C., Humphreys A., Lloyd K., Orlovich D., Pirie M., Simon B., Walsh N. & Verboom G., 2010. A generic classification of the Danthonioideae (Poaceae). Annals of the Missouri Botanical Garden 97 (3) : 306-364.
Lutwyche A., 1853. Récit du naufrage du Meridian sur l’île d’Amsterdam. Imprimerie de L. Channell, Port-Louis, 15 p.
Müller F., 2017. Porella biedermannii sp. nov. (Marchantiophyta, Porellaceae) and other new records of liverworts and hornworts from central Chile. Cryptogamie, Bryologie, 38 (4) : 349-363.
Muñoz J., Felicísimo A.M., Cabezas F., Burgaz A.R. & Martínez I., 2004. Wind as a long-distance dispersal vehicle in the Southern Hemisphere. Science 304 (5674) : 1144-1147.
Newsham K., 2010. The biology and ecology of the liverwort Cephaloziella varians in Antarctica. Antarctic Science 22 (2) : 131-143.
Nylander W., 1875. Liste de lichens recueilles par M.G. de l’Isle, aux îles Saint Paul et d’Amsterdam et description des espèces nouvelles. Comptes rendus hebdomadaires des séances de l’Académie des sciences 81 : 725-726.
Nylander W., 1886. Lichenes insulae Sancti Pauli. Flora 69 : 318-322.
O’Hara T.D. & Thuy B., 2022. Biogeography and taxonomy of Ophiuroidea (Echinodermata) from the Îles Saint-Paul and Amsterdam in the southern Indian Ocean. Zootaxa 5124 (1) : 1-49.
Ochyra R., Lewis Smith R.I. & Bednarek-Ochyra H., 2008. The illustrated moss flora of Antarctica. Cambridge University Press, 704 p.
Orchymont Q. (d’), 2022. État des lieux des populations d’oiseaux nicheurs et des otaries sur l’île Amsterdam. TAAF.DE. (n.pub.).
Orchymont Q. (d’) & Saboureau F., 2022a. L’île Amsterdam des Terres australes, une faune et une flore à la croisée des origines. Le Courrier de la Nature 335 : 32-40.
Peterson P., Romaschenko K., Arrieta Y. & Saarela J., 2014. A molecular phylogeny and new subgeneric classification of Sporobolus (Poaceae: Chloridoideae: Sporobolinae). Taxon 63 (6) : 1212-1243.
Petit-Thouars A. L.-M. (du), 1808. Esquisse de la Flore de l’Isle de Tristan d’Acugna.
Petit-Thouars A. L.-M. (du), 1811. Mélanges de botanique et de voyages, premier recueil. Arthus Bertrand, 352 p.
Reichardt H.W., 1871. Verhandlungen der Kaiserlich-Koniglichen Zoologisch-Botanischen Gesellschaft in Wien. Vienna, 21 : 33.
Rhumeur A., 2015. Fougères et plantes alliées de l’île d’Amsterdam. TAAF.DE. (n. pub.).
Richardson J.E., 2003. Species delimitation and the origin of population in island representatives of Phylica. Evolution 57 (4) : 816-827.
Rønsted N., Chase M.W., Albach D.C. & Bello M.A., 2002. Phylogenetic relationships within Plantago (Plantaginaceae): evidence from nuclear ribosomal ITS and plastid trnL-F sequence data. Botanical Journal of the Linnean Society 139 (4) : 323-338.
Roux J.P., 1991. A new species of Elaphoglossum (Pteridophyta: Lomariopsidaceae) from the Tristan da Cunha island group, central South Atlantic. South African Journal of Botany 57 (5) : 234-235.
Ryan P., 2007. Field Guide to the Animals and Plants of Tristan da Cunha and Gough Island. Pisces Publications, 162 p.
Saboureau F., 2022d. État des lieux des connaissances muscinales sur Amsterdam, décembre 2022. TAAF DE (n. pub.).
Schiffner V.F., 1906. Die Lebermoose der Deutschen Südpolar-Expedition 1901-1903. In E. von Drygalski (ed.), Deutsche Südpolar-Expedition 1901-1903 im Auftrage des Reichamtes des Innern 8. Botanik, Berlin, Georg Reimer : 57-80.
Séguy E., 1959. Insectes diptères de l’île Amsterdam (mission de M. Patrice Paulian, 1955-1956). Mémoires du Muséum national d‘histoire naturelle, série A, (17) : 133-154.
Sun Y., He X. & Glenny D., 2014. Transantarctic disjunctions in Schistochilaceae (Marchantiophyta) explained by early extinction events, post-Gondwanan radiations and palaeoclimatic changes. Molecular Phylogenetics and Evolution 76 : 189-201.
Sundue M.A., Rouhan G. & Moran R.C., 2010. Megalastrum (Dryopteridaceae) of the Circumaustral region: Chile, Argentina, and southern islands of the Atlantic, Pacific, and Indian Oceans. Systematic Botany 35 (3) : 461-475.
TAAF, 2017. Plan de gestion 2018-2027 de la réserve naturelle nationale des Terres australes françaises, A – Diagnostic et enjeux. 434 p.
Tardieu-Blot M.-L., 1954. Sur les Fougères récoltées par Aubert de la Rüe aux îles Kerguelen et Amsterdam. Mémoires de l’Institut scientifique de Madagascar, série B, 5 : 87-108.
Timaná M.E, 2018. Sagina diffusa (Hook. f.) Timaná, comb. nov. (Caryophyllaceae), a new combination for the flora of île St. Paul (Southern Indian Ocean), with some historical notes. Adansonia, série 3, 40 (3) : 47-53.
Timaná M.E., Lebouvier M. & Rouhan G., 2019. Sagina hookeri Timaná, sp. nov. (Caryophyllaceae), a new endemic species for the flora of île Amsterdam (French Southern and Antarctic Lands). Adansonia, série 3, 41 (2) : 17-23.
Tixier P., 1980. Bryophyta exotica, VI – Données muscologiques nouvelles sur l’île d’Amsterdam (océan Indien du Sud). Nova Hedwigia 32 : 483-491.
Tréhen P., Frenot Y., Lebouvier M. & Vernon P., 1990. Invertebrate fauna and their role in the degradation of cattle dung at Amsterdam Island. In K.R. Kerry & G. Hempel (eds.), Antarctic ecosystems, ecological change and conservation, Springer, Berlin Heidelberg : 337-346.
UICN Comité français, OFB & MNHN, 2022. La Liste rouge des espèces menacées en France, chapitre Flore vasculaire endémique des petits territoires d’outre-mer. Paris, France.
Van de Vijver B. & Cox E.J., 2013. New and interesting small celled naviculoid diatoms (Bacillariophyceae) from a lava tube cave on île Amsterdam (TAAF, Southern Indian Ocean). Cryptogamie, Algologie 34 (1) : 37-47.
Váña J., Lebouvier M., Ochyra R, Bednarek-Ochyra H. & Cykowska B, 2010. Two noteworthy records of hepatics from îles Amsterdam in the South Indian Ocean. Nova Hedwigia 138 : 231-241.
Váña J., Ochyra R., Lebouvier M. & Cykowska-Marzencka B., 2014. Bryophytes of île Amsterdam in the South Indian Ocean, 1 – Liverworts. Cryptogamie, Bryologie 4 : 335-371.
Vélain C., 1877. Passage de Vénus sur le Soleil (9 décember 1874). Expédition française aux îles Saint-Paul et Amsterdam. Zoologied. Observations générales sur la fauna des deux îles suivies d’une description des mollusques. Archives de zoologie expérimentale et générale 6 : 1-143.
Viane R., 2021. Aspleniaceae of Madagascar, a revision with annotations on species from the Mascarenes, the Comoros, TAAF, and continental Africa. University Press, 390 p.
Viette P., 1959. Lépidoptères de l’île Amsterdam (récoltes de Patrice Paulian). Bulletin de la Société entomologique de France 64 (1-2) : 22-29.
Walton D.W.H., 1980. Studies on Acaena (Rosaceae), IV – Distribution and ecology of the sub-Antarctic species. British Antarctic Survey Bulletin 49 : 59-72.
Warnstorf C., 1891. Beiträge zur Kenntnis Exotischer Sphagna. Hedwigia 30 : 12-46.
Wheeler, G.A. 2007. Carex and Uncinia (Cyperaceae, Cariceae) from the Juan Fernández Archipelago, Chile. Darwiniana 45 (1) : 120-141.
Whinam J. & Copson G., 2006. Sphagnum moss: an indicator of climate change in the sub-Antarctic. Polar Record 42 (01) : 43-49.
Sites Internet
Anderson R.J., Stegenga H. & Bolton J.J., 2016. Seaweeds of the South African South Coast. World Wide Web electronic publication, University of Cape Town [05/2022], http://southafrseaweeds.uct.ac.za/.
GBIF | Global Biodiversity Information Facility [09/2022], https://www.gbif.org/fr/.
Morel D. & Bourbon-Denis U., 2021. La folle histoire du Bovichtus… [09/2022], https://blog.saint-paul.ams.fr/
International Plant Name Index [09/2022], https://ipni.org/.
Muséum national d’histoire naturelle [09/2022], https://science.mnhn.fr/.
Orchymont Q. (d’) & Saboureau F., 2022b. La faune marine côtière de l’île Amsterdam [03/2022], https://blog.saint-paul.ams.fr/.
Royal Botanic Garden, Kew, Plant Of the World Online [09/2022], https://powo.science.kew.org/?.
Saboureau F., 2021. La dernière forêt de l’île Amsterdam [10/2021], https://blog.saint-paul.ams.fr/.
Saboureau F., 2022a. Les premières images d’un papillon inapte au vol, endémique de l’île Amsterdam [09/2022], https://blog.saint-paul.ams.fr/.
Saboureau F., 2022b. La tipule de Paulian, espèce endémique de l’île Amsterdam [11/2022], https://blog.saint-paul.ams.fr/.
Saboureau F., 2022c. Le crambe de Viette, un papillon endémique de l’île Amsterdam [12/2022], https://blog.saint-paul.ams.fr/.
Wikipédia [09/2022], https://fr.wikipedia.org.
Remerciements
La connaissance de la flore amstellodamoise doit beaucoup aux recherches menées avec le soutien de l’IPEV par M. Lebouvier et ses collaborateurs (D. Ertz pour les Lichens, R. Ochyra pour les Bryophytes, G. Rouhan pour les ptéridophytes, B. Van de Vijver pour les Diatomées et J. Whinam pour les Sphaignes).
Merci à Pierre Agnola (chargé de la connaissance et du suivi de la flore et des habitats terrestres à la direction de l’Environnement des TAAF), à Clément Quetel (chef du service Conservation et Restauration des milieux naturels à la direction de l’Environnement des TAAF), à Damien Morel (agent DE flore/habitat 2020/2021), à Germinal Rouhan (ptéridologue, maître de conférence au MNHN), à Damien Ertz (lichénologue, chercheur au jardin botanique de Meise), à Marc Lebouvier (programme IPEV 136) et au cabinet du préfet des TAAF pour leur relecture. Un merci particulier à P. Agnola et M. Lebouvier qui ont suivi et relu l’article au fur et à mesure de son avancement.
Merci à Lise Le Gall (phycologue, maître de conférence au MNHN), à Kjell Flatberg (spécialiste des Sphaignes, professeur au Muséum d’histoire naturelle et d’archéologie de Trondheim, en Norvège), à David Glenny (spécialiste des Bryophytes néo-zélandaises, chercheur à l’Institut de recherche de la Couronne néo-zélandais), à Halina Bednarek-Ochyra (spécialiste des Bryophytes, chercheuse à l’Institut de botanique Władysław Szafer de Cracovie, en Pologne) et à Hugo Berteloot (agent DE flore/habitat 2018/2019) pour leurs réponses à nos questions. Merci à Mathieu Reveillas (agent DE flore/habitat 2021/2022) pour son aide à la typologie d’habitats et à Gilles Mignon (agent DE flore/habitat 2022/2023), qui prendra le relais en 2023 pour l’amélioration des connaissances floristiques, pour son aide à l’identification de certaines Bryophytes.
Merci à Barbora Chattová (spécialiste des Diatomées, chercheuse à l’université de Masaryk) pour nous avoir transmis sa liste de travail de Diatomées encore non publiées.
Merci aussi à Marie Fretin (ornithologue IPEV-109 2021/2022), Bart Van de Vijver (spécialiste des Diatomées, chercheur au jardin botanique de Meise) et Quentin d’Orchymont (agent DE ornithologie 2021/2022) pour leurs photos, respectivement [72], [39] et [11].
Pour terminer, merci à Bruno de Foucault (ancien enseignant-chercheur en botanique) pour sa relecture et la mise en page de l’article.