Les bryophytes des Cévennes gréseuses ardéchoises
Title
The bryophytes of the Cévennes ardéchoises
Résumé
La bryoflore des Cévennes ardéchoises est encore mal connue. La découverte en mars 2021 de l’anthocérote Anthoceros caucasicus, espèce nouvelle pour la France, dans le secteur gréseux faisant la transition entre le Massif central et les plateaux calcaires ardéchois, a déterminé le Collectif bryologique du Massif central à consacrer trois jours de prospection à cette région. L’originalité géologique et climatique du secteur est présentée. Avec 229 taxons inventoriés, la bryoflore est riche, d’autant qu’elle inclue de nombreux taxons rares ou menacés dans la région, entre autres Anomobryum concinnatum, Campylopus atrovirens, Plagiomnium medium et Ptychostomum minii. La chorologie des espèces est analysée et les communautés rencontrées décrites. Trois sites en particulier, les Tétines de Vernon, Vignelongue et le ravin de Prades, représentent un enjeu majeur en termes de conservation.
Abstract
The bryoflora of the Cévennes ardéchoises is still poorly known. The discovery in 2021 of the hornwort Anthoceros caucasicus, which is new to France, in the sandstone sector that forms the transition between the Massif Central and the Ardèche limestone plateaux, prompted the Collectif bryologique du Massif central to devote three days to bryoprospecting in this region. The geological and climatic originality of the sector is presented. With 229 taxa inventoried, the bryoflora is rich, especially as it includes many taxa that are rare or threatened in the region, including Campylopus atrovirens, Cephaloziella turneri, Epipterygium tozeri, Gongylanthus ericetorum and Ptychostomum minii. The chorology of the species is analysed and the encountered communities described. Three sites in particular – the Tétines de Vernon, Vignelongue and Prades Ravine – represent a major conservation challenge.
1. Contexte
Initié par le Conservatoire botanique national du Massif central en 2022, le collectif bryologique du Massif central rassemble des bryologues experts et en devenir, pour l’essentiel de la région éponyme et de ses alentours. Un des premiers objectifs du collectif est de fédérer les bryologues autour du Massif central, avec pour finalité d’améliorer l’état des connaissances des Mousses, Hépatiques et Anthocérotes, de prendre part à leur conservation, tout en permettant à chacun de monter en compétences. Les secteurs du Massif central (comme ceux de France) bryologiquement méconnus sont encore nombreux. La découverte d’une anthocérote nouvelle pour la France (Anthoceros caucasicus) en avril 2021 dans les Cévennes gréseuses d’Ardèche et la méconnaissance de la bryoflore de cette région naturelle ont naturellement orienté le Collectif vers cette région pour sa première rencontre annuelle, en mars de l’année suivante. Les données collectées sur la flore et la végétation bryophytique, ainsi que les réflexions qui ont rythmé la vie du groupe pendant et après cet inventaire, sont exposées dans le présent article.
2. Méthodologie
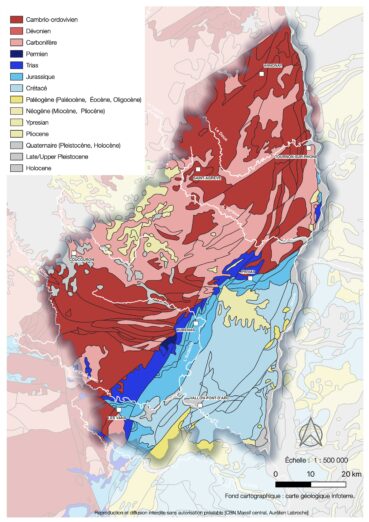
L’analyse de la base de données géoréférencées des cartes géologiques au 1/50 000e vectorisées et harmonisées – Bd Charm 50, mise à disposition par le Bureau de recherches géologiques et minières (BRGM) – a permis de délimiter les principaux bassins gréseux du département de l’Ardèche (carte 1).
Le choix des sites, facilité par un repérage de terrain, s’est porté naturellement sur des zones à accès suffisamment aisé, sûr, dont la surface et la sensibilité permettent d’y amener un groupe d’une vingtaine de bryologues et proches géographiquement les uns des autres. Le lieu-dit cascade de Baumicou à Vernon avait fait l’objet de brefs échantillonnages en 2005 qui avaient mis en évidence un cortège prometteur (Kurzia pauciflora, Sphagnum auriculatum et S. subnitens, etc.). Ce site a depuis fait l’objet d’un sentier d’interprétation (« les Tétines de Vernon », heureusement aujourd’hui fermé) ; la circulation libre de trop nombreux touristes a cependant considérablement érodé les cortèges bryologiques des dalles de grès. Suite à ce constat, il a été écarté de cette session. Les sites retenus comportent des conditions topographiques composites et la présence de suintements ou ruisselets, conditions réputées pour héberger un large panel de microhabitats favorables à l’expression de communautés bryophytiques contrastées et remarquables.
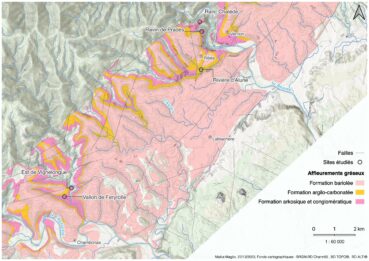
Les inventaires, qui se sont échelonnés sur trois journées (25 au 27 mars 2022), ont concerné cinq secteurs de l’Ardèche méridionale[1], tous situés dans le périmètre du Parc naturel régional des Monts d’Ardèche (carte 2) :
- aux lieux-dits Ranc Chalède et Ravin de Prades (commune de Ribes) ;
- au lieu-dit Vignelongue et dans le vallon du ruisseau de Feryrolle (commune de Chambonas) ;
- dans le vallon de la rivière d’Alune (à la limite entre les communes de Ribes et Lablachère).
Toutes les bryophytes rencontrées dans les sites visités ont été relevées, y compris les espèces corticoles ou saprolignicoles[2]. Des photographies, schémas et prises de notes ont permis a posteriori d’affiner la description des communautés rencontrées et d’en préciser le déterminisme spatial et écologique.
Des échantillons ont été collectés en vue d’une validation ou identification au laboratoire. Toutes les observations ont été rassemblées dans un tableau synthétique puis saisies pour intégration à Lobelia®, système d’information mutualisé de quatre conservatoires botaniques nationaux, dont fait partie le CBN Massif central.
La nomenclature des taxons (Bryophytes et Trachéophytes) cités dans ce document suit, sauf indication contraire, le référentiel national de France métropolitaine (TaxRef) du Muséum national d’histoire naturelle, version 16.0 (Gargominy et al., 2022). Afin de ne pas alourdir la lecture du document, les noms des espèces et des syntaxons sont indiqués sans leurs autorités. La liste complète des taxons accompagnés de leur autorité est présentée en annexe 1 ; la nomenclature des végétations citées dans le document est disponible en annexe 2 et suit :
- pour les communautés trachéophytiques, les synopsis et les catalogues des végétations de la région Auvergne-Rhône-Alpes (CBNMC, 2021+ ; Renaux et al., 2023) ;;
- pour les communautés bryophytiques, le synopsis bryosociologique pour la France (Bardat & Hauguel, 2002), Syntaxonomischer Konspekt der Moosgesellschaften Europas und angrenzender Gebiete (Marstaller, 2006) et Les bryophytes de France, 1 – Anthocérotes et Hépatiques (Hugonnot & Chavoutier, 2021).
3. Géographie, géologie et climat
De Mâcon à Valence, le rebord oriental du Massif central est orienté nord-sud, longeant la Saône puis le Rhône. Légèrement au sud de Valence, cette limite s’infléchit nettement et prend une direction sud-ouest. Elle suit une faille majeure, la faille des Cévennes. Celle-ci est très ancienne et date probablement de la fin de la phase hercynienne (310-270 m.a. AP[3]), quand le futur Massif central était une chaîne de montagne dépassant plusieurs milliers de mètres d’altitude. Entre les vallées de l’Eyrieux et celle du Chassezac, au niveau des Cévennes médianes, cette faille sépare le Massif central à l’ouest, où affleurent des roches généralement siliceuses (série cristallophyllienne ardéchoise, migmatites et granites du Velay) du Bas-Vivarais, où dominent des calcaires et des marnes beaucoup plus récents datant du Jurassique et du Crétacé. À la limite entre ces deux entités, on trouve une mince bande de basse altitude et au profil doux, suivant la direction de la faille des Cévennes, où affleurent des grès. Ceux-ci datent du Trias, ils ont donc entre 200 et 250 millions d’années.
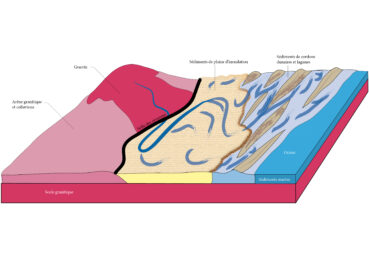
À cette époque, l’érosion a déjà presque complètement raboté le Massif central. Il n’y a plus de hauts sommets, mais plutôt des collines et des plaines. La végétation est sans doute limitée, le climat étant chaud et saisonnièrement aride, ce qui altère les granites et les gneiss du socle ancien, à l’ouest. L’érosion est intense et les rivières charrient d’importantes quantités de sables et de graviers. Ces sédiments se déposent le long des cours d’eau, dans de larges plaines d’inondation puis, plus bas, en bordure de mer, où ils participent à la mise en place d’un système de dunes entrecoupé de lagunes (figure 1). Ces alluvions siliceuses, plus tard cimentées, constituent les grès triasiques de la bordure cévenole médiane. Postérieurement, au Jurassique, le niveau de la mer s’élevant, l’ensemble est ennoyé et des sédiments bien différents, des marnes et des calcaires, sont déposés, venant recouvrir les grès du Trias. Il existe cependant quelques ensembles de grès jurassiques, par exemple ceux du lieu-dit « La Jaubernie » à Coux, près de Privas.
Figure 1. Contexte géomorphologique des Cévennes médianes à l'époque de formation des grès au Trias. Les arènes granitiques et colluvions forment des arkoses, poudingues, grès arkosiques à ciment argilo-siliceux. Les sédiments de plaine d'inondation forment des grès plus fins, à grains plus roulés et de taille plus régulière, à matrice majoritairement siliceuse, intercalés de bancs argileux. Les sédiments de cordons lagunaires et lagunes produisent des grès similaires à ceux de la plaine d'inondation, avec toutefois en plus de la dolomie (carbonate) et de l'anhydrite. Les sédiments marins sont carbonatés : marnes et marno-calcaires. Ils n'existent que beaucoup plus à l'est, dans le massif alpin (Trièves, Lamure) ; M. Philippe (schéma d’origine), A. Labroche (numérisation), CC-BY-NC-ND.
Les grès triasiques des Cévennes médianes livrent peu de fossiles, hormis quelques traces de vertébrés, et sont donc mal datés. On peut y reconnaître de bas en haut, et donc du plus vieux au plus récent, trois ensembles.
- La « Formation détritique de base » du Trias inférieur (251-247 m.a. AP) est un ensemble de grès siliceux grossiers, de 25 à 40 m d’épaisseur. Au plus près des sources de sédiments, ces grès sont arkosiques (grains anguleux, peu roulés) à conglomératiques (incluant des graviers, voire des galets), la taille des grains est irrégulière et les phénocristaux de feldspaths abondants. Ces grès, mal cimentés par des argiles, se désagrègent rapidement à l’affleurement et sont peu poreux. Plus au sud-est, en se rapprochant de là où était alors la mer, la formation est principalement constituée de grès à grains plus arrondis, de taille plus régulière, cimentés par de la silice qui constitue donc des grès plus résistants à l’érosion. Encore plus au sud-est, tandis que tri et émoussé sont encore plus marqués, le ciment devient carbonaté (dolomite) voire salin (anhydrite). La Formation détritique de base génère quelques escarpements à cause de ses bancs de grès, mais ceux-ci sont relativement fragiles à l’altération. Les intercalations argileuses déterminent des niveaux de sources d’eau, parfois carbonatées. C’est sur les grès arkosiques que se sont concentrés les efforts de prospection (Ranc Chalède, Ravin de Prades, Vignelongue et vallon de Feryrolle).
- Au-dessus de la « Formation détritique de base », on observe une « Formation argilo-carbonatée» (ensemble daté du Trias moyen, 247-237 m.a. AP), épaisse de 20 à 100 m, variable tant en épaisseur qu’en lithologie. La dolomie, carbonate double de calcium et de magnésium, y est accompagnée de minéraux typiques des milieux lagunaires (gypse, sels, argiles). Des niveaux de grès siliceux peuvent s’y intercaler localement. La Formation argilo-carbonatée, peu compétente et ressortant rarement dans la topographie, est observée surtout le long des cours d’eau ; relativement carbonatée, elle donne des eaux dures. Elle a été prospectée principalement à la rivière d’Alune (Ribes-Lablachère).
- Le troisième terme est dit « Formation bariolée supérieure », datée du Trias supérieur (237-201 m.a. AP). C’est un ensemble épais (souvent plus de 130 m) constitué de grès siliceux grossiers intercalés d’argilites bariolées et de dolomies. Elle est sans doute celle qui ressort le plus dans la topographie.
Les grès triasiques des Cévennes sont fondamentalement siliceux, avec des grains de quartz ou de divers silicates. Cependant leur ciment est variable et, selon que la matrice est plus ou moins siliceuse, argileuse ou dolomitique, la solution qui les percole peut être acide ou basique. Globalement pauvres en minéraux ferromagnésiens et associés, ils engendrent des sols peu fertiles. Les pendages sont généralement nuls à faibles.
On peut toutefois souligner leur intérêt minéralogique en de nombreux points du piémont cévenol. Des sites miniers sur grès (Saint-Laurent-le-Minier, Saint-Félix-de-Pallières, Carnoulès dans le Gard ou encore Largentière en Ardèche) ont exploité la capacité de ce substrat à capter et parfois concentrer les métaux ou minéraux lourds (zinc, plomb, argent, cuivre, barytine en particulier). Cette originalité minéralogique avait permis d’expliquer en 2007 la découverte sur des grès du Trias d’une espèce typique des métaux lourds, Cephaloziella phyllacantha, alors nouvelle pour la France (ravin de Montjardin, flanc sud-est du causse Noir, Lanuéjols, Gard ; Hugonnot et al., 2008). Le cortège bryologique métallophile des grès cévenols mériterait de faire l’objet de recherches ciblées.
Enfin, la végétation naturelle des Cévennes médianes traduit l’existence d’un climat de marge méditerranéenne dont les caractéristiques générales (données historiques MétéoFrance 1991-2020, station de Aubenas-Vals, 280 m)[4] sont :
- une distribution irrégulière des précipitations annuelles, autour de 1 000-1 100 mm, avec un minimum pluvial en été, habituellement en juillet ;
- un maximum pluvial en automne (en octobre ou en novembre), variable tant en intensité qu’en date ;
- les orages dits « cévenols », surtout automnaux, qui contribuent fortement à la pluviométrie annuelle et entretiennent une hygrométrie élevée au pied des reliefs ;
- l’existence d’une sécheresse estivale (au sens de Bagnouls & Gaussen, 1957) plus ou moins marquée selon les années ;
- une température moyenne annuelle de 13,7 °C, avec des minima moyens hivernaux peu accusés, de peu supérieurs à 0 °C ;
- des maxima moyens estivaux ne dépassant pas les 30 °C.
4. Une bryoflore subméditerranéo-subocéanique d’affinité montagnarde
Au total, ce sont 229 taxons que nous avons inventoriés sur les grès triasiques des Cévennes médianes, dont 225 espèces et 4 variétés (Hymenostylium recurvirostrum var. recurvirostrum, Hypnum cupressiforme var. filiforme, Fissidens bryoides var. caespitans, Weissia controversa var. crispata).
L’analyse de la représentativité des types chorologiques (sensu Düll, 1983, 1984, 1985, 1992 et Hugonnot & Chavoutier, 2021) révèle une bryoflore partagée principalement entre taxons tempérés (38 %) et taxons subméditerranéens et/ou subocéaniques (31%). Les 14 % d’éléments méditerranéens-océaniques (soit 33 taxons) ajoutés au cortège d’espèces subméditérranéeo-subocéaniques constituent 45 % de la bryoflore recensée et renseignent sur le macroclimat local : Anthoceros caucasicus, Atrichum angustatum, Bartramia aprica, Calypogeia arguta et C. fissa, Campylopus atrovirens, C. fragilis et C. pilifer, Cephaloziella turneri, Corsinia coriandrina, Epipterygium tozeri, Fabronia pusilla, Fossombronia angulosa et F. caespitiformis, Gongylanthus ericetorum, Grimmia lisae, Habrodon perpusillus, Leptodon smithii, Lunularia cruciata, Mesoptychia turbinata, Porella obtusata, Ptychostomum minii, Rhynchostegium confertum, Riccia beyrichiana et R. warnstorfii, Scleropodium touretii, Scorpiurium circinatum et S. deflexifolium, Southbya tophacea, Syntrichia laevipila, Tortella nitida. Toutes sont des espèces qui marquent l’originalité des communautés bryophytiques des grès ardéchois.
Situés au pied des montagnes ardéchoises et soumis à des influences plus typiquement méditerranéennes remontant du sud au nord par le couloir rhodanien, les affleurements gréseux profitent de façon très atténuée, étant à l’abri du Massif central, des influences thermo-océaniques qu’on peut retrouver bien plus marquées dans les vallons cévenols plus méridionaux, ainsi que sur les grès du bassin de Brive (Corrèze) et dans le nord-est de la France (Joly et al., 2010 ; Renaux et al., 2023). L’absence d’espèces telles que Fissidens polyphyllus, Hookeria lucens, Isothecium holthii, Jubula hutchinsiae, Lejeunea lamacerina, Lophocolea fragrans, toutes présentes dans les fonds des vallons cévenols méridionaux en situation d’isolats, en est la démonstration. En Cévennes gardoises, près de Champclauson à la Grand-Combe, on trouve cependant un ravin sur grès houiller à Campylopus atrovirens, Nardia compressa et Sphagnum auriculatum. Ce site au cortège relictuel est d’autant plus exceptionnel qu’il a échappé à l’impact de l’exploitation du charbon particulièrement intense dans ce secteur au cours des xixe et xxe siècles.
Un tiers des espèces recensées a des affinités montagnardes (31 %, soit 69 espèces), ce qui est significatif et mérite d’être souligné. La proximité des montagnes ardéchoises explique la présence de ces espèces, telles que Amphidium mougeotii, Chionoloma tenuirostre, Diphyscium foliosum, Hymenostylium recurvirostrum, Marsupella emarginata, Philonotis tomentella, Pogonatum urnigerum, Pohlia proligera, Racomitrium aquaticum, R. heterostichum et R. lanuginosum, Rhabdoweisia fugax, Scapania undulata, Trilophozia quinquedentata. Ces espèces deviennent nettement plus abondantes à mesure que l’on pénètre dans le Massif central, quelques dizaines de kilomètres plus à l’ouest.
À noter également la présence d’espèces subboréales et boréales (17 %, soit 35 espèces ; Bartramia pomiformis, Ditrichum heteromallum, Encalypta streptocarpa, Hygrohypnum luridum, Philonotis caespitosa et P. calcarea, Plagiomnium ellipticum, Racomitrium aciculare, etc.) et aussi de deux espèces d’affinité arctique, Anomobryum concinatum et Plagiomnium medium, des espèces exceptionnelles à cette altitude et dans ce secteur ardéchois.
Un dernier aspect original est la présence des trois taxons du groupe de Trichostomum brachydontium récemment proposés par Ros et al. (2022), T. brachydontium Buch. s.s., T. littorale Mitt. et T. meridionale Ros, O. Werner, R.D. Porley :
- Trichostomum brachydontium, taxon très plastique, paraît avoir une large répartition européenne, centrée sur la Macaronésie et le pourtour méditerranéen ; il a été trouvé aux bords de la rivière d’Alune sur le grès de la formation argilo-carbonatée ;
- Trichostomum littorale serait caractéristique des climats océaniques, avec une répartition centrée sur la côte ouest-européenne ainsi que sur les îles Anglo-Normandes et de Grande-Bretagne et plus ponctuelle au sud et centre Europe ; lui aussi a été détecté sur les rives de la rivière d’Alune ;
- Trichostomum meridionale présente la distribution et la niche écologique les plus étroites, son aire de répartition connue est macaronésienne et méditerranéenne, des îles Canaries à la Grèce, ce dernier taxon est présent au ravin de Prades sur les barres de grès arkosiques suintantes.
5. L’expression des communautés bryophytiques sur grès
Élément singulier du paysage cévenol ardéchois, les affleurements gréseux constituent un complexe d’habitats et de microhabitats permettant l’installation de nombreuses communautés bryophytiques. La nature des cortèges en place est fonction d’une multitude de paramètres : type de grès, disposition horizontale (dalle) ou verticale (parois) et degré d’inclinaison des pentes, microtopographie, niveau d’ensoleillement, enrichissement de la roche en éléments minéraux et organiques, temporalité et intensité de l’alimentation en eau, dureté de l’eau.
5.1. Les dalles et les surfaces tabulaires complexes
Généralement ensoleillées et dépourvues de végétations arborescentes étendues, les dalles et les structures tabulaires complexes sont occupées par des communautés bryophytiques dont la nature est déterminée par l’intensité de l’humidité du substrat, l’absence ou l’épaisseur de sol, la quantité d’humus en surface s’il existe.
Les affleurements du Ranc Chalède (Ribes) se présentent comme des dalles horizontales à subhorizontales avec des suintements épars, permettant le maintien d’une humidité relative et localisée (planche 1). D’autres présentent une architecture plus complexe, en larges terrasses irrégulières et obliques, très largement structurées en tétines[5], établies sur plusieurs niveaux et entrecoupées de fissures plus ou moins larges, notamment à Vignelongue (Chambonas, photo 1 et planche 2) et au lieu-dit « les Tétines » à Vernon. Ces affleurements, occupant des surfaces qui oscillent entre près de deux hectares (Tétines de Vignelongue) à cinq hectares (Ranc Chalède), s’ouvrent aux chênaies vertes mésoméditerranéennes à Asplenium onopteris (Asplenio onopteridis-Quercetum ilicis) et à des pinèdes maritimes claires ponctuées d’îlots à Calluna vulgaris, Cistus salviifolius, Erica scoparia et Juniperus oxycedrus (faciès de dégradation du Cisto salviifolii-Pinetum salzmannii). Les zones les plus sèches, éloignées des suintements ou jalonnées de petites convexités qui empêchent l’arrivée d’eau par écoulement, sont occupées principalement par des communautés épilithiques et acidiclinophiles à acidiphiles, mésoxérophiles et photophiles. Dominées par les genres Grimmia et Hedwigia, ces végétations (Grimmion commutatae) prennent des aspects variables en fonction de l’abondance des espèces en place : Grimmia decipiens, G. laevigata, G. pulvinata et Campylopus pilifer sont largement représentées, accompagnées par Hedwigia ciliata, H. emodica et H. stellata, Polytrichum piliferum. Des espèces euryèces comme Homalothecium sericeum et Hypnum cupressiforme var. cupressiforme colonisent également ces rochers chauds et ensoleillés.
Les emplacements les plus secs et exposés, en particulier sur les tétines et leurs rebords, sont investis par une communauté xérophile d’affinité subméditerranéenne que l’on peut rattacher au Grimmietum decipientis, structurée par Grimmia decipiens, G. laevigata et Campylopus pilifer, ces dernières ponctuellement accompagnées de Nogopterium gracile et Scorpiurium circinatum (photo 2). À l’échelle d’une protubérance de grès (ou « tétine »), on observe une nette préférence pour l’ubac pour Grimmia decipiens alors que c’est Grimmia laevigata qui domine sur l’adret.
Les épisodes pluvieux auxquels succèdent des périodes de sécheresse, parfois particulièrement intenses dans cette région de l’Ardèche méridionale, contribuent à alimenter le processus d’érosion par la désagrégation surfacique que connaissent les grès arkosiques. Une fois libérés, les éléments de la désagrégation des roches primaires (principalement granitoïdes) – quartz, feldspath, micas – vont s’accumuler progressivement en fonction du contexte topographique, aidés par les écoulements temporaires. Les milieux rocheux sur lesquels s’accumulent les éléments sableux sont favorables à des communautés xérophiles psammophiles appartenant à la classe des Ceratodonto-Polytrichetea piliferi, qui accompagnent des pelouses annuelles sur sables et arènes xériques des Tuberarietalia guttatae. Les deux communautés, étroitement imbriquées, profitent de l’humidité temporaire apportée par les suintements à proximité. Située à l’interface entre les domaines biogéographiques méditerranéen et continental, l’Ardèche méridionale abrite deux des trois alliances des Ceratodonto-Polytrichetea piliferi actuellement reconnues (Hugonnot & Chavoutier, 2021) : les communautés médioeuropéennes du Ceratodonto-Polytrichion piliferi (dans laquelle on trouve Brachythecium albicans, Campylopus introflexus, Ceratodon purpureus, Dicranum scoparium, Polytrichum juniperinum et P. piliferum, Racomitrium elongatum, Syntrichia ruralis, accompagnées de nombreux lichens terricoles) et les communautés méditerranéennes à thermo-atlantiques du Campylopodion polytrichoidis, qui se reconnaissent à l’abondance de Campylopus pilifer, celles-ci accompagnées ponctuellement par Bartramia aprica et Scleropodium touretii, cortège observé au Ranc Chalède et à Vignelongue. À noter aussi, dans le premier site, la présence isolée de Racomitrum lanuginosum, espèce boréo-montagnarde bien plus largement répandue sur les roches volcaniques des montagnes ardéchoises et particulièrement abondante sur les chirats[6], qui se présente ici sous une forme grêle induite vraisemblablement par des conditions excessivement thermophiles qui l’éloignent de son optimum écologique.
Sur les zones où dominent encore des arènes mais commençant à s’enrichir en argiles et soumises directement aux suintements temporaires, Cephaloziella rubella, Entosthodon obtusus, Fossombronia pusilla, avec Atrichum angustatum et Imbribryum alpinum accompagnent des placages denses de Riccia beyrichiana et R. warnstorfii (planche 3). Les Riccia profitent du printemps pluvieux pour se développer et se reproduire avant que la saison estivale et ses fortes températures ne viennent dessécher les thalles (Mady et al., 2019). Le rattachement bryosociologique n’est pas aisé, et la situation ne semble pas avoir été encore clarifiée. Du fait de son affinité subméditerranéenne et de sa richesse en hépatiques thalloïdes du genre Riccia, la végétation observée semble se rapprocher du Mannion androgynae.
L‘inclinaison des dalles suintantes, même si elle est faible, suffit à la formation de petits ruissellements. Dans ces microthalwegs à ruissellement temporaire s’accumule de la matière organique, conditions favorables à l’installation d’un groupement d’acrocarpes en coussinet hautement esthétique dominé par des Bryacées telles que Bryum gemmiparum, Imbribryum alpinum, Ptychostomum pseudotriquetrum et par Grimmia lisae (planche 4). Ce groupement, héliophile et acidiclinophile, est inféodé aux roches siliceuses suintantes mais soumises à une dessiccation estivale prononcée et il semble avoir déjà été observé dans le massif de Maures (Hugonnot, 2007) dans les mêmes conditions[7].
Les dépressions en cuvette qui ponctuent les dalles de grès constituent des zones d’accumulation de matériaux fins. Lorsque les accumulations sont composées majoritairement d’argiles et que leur épaisseur est suffisante, les cuvettes se trouvent temporairement inondées en période hivernale voire printanière selon le niveau des pluies. Celles-ci sont alors occupées par des tonsures amphibies à Archidium alternifolium et notamment très riches en flore vasculaire : Illecebrum verticillatum, Juncus capitatus, J. tenageia, Lysimachia minima, Lythrum hyssopifolia, Radiola linoides, etc., dont un certain nombre d’espèces méditerranéo-atlantiques.
À Vignelongue, dans les fissures et concavités se situant dans les zones de transition entre deux niveaux de terrasses, en situation plus fraîche et ombragée et avec une humidité atmosphérique renforcée par la présence de suintements, le sol squelettique s’enrichit en matières minérales et organiques. Ces milieux sont investis par des végétations de mousses et fougères, toutes s’insérant dans la classe des Anogrammo leptophyllae-Polypodietea cambrici et côtoyant de manière plus ou moins étroite des communautés chasmophytiques à Asplenium obovatum subsp. billotii et A. foreziense. On distingue dans ces communautés d’affinité méditerranéo-atlantique celles rupicoles appartenant à l’alliance du Bartramio strictae-Polypodion serrati de celles qui sont terricoles du Selaginello denticulatae-Anogrammion leptophyllae. Les fissures terreuses et les petits abris sous roche terreux, qui s’intègrent dans cette dernière alliance, se caractérisent par l’abondance d’Anogramma leptophylla[8]. Structurée principalement par les fougères, cette végétation est accompagnée d’un tapis muscinal dans lequel s’insère notamment le rarissime Anthoceros caucasicus (planche 5, A), Aulacomnium androgynum, Bartramia aprica, Entosthodon fascicularis, E. obtusus, Epipterygium tozeri, Homalotecium sericeum, Imbribryum alpinum, Philonotis fontana, Rhabdoweissia fugax et Scleropodium touretii ainsi qu’un cortège très fourni en hépatiques à thalle – Corsinia coriandrina (planche 5, B), Lunularia cruciata, Reboulia hemisphaerica, Targionia hypophylla – et à feuilles – Cephaloziella turneri, Fossombronia angulosa, Gongylanthus ericetorum et Scapania compacta. Le lien entre le Selaginello-Anogrammion et le Fissidenti serrulati-Fossombronienion angulosae est ici très net (cf. aussi figure 4).
Ces communautés bryophytiques, similaires à celles que l’on peut observer en région méditerranéenne dans le Var, comptent vraisemblablement parmi les plus originales et remarquables des grès ardéchois. En effet, celles-ci bénéficient d’une enveloppe écologique très spécifique (géologie, topographie, climat et microclimat) qui confère à ces communautés — comportant plusieurs espèces rares à l’échelle du Massif central et du sud-est de la France métropolitaine — une grande originalité.
C’est dans ce contexte écologique qu’a été découvert Ptychostomum minii, espèce montrant une répartition ouest-méditerranéenne et macaronésienne (Madère, péninsule Ibérique, France, Sardaigne). Il est très rare en France, connu exclusivement du Var et de l’Ardèche, ses deux localités ardéchoises se situant en limite nord de sa répartition. Inféodé au climat méditerranéen et aux roches siliceuses suintantes chaudes, il a été signalé en situation éclairée sur granites, quartzites, conglomérats (Holyoak, 2021) et sur les grès arkosiques permiens du rocher de Roquebrune dans le Var (Skrzypczak, 1998). En France, c’est donc la deuxième mention sur grès, roche qui réunit toutes les conditions nécessaires à l’installation de cette petite bryacée : suintements sur dalles et escarpements sur sols squelettiques et fissures terreuses dans un contexte climatique favorable.
En lisière et dans les clairières des chênaies et des pinèdes maritimes, la lente accumulation de matières organiques favorise l’installation des communautés d’ourlets humicoles, thermoclinophiles, photophiles et acidiphiles du Pleurozion schreberi dans lesquelles on trouve Dicranum scoparium, Hylocomium splendens, Polytrichum formosum et Pseudoscleropodium purum. Dans les boisements, les substrats les plus frais voient se développer les communautés neutrophiles et sciaphiles de l’Eurhynchion striati, caractérisées par la présence d’Eurhynchium striatum, Brachythecium rutabulum, Plagiomnium affine et P. undulatum. Par ailleurs, la base des troncs humifères est investie par des communautés post-pionnières à climaciques des troncs ou des substrats plus ou moins humifères appartenant au Dicrano scoparii-Hypnion filiformis et largement dominées par Dicranum scoparium, Hypnum cupressiforme var. cupressiforme, H. jutlandicum et quelques coussins de Leucobryum glaucum s.l., espèce indiquant une certaine continuité forestière. Par ailleurs, d’autres communautés humicoles paucispécifiques et assez mal caractérisées accueillent Dicranella heteromalla, Lophocolea heterophylla et Mnium hornum.
5.2. Les parois verticales et subverticales
D’inclinaison et hauteur très hétérogènes, les affleurements verticaux et subverticaux apparaissent comme un complexe topographique hébergeant des communautés rupicoles aux besoins écologiques contrastés.
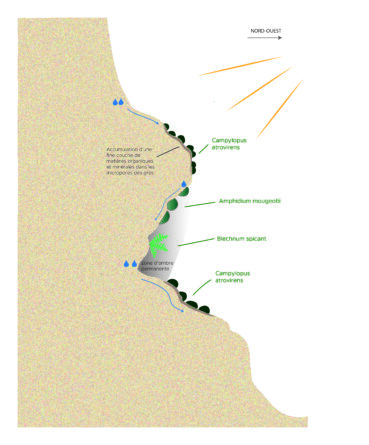
L’ubac du ravin de Prades (planche 6) se présente comme un versant pentu formé de gradins métriques de grès arkosiques suintants, avec des successions d’escarpements, corniches, balmes et vires (figure 2). Ce ravin, d’exposition nord/nord-ouest, en situation confinée, est couvert en bas de versant par la chênaie verte mésoméditerranéenne à Asplenium onopteris et en haut de versant par une pinède maritime secondaire sur maquis haut à Erica arborea.
Outre l’humidité atmosphérique prégnante induite par l’exposition, la base des affleurements bénéficie de suintements récurrents ainsi que de l’accumulation de matières minérales et organiques. Ces emplacements, régulièrement rajeunis par l’érosion, sont investis par des communautés bryophytiques pionnières dont la nature est fonction de l’épaisseur de l’humus, du sol et de la granulométrie associée, ainsi que de l’humidité édaphique. Tous ces facteurs sont principalement corrélés à l’inclinaison des affleurements et à la nature de la végétation trachéophytique en place. Relevant majoritairement des Diplophylletalia albicantis heteromallae, ces végétations sont dominées par des espèces terricoles[9], humicoles ou épilithiques, neutrophiles à acidiphiles, telles que Amphidium mougeotii, Bartramia pomiformis, Calypogeia arguta, C. fissa et C. muelleriana, Campylopus fragilis, Cephalozia bicuspidata, Diplophyllum albicans, Fissidens dubius et F. bryoides, Fossombronia angulosa, Jungermannia pumila, Pellia epiphylla, Plagiothecium succulentum, Pseudotaxiphyllum elegans, Scapania nemorea. La présence de Pohlia cruda, espèce plutôt alticole, illustre la fraîcheur dont bénéficie le système gréseux du ravin de Prades.
Les ruissellements quasi permanents favorisent le transport de matières organiques s’accumulant dans les innombrables pores de la roche. Ces microzones très humifères favorisent l’installation d’espèces humicoles et humo-épilithiques : Aulacomnium androgynum, Campylopus flexuosus et Lophocolea heterophylla. Tous les grès ne sont pas aussi poreux et c’est l’une de ses originalités, permettant un enrichissement superficiel en matières organiques et le stockage d’eau qu’il relargue de manière progressive. À noter l’existence de superbes parois gréseuses qui prennent place dans le site des Tétines de Vernon, à quelques centaines de mètres du ravin de Prades.
Les parois ensoleillées à semi-ombragées sont généralement occupées par des communautés chasmophytiques à Asarina procumbens et Umbilicus rupestris relevant de l’Antirrhinion asarinae, accompagnées par un cortège bryophytique d’espèces acidiphiles telles que Grimmia ovalis, Hedwigia ciliata, Racomitrium heterostichum et plus localement Cynodontium bruntonii. Lorsque les affleurements bénéficient d’une plus grande humidité atmosphérique et édaphique, contexte favorisé par l’exposition nord sous couvert forestier, la végétation des parois est marquée par la présence luxuriante de Struthtiopteris spicant et Osmunda regalis, qui forment des cordons étroits et fournis dans les fissures des barres rocheuses.
Les vires et corniches inférieures des encorbellements et balmes suintantes exposées au soleil matinal, à la faveur des trouées forestières au niveau des ressauts rocheux (figures 2 et 3), sont colonisées par une communauté bryophytique hygrophile inféodée aux sources d’eau pauvre en éléments nutritifs. Le cortège structuré autour de Campylopus atrovirens (planche 7, A et B) s’enrichit fréquemment par la présence de Blindia acuta, Heterocladium flaccidum et H. heteropterum, Imbribryum alpinum Marsupella emarginata, Ptychostomum pseudotriquetrum et Trichostomum meridionale. Sur les mêmes parois, les concavités supérieures, restant à l’abri du soleil dans des cônes d’ombre presque permanents, sont colonisées par des populations très étendues d’Amphidium mougeotii (planche 7, C).
Avec un port en gros coussins denses vert sombre à brunâtres, pouvant atteindre 10 cm de hauteur, Campylopus atrovirens est une espèce typique des rochers siliceux humides et ensoleillés. Présente sur les côtes est et nord-ouest de l’Amérique du Nord ainsi qu’en Asie du Sud-Est, elle est largement répartie en Europe occidentale. Le Royaume-Uni et la Scandinavie accueillent, au nord de sa distribution européenne, les noyaux de populations européennes les plus denses (Blockeel et al., 2014). Au contraire, l’espèce occupe une place nettement plus réduite à l’approche du nord des péninsules Ibérique et italienne qui constituent l’extrémité méridionale de l’aire de distribution européenne de l’espèce. Notons aussi l’existence de populations isolées aux Açores et dans le Caucase.
En France, cette espèce d’affinité océanique-méditerranéenne est rare. Présente en Bretagne, son affinité montagnarde lui permet de se maintenir dans les principaux massifs montagneux de la métropole : Pyrénées, Alpes du Nord et ouest du Massif central (Corrèze, Cantal). La population ardéchoise constitue, avec la station relictuelle de la Grand-Combe (Gard), l’une des deux localités répertoriées sur le rebord oriental du Massif central. En région Auvergne-Rhône-Alpes, elle est en danger d’extinction (EN) selon la liste rouge régionale. Sont en cause la réduction de la taille de la population, une zone d’occupation réduite en déclin estimée à moins de 10 km2, ainsi qu’une population très fragmentée. La découverte de l’espèce sur les grès ardéchois augmente légèrement son aire d’occupation et confère à ce secteur un rôle important dans la conservation de l’espèce en France méditerranéenne.
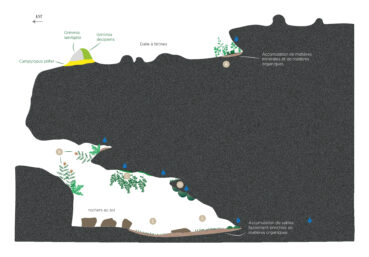
Un certain nombre de sites, et notamment à Vignelongue (Chambonas), comportent de vastes et profonds abris sous roche ombragés bénéficiant d’un microclimat stable saturé d’humidité (figure 4). Des suintements permanents tantôt d’eau douce, tantôt d’eau dure parcourent les fissures et les interbancs de grès, les suintements carbonatés provenant d’infiltrations qui traversent des niveaux de grès à ciment calcaire. En effet, au cours du processus de percolation à travers des couches de grès à ciment carbonaté, l’eau va progressivement s’enrichir en carbonate, calcium et magnésium. C’est avant tout l’exubérance des rideaux d’Adiantum capillus-veneris pendants depuis le plafond qui marque cette végétation des suintements carbonatés faiblement incrustants (planche 8, C) : les touffes de cette fougère se développent ici au sein d’un tapis dense de Conocephalum conicum, où on trouve également Calypogeia fissa, Fossombronia sp., Microeurhynchium pumilum, Oxyrrhynchium hians et Rhynchostegiella tenella. Eucladium verticillatum n’y est, curieusement, pas systématique. Cette végétation est à rapprocher des complexes des sources pétrifiantes comprenant l’Adiantion, le Pellion endiviifoliae et le Riccardio-Eucladion. À des niveaux différents de ces suintements carbonatés, les parois humides subverticales et les corniches soumises à des suintements d’eau douce accueillent de riches draperies à Osmunda regalis, Struthiopteris spicant, Athyrium filix-femina accompagnées par Asplenium foreziense et A. trichomanes (planche 8, A, B, D), qui s’associent notamment à Chionoloma tenuirostre, Dicranella heteromalla, Diplophyllum albicans, Hypnum cupressiforme var. filiforme, Oxyrrhynchium hians et Fissidens bryoides var. caespitans (= F. curnovii), un Fissidens disséminé sur les façades atlantique et méditerranéenne françaises, avec des incursions dans les Cévennes. Amphidium mougeotii est présent mais pas de manière systématique non plus. À proximité des fissures plus ou moins humides marquant les interbancs de grès, Pseudotaxiphyllum elegans trouve son optimum de développement accompagné dans les parties les plus obscures par des filaments enchevêtrés d’Heterocladium heteropterum.
Figure 4. Est de Vignelongue (Chambonas, 07), 175 m ; coupe schématique d’un abri-sous-roche ; A : Selaginello denticulatae-Anogrammion leptophyllae / Fissidenti serrulati-Fossombronienion angulosae ; B : communautés de corniche avec Osmunda regalis, Struthiopteris spicant, Athyrium filix-femina, Asplenium foreziense, A. trichomanes, Chionoloma tenuirostre, Dicranella heteromalla, Diplophyllum albicans, Metzgeria furcata, Hypnum cupressiforme var. filiforme, Oxyrrhynchium hians, Pseudotaxiphyllum elegans (fissures) ; C : communauté au plafond à Adiantum capillus-veneris, Conocephalum conicum, Eucladium verticillatum, Calypogeia fissa, Fossombronia sp., Microeurrhynchium pumilum, Oxyrrhynchium hians, Rhynchostegiella tenella ; D : communautés de parois à Amphidium mougeotii, Fissidens bryoides var. caespitans, Osmunda regalis (jeunes plantes), Oxyrrhynchium hians, Plagiomnium rostratum, Heterocladium heteropterum et Pseudotaxiphyllum elegans (fissures) ; E : communautés en pied de balme et au sol, avec Heterocladium heteropterum Leucobryum juniperoideum, Mnium hornum, Plagiomnium medium, P. undulatum, Pseudotaxiphyllum elegans et Fossombronia angulosa, Calypogeia fissa, Fissidens bryoides var. caespitans ; M. Maglio (schéma d’origine), A. Labroche (numérisation), CC-BY-NC-ND.
Sur le sol humide et dans les anfractuosités au pied des balmes, riches en matériaux sableux conférant un caractère acide au substrat, les tapis de Heterocladium heteropterum, Mnium hornum, Plagiomnium medium et P. undulatum, Pseudotaxiphyllum elegans et les coussins de Leucobryum juniperoideum (planche 8, E et F) indiquent l’existence de conditions microclimatiques suffisamment « fraîches » pour l’installation de ces espèces de climats généralement plus froids. Il est par ailleurs assez étonnant que ce cortège se présente quelle que soit la chimie apparente des eaux de suintements réceptionnées. En complément du caractère sableux du sol, l’eau des suintements calcaires doit en effet se décharger du carbonate de calcium plus en amont. Lorsque davantage de particules fines d’humus enrichissent le substrat, celui-ci voit alors se développer un dense tapis de Fossombronia angulosa mêlé de Calypogeia fissa et de Fissidens bryoides var. caespitans.
Le phénomène de suintements carbonatés sur grès, abordé ci-avant en évoquant les abris sous roche, s’exprime de manière optimale sur les grès arkosiques observés dans le vallon de Feryrolle et sur ceux de la formation argilo-carbonatée de la rivière d’Alune, avec de véritables résurgences qui s’associent aux suintements permanents de moindre intensité. Ici les sources, très riches en carbonate de calcium, sont pétrifiantes grâce au développement de communautés à Palustriella commutata (planche 9, C), espèce caractéristique de cette végétation (Cratoneuretum filicino-commutati) autour de laquelle s’opèrent les précipitations de calcite. Cette mousse est accompagnée de Aneura pinguis, Apopellia endiviifolia, Campylium protensum, Cratoneuron filicinum, Eucladium verticillatum, Hymenostylium recurvirostrum, Marchantia quadrata, Mesoptychia turbinata Philonotis calcarea et Southbya tophacea. Les contrastes déjà évoqués pour les grès ardéchois sont ici à nouveau marqués par la présence à la fois de Palustriella falcata, vicariant montagnard à subalpin de Palustriella commutata, et de Didymodon tophaceus, taxon à caractère plus thermophile.
Les suintements tufeux alimentés non pas par ruissellement mais par le suintement goutte à goutte sont dominés par Eucladium verticillatum (Eucladietum verticillati). Si les sources se trouvent en situation ombragée et ont un débit soutenu, les communautés du Pellion endiviifoliae prennent le relais et se différencient de celles du Riccardio-Eucladion par l’abondance des Hépatiques, en particulier de Apopellia endiviifolia, Conocephalum conicum et Mesoptychia turbinata. Enfin, l’apparition en périphérie des sources d’espèces moins exigeantes telles que Gymnostomum calcareum, et d’autres encore caractérisant le Cephaloziello baumgartneri-Southbyon nigrellae voire du Ctenidion mollusci, indique l’inconstance de l’alimentation en eau.
Les sous-bois des chênaies vertes d’ubac sur les grès de la formation argilo-carbonatée de la rivière d’Alune (Ribes, Lablachère) sont riches en blocs et barres rocheuses. Ils hébergent des communautés climaciques qui relèvent du Neckerion complanatae pour la composante humo-épilithique et corticole (Alleniella complanata, Anomodon viticulosus, Didymodon insulanus, Exsertotheca crispa…) et du Ctenidion mollusci pour les communautés épilithiques (Ctenidium molluscum, Encalypta streptocarpa, Scorpiurium circinatum, Tortella tortuosa, Trichostomum crispulum). Ces espèces, auxquelles il faut rajouter Dicranum scoparium, Frullania dilatata et F. tamarisci, Hylocomium splendens, Lejeunea cavifolia, Lophocolea bidentata, Metzgeria furcata, Plagiochila porelloides, Plagiomnium affine, Porella arboris-vitae, Ptychostomum capillare et Trichostomum brachydontium, représentent l’essentiel du cortège muscinal.
6. Intérêt patrimonial, conservation et menaces
La bryoflore inventoriée se compose de 182 mousses sensu stricto, 46 hépatiques et d’une anthocérote de grande valeur patrimoniale, Anthoceros caucasicus, seule mention française actuelle, découverte dans le secteur de Vignelongue (Chambonas) en début du printemps 2021. Notons également la seconde observation à l’échelle de la région Auvergne-Rhône-Alpes pour Ptychostomum minii, espèce méditerranéenne connue auparavant en France dans le massif varois des Maures seulement (Skrzypczak, 1998) puis récemment observée toujours en Ardèche, au nord d’Aubenas (Ellis et al., 2021). Quatre nouvelles espèces viennent enrichir la bryoflore d’Ardèche : Campylopus atrovirens, Didymodon ferrugineus, Palustriella falcata et Tortella fasciculata. Pour cette dernière espèce, il s’agissait de la première mention pour le Massif central, elle a depuis de nouveau été découverte dans les monts d’Or (Rhône) en 2022 et en 2023 dans le vallon de la Fellodière à Ampuis (Rhône), sur un affleurement de granites d’anatexie en exposition sud.
Près de 8 % (soit 17 taxons) de la bryoflore inventoriée sont inscrits sur la Liste rouge de l’ex-région Rhône-Alpes (CBNA & CBNMC, 2022) sous un statut de menace :
- quatre en danger (EN), Campylopus atrovirens, Cephaloziella turneri, Epipterygium tozeri, Gongylanthus ericetorum ;
- treize vulnérables (VU), Archidium alternifolium, Bartramia aprica, Campylopus flexuosus et fragilis, Corsinia coriandrina, Entosthodon obtusus, Fissidens pusillus, Fossombronia angulosa et F. caespitiformis, Grimmia lisae, Heterocladium flaccidum, Porella obtusata, Riccia beyrichiana.
Par ailleurs, vingt-quatre taxons sont classés comme quasi menacés (NT).
Quatre taxons figurent sur la Liste rouge européenne (Hoddgets et al., 2019), parmi lesquels deux au rang de vulnérable (VU) – Atrichum angustatum et Riccia warnstorfii – et deux au rang de quasi menacé (NT) – Philonotis calcarea et Porella arboris-vitae. Enfin, une seule espèce fait l’objet d’un statut réglementaire (Leucobryum glaucum) inscrite à l’annexe V de la directive Habitat (92/43/CEE).
Bien qu’ils soient inclus dans le périmètre du PNR des Monts d’Ardèche, en dehors des agglomérations urbaines et des grands circuits touristiques, les sites étudiés ne sont pas à l’abri des menaces récurrentes qui atteignent les milieux naturels. La qualité et la quantité d’eau sont des éléments fondamentaux pour la bonne conservation des communautés liées aux sources et suintements, ce qui implique une attention particulière sur les activités de captage et sur les phénomènes de pollution des sources en amont. De plus, le changement climatique détermine un prolongement et une aggravation des sécheresses et une hausse générale des températures, ce qui n’est pas sans impact sur la quantité d’eau disponible dans le sous-sol (bilan hydrique climatique annuel déficitaire).
La fragilité des communautés bryophytiques colonisant les dalles et surplombs de grès est trop grande pour ouvrir ces sites à une mise en valeur touristique, et ce malgré leur extraordinaire originalité. L’impact d’une fréquentation régulière (principalement par piétinement, arrachage et eutrophisation), comme l’illustre l’expérience malheureuse d’aménagement des Tétines de Vernon, aurait des répercussions significatives et rapides sur l’état de conservation de ces milieux et des communautés bryophytiques associées. Un suivi des communautés des mousses et d’hépatiques érodées par la surfréquentation touristique dans le site des Tétines de Vernon permettrait de documenter le temps nécessaire aux communautés pour reconstituer les formes originelles et d’évaluer en quelque sorte leur résilience.
Les plus importantes sources pétrifiantes du vallon du ruisseau de Feryrolle sont situées en bord de route : tous les travaux routiers (aménagement, mise en sécurité, gestion et entretien, etc.) devront tenir en compte de l’extrême fragilité de ces milieux.
Au ravin de Prades, la situation est complexe car les communautés muscinales dépendent à la fois de la ressource en eau et de la naturalité du contexte forestier. La présence de Leucobryum glaucum s.l. nous indique l’existence d’une certaine continuité forestière et d’un niveau de perturbation faible en bas de versant, nécessaire au maintien de l’ensemble des bryocénoses. Néanmoins, le site n’est pas loin de plantations de résineux et de châtaigniers. L’extension de telles exploitations pourrait constituer une menace. Les pinèdes secondaires sur maquis à éricacées, en haut du versant, indiquent une exploitation ou un défrichement passé en train de se cicatriser. La gestion forestière, si elle existe, doit être raisonnée et douce pour garder dans le sous-bois un microclimat confiné favorable. La mise en place pour les milieux forestiers d’îlots de vieillissement reste la meilleure préconisation, en prenant soin de conserver les trouées forestières – toutefois naturellement présentes au niveau des sauts de roche et des escarpements les plus raides – dans la structure du couvert forestier, nécessaires au maintien des communautés à Campylopus atrovirens.
7. Perspectives
Ce travail pose les bases d’une meilleure connaissance des Mousses et Hépatiques des grès ardéchois. Les premiers résultats livrent un large aperçu de la richesse bryophytique et en même temps ouvrent une série de questions auxquelles il faut encore répondre :
- concernant les espèces en situation d’isolat comme Campylopus atrovirens, Anthoceros caucasicus ou Ptychostomum minii, s’agit-il de reliques de stations autrefois plus étendues ? Ou s’agit-il d’ensemencements fortuits par des diaspores transportées lors de tempêtes ? Des études génétiques comparées avec d’autres isolats et les principaux noyaux de populations de ces espèces permettraient-elles d’en savoir plus sur l’origine géographique, la date et donc le contexte climatique de leur installation en Ardèche ?
- les nombreux sites miniers des grès du Trias hébergent-ils un cortège d’espèces métallophiles remarquable ?
- les grès du Trias et les grès-conglomérats du Houiller (Carbonifère) sont régulièrement en contact le long du piémont cévenol du Massif central et on constate déjà des différences notables du point de vue de la flore vasculaire. Quel est le niveau de similarité entre les communautés muscinales de ces deux situations géologiques ?
- les grès représentent-ils un meilleur refuge pour les bryophytes face au changement climatique que d’autres substrats, tels les schistes ou les granites par exemple ? Le cas échéant, devraient-ils faire l’objet d’une plus grande attention et de mesures de protection ?
- où se trouvent les sites gréseux les plus riches qui nécessitent des mesures de protection fortes ?
Rejoignez le collectif bryologique du Massif central ! Pour plus d’informations : cbnmc.fr, aurelien.labroche@cbnmc.fr.
[1] Quelques données collectées au cours de journées antérieures ou postérieures à la session, dans les mêmes secteurs, ont été intégrées à cette étude.
[2] Plusieurs espèces, non citées dans les parties suivantes mais figurant dans la liste complète des espèces inventoriées et présentées en annexe 1, ont été observées sur d’autres types de roches que les grès, notamment sur schistes, gneiss, quartzites et quartzoleptynites.
[3] Références des indications relatives à la datation (Cohen et al., 2013)
[4] https://www.infoclimat.fr/climatologie/normales-records/1991-2020/aubenas-vals-lanas/valeurs/07570.html [le 7 juin 2022]
[5] Les tétines sont des protubérances de taille variable et de forme généralement conique, dégagées par l’érosion de bancs de grès grossiers du Trias.
[6] Terme propre au massif du Pilat et aux montagnes environnantes de la bordure orientale du Massif central, il indique les étendues de gros blocs rocheux, formés par cryoclastie et thermoclastie en l’absence de phénomènes gravitaires majeurs.
[7] Hébrard (1970) rassemble des communautés similaires de la Provence cristalline à P. alpinum, Grimmia lisae, Campylopus pilifer, Riccia spp., etc. sous le nom de Campylopetum introflexi (correspondant à l’association à Campylopus pilifer et Imbribryum alpinum, in Jauffret et al., 2001), groupement thermohygrophile des surfaces tabulaires suintantes et cuvettes d’accumulation sur substrat cristallin associant des ricciaies. Ces communautés mériteraient une analyse phytosociologique plus approfondie (Hugonnot, 2004, 2007).
[8] Sur les grès triasiques de Brive, Anogramma leptophylla forme avec Umbilicus rupestris une communauté à écologie apparemment similaire (Anogrammo leptophyllae-Umbilicetum rupestris), mais intégrée au Bartramio-Polypodion (Mady et al., 2019 ; Lafon et al., 2021) et dont le cortège bryophytique du relevé-type est différent (Amor et al., 1993) par rapport à la communauté des dalles de Vignelongue. Le lien entre toutes ces petites communautés à Anogramme à feuilles minces, peu étudiées et donc mal connues, et les éventuelles relations entre syntaxons bryo-ptéridophytiques et trachéophytiques restent à approfondir.
[9] Bien qu’enrichi en matière organique, le sol présente encore une forte matrice arénique issu de la désagrégation des grès.
Annexes
Annexe 1 – Catalogue complet des taxons observés
| Alleniella complanata (Hedw.) S. Olsson, Enroth & D. Quandt, 2011 |
| Amphidium mougeotii (Bruch & Schimp.) Schimp., 1856 |
| Aneura pinguis (L.) Dumort., 1822 |
| Anomobryum concinnatum (Spruce) Lindb., 1861 |
| Anomodon viticulosus (Hedw.) Hook. & Taylor, 1818 |
| Anthoceros caucasiacus Steph. |
| Apopellia endiviifolia (Dicks.) Nebel & D. Quandt, 2016 |
| Archidium alternifolium (Hedw.) Mitt., 1851 |
| Atrichum angustatum (Brid.) Bruch & Schimp., 1844 |
| Atrichum undulatum (Hedw.) P. Beauv., 1805 |
| Aulacomnium androgynum (Hedw.) Schwägr., 1827 |
| Bartramia aprica Müll. Hal. |
| Bartramia pomiformis Hedw., 1801 |
| Blindia acuta (Hedw.) Bruch & Schimp., 1846 |
| Brachythecium glareosum (Bruch ex Spruce) Schimp., 1853 |
| Brachythecium rivulare Schimp., 1853 |
| Brachythecium rutabulum (Hedw.) Schimp., 1853 |
| Bryum argenteum Hedw., 1801 |
| Bryum dichotomum Hedw., 1801 |
| Bryum gemmiparum De Not., 1865 |
| Calliergonella cuspidata (Hedw.) Loeske, 1911 |
| Calypogeia arguta Nees & Mont., 1838 |
| Calypogeia fissa (L.) Raddi, 1818 |
| Calypogeia muelleriana (Schiffn.) Müll. Frib., 1901 |
| Campylium protensum (Brid.) Kindb., 1894 |
| Campylophyllopsis calcarea (Crundw. & Nyholm) Ochyra, 2010 |
| Campylopus atrovirens De Not., 1838 |
| Campylopus flexuosus (Hedw.) Brid., 1819 |
| Campylopus fragilis (Brid.) Bruch & Schimp., 1847 |
| Campylopus introflexus (Hedw.) Brid., 1819 |
| Campylopus pilifer Brid., 1819 |
| Cephalozia bicuspidata (L.) Dumort., 1835 |
| Cephaloziella divaricata (Sm.) Schiffn., 1909 |
| Cephaloziella rubella (Nees) Warnst., 1902 |
| Cephaloziella turneri (Hook.) Müll. Frib., 1913 |
| Ceratodon purpureus (Hedw.) Brid., 1826 |
| Chiloscyphus polyanthos (L.) Corda, 1829 |
| Chionoloma tenuirostre (Hook. & Taylor) M. Alonso, M.J. Cano & J.A. Jiménez, 2016 |
| Cinclidotus fontinaloides (Hedw.) P. Beauv., 1805 |
| Cirriphyllum crassinervium (Taylor) Loeske & M. Fleisch., 1907 |
| Climacium dendroides (Hedw.) F. Weber & D. Mohr, 1804 |
| Conocephalum conicum (L.) Dumort., 1822 |
| Conocephalum salebrosum Szweyk., Buczk.& Odrzyk., 2005 |
| Corsinia coriandrina (Spreng.) Lindb., 1877 |
| Cratoneuron filicinum (Hedw.) Spruce, 1867 |
| Cryphaea heteromalla (Hedw.) D.Mohr, 1814 |
| Ctenidium molluscum (Hedw.) Mitt., 1869 |
| Cynodontium bruntonii (Sm.) Bruch & Schimp., 1846 |
| Dichodontium pellucidum (Hedw.) Schimp., 1856 |
| Dicranella heteromalla (Hedw.) Schimp., 1856 |
| Dicranella varia (Hedw.) Schimp., 1856 |
| Dicranoweisia cirrata (Hedw.) Lindb., 1869 |
| Dicranum scoparium Hedw., 1801 |
| Didymodon fallax (Hedw.) R.H. Zander, 1978 |
| Didymodon ferrugineus (Schimp. ex Besch.) M.O. Hill, 1981 |
| Didymodon insulanus (De Not.) M.O. Hill, 1981 |
| Didymodon luridus Hornsch., 1827 |
| Didymodon spadiceus (Mitt.) Limpr., 1888 |
| Didymodon tophaceus (Brid.) Lisa, 1837 |
| Didymodon vinealis (Brid.) R.H. Zander, 1978 |
| Diphyscium foliosum (Hedw.) D. Mohr, 1803 |
| Diplophyllum albicans (L.) Dumort., 1835 |
| Ditrichum heteromallum (Hedw.) E. Britton, 1913 |
| Encalypta streptocarpa Hedw., 1801 |
| Entosthodon fascicularis (Hedw.) Müll. Hal., 1848 |
| Entosthodon obtusus (Hedw.) Lindb., 1865 |
| Ephemerum serratum (Hedw.) Hampe, 1837 |
| Epipterygium tozeri (Grev.) Lindb., 1864 |
| Eucladium verticillatum (With.) Bruch & Schimp., 1846 |
| Eurhynchium striatum (Hedw.) Schimp. |
| Exsertotheca crispa (Hedw.) S. Olsson, Enroth & D. Quandt, 2011 |
| Fabronia pusilla Raddi, 1808 |
| Fissidens adianthoides Hedw., 1801 |
| Fissidens bryoides Hedw., 1801 |
| Fissidens bryoides var. caespitans Schimp., 1876 |
| Fissidens crassipes Wilson ex Bruch & Schimp., 1849 |
| Fissidens dubius P.Beauv., 1805 |
| Fissidens gracilifolius Brugg.-Nann. & Nyholm, 1986 |
| Fissidens incurvus Starke ex Röhl., 1813 |
| Fissidens pusillus (Wilson) Milde, 1869 |
| Fissidens taxifolius Hedw., 1801 |
| Fontinalis antipyretica Hedw., 1801 |
| Fossombronia angulosa (Dicks.) Raddi, 1818 |
| Fossombronia caespitiformis (Raddi) De Not. ex Rabenh., 1860 |
| Fossombronia pusilla (L.) Nees, 1838 |
| Frullania dilatata (L.) Dumort., 1835 |
| Frullania fragilifolia (Taylor) Gottsche, Lindenb. & Nees, 1845 |
| Frullania tamarisci (L.) Dumort., 1835 |
| Funaria hygrometrica Hedw., 1801 |
| Gongylanthus ericetorum (Raddi) Nees, 1836 |
| Grimmia decipiens (Schultz) Lindb., 1861 |
| Grimmia laevigata (Brid.) Brid., 1826 |
| Grimmia lisae De Not., 1837 |
| Grimmia ovalis (Hedw.) Lindb., 1871 |
| Grimmia pulvinata (Hedw.) Sm., 1807 |
| Grimmia trichophylla Grev., 1824 |
| Gymnostomum calcareum Nees & Hornsch., 1823 |
| Gyroweisia tenuis (Hedw.) Schimp., 1876 |
| Habrodon perpusillus (De Not.) Lindb., 1863 |
| Hedwigia ciliata (Hedw.) P. Beauv., 1805 |
| Hedwigia emodica Hampe ex Müll. Hal., 1878 |
| Hedwigia stellata Hedenäs |
| Heterocladium flaccidum (Schimp.) A.J.E. Sm., 2006 |
| Heterocladium heteropterum (Brid.) Schimp., 1852 |
| Homalia trichomanoides (Hedw.) Brid. |
| Homalothecium lutescens (Hedw.) H. Rob., 1962 |
| Homalothecium sericeum (Hedw.) Schimp., 1851 |
| Hygroamblystegium varium (Hedw.) Mönk., 1911 |
| Hygrohypnum luridum (Hedw.) Jenn., 1913 |
| Hylocomium splendens (Hedw.) Schimp., 1852 |
| Hymenostylium recurvirostrum var. recurvirostrum (Hedw.) Dixon, 1933 |
| Hypnum cupressiforme Hedw., 1801 |
| Hypnum cupressiforme var. filiforme Brid., 1801 |
| Hypnum jutlandicum Holmen & E. Warncke, 1969 |
| Imbribryum alpinum (Huds. ex With.) N. Pedersen, 2005 |
| Imbribryum subapiculatum (Hampe) D. Bell & Holyoak, 2020 |
| Isothecium alopecuroides (Lam. ex Dubois) Isov., 1981 |
| Isothecium myosuroides Brid., 1827 |
| Jungermannia atrovirens Dumort., 1831 |
| Jungermannia pumila With., 1796 |
| Kindbergia praelonga (Hedw.) Ochyra, 1982 |
| Lejeunea cavifolia (Ehrh.) Lindb., 1871 |
| Leptodon smithii (Hedw.) F. Weber & D. Mohr, 1803 |
| Leskea polycarpa Hedw., 1801 |
| Leucobryum glaucum (Hedw.) Ångstr., 1845 |
| Leucobryum juniperoideum (Brid.) Müll. Hal., 1844 |
| Leucodon sciuroides (Hedw.) Schwägr., 1816 |
| Lewinskya acuminata (H.Philib.) F. Lara, Garilleti & Goffinet, 2016 |
| Lewinskya affinis (Schrad. ex Brid.) F. Lara, Garilleti & Goffinet, 2016 |
| Lewinskya fastigiata (Bruch ex Brid.) Vigalondo, F. Lara & Garilleti, 2019 |
| Lewinskya rupestris (Schleich. ex Schwägr.) F. Lara, Garilleti & Goffinet, 2016 |
| Lophocolea bidentata (L.) Dumort., 1835 |
| Lophocolea heterophylla (Schrad.) Dumort., 1835 |
| Lunularia cruciata (L.) Dumort. ex Lindb., 1868 |
| Marchantia quadrata Scop., 1772 |
| Marsupella emarginata (Ehrh.) Dumort., 1835 |
| Mesoptychia turbinata (Raddi) L. Söderstr. & Váňa, 2012 |
| Metzgeria furcata (L.) Corda, 1829 |
| Microeurhynchium pumilum (Wilson) Ignatov & Vanderp., 2009 |
| Mnium hornum Hedw., 1801 |
| Nogopterium gracile (Hedw.) Crosby & W.R. Buck, 2011 |
| Orthotrichum diaphanum Schrad. ex Brid., 1801 |
| Orthotrichum schimperi Hammar, 1852 |
| Orthotrichum tenellum Bruch ex Brid., 1827 |
| Oxyrrhynchium hians (Hedw.) Loeske, 1907 |
| Palustriella commutata (Hedw.) Ochyra, 1989 |
| Palustriella falcata (Brid.) Hedenäs, 1992 |
| Pellia epiphylla (L.) Corda, 1829 |
| Philonotis caespitosa Jur., 1862 |
| Philonotis calcarea (Bruch & Schimp.) Schimp., 1856 |
| Philonotis capillaris Lindb., 1867 |
| Philonotis tomentella Molendo, 1864 |
| Plagiochila porelloides (Torr. ex Nees) Lindenb., 1840 |
| Plagiomnium affine (Blandow ex Funck) T.J. Kop., 1968 |
| Plagiomnium ellipticum (Brid.) T.J. Kop., 1971 |
| Plagiomnium medium (Bruch & Schimp.) T.J. Kop., 1968 |
| Plagiomnium rostratum (Schrad.) T.J. Kop., 1968 |
| Plagiomnium undulatum (Hedw.) T.J. Kop., 1968 |
| Plagiothecium denticulatum (Hedw.) Schimp., 1851 |
| Plagiothecium succulentum (Wilson) Lindb., 1865 |
| Plasteurhynchium meridionale (Schimp.) M. Fleisch., 1925 |
| Platygyrium repens (Brid.) Schimp., 1851 |
| Pleuridium acuminatum Lindb., 1863 |
| Pogonatum aloides (Hedw.) P. Beauv., 1805 |
| Pogonatum nanum (Schreb. ex Hedw.) P. Beauv., 1805 |
| Pogonatum urnigerum (Hedw.) P. Beauv., 1805 |
| Pohlia cruda (Hedw.) Lindb., 1879 |
| Pohlia proligera (Kindb.) Lindb. ex Broth. |
| Pohlia annotina (Hedw.) Lindb., 1879 |
| Polytrichum formosum Hedw., 1801 |
| Polytrichum juniperinum Hedw., 1801 |
| Polytrichum piliferum Hedw., 1801 |
| Porella platyphylla (L.) Pfeiff., 1855 |
| Porella arboris-vitae (With.) Grolle, 1969 |
| Porella obtusata (Taylor) Trevis., 1877 |
| Pseudocrossidium hornschuchianum (Schultz) R.H. Zander, 1979 |
| Pseudoscleropodium purum (Hedw.) M. Fleisch., 1923 |
| Pseudotaxiphyllum elegans (Brid.) Z. Iwats., 1987 |
| Ptychostomum capillare (Hedw.) Holyoak & N. Pedersen, 2007 |
| Ptychostomum minii (Podp.) D. Bell & Holyoak, 2020 |
| Ptychostomum pseudotriquetrum (Hedw.) J.R. Spence & H.P. Ramsay ex Holyoak & N. Pedersen, 2007 |
| Ptychostomum rubens (Mitt.) Holyoak & N. Pedersen, 2007 |
| Ptychostomum torquescens (Bruch & Schimp.) Ros & Mazimpaka, 2013 |
| Pulvigera lyellii (Hook. & Taylor) Plášek, Sawicki & Ochyra, 2015 |
| Racomitrium aciculare (Hedw.) Brid., 1819 |
| Racomitrium aquaticum (Brid. ex Schrad.) Brid., 1819 |
| Racomitrium heterostichum (Hedw.) Brid., 1819 |
| Racomitrium lanuginosum (Hedw.) Brid., 1819 |
| Radula complanata (L.) Dumort., 1831 |
| Reboulia hemisphaerica (L.) Raddi, 1818 |
| Rhabdoweisia fugax (Hedw.) Bruch & Schimp., 1846 |
| Rhizomnium punctatum (Hedw.) T.J. Kop., 1968 |
| Rhynchostegiella curviseta (Brid.) Limpr., 1896 |
| Rhynchostegiella tenella (Dicks.) Limpr., 1890 |
| Rhynchostegium confertum (Dicks.) Schimp., 1852 |
| Rhynchostegium riparioides (Hedw.) Cardot, 1913 |
| Riccia beyrichiana Hampe, 1838 |
| Riccia warnstorfii Limpr. ex Warnst., 1899 |
| Scapania compacta (Roth) Dumort., 1835 |
| Scapania nemorea (L.) Grolle, 1963 |
| Scapania undulata (L.) Dumort., 1835 |
| Schistidium apocarpum (Hedw.) Bruch & Schimp., 1845 |
| Schistidium crassipilum H.H. Blom, 1996 |
| Sciuro-hypnum plumosum (Hedw.) Ignatov & Huttunen, 2002 |
| Sciuro-hypnum populeum (Hedw.) Ignatov & Huttunen, 2002 |
| Scleropodium touretii (Brid.) L.F. Koch, 1949 |
| Scorpiurium circinatum (Brid.) M. Fleisch. & Loeske, 1907 |
| Scorpiurium deflexifolium (Solms) M. Fleisch. & Loeske, 1907 |
| Southbya tophacea (Spruce) Spruce, 1850 |
| Syntrichia laevipila Brid., 1819 |
| Targionia hypophylla L., 1753 |
| Thamnobryum alopecurum (Hedw.) Gangulee |
| Thuidium tamariscinum (Hedw.) Schimp., 1852 |
| Tortella fasciculata (Culm.) Culm., 1924 |
| Tortella nitida (Lindb.) Broth., 1902 |
| Tortella squarrosa (Brid.) Limpr., 1888 |
| Tortella tortuosa (Hedw.) Limpr., 1888 |
| Tortula acaulon (With.) R.H. Zander, 1993 |
| Tortula caucasica Broth. |
| Tortula subulata Hedw., 1801 |
| Trichostomum brachydontium Bruch, 1829 |
| Trichostomum crispulum Bruch, 1829 |
| Trichostomum littorale Mitt., 1868 |
| Trichostomum meridionale Ros, O. Werner, R.D. Porley, 2022 |
| Trilophozia quinquedentata (Huds.) Bakalin, 2005 |
| Weissia brachycarpa (Nees & Hornsch.) Jur., 1882 |
| Weissia controversa Hedw., 1801 |
| Weissia controversa var. crispata (Nees & Hornsch.) Nyholm, 1969 |
| Zygodon rupestris Schimp. ex Lorentz, 1865 |
Annexe 2 – Catalogue complet des syntaxons observés
Adiantetea capilli-veneris Braun-Blanq. ex Braun-Blanq., Roussine & Nègre 1952
Adiantetalia capilli-veneris Braun-Blanq. ex Horvatić 1939
Adiantion capilli-veneris Braun-Blanq. ex Horvatić 1934*
Anogrammo-leptophyllae-Polypodietea cambrici Rivas Mart. 1975*
Anomodonto viticulosi-Polypodietalia cambrici O. Bolòs & Vives in O. Bolòs 1957
Bartramio strictae-Polypodion serrati O. Bolòs et Vives in O. Bolòs 1957*
Anogrammo leptophyllae-Umbilicetum rupestris Amor, Ladero & C.J. Valle 1993*
Selaginello denticulatae-Anogrammion leptophyllae Rivas Mart. et al. 1999*
Asplenietea trichomanis (Braun-Blanq. in Meier & Braun-Blanq. 1934) Oberdorfer 1977
Androsacetalia vandellii Braun-Blanq. in Meier & Braun-Blanq. 1934 nom. corr.
Antirrhinion asarinae (Braun-Blanq. in Meier & Braun-Blanq. 1934) Braun-Blanq., Roussine &
Nègre 1952
Ceratodonto purpurei-Polytrichetea piliferi Mohan 1978*
Polytrichetalia piliferi v. Hübschm. 1975
Campylopodion polytrichoidis Giacom. 1951*
Ceratodonto purpurei-Polytrichion piliferi Waldh. ex v. Hübschm. 1967*
Cladonio digitatae-Lepidozietea reptantis Jež. & Vondr. 1962
Dicranetalia scoparii Barkm. 1958
Dicrano scoparii-Hypnion filiformis Barkm. 1958*
Diplophylletalia albicantis G. Phil. 1963 nom. cons. propos.
Dicranellion heteromallae G. Phil. 1963*
Fissidenti serrulati-Fossombronienion angulosae Marst. 1993*
Diplophyllion albicantis G. Phil. 1956*
Ctenidietea mollusci v. Hübschm. ex Grgić 1980
Ctenidietalia mollusci Had. & Šm. ex Klika 1948
Ctenidion mollusci Stef. ex Klika 1948 nom. cons. propos.*
Hylocomietea splendentis Marst. 1992
Hylocomietalia splendentis Gillet ex Vadam 1990
Eurhynchion striati Waldh. 1944*
Pleurozion schreberi v. Krus. 1945*
Helianthemetea guttati (Braun-Blanq. ex Rivas Goday 1958) Rivas Goday & Rivas Mart. 1963
Helianthemetalia guttati Braun-Blanq. in Braun-Blanq., Molin. & He Wagner 1940*
Junipero sabinae-Pinetea ibericae Rivas Mart. 1983
Junipero-Pinetalia sylvestris Rivas Mart. 1965
Goodyero repentis -Pinion sylvestris Thébaud & C.-E. Bernard 2018
Cisto salviifolii-Pinetum salzmannii Bianchin & Culat 2024*
Grimmietea alpestris Had. & Vondr. in Jež. & Vondr. 1962
Grimmietalia alpestris Šm. 1944
Grimmion commutatae v. Krus. 1945*
Grimmietum decipientis Varo et al. 1988*
Montio fontanae-Cardaminetea amarae Braun-Blanq. & Tüxen ex Klika & Hadač 1944
Cardamino amarae-Chrysosplenietalia alternifolii Hinterlang ex B. Foucault 2018
Pellion endiviifoliae Bardat 1998 prov.*
Riccardio-Eucladion verticillati Bardat 1998 prov.*
Cratoneuretum filicino-commutati (Kuhn 1937) Oberd. 1977*
Eucladietum verticillati P. Allorge 1922*
Neckeretea complanatae Marst. 1986
Neckeretalia complanatae Jež. & Vondr. 1962
Neckerion complanatae Šm. & Had. ex Klika 1948 nom. cons. propos.*
Quercetea ilicis Braun-Blanq. in Braun-Blanq., Roussine & Nègre 1952
Quercetalia ilicis Braun-Blanq. ex Molin. 1934
Erico arboreae-Quercion ilicis Brullo, Di Martino & Marcenò 1977
Asplenio onopteridis-Quercetum ilicis (Braun-Blanq. 1936) Rivas Mart. 1974*
Psoretea decipientis Matt. ex Follm. 1974
Barbuletalia unguiculatae v. Hübschm. 1960
Cephaloziello baumgartneri-Southbyon nigrellae Guerra & Gil 1982*
Mannion androgynae Ros & Guerra 1987*
Bibliographie
Amor A., Ladero M. & Valle C.J., 1993. Flora y vegetación vascular de la comarca de La Vera y laderas meridionales de la Sierra de Tormantos (Cáceres, España). Stvdia Botánica 11 : 11-207.
Bagnouls F. & Gaussen H., 1957. Les climats biologiques et leur classification. Annales de Géographie 66, 355 : 193-220, https ://doi.org/10.3406/geo.1957.18273.
Bardat J. & Hauguel J.-Ch., 2002. Synopsis bryosociologique pour la France. Cryptogamie, Bryologie 23 (4) : 279-343.
Blockeel T.L., Bosanquet S.D.S., Hill M.O. & Preston C.D., 2014. Atlas of British and Irish bryophytes: the distribution and habitat of mosses and liverworts in Britain and Ireland. Pisces Publications.Newbury, Berkshire, UK.
Cohen K.M., Finney S.C., Gibbard P. L. & Fan, J.X., 2013 (updated). The ICS International Chronostratigraphic Chart. Episodes 36 :199-204.
Conservatoire botanique national alpin et Conservatoire botanique national du Massif Central, 2022. Compilation des listes rouges des bryophytes de la région Auvergne-Rhône-Alpes, http ://www.cbn-alpin-biblio.fr/Record.htm ?idlist=10&record=19644156124914623389.
Conservatoire botanique national du Massif central, 2021+. Synopsis des végétations de la région Auvergne-Rhône-Alpes. Conservatoire botanique national du Massif central / Région Auvergne-Rhône-Alpes, 423 p.
Düll R., 1983. Distribution of the European and Macaronesian liverworts (Hepaticophytina). Bryologische Beiträge 2 : 1-115.
Düll R., 1984. Distribution of the European and Macaronesian mosses (Bryophytina). Bryologische Beiträge 4 : 1-114.
Düll R., 1985. Distribution of the European and Macaronesian mosses (Bryophytina), II. Bryologische Beiträge 5 : 110-232.
Düll R., 1992. Distribution of the European and Macaronesian Mosses (Bryophytina), annotations and progress. Bryologische Beiträge 8-9 : 1-223.
Ellis L. T., Ah-Peng C., Aslan G., Bakalin V.A. et al., 2021. New national and regional bryophyte records, 65. Journal of Bryology 43 (1) : 67-91, https://doi.org/10.1080/03736687.2021.1878804.
Gargominy O., Tercerie S., Régnier C. et al., 2022. Taxref v. 16.0, référentiel taxonomique pour la France. UMS PatriNat, Muséum national d’histoire naturelle, Paris, https://inpn.mnhn.fr/telechargement/referentielEspece/taxref/
16.0/menu.
Hébrard J.-P., 1970. Formations muscinales rupicoles de Provence cristalline. Annales de la Faculté des sciences de Marseille 44 : 99-119.
Hodgetts N., Cálix M., Englefield E. et al., 2019. A miniature world in decline: European Red List of Mosses, Liverworts and Hornworts. IUCN, Brussels, Belgium, 88 p.
Holyoak D.T., 2021. European Bryaceae: a guide to the species of the moss family Bryaceae in Western and Central Europe and Macaronesia. Pisces Publications, Newbury, Berkshire, UK. 352 p.
Hugonnot V., 2004. Contribution à la chorologie et à l’écologie des Ricciacées du Massif central (France), principalement de l’Ardèche et de la Haute-Loire. Cryptogamie, Bryologie 25 (1) : 39-67
Hugonnot V., 2007. Aperçu de la flore et de la végétation bryophytiques des sites de Saint-Daumas, du bois du Rouquan et du vallon de Sauronne. Leur place dans le contexte du massif des Maures. Rapport. WWF-France, CEEP-Mission Var, 99 p.
Hugonnot V., Sulmont E. & Chavoutier J., 2008. Cephaloziella phyllacantha (C. Massal. & Carestia) Müll. Frib. sur le contrefort occidental du massif de l’Aigoual (Gard), première mention en France. Bulletin de la Société botanique du Centre-Ouest, n. s., 40 : 537-548.
Hugonnot V. & Chavoutier J.-L., 2021. Les bryophytes de France, 1 – Anthocérotes et Hépatiques. Biotope, Mèze, 652 p.
Jauffret S., Hébrard J.-P. & Loisel R., 2001. Facteurs de la diversité des peuplements de bryophytes dans les pelouses oligotrophes à thérophytes de la bordure nord-ouest du massif des Maures (Var, Maures). Bocconea 13 : 107-117.
Joly D., Brossard T., Cardot H. et al., 2010. Les types de climats en France, une construction spatiale. Cybergeo : Revue européenne de géographie / European Journal of Geography 501 : 1-23, Hal-02660374, https ://doi.org/10.4000/cybergeo.23155.
Lafon P. (coord.), Mady M., Corriol G. et al., 2021. Catalogue des végétations de Nouvelle-Aquitaine. Classification, chorologie et correspondances avec les habitats européens. Conservatoire botanique national Sud-Atlantique, Conservatoire botanique national du Massif central et Conservatoire botanique national des Pyrénées et de Midi-Pyrénées, 265 p.
Mady M., Nawrot O. & Celle J., 2019. Flore et végétations remarquables du bassin gréseux de Brive-la-Gaillarde. Conservatoire botanique national du Massif central, 56 p.
Marstaller R., 2006. Syntaxonomischer Konspekt der Moosgesellschaften Europas und angrenzender Gebiete. Haussknechtia 13 : 1-192.
Renaux B., Le Gloanec V., Le Hénaff P.-M. & Bianchin N., 2023. Végétations forestières du Massif central – Catalogue phytosociologique. Conservatoire botanique national du Massif central, 480 pages.
Ros R.M, Werner O. & Porley R.D., 2022. Herzog vindicated: integrative taxonomy reveals that Trichostomum brachydontium (Pottiaceae, Bryophyta) comprises several species. Taxonomy 2 : 57-88, https://doi.org/10.3390/taxonomy2010005.
Skrzypczak R., 1998. Présence de Bryum minii (Podp.) en France. Bulletin de la Société botanique.du Centre-Ouest, n. s., 20 : 477-478.
Remerciements
Les auteurs souhaitent remercier Nicolas Bianchin (CBN Massif central), Jaoua Celle (CBN Massif central) et Denis Cartier (CB Alsace-Lorraine) pour la relecture du texte et les conseils avisés qui ont sensiblement amélioré l’article.